沪教版(上海)初中化学九年级下册 6.2 盐和肥料--物质的分离与提纯 课件(18张PPT)
文档属性
| 名称 | 沪教版(上海)初中化学九年级下册 6.2 盐和肥料--物质的分离与提纯 课件(18张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 835.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-23 00:00:00 | ||
图片预览





文档简介
石油分馏
原理:利用各物质沸点不同
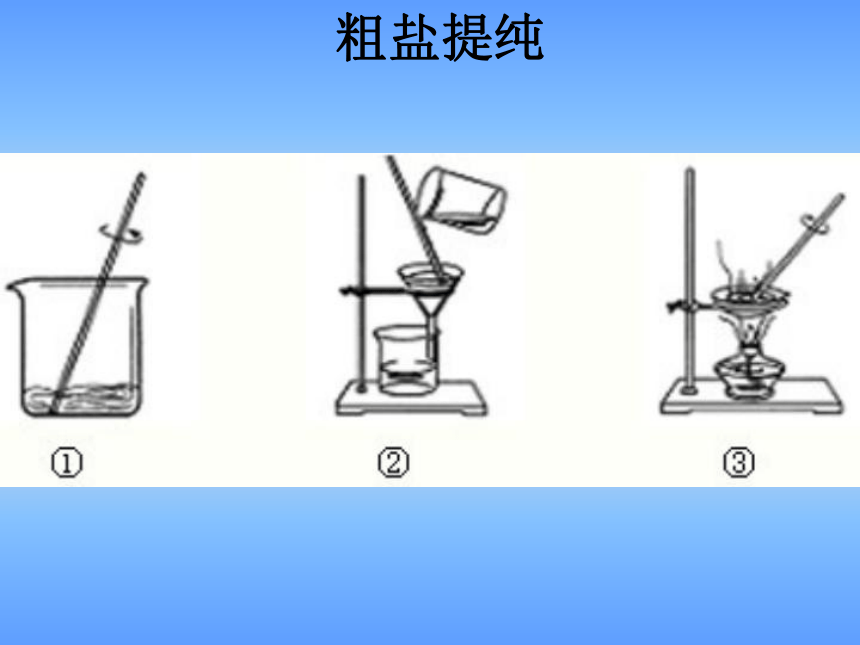
粗盐提纯
典型案例:
1、KNO3中混有少量的NaCl,如何提纯KNO3?
结晶
已知KNO3和NaCl的溶解度曲线如图所示
溶解
(配成热的浓溶液)
降温结晶
(KNO3结晶析出)
过 滤
70
30
物理方法:
1、利用物质的沸点(石油的分馏、氧气的工业制法、水的蒸馏)
2、利用物质的溶解性(粗盐的提纯)
3、利用物质的溶解度(KNO3、NaCl的分离)
粗食盐中含有少量氯化镁等可溶性杂质和泥沙等难溶性杂质。某研究小组设计了如下的实验,以便从粗食盐中提取纯净的氯化钠。
操作I
NaCl
MgCl2
难溶性杂质
NaCl
MgCl2
OH+ MgCl2 → Mg(OH)2↓ + Cl
NaCl
NaOH
NaOH+ HCl → H2O + NaCl
Mg(OH)2
过滤
操作M
NaCl固体
试剂b
过量NaOH溶液
难溶性杂质
HCl
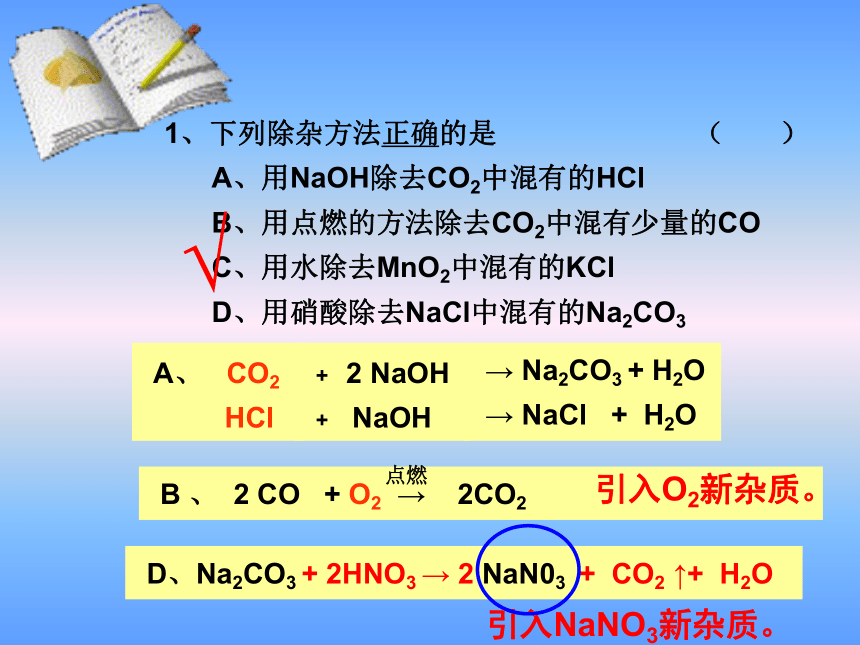
1、下列除杂方法正确的是 ( )
A、用NaOH除去CO2中混有的HCl
B、用点燃的方法除去CO2中混有少量的CO
C、用水除去MnO2中混有的KCl
D、用硝酸除去NaCl中混有的Na2CO3
→ Na2CO3 + H2O
→ NaCl + H2O
B 、 2 CO + O2 → 2CO2
点燃
D、Na2CO3 + 2HNO3 → 2 NaN03 + CO2 ↑+ H2O
√
A、 CO2
HCl
+ 2 NaOH
+ NaOH
引入O2新杂质。
引入NaNO3新杂质。
2、下表列出了除去物质中所含少量杂质的方法,其中错误的
是 ( )
物质
所含杂质
除去杂质的方法
A
CO
CO2
通过足量氢氧化钠溶液,干燥
B
NaCl
泥沙
溶解、过滤、蒸发
C
NaOH溶液
Na2CO3
加入足量稀盐酸至不再产生气泡
D
Cu(NO3)2溶液
AgNO3
加入过量的铜粉,过滤
只吸收 CO2
都和HCl反应了
D、Cu+ 2AgNO3 → Cu(N03)2 + 2Ag
3、某学生设计实验方案,分离NaCl和CaCl2两种固体组成的
混合物A
试回答:
(1)B物质的名称_______,写出生成B的化学方程式______________________
(2)C溶液溶质的名称________,蒸发氯化钙溶液过程中需要用到的仪器除蒸发
皿、烧杯、铁架台(带铁圈)、酒精灯,还必须要有的一种仪器是 。
(3)同学在实验过程发现此方案很容易引入新的杂质。经分析实验得到的NaCl
含有杂质, 是 。
(4)有同学提出滤液中应加入___________至不再产生气体为止,则有效除去
杂质,又能防止新杂质的引入。
写出有关反应的化学方程式: 。
蒸发
蒸发
试剂甲
加过量碳酸钠溶液
溶解
混合物A
NaCl、CaCl2溶液
B↓
滤液
NaCl晶体
C溶液
CaCl2固体
过滤
结晶
干燥
Na2CO3 NaCl
过量
Na2CO3 + CaCl2 → CaCO3 ↓ + 2 NaCl
CaCl2
CaCO3
HCl
Na2CO3 + 2HCl → 2 NaCl + CO2 ↑+ H2O
HCl
4、目前世界上60%的镁是从海水中提取的。其主要步骤如下:
(1)提取Mg的过程中,试剂A可以选用 .
试剂B选用_________(填名称),
操作I名称为_________,操作名称II为_________。
由无水MgCl2制取Mg的反应类型为 。
过量NaOH
2NaOH+ MgSO4 → Mg(OH)2↓ + Na2SO4
MgCl2 → Mg + Cl2↑
通电
熔融
分解反应
稀盐酸
操作II
操作I
过滤
蒸发
NaOH溶液
蒸发
过滤
HCl
MgSO4 → Mg(OH)2↓
+ SO4
+ OH
4、目前世界上60%的镁是从海水中提取的。其主要步骤如下:
分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得
NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸。
实验中加入过量BaCl2溶液是为了除去 ;加入过量
Na2CO3溶液的目的 。
NaCl
CaCl2
Na2SO4
过量
BaCl2溶液
NaCl
溶液
过量
Na2CO3溶液
适量
HCl
Na2sO4 + BaCl2 → BaSO4↓ + 2 NaCl
NaCl
CaCl2
BaCl2
Na2CO3 + BaCl2 → BaCO3 ↓ + 2 NaCl
Na2CO3 + CaCl2 → CaCO3 ↓ + 2 NaCl
Na2CO3
NaCl
5、为验证并除去食盐晶体中含有少量的Na2CO3和Na2SO4两种杂质,现设计了如下实验方案:
请回答:
(1)食盐晶体中加入A溶液是 ;操作1是利用 方法进行
混合物分离。
(2)溶液乙中含有的溶质是 。
沉淀2是 物质。
(3)利用此实验方案所得的NaCl晶体质量比样品中NaCl晶体质量 。
(填“多”或“少”)
食盐晶体样品溶液
过量
溶液甲
气体
过量
B溶液
操作1
沉淀1
溶液乙
适量
Na2CO3溶液
沉淀2
NaCl溶液
操作2
A溶液
气体
NaCl
Na2CO3
Na2SO4
HCl
NaCl
HCl
Na2SO4
Na2CO3 + 2HCl → 2 NaCl + CO2 ↑+ H2O
Na2SO4
BaCl2
+
BaSO4↓
NaCl
+
→
BaCl2
BaSO4↓
NaCl
HCl
BaCl2
Na2CO3 +BaCl2 → BaCO3 ↓ + 2 NaCl
BaCO3
BaCO3
6、人类的生活离不开水。某生活污水有一股臭味,主要含有碎菜叶、碎塑料
薄膜、泥沙、氯化钠和碳酸钠等物质。现欲将其经去渣、除臭处理后作为
清洗厕所的用水。请问:
① 检掉污水中的碎菜叶、碎塑料薄膜等较大的固体后,可对污水进行
操作除去其中检不掉的固体物质;用 可除去污水
的臭味;把生活污水进行处理再利用的目的是 ;
② 实验室检验经①处理后的水中还存在氯化钠的实验流程如下:
Ⅱ
Ⅰ
加过量试剂A
气体
加过量试剂B
白色沉淀
经①处理后的水样
滤液C
试剂A的化学式是 ,
试剂A加入过量的作用是 ;
写出步骤Ⅱ所发生的化学反应式 ;
如果步骤Ⅰ先加入试剂B,步骤Ⅱ加入过量试剂A,也能达到检验氯化钠目的,理由是 。
过滤
活性炭
节约用水
NaCl
Na2CO3
CO2
HNO3
HNO3
NaCl
AgNO3
AgCl
NaCl+ AgNO3 → NaNO3 + AgCl↓
2HNO3+ Ag2CO3 → 2AgNO3 + H2O + CO2↑
8、通过海水晾晒可得粗盐,粗盐除NaCl外,还含有CaCl2、Na2SO4以及泥沙等
杂质。由粗盐制备精盐的操作流程如下:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,其作用 。
第③步的操作名称是 。
(2)第②步加试剂的目的是除去粗盐中的 (填化学式),
第④步中加入的试剂A是 (填化学式)。
NaCl
CaCl2
Na2SO4
过量
BaCl2溶液
NaCl
溶液
过量
Na2CO3溶液
?
Na2sO4 + BaCl2 → BaSO4↓ + 2 NaCl
NaCl
CaCl2
BaCl2
Na2CO3 + BaCl2 → BaCO3 ↓ + 2 NaCl
Na2CO3 + CaCl2 → CaCO3 ↓ + 2 NaCl
Na2CO3
NaCl
A
HCl
9、除去下列各物质中的少量杂质所选用的试剂及操作方法均正确
的是 ( )
项目
物质
杂质(少量)
试剂
操作方法
A
KNO3
MnO2
足量的水
溶解、过滤、蒸发
B
H2
水蒸气
适量的NaOH溶液
洗气
C
硝酸
盐酸
过量的硝酸银溶液
过滤
D
CaO
CaCO3
足量的水
溶解、过滤
10、不能有效去除杂质的方法是 ( )
物质(括号内为杂质)
除杂所用试剂和方法
A
CO2(CO)
点燃
B
C(CuO)
加入过量稀硫酸,充分反应后,过滤
C
FeSO4(CuSO4)
加入过量铁粉,充分反应后,过滤
D
CaO(CaCO3)
高温煅烧
(4) 最佳:
提纯的原则是:
(1) 不引:
(2) 不减:
(3) 易分:
除掉杂质时不引入新杂质。
不减少或改变被提纯物
操作简便易行,杂质易分离除去。
最好在除去杂质的同时能增加被提纯物质的量。即(将杂质 →被提纯物)
所加试剂只和杂质发生反应
为了除去氯化钠样品中的碳酸钠杂质,兴趣小组最初设计了如下的方案
并进行实验。
(1)写出沉淀A的化学式 。
(2)加入过量CaCl2溶液的作用是 ,
分离除去沉淀A的实验操作I是 。
(3)同学在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,
请写出固体物质B的成分 (用化学式表示)。
(4)同学继续探究后又提出新的方案:将混合物溶解,若滴加盐酸至不再产
生气体为止,则既能除去Na2CO3杂质,又能有效地防止新杂质的引入。
写出有关反应的化学方程式: 。
过量CaCl2溶液
混合物溶解
NaCl溶液中
含少量Na2CO3
操作II
溶液
沉淀A
固体物质B
操作I
Na2CO3 + CaCl2 → CaCO3 ↓ + 2 NaCl
CaCO3
除去样品中的碳酸钠杂质
过滤
NaCl 和CaCl2
Na2CO3 + 2HCl → 2 NaCl + CO2 ↑+ H2O
过滤
蒸发
NaCl 和CaCl2
CaCO3
原理:利用各物质沸点不同
粗盐提纯
典型案例:
1、KNO3中混有少量的NaCl,如何提纯KNO3?
结晶
已知KNO3和NaCl的溶解度曲线如图所示
溶解
(配成热的浓溶液)
降温结晶
(KNO3结晶析出)
过 滤
70
30
物理方法:
1、利用物质的沸点(石油的分馏、氧气的工业制法、水的蒸馏)
2、利用物质的溶解性(粗盐的提纯)
3、利用物质的溶解度(KNO3、NaCl的分离)
粗食盐中含有少量氯化镁等可溶性杂质和泥沙等难溶性杂质。某研究小组设计了如下的实验,以便从粗食盐中提取纯净的氯化钠。
操作I
NaCl
MgCl2
难溶性杂质
NaCl
MgCl2
OH+ MgCl2 → Mg(OH)2↓ + Cl
NaCl
NaOH
NaOH+ HCl → H2O + NaCl
Mg(OH)2
过滤
操作M
NaCl固体
试剂b
过量NaOH溶液
难溶性杂质
HCl
1、下列除杂方法正确的是 ( )
A、用NaOH除去CO2中混有的HCl
B、用点燃的方法除去CO2中混有少量的CO
C、用水除去MnO2中混有的KCl
D、用硝酸除去NaCl中混有的Na2CO3
→ Na2CO3 + H2O
→ NaCl + H2O
B 、 2 CO + O2 → 2CO2
点燃
D、Na2CO3 + 2HNO3 → 2 NaN03 + CO2 ↑+ H2O
√
A、 CO2
HCl
+ 2 NaOH
+ NaOH
引入O2新杂质。
引入NaNO3新杂质。
2、下表列出了除去物质中所含少量杂质的方法,其中错误的
是 ( )
物质
所含杂质
除去杂质的方法
A
CO
CO2
通过足量氢氧化钠溶液,干燥
B
NaCl
泥沙
溶解、过滤、蒸发
C
NaOH溶液
Na2CO3
加入足量稀盐酸至不再产生气泡
D
Cu(NO3)2溶液
AgNO3
加入过量的铜粉,过滤
只吸收 CO2
都和HCl反应了
D、Cu+ 2AgNO3 → Cu(N03)2 + 2Ag
3、某学生设计实验方案,分离NaCl和CaCl2两种固体组成的
混合物A
试回答:
(1)B物质的名称_______,写出生成B的化学方程式______________________
(2)C溶液溶质的名称________,蒸发氯化钙溶液过程中需要用到的仪器除蒸发
皿、烧杯、铁架台(带铁圈)、酒精灯,还必须要有的一种仪器是 。
(3)同学在实验过程发现此方案很容易引入新的杂质。经分析实验得到的NaCl
含有杂质, 是 。
(4)有同学提出滤液中应加入___________至不再产生气体为止,则有效除去
杂质,又能防止新杂质的引入。
写出有关反应的化学方程式: 。
蒸发
蒸发
试剂甲
加过量碳酸钠溶液
溶解
混合物A
NaCl、CaCl2溶液
B↓
滤液
NaCl晶体
C溶液
CaCl2固体
过滤
结晶
干燥
Na2CO3 NaCl
过量
Na2CO3 + CaCl2 → CaCO3 ↓ + 2 NaCl
CaCl2
CaCO3
HCl
Na2CO3 + 2HCl → 2 NaCl + CO2 ↑+ H2O
HCl
4、目前世界上60%的镁是从海水中提取的。其主要步骤如下:
(1)提取Mg的过程中,试剂A可以选用 .
试剂B选用_________(填名称),
操作I名称为_________,操作名称II为_________。
由无水MgCl2制取Mg的反应类型为 。
过量NaOH
2NaOH+ MgSO4 → Mg(OH)2↓ + Na2SO4
MgCl2 → Mg + Cl2↑
通电
熔融
分解反应
稀盐酸
操作II
操作I
过滤
蒸发
NaOH溶液
蒸发
过滤
HCl
MgSO4 → Mg(OH)2↓
+ SO4
+ OH
4、目前世界上60%的镁是从海水中提取的。其主要步骤如下:
分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得
NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸。
实验中加入过量BaCl2溶液是为了除去 ;加入过量
Na2CO3溶液的目的 。
NaCl
CaCl2
Na2SO4
过量
BaCl2溶液
NaCl
溶液
过量
Na2CO3溶液
适量
HCl
Na2sO4 + BaCl2 → BaSO4↓ + 2 NaCl
NaCl
CaCl2
BaCl2
Na2CO3 + BaCl2 → BaCO3 ↓ + 2 NaCl
Na2CO3 + CaCl2 → CaCO3 ↓ + 2 NaCl
Na2CO3
NaCl
5、为验证并除去食盐晶体中含有少量的Na2CO3和Na2SO4两种杂质,现设计了如下实验方案:
请回答:
(1)食盐晶体中加入A溶液是 ;操作1是利用 方法进行
混合物分离。
(2)溶液乙中含有的溶质是 。
沉淀2是 物质。
(3)利用此实验方案所得的NaCl晶体质量比样品中NaCl晶体质量 。
(填“多”或“少”)
食盐晶体样品溶液
过量
溶液甲
气体
过量
B溶液
操作1
沉淀1
溶液乙
适量
Na2CO3溶液
沉淀2
NaCl溶液
操作2
A溶液
气体
NaCl
Na2CO3
Na2SO4
HCl
NaCl
HCl
Na2SO4
Na2CO3 + 2HCl → 2 NaCl + CO2 ↑+ H2O
Na2SO4
BaCl2
+
BaSO4↓
NaCl
+
→
BaCl2
BaSO4↓
NaCl
HCl
BaCl2
Na2CO3 +BaCl2 → BaCO3 ↓ + 2 NaCl
BaCO3
BaCO3
6、人类的生活离不开水。某生活污水有一股臭味,主要含有碎菜叶、碎塑料
薄膜、泥沙、氯化钠和碳酸钠等物质。现欲将其经去渣、除臭处理后作为
清洗厕所的用水。请问:
① 检掉污水中的碎菜叶、碎塑料薄膜等较大的固体后,可对污水进行
操作除去其中检不掉的固体物质;用 可除去污水
的臭味;把生活污水进行处理再利用的目的是 ;
② 实验室检验经①处理后的水中还存在氯化钠的实验流程如下:
Ⅱ
Ⅰ
加过量试剂A
气体
加过量试剂B
白色沉淀
经①处理后的水样
滤液C
试剂A的化学式是 ,
试剂A加入过量的作用是 ;
写出步骤Ⅱ所发生的化学反应式 ;
如果步骤Ⅰ先加入试剂B,步骤Ⅱ加入过量试剂A,也能达到检验氯化钠目的,理由是 。
过滤
活性炭
节约用水
NaCl
Na2CO3
CO2
HNO3
HNO3
NaCl
AgNO3
AgCl
NaCl+ AgNO3 → NaNO3 + AgCl↓
2HNO3+ Ag2CO3 → 2AgNO3 + H2O + CO2↑
8、通过海水晾晒可得粗盐,粗盐除NaCl外,还含有CaCl2、Na2SO4以及泥沙等
杂质。由粗盐制备精盐的操作流程如下:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,其作用 。
第③步的操作名称是 。
(2)第②步加试剂的目的是除去粗盐中的 (填化学式),
第④步中加入的试剂A是 (填化学式)。
NaCl
CaCl2
Na2SO4
过量
BaCl2溶液
NaCl
溶液
过量
Na2CO3溶液
?
Na2sO4 + BaCl2 → BaSO4↓ + 2 NaCl
NaCl
CaCl2
BaCl2
Na2CO3 + BaCl2 → BaCO3 ↓ + 2 NaCl
Na2CO3 + CaCl2 → CaCO3 ↓ + 2 NaCl
Na2CO3
NaCl
A
HCl
9、除去下列各物质中的少量杂质所选用的试剂及操作方法均正确
的是 ( )
项目
物质
杂质(少量)
试剂
操作方法
A
KNO3
MnO2
足量的水
溶解、过滤、蒸发
B
H2
水蒸气
适量的NaOH溶液
洗气
C
硝酸
盐酸
过量的硝酸银溶液
过滤
D
CaO
CaCO3
足量的水
溶解、过滤
10、不能有效去除杂质的方法是 ( )
物质(括号内为杂质)
除杂所用试剂和方法
A
CO2(CO)
点燃
B
C(CuO)
加入过量稀硫酸,充分反应后,过滤
C
FeSO4(CuSO4)
加入过量铁粉,充分反应后,过滤
D
CaO(CaCO3)
高温煅烧
(4) 最佳:
提纯的原则是:
(1) 不引:
(2) 不减:
(3) 易分:
除掉杂质时不引入新杂质。
不减少或改变被提纯物
操作简便易行,杂质易分离除去。
最好在除去杂质的同时能增加被提纯物质的量。即(将杂质 →被提纯物)
所加试剂只和杂质发生反应
为了除去氯化钠样品中的碳酸钠杂质,兴趣小组最初设计了如下的方案
并进行实验。
(1)写出沉淀A的化学式 。
(2)加入过量CaCl2溶液的作用是 ,
分离除去沉淀A的实验操作I是 。
(3)同学在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,
请写出固体物质B的成分 (用化学式表示)。
(4)同学继续探究后又提出新的方案:将混合物溶解,若滴加盐酸至不再产
生气体为止,则既能除去Na2CO3杂质,又能有效地防止新杂质的引入。
写出有关反应的化学方程式: 。
过量CaCl2溶液
混合物溶解
NaCl溶液中
含少量Na2CO3
操作II
溶液
沉淀A
固体物质B
操作I
Na2CO3 + CaCl2 → CaCO3 ↓ + 2 NaCl
CaCO3
除去样品中的碳酸钠杂质
过滤
NaCl 和CaCl2
Na2CO3 + 2HCl → 2 NaCl + CO2 ↑+ H2O
过滤
蒸发
NaCl 和CaCl2
CaCO3
