沪教版(上海)初中化学九年级下册 6.2 盐和肥料--盐的化学性质 课件(13张PPT)
文档属性
| 名称 | 沪教版(上海)初中化学九年级下册 6.2 盐和肥料--盐的化学性质 课件(13张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 798.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-23 00:00:00 | ||
图片预览





文档简介
在农业上,波尔多液可用于杀菌,它是由硫酸铜溶液和氢氧化钙溶液按一定比例混合配制而成。
1)请写出有关的化学方程式
2)在配制过程中,不能用铁桶盛放,原因
是?(用化学方程式表示)
CuSO4+Ca(OH)2 → CaSO4+Cu(OH)2↓
CuSO4+Fe → FeSO4+Cu
盐的化学性质1:盐+碱→新盐+新碱
盐的化学性质2:盐+某些金属→新盐+新金属
实验一:盐溶液与酸的反应
序
号
实验步骤
实验
现象
化学方程式
1
取少量稀HCl于
试管中,滴加适量
AgNO3溶液
2
取少量稀H2SO4于
试管中,滴加适量
Ba(NO3)2溶液
3
取少量稀H2SO4于
试管中,滴加适量
BaCl2溶液
白色
沉淀
白色
沉淀
白色
沉淀
HCl+AgNO3→AgCl +HNO3
↓
H2SO4+BaCl2→BaSO4 +2HCl
↓
H2SO4+Ba(NO3)2→BaSO4 +2HNO3
↓
盐的化学性质3:盐+酸→新盐+新酸
HCl+AgNO3→AgCl ↓ +HNO3
H2SO4+BaCl2→BaSO4 ↓ +2HCl
H2SO4+Ba(NO3)2→BaSO4 ↓ +2HNO3
AgCl 和 BaSO4 是不溶于酸的沉淀
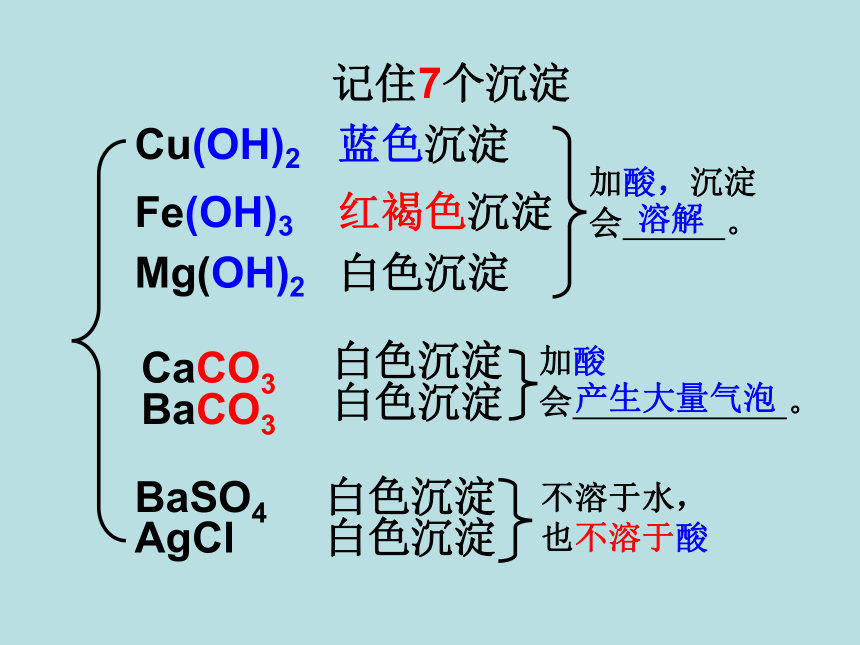
记住7个沉淀
Cu(OH)2
Fe(OH)3
Mg(OH)2
CaCO3
BaCO3
AgCl
BaSO4
蓝色沉淀
红褐色沉淀
白色沉淀
白色沉淀
白色沉淀
白色沉淀
白色沉淀
不溶于水,也不溶于酸
加酸,沉淀会 。
溶解
加酸会 。
产生大量气泡
想一想:怎样检验一瓶酸溶液是HCl?
取样某酸→
滴加AgNO3溶液→
出现白色沉淀
↓
滴加稀硝酸
↓
白色沉淀不消失
AgCl
HCl
硝酸银溶液可以用于检验盐酸
想一想:怎样检验一瓶酸溶液是H2SO4?
取样某酸→
滴加Ba(NO3)2溶液→
出现白色沉淀
↓
滴加稀硝酸
↓
白色沉淀不消失
BaSO4
H2SO4
硝酸钡溶液或者氯化钡溶液可以用于检验稀硫酸
实验二:盐溶液与某些盐溶液的反应
序
号
实验步骤
实验
现象
化学方程式
1
取少量AgNO3溶
液于试管中,滴
加适量NaCl溶液
2
取少量Na2SO4溶液
于试管中,滴加
适量Ba(NO3)2溶
液
3
取少量NaCl溶液
于试管中,滴加
适量KNO3溶液
白色
沉淀
白色
沉淀
无明显
现象
AgNO3+NaCl→AgCl↓+NaNO3
Na2SO4+Ba(NO3)2→BaSO4↓+2NaNO3
盐的化学性质4:盐+盐→新盐+新盐
/
练习1:
甲试管里盛有Na2SO4溶液,乙试管里盛有Na2CO3溶液,分别滴入BaCl2溶液,可以看到甲试管里有_________生成,乙试管里有________生成;再分别滴入过量的稀硝酸,可以看到甲试管里_________,
乙试管里__________
白色沉淀
白色沉淀
沉淀不消失
沉淀消失
盐的检验
⑴盐酸盐(MCl)的检验方法:
滴加 ,产生 ;
再滴加 ,沉淀 ;
AgNO3
白色沉淀
硝酸
不消失
⑵硫酸盐(MSO4)的检验方法:
滴加 ,产生 ;
再滴加 ,沉淀 ;
白色沉淀
硝酸
不消失
BaCl2
⑶ 碳酸盐(MCO3)的检验方法:
滴加 ,产生 ;
HCl
大量气泡
1、酸根的检验
或Ba(NO3)2
NaNO3 + → + ;
KNO3 + → + ;
思考:能否完成下列化学方程式
特别说明:
NaNO3
KNO3
不会发生复分解反应
2、用焰色反应区别
钠盐:
钾盐:
火焰呈黄色
火焰呈紫色
(要透过蓝色钴玻璃观察)
3、用溶液的颜色区别
铜盐溶液蓝色
CuSO4
CuCl2
Cu(NO3)2
+3价铁盐溶液棕黄色
Fe2(SO4)3
FeCl3
Fe(NO3)3
注:无水硫酸铜白色粉末
4、用溶液的酸碱性区别
石蕊试剂
酚酞试剂
酸红碱蓝(中紫)
酸无碱红(中无)
常见酸碱指示剂
HNO3
小结:
1、盐的化学性质
2、初步学会盐酸,硫酸的检验
3、物质的检验
1)请写出有关的化学方程式
2)在配制过程中,不能用铁桶盛放,原因
是?(用化学方程式表示)
CuSO4+Ca(OH)2 → CaSO4+Cu(OH)2↓
CuSO4+Fe → FeSO4+Cu
盐的化学性质1:盐+碱→新盐+新碱
盐的化学性质2:盐+某些金属→新盐+新金属
实验一:盐溶液与酸的反应
序
号
实验步骤
实验
现象
化学方程式
1
取少量稀HCl于
试管中,滴加适量
AgNO3溶液
2
取少量稀H2SO4于
试管中,滴加适量
Ba(NO3)2溶液
3
取少量稀H2SO4于
试管中,滴加适量
BaCl2溶液
白色
沉淀
白色
沉淀
白色
沉淀
HCl+AgNO3→AgCl +HNO3
↓
H2SO4+BaCl2→BaSO4 +2HCl
↓
H2SO4+Ba(NO3)2→BaSO4 +2HNO3
↓
盐的化学性质3:盐+酸→新盐+新酸
HCl+AgNO3→AgCl ↓ +HNO3
H2SO4+BaCl2→BaSO4 ↓ +2HCl
H2SO4+Ba(NO3)2→BaSO4 ↓ +2HNO3
AgCl 和 BaSO4 是不溶于酸的沉淀
记住7个沉淀
Cu(OH)2
Fe(OH)3
Mg(OH)2
CaCO3
BaCO3
AgCl
BaSO4
蓝色沉淀
红褐色沉淀
白色沉淀
白色沉淀
白色沉淀
白色沉淀
白色沉淀
不溶于水,也不溶于酸
加酸,沉淀会 。
溶解
加酸会 。
产生大量气泡
想一想:怎样检验一瓶酸溶液是HCl?
取样某酸→
滴加AgNO3溶液→
出现白色沉淀
↓
滴加稀硝酸
↓
白色沉淀不消失
AgCl
HCl
硝酸银溶液可以用于检验盐酸
想一想:怎样检验一瓶酸溶液是H2SO4?
取样某酸→
滴加Ba(NO3)2溶液→
出现白色沉淀
↓
滴加稀硝酸
↓
白色沉淀不消失
BaSO4
H2SO4
硝酸钡溶液或者氯化钡溶液可以用于检验稀硫酸
实验二:盐溶液与某些盐溶液的反应
序
号
实验步骤
实验
现象
化学方程式
1
取少量AgNO3溶
液于试管中,滴
加适量NaCl溶液
2
取少量Na2SO4溶液
于试管中,滴加
适量Ba(NO3)2溶
液
3
取少量NaCl溶液
于试管中,滴加
适量KNO3溶液
白色
沉淀
白色
沉淀
无明显
现象
AgNO3+NaCl→AgCl↓+NaNO3
Na2SO4+Ba(NO3)2→BaSO4↓+2NaNO3
盐的化学性质4:盐+盐→新盐+新盐
/
练习1:
甲试管里盛有Na2SO4溶液,乙试管里盛有Na2CO3溶液,分别滴入BaCl2溶液,可以看到甲试管里有_________生成,乙试管里有________生成;再分别滴入过量的稀硝酸,可以看到甲试管里_________,
乙试管里__________
白色沉淀
白色沉淀
沉淀不消失
沉淀消失
盐的检验
⑴盐酸盐(MCl)的检验方法:
滴加 ,产生 ;
再滴加 ,沉淀 ;
AgNO3
白色沉淀
硝酸
不消失
⑵硫酸盐(MSO4)的检验方法:
滴加 ,产生 ;
再滴加 ,沉淀 ;
白色沉淀
硝酸
不消失
BaCl2
⑶ 碳酸盐(MCO3)的检验方法:
滴加 ,产生 ;
HCl
大量气泡
1、酸根的检验
或Ba(NO3)2
NaNO3 + → + ;
KNO3 + → + ;
思考:能否完成下列化学方程式
特别说明:
NaNO3
KNO3
不会发生复分解反应
2、用焰色反应区别
钠盐:
钾盐:
火焰呈黄色
火焰呈紫色
(要透过蓝色钴玻璃观察)
3、用溶液的颜色区别
铜盐溶液蓝色
CuSO4
CuCl2
Cu(NO3)2
+3价铁盐溶液棕黄色
Fe2(SO4)3
FeCl3
Fe(NO3)3
注:无水硫酸铜白色粉末
4、用溶液的酸碱性区别
石蕊试剂
酚酞试剂
酸红碱蓝(中紫)
酸无碱红(中无)
常见酸碱指示剂
HNO3
小结:
1、盐的化学性质
2、初步学会盐酸,硫酸的检验
3、物质的检验
