人教版九年级下册 第十一单元 生活中常见的盐 第一课时课件(11张PPT)
文档属性
| 名称 | 人教版九年级下册 第十一单元 生活中常见的盐 第一课时课件(11张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-24 05:07:07 | ||
图片预览



文档简介
课题1 生活中常见的盐 (第一课时)
第十一单元 盐 化肥
第十一单元 盐 化肥
第十一单元 盐 化肥
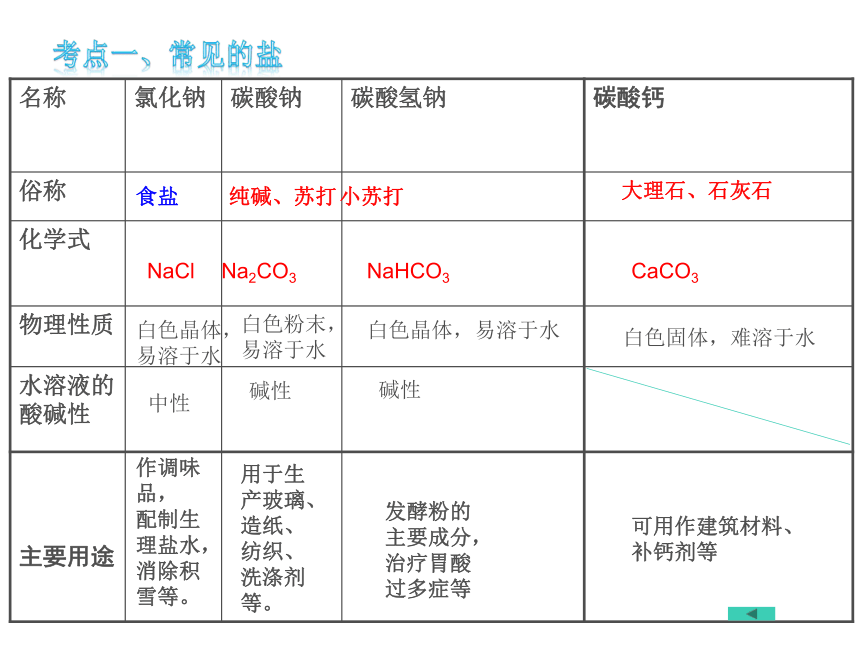
名称
氯化钠
碳酸钠
碳酸氢钠
碳酸钙
俗称
化学式
物理性质
水溶液的酸碱性
主要用途
NaCl
CaCO3
NaHCO3
Na2CO3
食盐
纯碱、苏打
小苏打
大理石、石灰石
作调味品,
配制生理盐水,
消除积雪等。
用于生产玻璃、
造纸、
纺织、
洗涤剂等。
发酵粉的主要成分,
治疗胃酸过多症等
可用作建筑材料、
补钙剂等
白色晶体,易溶于水
白色粉末,易溶于水
白色晶体,易溶于水
白色固体,难溶于水
中性
碱性
碱性
考点一、常见的盐
1、分类:根据阳离子不同,可将盐分为钠盐、钾盐、钙盐、铵盐等;根据阴离子不同,可将盐分为硫酸盐、碳酸盐、硝酸盐等
2、盐的溶解性口诀:
钾钠铵硝皆可溶;盐酸盐中银不溶;
硫酸盐中钡不溶,其他碳酸都不溶
与某些
金属反应
通式:金属 +盐 →新金属+新盐(置换反应)
举例:Fe+CuSO4=== ________________
______________________________________
(工业上用纯碱制取烧碱)
CuSO4+2NaOH ===____________________
与碱反应
通式:盐 + 碱 → 新盐 +新碱
举例
化学性质
复分解反应表达式:AB+CD→AD+CB
FeSO4+Cu
2NaCl+H2O+CO2↑
CaCl2+H2O+CO2↑
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
Cu(OH)2↓+Na2SO4
与酸反应
通式:盐+酸→新盐+新酸
举例
Na2CO3+2HCl===____________________
CaCO3+2HCl === ________________________
与某些盐反应
通式:盐 + 盐 → 新盐 + 新盐
举例
CuSO4+BaCl2 === ____________________
AgNO3+NaCl === _________________________
BaSO4↓+CuCl2
AgCl↓+NaNO3
考点二、盐的化学性质
考点三、粗盐的提纯
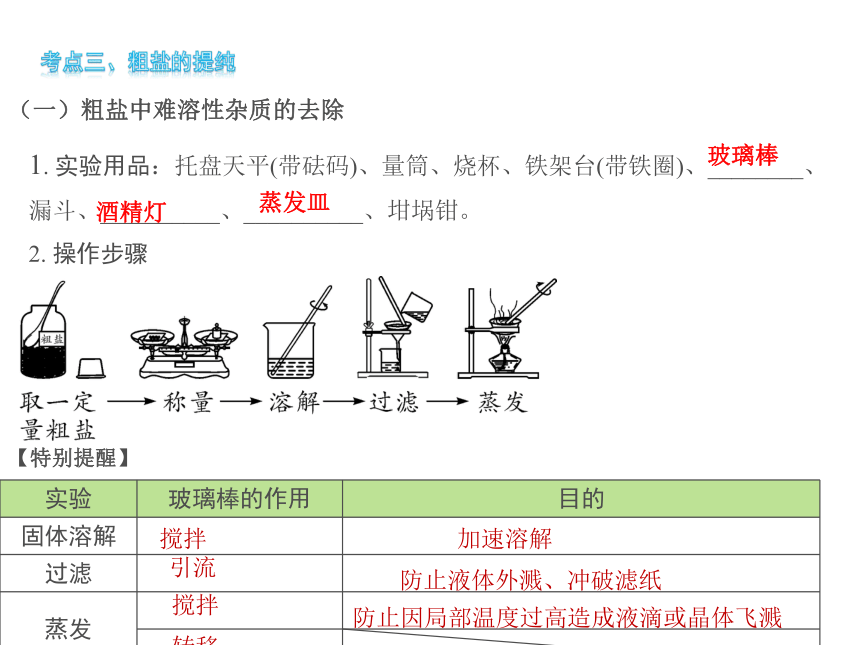
(一)粗盐中难溶性杂质的去除
1. 实验用品:托盘天平(带砝码)、量筒、烧杯、铁架台(带铁圈)、________、
漏斗、__________、__________、坩埚钳。
2. 操作步骤
玻璃棒
酒精灯
蒸发皿
{5940675A-B579-460E-94D1-54222C63F5DA}实验
玻璃棒的作用
目的
固体溶解
过滤
蒸发
【特别提醒】
搅拌
加速溶解
引流
防止液体外溅、冲破滤纸
搅拌
防止因局部温度过高造成液滴或晶体飞溅
转移
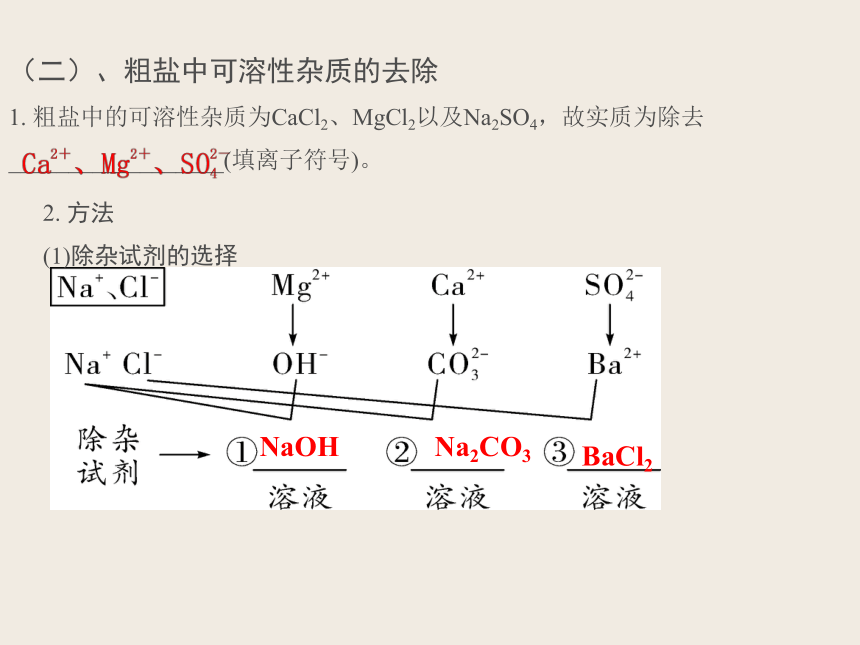
(二)、粗盐中可溶性杂质的去除
1. 粗盐中的可溶性杂质为CaCl2、MgCl2以及Na2SO4,故实质为除去__________________(填离子符号)。
NaOH
Na2CO3
BaCl2
2. 方法
(1)除杂试剂的选择
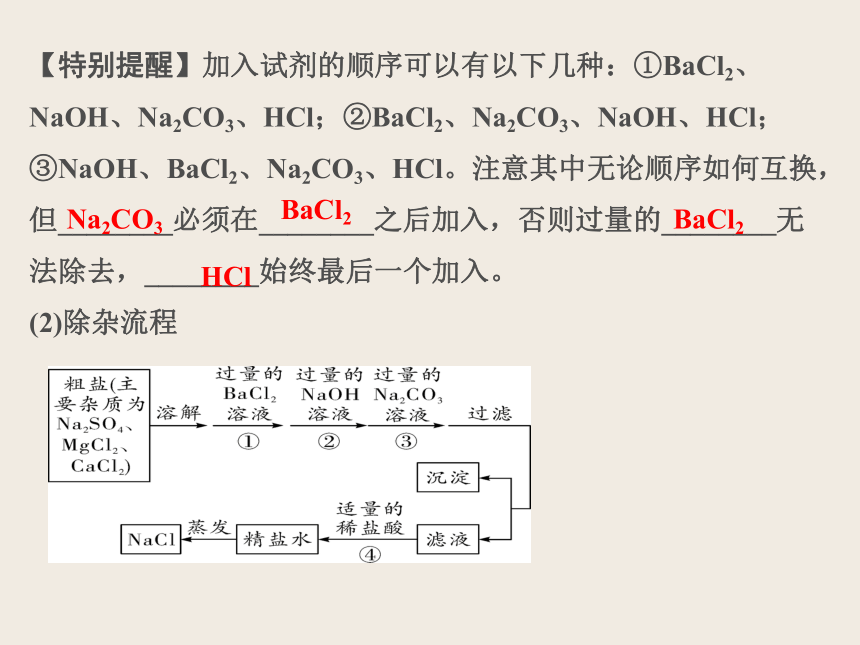
【特别提醒】加入试剂的顺序可以有以下几种:①BaCl2、NaOH、Na2CO3、HCl;②BaCl2、Na2CO3、NaOH、HCl;③NaOH、BaCl2、Na2CO3、HCl。注意其中无论顺序如何互换,但________必须在________之后加入,否则过量的________无法除去,________始终最后一个加入。
Na2CO3
BaCl2
BaCl2
HCl
(2)除杂流程
{5940675A-B579-460E-94D1-54222C63F5DA}步骤
目的
生成的沉淀(填化学式)
所得溶液中的溶质(填化学式)
①
除去____________
______________
____________________________
②
除去____________
______________
____________________________
③
除去____________
______________
____________________________
④
除去____________
\
____________________________
Na2SO4
BaSO4
NaCl、MgCl2、CaCl2、BaCl2
MgCl2
Mg(OH)2
NaCl、CaCl2、BaCl2、NaOH
CaCl2、BaCl2
CaCO3、BaCO3
NaCl、NaOH、Na2CO3
NaOH、Na2CO3
NaCl
各步骤发生反应的化学方程式
步骤①:___________________________________________。
步骤②:____________________________________________。
步骤③______________________________________________、
____________________________________________________。
步骤________________________________________________、
____________________________________________________。
Na2SO4+BaCl2 === BaSO4↓+2NaCl
2NaOH+MgCl2 === Mg(OH)2↓+2NaCl
CaCl2+Na2CO3 === CaCO3↓+ 2NaCl
BaCl2 + Na2CO3 === BaCO3↓+ 2NaCl
HCl + NaOH === NaCl +H2O
Na2CO3+ 2HCl === 2NaCl + H2O+CO2 ↑
1. [2018河南25(1)题1分]焙制糕点所用发酵粉中含有碳酸氢钠,其俗名为________(填字母代号)。
a. 纯碱 b. 烧碱 c. 苏打 d. 小苏打
d
2. (2016河南备用卷19题2分)如图是某胃药
标签说明书。
(1)若用碳酸镁代替碳酸氢钠,则每次用量需减少。
请解释其中的道理。
(2)此胃药不适用于胃溃疡患者,其原因是什么?
相同质量的碳酸镁和碳酸氢钠比较,碳酸镁消耗的盐酸多。
碳酸氢钠与胃酸反应生成二氧化碳气体,会加重胃溃疡病情。
第3题图
题型一、常见的盐
衔接中考之中考真题
真题改编
1.下列有关物质的化学式、俗名、分类不完全对应的是
( )
A.NaOH 苛性钠 碱 B.CaO 生石灰 氧化物
C.Na2CO3 纯碱 碱 D.NaHCO3 小苏打 盐
2.酸、碱、盐在工农业生产、生活中应用广泛。请回答相关问题:
(1)硫酸是一种重要的酸,在稀释浓硫酸时的操作为
________
盐酸、硫酸等酸具有相似的化学性质,是因为它们在水中都能够解离出酸根离子和H+,写出硫酸在水中解离的化学表达式_______。
(2)酸和碱的中和反应在实际中应用广泛。我市某校化学实验室废液呈酸性,应选用试剂_______ (指示剂)检验该废液。若直接排放会导致环境污染,从经济可行的角度考虑,选用_______处理该废液。
(3)小苏打是焙制糕点所用的发酵粉的主要成分之一;在医疗上,它是治疗胃酸过多症的一种药剂,请写出该反应的化学方程式_______
C
将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,并用玻璃棒不断搅拌
H2SO4=== 2H+++SO42-
紫色石蕊溶液
熟石灰
NaHCO3+HCl=== NaCl+H2O+CO2↑
。
(4)现有Ba(NO3)2溶液、稀硫酸、Na2CO3溶液、KOH溶液和CuSO4溶液。请从下列选项中选择能够与上述物质发生复分解反应、并有沉淀生成的物质。
A. 稀盐酸 B. 烧碱溶液 C. 硝酸铵溶液
写出上述反应的化学方程式_______。
3. 甲同学对硫酸铵、氯化铵和硝酸铵进行简单鉴别,设计了如图的实验方案。
(1)请你写出加入硝酸钡生成白色沉淀的化学反应方程式_______
(2)乙同学认为硝酸钡溶液可以用氯化钡溶液来代替,你认为乙同学的说法正确吗?请说明理由。
2NaOH+CuSO4=== Na2SO4+Cu(OH)2↓
(NH4)2SO4+Ba(NO3)2=BaSO4↓+2NH4NO3
不正确,不能用氯化钡来代替,因为加入氯化钡后引入氯离子,对下一步加入硝酸银溶液鉴别氯离子产生干扰。
先加入硝酸银溶液,硝酸银与氯化铵反应能生成氯化银白色沉淀,但是同时也会生成硫酸银,硫酸银是微溶物,也可能使溶液变浑浊,对于物质判断有影响。
(3)丙同学认为也可以先加入硝酸银溶液,然后再加入硝酸钡溶液,对实验的结论没有影响,请你加以论证。(硫酸钡、氯化银难溶于水;硫酸银微溶于水)
题型二、盐的化学性质
5. (2014河南3题1分)发明了“联合制碱法”的科学家是( )
A
6. [2012河南18(4)题1分]用化学方程式表示“联合制碱法”中的如下反应:向饱和食盐水中先后通入足量的NH3和CO2,生成小苏打(在该溶液中难溶)
和一种氮肥。
NaCl+H2O+NH3+CO2=== NaHCO3↓+NH4Cl
真题改编
1. (2019河南省实验一模改编)Na2CO3 在工业和生活中有重要的作用。它的来源主要有以下两种途径:
Ⅰ. 将制碱与制氨结合起来的联合制碱法。这个方法是由我国的制碱工业先驱( )发明的。
A. 张青莲 B. 道尔顿 C. 侯德榜 D. 华罗庚
Ⅱ. 自然界有很多咸水湖,人们通过“冬天捞碱,夏天晒盐”的方式获得湖盐,其中就含有Na2CO3。
(1)小明同学想对某夏天制得的湖盐样品成分进行探究,查阅资料后他对样品成分做出了三种猜想。猜想一:NaCl、Na2CO3;猜想二:NaCl、Na2SO4;猜想三:NaCl、Na2CO3、Na2SO4。请帮助他完成如下实验:
C
{5940675A-B579-460E-94D1-54222C63F5DA}
实验操作
实验现象
实验结论
实验一
取少量样品于试管中,加适量水溶解后,加入过量稀HNO3
产生能使澄清石灰水变浑浊的气体
①猜想 不成立
实验二
向实验一所得的溶液中加入适量的
————+——②
③
猜想三成立
(2)小明同学为进一步确定上述湖盐样品中Na2CO3的质量分数,取该湖盐样品10.0 g做了如图所示的补充实验。(注:所用药品均足量)
①反应结束之后打开止水夹并通入空气的目的是——————————————:
②装置D中发生的反应为——————————(用化学方程式表示)。
二
BaCl2溶液[或Ba(NO3)2溶液]
产生白色沉淀
将生成的CO2全部赶入装置D中
CO2+2NaOH=== Na2CO3+H2O
③实验中碱石灰(含氧化钙和氢氧化钠)的作用是————————————
④实验结束后,测得装置D增重0.44 g,则该湖盐样品中Na2CO3的质量分数为多少?
防止空气中的CO2从右端进入装置D
解:装置D增加的0.44 g即是B中反应生成二氧化碳的质量,设该湖盐样品中Na2CO3的质量为x
Na2CO3+H2SO4=== Na2SO4+H2O+CO2↑
106 44
x 0.44 g
x=1.06 g
则该湖盐样品中Na2CO3的质量分数为×100%=10.6%
答:则该湖盐样品中Na2CO3的质量分数为10.6%。
题型三、粗盐提纯
1. (2019河南)为除去氯化钠中的泥沙和CaCl2、MgCl2、Na2SO4杂质,某化学兴趣小组的同学先将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按以下流程进行实验探究。
(1)溶解、过滤、蒸发操作中都要用到的一种玻璃仪器是____________。
(2)写出一个加入Na2CO3溶液时所发生反应的化学方程式。
(3)上述流程中,若将过滤和加盐酸的操作顺序颠倒,所得精盐产品中含哪些杂质?
(BaSO4不溶于水,也不溶于酸)
第8题图
玻璃棒
Na2CO3+CaCl2=== CaCO3↓+2NaCl(或Na2CO3+BaCl2=== BaCO3↓+2NaCl)
所得精盐产品中含MgCl2、CaCl2、BaCl2杂质。
真题改编
1.有一包由KCl、MgSO4和CaCl2组成的固体混合物,为了除去其中的MgSO4和CaCl2,得到纯净的KCl,设计如下实验方案:
(1)M(是混合物)溶液中的溶质是什么?
(2)请设计实验证明滤液Ⅱ中除KCl外,还存在其他两种溶质。(简要写出实验步骤和现象)
(3)最后所得KCl的质量大于原固体中KCl的质量,写出一个使KCl质量增加的化学方程式。
BaCl2和KOH
取滤液Ⅱ少量,加入足量CaCl2溶液(或BaCl2溶液等),有白色沉淀生成,证明有K2CO3;静置后取上层清液滴加酚酞溶液,溶液变成红色,证明有KOH。
K2CO3+CaCl2=== CaCO3↓ +2KCl(合理即可)
第十一单元 盐 化肥
第十一单元 盐 化肥
第十一单元 盐 化肥
名称
氯化钠
碳酸钠
碳酸氢钠
碳酸钙
俗称
化学式
物理性质
水溶液的酸碱性
主要用途
NaCl
CaCO3
NaHCO3
Na2CO3
食盐
纯碱、苏打
小苏打
大理石、石灰石
作调味品,
配制生理盐水,
消除积雪等。
用于生产玻璃、
造纸、
纺织、
洗涤剂等。
发酵粉的主要成分,
治疗胃酸过多症等
可用作建筑材料、
补钙剂等
白色晶体,易溶于水
白色粉末,易溶于水
白色晶体,易溶于水
白色固体,难溶于水
中性
碱性
碱性
考点一、常见的盐
1、分类:根据阳离子不同,可将盐分为钠盐、钾盐、钙盐、铵盐等;根据阴离子不同,可将盐分为硫酸盐、碳酸盐、硝酸盐等
2、盐的溶解性口诀:
钾钠铵硝皆可溶;盐酸盐中银不溶;
硫酸盐中钡不溶,其他碳酸都不溶
与某些
金属反应
通式:金属 +盐 →新金属+新盐(置换反应)
举例:Fe+CuSO4=== ________________
______________________________________
(工业上用纯碱制取烧碱)
CuSO4+2NaOH ===____________________
与碱反应
通式:盐 + 碱 → 新盐 +新碱
举例
化学性质
复分解反应表达式:AB+CD→AD+CB
FeSO4+Cu
2NaCl+H2O+CO2↑
CaCl2+H2O+CO2↑
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
Cu(OH)2↓+Na2SO4
与酸反应
通式:盐+酸→新盐+新酸
举例
Na2CO3+2HCl===____________________
CaCO3+2HCl === ________________________
与某些盐反应
通式:盐 + 盐 → 新盐 + 新盐
举例
CuSO4+BaCl2 === ____________________
AgNO3+NaCl === _________________________
BaSO4↓+CuCl2
AgCl↓+NaNO3
考点二、盐的化学性质
考点三、粗盐的提纯
(一)粗盐中难溶性杂质的去除
1. 实验用品:托盘天平(带砝码)、量筒、烧杯、铁架台(带铁圈)、________、
漏斗、__________、__________、坩埚钳。
2. 操作步骤
玻璃棒
酒精灯
蒸发皿
{5940675A-B579-460E-94D1-54222C63F5DA}实验
玻璃棒的作用
目的
固体溶解
过滤
蒸发
【特别提醒】
搅拌
加速溶解
引流
防止液体外溅、冲破滤纸
搅拌
防止因局部温度过高造成液滴或晶体飞溅
转移
(二)、粗盐中可溶性杂质的去除
1. 粗盐中的可溶性杂质为CaCl2、MgCl2以及Na2SO4,故实质为除去__________________(填离子符号)。
NaOH
Na2CO3
BaCl2
2. 方法
(1)除杂试剂的选择
【特别提醒】加入试剂的顺序可以有以下几种:①BaCl2、NaOH、Na2CO3、HCl;②BaCl2、Na2CO3、NaOH、HCl;③NaOH、BaCl2、Na2CO3、HCl。注意其中无论顺序如何互换,但________必须在________之后加入,否则过量的________无法除去,________始终最后一个加入。
Na2CO3
BaCl2
BaCl2
HCl
(2)除杂流程
{5940675A-B579-460E-94D1-54222C63F5DA}步骤
目的
生成的沉淀(填化学式)
所得溶液中的溶质(填化学式)
①
除去____________
______________
____________________________
②
除去____________
______________
____________________________
③
除去____________
______________
____________________________
④
除去____________
\
____________________________
Na2SO4
BaSO4
NaCl、MgCl2、CaCl2、BaCl2
MgCl2
Mg(OH)2
NaCl、CaCl2、BaCl2、NaOH
CaCl2、BaCl2
CaCO3、BaCO3
NaCl、NaOH、Na2CO3
NaOH、Na2CO3
NaCl
各步骤发生反应的化学方程式
步骤①:___________________________________________。
步骤②:____________________________________________。
步骤③______________________________________________、
____________________________________________________。
步骤________________________________________________、
____________________________________________________。
Na2SO4+BaCl2 === BaSO4↓+2NaCl
2NaOH+MgCl2 === Mg(OH)2↓+2NaCl
CaCl2+Na2CO3 === CaCO3↓+ 2NaCl
BaCl2 + Na2CO3 === BaCO3↓+ 2NaCl
HCl + NaOH === NaCl +H2O
Na2CO3+ 2HCl === 2NaCl + H2O+CO2 ↑
1. [2018河南25(1)题1分]焙制糕点所用发酵粉中含有碳酸氢钠,其俗名为________(填字母代号)。
a. 纯碱 b. 烧碱 c. 苏打 d. 小苏打
d
2. (2016河南备用卷19题2分)如图是某胃药
标签说明书。
(1)若用碳酸镁代替碳酸氢钠,则每次用量需减少。
请解释其中的道理。
(2)此胃药不适用于胃溃疡患者,其原因是什么?
相同质量的碳酸镁和碳酸氢钠比较,碳酸镁消耗的盐酸多。
碳酸氢钠与胃酸反应生成二氧化碳气体,会加重胃溃疡病情。
第3题图
题型一、常见的盐
衔接中考之中考真题
真题改编
1.下列有关物质的化学式、俗名、分类不完全对应的是
( )
A.NaOH 苛性钠 碱 B.CaO 生石灰 氧化物
C.Na2CO3 纯碱 碱 D.NaHCO3 小苏打 盐
2.酸、碱、盐在工农业生产、生活中应用广泛。请回答相关问题:
(1)硫酸是一种重要的酸,在稀释浓硫酸时的操作为
________
盐酸、硫酸等酸具有相似的化学性质,是因为它们在水中都能够解离出酸根离子和H+,写出硫酸在水中解离的化学表达式_______。
(2)酸和碱的中和反应在实际中应用广泛。我市某校化学实验室废液呈酸性,应选用试剂_______ (指示剂)检验该废液。若直接排放会导致环境污染,从经济可行的角度考虑,选用_______处理该废液。
(3)小苏打是焙制糕点所用的发酵粉的主要成分之一;在医疗上,它是治疗胃酸过多症的一种药剂,请写出该反应的化学方程式_______
C
将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,并用玻璃棒不断搅拌
H2SO4=== 2H+++SO42-
紫色石蕊溶液
熟石灰
NaHCO3+HCl=== NaCl+H2O+CO2↑
。
(4)现有Ba(NO3)2溶液、稀硫酸、Na2CO3溶液、KOH溶液和CuSO4溶液。请从下列选项中选择能够与上述物质发生复分解反应、并有沉淀生成的物质。
A. 稀盐酸 B. 烧碱溶液 C. 硝酸铵溶液
写出上述反应的化学方程式_______。
3. 甲同学对硫酸铵、氯化铵和硝酸铵进行简单鉴别,设计了如图的实验方案。
(1)请你写出加入硝酸钡生成白色沉淀的化学反应方程式_______
(2)乙同学认为硝酸钡溶液可以用氯化钡溶液来代替,你认为乙同学的说法正确吗?请说明理由。
2NaOH+CuSO4=== Na2SO4+Cu(OH)2↓
(NH4)2SO4+Ba(NO3)2=BaSO4↓+2NH4NO3
不正确,不能用氯化钡来代替,因为加入氯化钡后引入氯离子,对下一步加入硝酸银溶液鉴别氯离子产生干扰。
先加入硝酸银溶液,硝酸银与氯化铵反应能生成氯化银白色沉淀,但是同时也会生成硫酸银,硫酸银是微溶物,也可能使溶液变浑浊,对于物质判断有影响。
(3)丙同学认为也可以先加入硝酸银溶液,然后再加入硝酸钡溶液,对实验的结论没有影响,请你加以论证。(硫酸钡、氯化银难溶于水;硫酸银微溶于水)
题型二、盐的化学性质
5. (2014河南3题1分)发明了“联合制碱法”的科学家是( )
A
6. [2012河南18(4)题1分]用化学方程式表示“联合制碱法”中的如下反应:向饱和食盐水中先后通入足量的NH3和CO2,生成小苏打(在该溶液中难溶)
和一种氮肥。
NaCl+H2O+NH3+CO2=== NaHCO3↓+NH4Cl
真题改编
1. (2019河南省实验一模改编)Na2CO3 在工业和生活中有重要的作用。它的来源主要有以下两种途径:
Ⅰ. 将制碱与制氨结合起来的联合制碱法。这个方法是由我国的制碱工业先驱( )发明的。
A. 张青莲 B. 道尔顿 C. 侯德榜 D. 华罗庚
Ⅱ. 自然界有很多咸水湖,人们通过“冬天捞碱,夏天晒盐”的方式获得湖盐,其中就含有Na2CO3。
(1)小明同学想对某夏天制得的湖盐样品成分进行探究,查阅资料后他对样品成分做出了三种猜想。猜想一:NaCl、Na2CO3;猜想二:NaCl、Na2SO4;猜想三:NaCl、Na2CO3、Na2SO4。请帮助他完成如下实验:
C
{5940675A-B579-460E-94D1-54222C63F5DA}
实验操作
实验现象
实验结论
实验一
取少量样品于试管中,加适量水溶解后,加入过量稀HNO3
产生能使澄清石灰水变浑浊的气体
①猜想 不成立
实验二
向实验一所得的溶液中加入适量的
————+——②
③
猜想三成立
(2)小明同学为进一步确定上述湖盐样品中Na2CO3的质量分数,取该湖盐样品10.0 g做了如图所示的补充实验。(注:所用药品均足量)
①反应结束之后打开止水夹并通入空气的目的是——————————————:
②装置D中发生的反应为——————————(用化学方程式表示)。
二
BaCl2溶液[或Ba(NO3)2溶液]
产生白色沉淀
将生成的CO2全部赶入装置D中
CO2+2NaOH=== Na2CO3+H2O
③实验中碱石灰(含氧化钙和氢氧化钠)的作用是————————————
④实验结束后,测得装置D增重0.44 g,则该湖盐样品中Na2CO3的质量分数为多少?
防止空气中的CO2从右端进入装置D
解:装置D增加的0.44 g即是B中反应生成二氧化碳的质量,设该湖盐样品中Na2CO3的质量为x
Na2CO3+H2SO4=== Na2SO4+H2O+CO2↑
106 44
x 0.44 g
x=1.06 g
则该湖盐样品中Na2CO3的质量分数为×100%=10.6%
答:则该湖盐样品中Na2CO3的质量分数为10.6%。
题型三、粗盐提纯
1. (2019河南)为除去氯化钠中的泥沙和CaCl2、MgCl2、Na2SO4杂质,某化学兴趣小组的同学先将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按以下流程进行实验探究。
(1)溶解、过滤、蒸发操作中都要用到的一种玻璃仪器是____________。
(2)写出一个加入Na2CO3溶液时所发生反应的化学方程式。
(3)上述流程中,若将过滤和加盐酸的操作顺序颠倒,所得精盐产品中含哪些杂质?
(BaSO4不溶于水,也不溶于酸)
第8题图
玻璃棒
Na2CO3+CaCl2=== CaCO3↓+2NaCl(或Na2CO3+BaCl2=== BaCO3↓+2NaCl)
所得精盐产品中含MgCl2、CaCl2、BaCl2杂质。
真题改编
1.有一包由KCl、MgSO4和CaCl2组成的固体混合物,为了除去其中的MgSO4和CaCl2,得到纯净的KCl,设计如下实验方案:
(1)M(是混合物)溶液中的溶质是什么?
(2)请设计实验证明滤液Ⅱ中除KCl外,还存在其他两种溶质。(简要写出实验步骤和现象)
(3)最后所得KCl的质量大于原固体中KCl的质量,写出一个使KCl质量增加的化学方程式。
BaCl2和KOH
取滤液Ⅱ少量,加入足量CaCl2溶液(或BaCl2溶液等),有白色沉淀生成,证明有K2CO3;静置后取上层清液滴加酚酞溶液,溶液变成红色,证明有KOH。
K2CO3+CaCl2=== CaCO3↓ +2KCl(合理即可)
同课章节目录
