沪教版初中化学九年级上册 2.1 性质活泼的氧气 教案 (1)
文档属性
| 名称 | 沪教版初中化学九年级上册 2.1 性质活泼的氧气 教案 (1) |

|
|
| 格式 | zip | ||
| 文件大小 | 192.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-26 00:00:00 | ||
图片预览


文档简介
性质活泼的氧气
教学目标:
1.了解实验室制取氧气的主要方法和原理
2.了解氧气工业制法
3.掌握实验装置和操作方法
教学重点难点:
氧气实验室制法的操作及注意事项
教学准备:
课件
实验仪器
药品
教学过程:
复习氧气的性质和用途导入制发法
板书氧气的制法
提问:
人类呼吸的氧气是怎样获得的?
讲解:
绿色植物光合作用放出的
自然界中氧气的获得:绿色植物的光合作用
提问:
医院里医生给病人吸的氧气是从哪里得来的?
讲解:
氧气的工业制法
工业上氧气的制法:
分离液态空气法
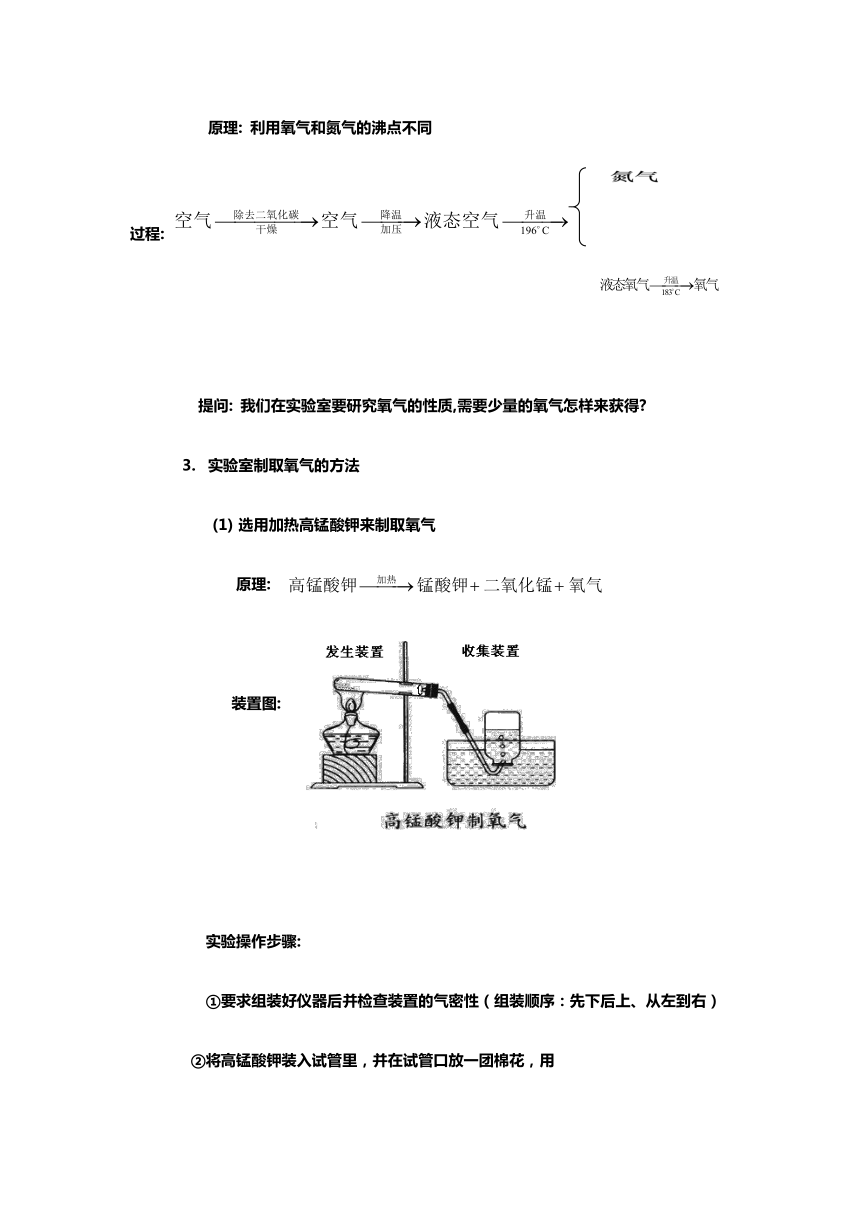
原理:
利用氧气和氮气的沸点不同
过程:
提问:
我们在实验室要研究氧气的性质,需要少量的氧气怎样来获得?
实验室制取氧气的方法
选用加热高锰酸钾来制取氧气
原理:
装置图:
实验操作步骤:
①要求组装好仪器后并检查装置的气密性(组装顺序:先下后上、从左到右)
②将高锰酸钾装入试管里,并在试管口放一团棉花,用
带有导管的塞子塞紧试管口;
③把试管口略向下倾斜,固定在铁架台上;
④点燃酒精灯,给试管均匀加热后再集中加热
⑤等气泡连续、均匀放出时,用排水法收集氧气,并将收集好的集气瓶盖上玻璃片后正放在桌上;
⑥实验完毕,将导管移离水面;
⑦熄灭酒精灯,停止加热。
⑧仪器的拆卸:一般与组装顺序相反,先右后左、先上后
下的顺序。
注意事项:
①试管口要略向下倾斜,防止冷凝后的水倒流回试管底部使试管炸裂。
②试管口要放一团棉花,防止固体颗粒进入导管,堵塞导管、污染气体。
③导管伸入试管时露出橡皮塞少许即可,以便于气体排出
④用排水法集气时,应等气泡连续、均匀冒出时再收集,以免收集的气体中混有空气。
⑤用向上排空气法集气时,应将导管伸到接近集气瓶底部,赶尽空气以免收集的气体不纯。
⑥停止加热时,要先将导管从水槽取出然后再熄灭酒精灯,防止试管冷却过程中水槽里的水倒流使试管炸裂。
验满的方法:
排水法:
当集气瓶口有气泡冒出时,
证明已满。
排空气法:
将带火星的木条伸至集气瓶口,复燃则满。
(2)氧气的实验室制法
双氧水分解制取氧气
原理:
过氧化氢
二氧化锰
水
+
氧气
H2O2
H2O
O2
装置:
操作步骤:
①要求组装好仪器后检查装置的气密性。
②将二氧化锰放入锥形瓶中,塞紧橡皮塞(先装固体后状液体)。
③打开分液漏斗的开关,滴加双氧水
④等气泡连续均匀放出时用排水法收集氧气,并将收集好的集气瓶正放在桌子上。
催化剂:在化学反应中,能增大化学反应速率,但本身的质量和化学性质在反应前后都没有发生变化的物质
“一变”
“两不变”
催化作用:催化剂在化学反应中起的作用
固固加热型
固液不加热型
思考:双氧水制氧气与高锰酸钾制氧气相比具有的优点是:
1.操作简单
2.产物无污染
3.不需要加热,节约能源
4.习题练习
(1)如图是实验室加热高锰酸钾制取氧气的装置图,下列有关实验操作的分析错误的是(
)
A.气密性检查:用手握紧试管,观察到水中导气管有气泡冒出,说明装置不漏气
B.试管口略向下倾斜:防止试管壁上的水回流到试管底部,导致试管炸裂
C.加热:直接用酒精灯的火焰对准药品所在位置加热
D.停止加热:先把导管移出水面,再熄灭酒精灯
(2)工业上制取大量氧气的方法是(
)
A.加热氯酸钾
B.加热高锰酸钾
C.分离液态空气
D.加热二氧化锰
(3)下图是实验室制备、收集、验满、验证氧气性质的操作,其中正确的是(
)
教学目标:
1.了解实验室制取氧气的主要方法和原理
2.了解氧气工业制法
3.掌握实验装置和操作方法
教学重点难点:
氧气实验室制法的操作及注意事项
教学准备:
课件
实验仪器
药品
教学过程:
复习氧气的性质和用途导入制发法
板书氧气的制法
提问:
人类呼吸的氧气是怎样获得的?
讲解:
绿色植物光合作用放出的
自然界中氧气的获得:绿色植物的光合作用
提问:
医院里医生给病人吸的氧气是从哪里得来的?
讲解:
氧气的工业制法
工业上氧气的制法:
分离液态空气法
原理:
利用氧气和氮气的沸点不同
过程:
提问:
我们在实验室要研究氧气的性质,需要少量的氧气怎样来获得?
实验室制取氧气的方法
选用加热高锰酸钾来制取氧气
原理:
装置图:
实验操作步骤:
①要求组装好仪器后并检查装置的气密性(组装顺序:先下后上、从左到右)
②将高锰酸钾装入试管里,并在试管口放一团棉花,用
带有导管的塞子塞紧试管口;
③把试管口略向下倾斜,固定在铁架台上;
④点燃酒精灯,给试管均匀加热后再集中加热
⑤等气泡连续、均匀放出时,用排水法收集氧气,并将收集好的集气瓶盖上玻璃片后正放在桌上;
⑥实验完毕,将导管移离水面;
⑦熄灭酒精灯,停止加热。
⑧仪器的拆卸:一般与组装顺序相反,先右后左、先上后
下的顺序。
注意事项:
①试管口要略向下倾斜,防止冷凝后的水倒流回试管底部使试管炸裂。
②试管口要放一团棉花,防止固体颗粒进入导管,堵塞导管、污染气体。
③导管伸入试管时露出橡皮塞少许即可,以便于气体排出
④用排水法集气时,应等气泡连续、均匀冒出时再收集,以免收集的气体中混有空气。
⑤用向上排空气法集气时,应将导管伸到接近集气瓶底部,赶尽空气以免收集的气体不纯。
⑥停止加热时,要先将导管从水槽取出然后再熄灭酒精灯,防止试管冷却过程中水槽里的水倒流使试管炸裂。
验满的方法:
排水法:
当集气瓶口有气泡冒出时,
证明已满。
排空气法:
将带火星的木条伸至集气瓶口,复燃则满。
(2)氧气的实验室制法
双氧水分解制取氧气
原理:
过氧化氢
二氧化锰
水
+
氧气
H2O2
H2O
O2
装置:
操作步骤:
①要求组装好仪器后检查装置的气密性。
②将二氧化锰放入锥形瓶中,塞紧橡皮塞(先装固体后状液体)。
③打开分液漏斗的开关,滴加双氧水
④等气泡连续均匀放出时用排水法收集氧气,并将收集好的集气瓶正放在桌子上。
催化剂:在化学反应中,能增大化学反应速率,但本身的质量和化学性质在反应前后都没有发生变化的物质
“一变”
“两不变”
催化作用:催化剂在化学反应中起的作用
固固加热型
固液不加热型
思考:双氧水制氧气与高锰酸钾制氧气相比具有的优点是:
1.操作简单
2.产物无污染
3.不需要加热,节约能源
4.习题练习
(1)如图是实验室加热高锰酸钾制取氧气的装置图,下列有关实验操作的分析错误的是(
)
A.气密性检查:用手握紧试管,观察到水中导气管有气泡冒出,说明装置不漏气
B.试管口略向下倾斜:防止试管壁上的水回流到试管底部,导致试管炸裂
C.加热:直接用酒精灯的火焰对准药品所在位置加热
D.停止加热:先把导管移出水面,再熄灭酒精灯
(2)工业上制取大量氧气的方法是(
)
A.加热氯酸钾
B.加热高锰酸钾
C.分离液态空气
D.加热二氧化锰
(3)下图是实验室制备、收集、验满、验证氧气性质的操作,其中正确的是(
)
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
