初中化学人教版九年级下册第九单元课题3溶质的质量分数练习(含答案)
文档属性
| 名称 | 初中化学人教版九年级下册第九单元课题3溶质的质量分数练习(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-28 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
初中化学人教版九年级下册第九单元课题3溶质的质量分数
学校:
学号:
班级:
姓名:
一、单选题
1.如图是A、B两种物质的溶解度曲线,下列有关说法错误的是(
???)
A.?P点表示A,B物质在t1℃时溶解度相等
B.?若B物质的溶液中混有少量A物质,可通过升温结晶的方法提纯B物质
C.?t2℃时,将75gA物质的饱和溶液稀释成质量分数为20%的溶液,需加水50g
D.?t2℃时,将等质量A,B物质配成饱和溶液,所得溶液的质量A>B
2.现有t2℃时的溶液I、II各100g,溶液I中含物质甲50g,溶液II是物质乙的饱和溶液。物质甲、乙(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是(
?)
A.?t2℃时,溶液I是甲的饱和溶液????????????????????????????B.?t2℃时,溶液I中甲的质量分数为50%
C.?t2℃时,溶液II中含乙37g???????????????????????????????????D.?从t2℃降温至t1℃时,乙不会从溶液II中析出
3.如图是KNO3和NH4Cl的溶解度曲线,下列叙述错误的是(
??)
A.?t1℃时,KNO3的溶解度与NH4Cl的溶解度相等
B.?t2℃时,KNO3饱和溶液中溶质的质量分数是37.5%
C.?t1℃时,NH4Cl的不饱和溶液降温,肯定无晶体析出
D.?t2℃时,KNO3饱和溶液中溶质的质量分数大于NH4Cl饱和溶液中溶质的质量分数
4.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是(?
)
A.?t1℃时,甲和丙的溶解度相等
B.?降低温度可使丙的不饱和溶液变成饱和溶液
C.?甲中含有少量乙时,可采用降温结晶的方法提纯甲
D.?t2℃时,向80g水中加入20g甲,溶解后其溶质质量分数为20%
5.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是(?
)
温度/℃
0
20
40
60
NaCl的溶解度/g
35.7
36.0
36.6
37.3
KNO3的溶解度/g
13.3
31.6
63.9
110
A.?20℃时,100gH2O最多能溶解36.0gNaCl
B.?40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.?可用冷却海水的方法获取大量食盐
D.?其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
6.盐水选种是把种子放在一定浓度的盐水里,利用浮力把好坏种子分开来。20℃时,技术员将一包氯化钠(20℃,S(NaCl)=36g)放入容器中,分三次加入水,充分搅拌,记录情况如下:
次数
第一次
第二次
第三次
加水质量
1000g
1000g
1000g
烧杯内NaCl晶体剩余情况
有
无
无
则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数ω的范围是(
??)
A.?10.71%<ω≤19.35%??????????B.?12%<ω≤24%??????????C.?10.71%≤ω<21.43%??????????D.?12%≤ω<24%
二、填空题
7.硝酸钾的溶解度曲线如图所示。回答下列问题:
(1)30℃时,硝酸钾的溶解度是________g。
(2)60℃时,在100g水中加入60g硝酸钾固体,充分搅拌,所得溶液是________(填“饱和”或“不饱和”)溶液。
(3)将(2)中所得的溶液从60℃降温至30℃,可析出硝酸钾晶体________g,此时溶液的溶质质量分数________45.8%(填“>”“<”或“=”)。
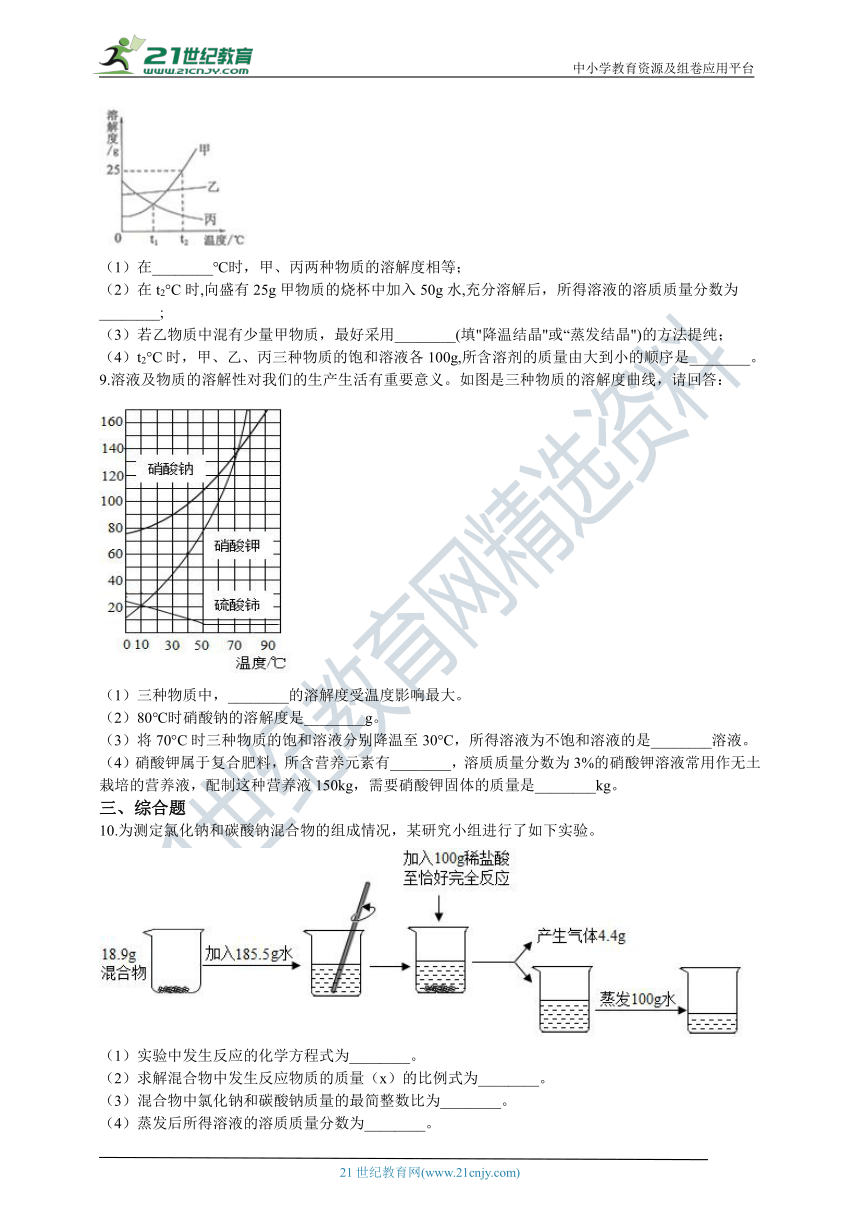
8.请根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)在________℃时,甲、丙两种物质的溶解度相等;
(2)在t2°C时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数为________;
(3)若乙物质中混有少量甲物质,最好采用________(填"降温结晶''或“蒸发结晶")的方法提纯;
(4)t2°C时,甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是________。
9.溶液及物质的溶解性对我们的生产生活有重要意义。如图是三种物质的溶解度曲线,请回答:
(1)三种物质中,________的溶解度受温度影响最大。
(2)80℃时硝酸钠的溶解度是________g。
(3)将70°C时三种物质的饱和溶液分别降温至30°C,所得溶液为不饱和溶液的是________溶液。
(4)硝酸钾属于复合肥料,所含营养元素有________,溶质质量分数为3%的硝酸钾溶液常用作无土栽培的营养液,配制这种营养液150kg,需要硝酸钾固体的质量是________kg。
三、综合题
10.为测定氯化钠和碳酸钠混合物的组成情况,某研究小组进行了如下实验。
(1)实验中发生反应的化学方程式为________。
(2)求解混合物中发生反应物质的质量(x)的比例式为________。
(3)混合物中氯化钠和碳酸钠质量的最简整数比为________。
(4)蒸发后所得溶液的溶质质量分数为________。
(5)若用36.5%的浓盐酸配制实验所用的稀盐酸,需加水的质量________。
(6)上述稀释操作中,需要用到的实验仪器有量筒、烧杯、________。
11.溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是___________(填序号)。
A.硝酸钾??????????????B.植物油???????????C.面粉
(2)下列有关溶液的说法中,正确的是_________(填序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
(3)如图为甲、乙、丙三种固体物质的溶解度曲线。
①t1℃时,甲、乙两种物质的溶解度________(填“相等”或“不相等”)。
②t2℃时,甲物质饱和溶液中溶质与溶剂的质量比为________(填最简比)。
③现有t1℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t2℃,所得溶液中溶质质量分数大小关系是________(填序号)。
A.甲>乙>丙???????????
B.甲=乙<丙???????????
C.甲=乙>丙
(4)用固体氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,需要氯化钠的质量为________g。若用已配好的50g溶质质量分数为6%的氯化钠溶液配制溶质质量分数为3%的氯化钠溶液,需要加水的质量为________g。
四、计算题
12.铜锌合金又称假黄金。向盛有30g铜锌合金粉末样品的烧杯中逐渐加入稀硫酸,生成氢的质量与加入稀硫酸的质量关系如右图所示,计算:
(1)充分反应后生成氢气的质量为________g。
(2)合金样品中锌的质量为________。
(3)恰好完全反应时,所得溶液溶质的质量分数为________。(结果保留一位小数)
13.为了测定某银、锌合金(假设合金中只含银和锌)中银的质量分数,某同学称取20g银锌合金粉末进行实验,现将125g稀硫酸分五次加入合金粉末中,充分反应后测得生成气体的总质量如表所示:
第1次
第2次
第3次
第4次
第5次
滴入稀硫酸的质量/g
25
25
25
25
25
生成气体的总质量/g
0.05
m
0.15
0.20
0.20
请完成下列问题:
(1)表中m的值为________;
(2)银、锌合金中银的质量分数为________;
(3)所用稀硫酸的溶质质量分数是多少?(写出具体计算过程)
14.实验室用硫酸铜(不含结晶水)作过氧化氢溶液制取氧气的催化剂。现在2.0g硫酸铜中加入34.0g过氧化氢溶液,充分反应后,实验的相关数据如图。(不考虑反应过程中水分的蒸发),请计算:
(1)制得氧气的质量为________g。
(2)过氧化氢溶液中溶质的质量分数为多少?(写出计算过程)。
(3)反应后所得硫酸铜溶液的溶质质量分数为________(精确到0.1%)。
15.过氧化氢溶液俗称双氧水,是一种常见消毒剂。实验员用以下方法制取了少量过氧化氢溶液,在低温下,向56.4g某浓度的稀硫酸中逐渐加入一定量的过氧化钡(BaO2),发生的化学反应为BaO2+H2SO4=BaSO4↓+H2O2,当恰好完全反应时生成23.3g沉淀。计算:
(1)加入BaO2的质量。
(2)反应后所得溶液中溶质质量分数。
(3)医用双氧水常为溶质质量分数为3%的过氧化氢溶液,如果将(2)中所得溶液稀释到医用双氧水浓度,计算需加入水的质量(结果精确到0.1g)。
初中化学人教版九年级下册第九单元课题3溶质的质量分数
一、单选题
1.如图是A、B两种物质的溶解度曲线,下列有关说法错误的是(
???)
A.?P点表示A,B物质在t1℃时溶解度相等
B.?若B物质的溶液中混有少量A物质,可通过升温结晶的方法提纯B物质
C.?t2℃时,将75gA物质的饱和溶液稀释成质量分数为20%的溶液,需加水50g
D.?t2℃时,将等质量A,B物质配成饱和溶液,所得溶液的质量A>B
【答案】
D
【解析】A.
P点表示A,B物质在t1℃时溶解度相等
,表示正确,故A不符合题意
B.A物质的溶解度随温度的升高而增大,B物质的溶解度随温度的升高而减小,因此
B物质的溶液中混有少量A物质,可通过升温结晶的方法提纯B物质
,故B不符合题意
C.
t2℃时,
将75gA物质的饱和溶液稀释成质量分数为20%的溶液
需要加水的质量为,
故C不符合题意;D.t2℃时,物质A的溶解度大于物质B,配制等质量的溶液时,溶解度大的需要的水的质量少,因此配制等质量的饱和溶液的质量B大于A,故D符合题意。
故答案为:D。
2.现有t2℃时的溶液I、II各100g,溶液I中含物质甲50g,溶液II是物质乙的饱和溶液。物质甲、乙(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是(
?)
A.?t2℃时,溶液I是甲的饱和溶液????????????????????????????B.?t2℃时,溶液I中甲的质量分数为50%
C.?t2℃时,溶液II中含乙37g???????????????????????????????????D.?从t2℃降温至t1℃时,乙不会从溶液II中析出
【答案】
B
【解析】A、t2℃时,甲的溶解度为137g,则溶液I是甲的不饱和溶液,故不符合题意;
B、t2℃时,溶液
I
中甲的质量分数为
,故符合题意;
C、t2℃时,甲的溶解度为137g,溶液II中含乙的量大于37g,故不符合题意;
D、根据曲线,乙的溶解度随温度升高而增大,从
t2℃降温至
t1℃时,乙会从溶液
II
中析出,故不符合题意。
故答案为:B。
3.如图是KNO3和NH4Cl的溶解度曲线,下列叙述错误的是(
??)
A.?t1℃时,KNO3的溶解度与NH4Cl的溶解度相等
B.?t2℃时,KNO3饱和溶液中溶质的质量分数是37.5%
C.?t1℃时,NH4Cl的不饱和溶液降温,肯定无晶体析出
D.?t2℃时,KNO3饱和溶液中溶质的质量分数大于NH4Cl饱和溶液中溶质的质量分数
【答案】
C
【解析】A、如溶解度曲线图所示,t1℃时,KNO3的溶解度与NH4Cl的溶解度曲线相交,此时KNO3的溶解度与NH4Cl的溶解度相等,故说法A不符合题意;
B、t2℃时,KNO3饱和溶液中溶解度为60g,所以此时KNO3饱和溶液中溶质的质量分数为
,故说法B不符合题意;C、如溶解度曲线图所示,NH4Cl的溶解度随着温度的降低而降低,所以给NH4Cl的不饱和溶液降温,可能有晶体析出,故说法C符合题意;
D、如溶解度曲线图所示,t2℃时,KNO3的溶解度大于NH4Cl的溶解度,所以此时KNO3饱和溶液中溶质的质量分数大于NH4Cl饱和溶液中溶质的质量分数,故说法D不符合题意。
故答案为:C。
4.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是(?
)
A.?t1℃时,甲和丙的溶解度相等
B.?降低温度可使丙的不饱和溶液变成饱和溶液
C.?甲中含有少量乙时,可采用降温结晶的方法提纯甲
D.?t2℃时,向80g水中加入20g甲,溶解后其溶质质量分数为20%
【答案】
B
【解析】A、根据图示可知,t1℃时,甲、丙的溶解度相等,故A不符合题意;
B、丙的溶解度随温度降低而升高,所以降低温度时,丙的不饱和溶液还是不饱和溶液,故B符合题意;
C、甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,甲中含有少量乙时,可采用降温结晶的方法提纯甲,故C不符合题意;
D、t2℃时,甲的溶解度为50g,向80g水中加入20g甲能全部溶解,溶解后溶质质量分数为
,故D不符合题意。
故答案为:B。
5.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是(?
)
温度/℃
0
20
40
60
NaCl的溶解度/g
35.7
36.0
36.6
37.3
KNO3的溶解度/g
13.3
31.6
63.9
110
A.?20℃时,100gH2O最多能溶解36.0gNaCl
B.?40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.?可用冷却海水的方法获取大量食盐
D.?其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
【答案】
C
【解析】A、根据表格提供的数据,20℃时NaCl的溶解度是36.0g,固体的溶解度是在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,因此20℃时,100gH2O中最多能溶解36.0gNaCl,选项A不符合题意;
B、根据表格提供的数据,40℃时KNO3的溶解度是63.9g,则40℃时KNO3饱和溶液的溶质质量分数为:
,小于63.9%,选项B不符合题意;
C、根据表格提供的数据,氯化钠的溶解度受温度影响较小,且海水中氯化钠的浓度较低,从海水中获取食盐应该采用蒸发结晶的方法(即海水晒盐),用冷却海水的方法不能获取大量食盐,选项C符合题意;
D、从表中数据可知,硝酸钾的溶解度随温度升高而增大,因此在其他条件不变时,升温可将KNO3饱和溶液变为不饱和溶液,选项D不符合题意。
故答案为:C。
6.盐水选种是把种子放在一定浓度的盐水里,利用浮力把好坏种子分开来。20℃时,技术员将一包氯化钠(20℃,S(NaCl)=36g)放入容器中,分三次加入水,充分搅拌,记录情况如下:
次数
第一次
第二次
第三次
加水质量
1000g
1000g
1000g
烧杯内NaCl晶体剩余情况
有
无
无
则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数ω的范围是(
??)
A.?10.71%<ω≤19.35%??????????B.?12%<ω≤24%??????????C.?10.71%≤ω<21.43%??????????D.?12%≤ω<24%
【答案】
A
【解析】20℃时,NaCl溶解度为36g;此时1000g水中最多可溶解NaCl的质量为360g;
第一次:加入1000g水,食盐固体有剩余,则NaCl的总质量大于360g;
第二次:再加入1000g水,食盐固体没有剩余,则NaCl的总质量小于或等于720g;
则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数ω的范围是
,即10.71%<ω≤19.35%。
故答案为:A。
二、填空题
7.硝酸钾的溶解度曲线如图所示。回答下列问题:
(1)30℃时,硝酸钾的溶解度是________g。
(2)60℃时,在100g水中加入60g硝酸钾固体,充分搅拌,所得溶液是________(填“饱和”或“不饱和”)溶液。
(3)将(2)中所得的溶液从60℃降温至30℃,可析出硝酸钾晶体________g,此时溶液的溶质质量分数________45.8%(填“>”“<”或“=”)。
【答案】
(1)45.8
(2)不饱和
(3)14.2g;<
【解析】(1)根据溶解度曲线可知,30℃时,硝酸钾的溶解度是45.8g。(2)根据溶解度曲线可知,60℃时,硝酸钾的溶解度为110g,根据溶解度概念可知,60℃时,100g水与110g的硝酸钾形成饱和溶液。在100g水中加入60g硝酸钾固体,充分搅拌,所得溶液是不饱和溶液;(3)将(2)中所得的溶液从60℃降温至30℃,溶液中的溶剂质量保持不变,仍为100g,根据溶解度概念可知,此时溶液中可溶的溶质质量为45.8g,可析出硝酸钾晶体的质量60g-45.8=14.2g,此时溶液的溶质质量分数=
,小于45.8%,故填<。
8.请根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)在________℃时,甲、丙两种物质的溶解度相等;
(2)在t2°C时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数为________;
(3)若乙物质中混有少量甲物质,最好采用________(填"降温结晶''或“蒸发结晶")的方法提纯;
(4)t2°C时,甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是________。
【答案】
(1)t1
(2)20%
(3)降温结晶
(4)
【解析】(1)有溶解度曲线可知,在t1℃时,甲、丙两条曲线有交点,故t1℃时甲、丙两种物质的溶解度相等;(2)在t2°C时甲物质的溶解度为25g,即100g水中最多溶解25g甲物质。向盛有25g甲物质的烧杯中加入50g水,甲物质的溶解12.5g,
所得溶液的溶质质量分数为
;(3)由溶解度曲线可知甲、乙的溶解度都随温度的升高而增大,但甲受温度的影响变化较大,乙受温度的影响变化较小,故若乙物质中混有少量甲物质,最好采用降温结晶的方法提纯;(4)由溶解度曲线可知,t2°C时,甲、乙、丙三种物质的溶解度大小关系是
,故t2°C时,甲、乙、丙三种溶液的溶质大小关系是
,因此甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是
。
9.溶液及物质的溶解性对我们的生产生活有重要意义。如图是三种物质的溶解度曲线,请回答:
(1)三种物质中,________的溶解度受温度影响最大。
(2)80℃时硝酸钠的溶解度是________g。
(3)将70°C时三种物质的饱和溶液分别降温至30°C,所得溶液为不饱和溶液的是________溶液。
(4)硝酸钾属于复合肥料,所含营养元素有________,溶质质量分数为3%的硝酸钾溶液常用作无土栽培的营养液,配制这种营养液150kg,需要硝酸钾固体的质量是________kg。
【答案】
(1)硝酸钾(或KNO3)
(2)150
(3)硫酸铈
(4)K、N(或“钾、氮”);4.5
【解析】(1)由图示可知,硝酸钾的溶解度受温度影响最大。(2)由图示可知,80℃时硝酸钠的溶解度为150g。(3)将70℃时三种物质的饱和溶液分别降温至30℃,从图示可以看出,硝酸钾和硝酸钠的溶解度降低,而硫酸铈的溶解度升高,所以硝酸钾和硝酸钠还是饱和溶液,硫酸铈从饱和溶液变为了不饱和溶液,故填硫酸铈。(4)硝酸钾属于复合肥,从其化学式KNO3可以看出含钾元素和氮元素,故填K、N(或“钾、氮”);配置150kg的3%的硝酸钾溶液,需要硝酸钾固体的质量是
,故填4.5。
三、综合题
10.为测定氯化钠和碳酸钠混合物的组成情况,某研究小组进行了如下实验。
(1)实验中发生反应的化学方程式为________。
(2)求解混合物中发生反应物质的质量(x)的比例式为________。
(3)混合物中氯化钠和碳酸钠质量的最简整数比为________。
(4)蒸发后所得溶液的溶质质量分数为________。
(5)若用36.5%的浓盐酸配制实验所用的稀盐酸,需加水的质量________。
(6)上述稀释操作中,需要用到的实验仪器有量筒、烧杯、________。
【答案】
(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)
(3)83:106
(4)10%
(5)80g
(6)胶头滴管、玻璃棒
【解析】【解答】(1)该实验碳酸钠与盐酸反应生成二氧化碳和水和氯化钠,化学方程式为:
;(2)设碳酸钠的质量为x
,
消耗氯化氢的质量为y
,
生成氯化钠的质量为z
,
?x=10.6g
y=7.3g
z=11.7g
混合物中氯化钠和碳酸钠质量的最简整数比:(18.9g﹣10.6g):10.6g=83:106;
蒸发后所得溶液的溶质质量分数为:
答:蒸发后所得溶液的溶质质量分数为10%;
(5)若用36.5%的浓盐酸配制实验所用的稀盐酸,用36.5%的浓盐酸的质量为:7.3g÷36.5%=20g
则加入的水的质量为:100g﹣20g=80g
(6)稀释操作中,需要用到的实验仪器有量筒、烧杯、胶头滴管、玻璃棒。
11.溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是___________(填序号)。
A.硝酸钾??????????????
B.植物油???????????
C.面粉
(2)下列有关溶液的说法中,正确的是_________(填序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
(3)如图为甲、乙、丙三种固体物质的溶解度曲线。
①t1℃时,甲、乙两种物质的溶解度________(填“相等”或“不相等”)。
②t2℃时,甲物质饱和溶液中溶质与溶剂的质量比为________(填最简比)。
③现有t1℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t2℃,所得溶液中溶质质量分数大小关系是________(填序号)。
A.甲>乙>丙???????????
B.甲=乙<丙???????????
C.甲=乙>丙
(4)用固体氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,需要氯化钠的质量为________g。若用已配好的50g溶质质量分数为6%的氯化钠溶液配制溶质质量分数为3%的氯化钠溶液,需要加水的质量为________g。
【答案】
(1)A
(2)B
(3)相等;1:2;C
(4)3;50
【解析】(1)把硝酸钾放入水中充分搅拌,能得到溶液,把植物油放入水中充分搅拌会生成乳浊液,面粉放入水中充分搅拌会形成悬浊液,
故答案为:A。
(2)A、均一的、稳定的液体不一定是溶液,如水,故A选项不正确;B、溶液是均一的、稳定的混合物,故B选项正确;C、溶液不一定是无色的,如硫酸铜溶液是蓝色的,且溶剂不一定是水,如碘酒中溶剂是酒精,故C选项不正确。故答案为:B。
(3)①在t1°C时,甲与乙的溶解度曲线交于一点,表示该温度下二者的溶解度相等。
②据溶解度曲线知,t2°C时甲物质的溶解度为50g,即100g溶剂中溶解50g甲,故t2°C时,甲物质的饱和溶液中溶质与溶剂的质量比为50:
100=1:2。
③t1°C时,甲和乙的溶解度相等,质量分数也相等,丙的溶解度最小,丙的质量分数也最小,所以此时质量分数大小为甲=乙>丙。升高温度后,甲、乙丙溶质质量不变,溶液质量不变,因此溶质质量分数不变,仍然是甲=乙>丙,故答案为:C。
(4)用固体氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,需要氯化钠的质量
;若用已配好的50g溶质质量分数为6%的氯化钠溶液配制溶质质量分数为3%的氯化钠溶液,设3%的氯化钠溶液的质量为
,则
,解得:
,3%的氯化钠溶液质量是100g,则还需要水的质量是100g-50g=50g。
四、计算题
12.铜锌合金又称假黄金。向盛有30g铜锌合金粉末样品的烧杯中逐渐加入稀硫酸,生成氢的质量与加入稀硫酸的质量关系如右图所示,计算:
(1)充分反应后生成氢气的质量为________g。
(2)合金样品中锌的质量为________。
(3)恰好完全反应时,所得溶液溶质的质量分数为________。(结果保留一位小数)
【答案】
(1)0.2
(2)6.5g
(3)15.1%
【解析】(1)由图中信息知,充分反应后生成氢气的质量为0.2g。(2)解∶设合金样品中锌的质量为x,反应生成硫酸锌质量为y
Zn+H2SO4=
ZnSO4+
H2↑
65
161
2
x
y
0.2g
=
,x=6.5g;
=
,y=16.1g。(3)恰好完全反应时,所得溶液溶质的质量分数为∶
×100%=15.1%。
13.为了测定某银、锌合金(假设合金中只含银和锌)中银的质量分数,某同学称取20g银锌合金粉末进行实验,现将125g稀硫酸分五次加入合金粉末中,充分反应后测得生成气体的总质量如表所示:
第1次
第2次
第3次
第4次
第5次
滴入稀硫酸的质量/g
25
25
25
25
25
生成气体的总质量/g
0.05
m
0.15
0.20
0.20
请完成下列问题:
(1)表中m的值为________;
(2)银、锌合金中银的质量分数为________;
(3)所用稀硫酸的溶质质量分数是多少?(写出具体计算过程)
【答案】
(1)0.10
(2)67.5%
(3)解:设硫酸的质量是
,
,解得
=2.45g,所用稀硫酸的溶质质量分数是
。
答:所用稀硫酸的溶质质量分数为9.8%。
【解析】(1)由分析知:m为0.10g;(2)设锌的质量为
,
?,解得
=6.5g,则银、锌合金中银的质量分数为
;
14.实验室用硫酸铜(不含结晶水)作过氧化氢溶液制取氧气的催化剂。现在2.0g硫酸铜中加入34.0g过氧化氢溶液,充分反应后,实验的相关数据如图。(不考虑反应过程中水分的蒸发),请计算:
(1)制得氧气的质量为________g。
(2)过氧化氢溶液中溶质的质量分数为多少?(写出计算过程)。
(3)反应后所得硫酸铜溶液的溶质质量分数为________(精确到0.1%)。
【答案】
(1)0.8
(2)解:设过氧化氢溶液中溶质的质量分数为x
?
x=5%(3)反应后所得硫酸铜溶液的溶质质量分数为
×100%=5.7%。
【解析】根据质量守恒定律可得,生成的氧气的质量为36g﹣35.2g=0.8g
15.过氧化氢溶液俗称双氧水,是一种常见消毒剂。实验员用以下方法制取了少量过氧化氢溶液,在低温下,向56.4g某浓度的稀硫酸中逐渐加入一定量的过氧化钡(BaO2),发生的化学反应为BaO2+H2SO4=BaSO4↓+H2O2,当恰好完全反应时生成23.3g沉淀。计算:
(1)加入BaO2的质量。
(2)反应后所得溶液中溶质质量分数。
(3)医用双氧水常为溶质质量分数为3%的过氧化氢溶液,如果将(2)中所得溶液稀释到医用双氧水浓度,计算需加入水的质量(结果精确到0.1g)。
【答案】
(1)解:设加入BaO2的质量为x,生成的H2O2质量为y。
x=16.9g,
y=3.4g,
答:加入BaO2的质量为16.9g
(2)反应后所得溶液中溶质质量分数=
×100%
=
6.8%
(3)设需加入水的质量为z,则(16.9+56.4-23.3)×6.8%
=(50+z)×3%
,z=63.3g;
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
初中化学人教版九年级下册第九单元课题3溶质的质量分数
学校:
学号:
班级:
姓名:
一、单选题
1.如图是A、B两种物质的溶解度曲线,下列有关说法错误的是(
???)
A.?P点表示A,B物质在t1℃时溶解度相等
B.?若B物质的溶液中混有少量A物质,可通过升温结晶的方法提纯B物质
C.?t2℃时,将75gA物质的饱和溶液稀释成质量分数为20%的溶液,需加水50g
D.?t2℃时,将等质量A,B物质配成饱和溶液,所得溶液的质量A>B
2.现有t2℃时的溶液I、II各100g,溶液I中含物质甲50g,溶液II是物质乙的饱和溶液。物质甲、乙(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是(
?)
A.?t2℃时,溶液I是甲的饱和溶液????????????????????????????B.?t2℃时,溶液I中甲的质量分数为50%
C.?t2℃时,溶液II中含乙37g???????????????????????????????????D.?从t2℃降温至t1℃时,乙不会从溶液II中析出
3.如图是KNO3和NH4Cl的溶解度曲线,下列叙述错误的是(
??)
A.?t1℃时,KNO3的溶解度与NH4Cl的溶解度相等
B.?t2℃时,KNO3饱和溶液中溶质的质量分数是37.5%
C.?t1℃时,NH4Cl的不饱和溶液降温,肯定无晶体析出
D.?t2℃时,KNO3饱和溶液中溶质的质量分数大于NH4Cl饱和溶液中溶质的质量分数
4.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是(?
)
A.?t1℃时,甲和丙的溶解度相等
B.?降低温度可使丙的不饱和溶液变成饱和溶液
C.?甲中含有少量乙时,可采用降温结晶的方法提纯甲
D.?t2℃时,向80g水中加入20g甲,溶解后其溶质质量分数为20%
5.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是(?
)
温度/℃
0
20
40
60
NaCl的溶解度/g
35.7
36.0
36.6
37.3
KNO3的溶解度/g
13.3
31.6
63.9
110
A.?20℃时,100gH2O最多能溶解36.0gNaCl
B.?40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.?可用冷却海水的方法获取大量食盐
D.?其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
6.盐水选种是把种子放在一定浓度的盐水里,利用浮力把好坏种子分开来。20℃时,技术员将一包氯化钠(20℃,S(NaCl)=36g)放入容器中,分三次加入水,充分搅拌,记录情况如下:
次数
第一次
第二次
第三次
加水质量
1000g
1000g
1000g
烧杯内NaCl晶体剩余情况
有
无
无
则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数ω的范围是(
??)
A.?10.71%<ω≤19.35%??????????B.?12%<ω≤24%??????????C.?10.71%≤ω<21.43%??????????D.?12%≤ω<24%
二、填空题
7.硝酸钾的溶解度曲线如图所示。回答下列问题:
(1)30℃时,硝酸钾的溶解度是________g。
(2)60℃时,在100g水中加入60g硝酸钾固体,充分搅拌,所得溶液是________(填“饱和”或“不饱和”)溶液。
(3)将(2)中所得的溶液从60℃降温至30℃,可析出硝酸钾晶体________g,此时溶液的溶质质量分数________45.8%(填“>”“<”或“=”)。
8.请根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)在________℃时,甲、丙两种物质的溶解度相等;
(2)在t2°C时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数为________;
(3)若乙物质中混有少量甲物质,最好采用________(填"降温结晶''或“蒸发结晶")的方法提纯;
(4)t2°C时,甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是________。
9.溶液及物质的溶解性对我们的生产生活有重要意义。如图是三种物质的溶解度曲线,请回答:
(1)三种物质中,________的溶解度受温度影响最大。
(2)80℃时硝酸钠的溶解度是________g。
(3)将70°C时三种物质的饱和溶液分别降温至30°C,所得溶液为不饱和溶液的是________溶液。
(4)硝酸钾属于复合肥料,所含营养元素有________,溶质质量分数为3%的硝酸钾溶液常用作无土栽培的营养液,配制这种营养液150kg,需要硝酸钾固体的质量是________kg。
三、综合题
10.为测定氯化钠和碳酸钠混合物的组成情况,某研究小组进行了如下实验。
(1)实验中发生反应的化学方程式为________。
(2)求解混合物中发生反应物质的质量(x)的比例式为________。
(3)混合物中氯化钠和碳酸钠质量的最简整数比为________。
(4)蒸发后所得溶液的溶质质量分数为________。
(5)若用36.5%的浓盐酸配制实验所用的稀盐酸,需加水的质量________。
(6)上述稀释操作中,需要用到的实验仪器有量筒、烧杯、________。
11.溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是___________(填序号)。
A.硝酸钾??????????????B.植物油???????????C.面粉
(2)下列有关溶液的说法中,正确的是_________(填序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
(3)如图为甲、乙、丙三种固体物质的溶解度曲线。
①t1℃时,甲、乙两种物质的溶解度________(填“相等”或“不相等”)。
②t2℃时,甲物质饱和溶液中溶质与溶剂的质量比为________(填最简比)。
③现有t1℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t2℃,所得溶液中溶质质量分数大小关系是________(填序号)。
A.甲>乙>丙???????????
B.甲=乙<丙???????????
C.甲=乙>丙
(4)用固体氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,需要氯化钠的质量为________g。若用已配好的50g溶质质量分数为6%的氯化钠溶液配制溶质质量分数为3%的氯化钠溶液,需要加水的质量为________g。
四、计算题
12.铜锌合金又称假黄金。向盛有30g铜锌合金粉末样品的烧杯中逐渐加入稀硫酸,生成氢的质量与加入稀硫酸的质量关系如右图所示,计算:
(1)充分反应后生成氢气的质量为________g。
(2)合金样品中锌的质量为________。
(3)恰好完全反应时,所得溶液溶质的质量分数为________。(结果保留一位小数)
13.为了测定某银、锌合金(假设合金中只含银和锌)中银的质量分数,某同学称取20g银锌合金粉末进行实验,现将125g稀硫酸分五次加入合金粉末中,充分反应后测得生成气体的总质量如表所示:
第1次
第2次
第3次
第4次
第5次
滴入稀硫酸的质量/g
25
25
25
25
25
生成气体的总质量/g
0.05
m
0.15
0.20
0.20
请完成下列问题:
(1)表中m的值为________;
(2)银、锌合金中银的质量分数为________;
(3)所用稀硫酸的溶质质量分数是多少?(写出具体计算过程)
14.实验室用硫酸铜(不含结晶水)作过氧化氢溶液制取氧气的催化剂。现在2.0g硫酸铜中加入34.0g过氧化氢溶液,充分反应后,实验的相关数据如图。(不考虑反应过程中水分的蒸发),请计算:
(1)制得氧气的质量为________g。
(2)过氧化氢溶液中溶质的质量分数为多少?(写出计算过程)。
(3)反应后所得硫酸铜溶液的溶质质量分数为________(精确到0.1%)。
15.过氧化氢溶液俗称双氧水,是一种常见消毒剂。实验员用以下方法制取了少量过氧化氢溶液,在低温下,向56.4g某浓度的稀硫酸中逐渐加入一定量的过氧化钡(BaO2),发生的化学反应为BaO2+H2SO4=BaSO4↓+H2O2,当恰好完全反应时生成23.3g沉淀。计算:
(1)加入BaO2的质量。
(2)反应后所得溶液中溶质质量分数。
(3)医用双氧水常为溶质质量分数为3%的过氧化氢溶液,如果将(2)中所得溶液稀释到医用双氧水浓度,计算需加入水的质量(结果精确到0.1g)。
初中化学人教版九年级下册第九单元课题3溶质的质量分数
一、单选题
1.如图是A、B两种物质的溶解度曲线,下列有关说法错误的是(
???)
A.?P点表示A,B物质在t1℃时溶解度相等
B.?若B物质的溶液中混有少量A物质,可通过升温结晶的方法提纯B物质
C.?t2℃时,将75gA物质的饱和溶液稀释成质量分数为20%的溶液,需加水50g
D.?t2℃时,将等质量A,B物质配成饱和溶液,所得溶液的质量A>B
【答案】
D
【解析】A.
P点表示A,B物质在t1℃时溶解度相等
,表示正确,故A不符合题意
B.A物质的溶解度随温度的升高而增大,B物质的溶解度随温度的升高而减小,因此
B物质的溶液中混有少量A物质,可通过升温结晶的方法提纯B物质
,故B不符合题意
C.
t2℃时,
将75gA物质的饱和溶液稀释成质量分数为20%的溶液
需要加水的质量为,
故C不符合题意;D.t2℃时,物质A的溶解度大于物质B,配制等质量的溶液时,溶解度大的需要的水的质量少,因此配制等质量的饱和溶液的质量B大于A,故D符合题意。
故答案为:D。
2.现有t2℃时的溶液I、II各100g,溶液I中含物质甲50g,溶液II是物质乙的饱和溶液。物质甲、乙(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是(
?)
A.?t2℃时,溶液I是甲的饱和溶液????????????????????????????B.?t2℃时,溶液I中甲的质量分数为50%
C.?t2℃时,溶液II中含乙37g???????????????????????????????????D.?从t2℃降温至t1℃时,乙不会从溶液II中析出
【答案】
B
【解析】A、t2℃时,甲的溶解度为137g,则溶液I是甲的不饱和溶液,故不符合题意;
B、t2℃时,溶液
I
中甲的质量分数为
,故符合题意;
C、t2℃时,甲的溶解度为137g,溶液II中含乙的量大于37g,故不符合题意;
D、根据曲线,乙的溶解度随温度升高而增大,从
t2℃降温至
t1℃时,乙会从溶液
II
中析出,故不符合题意。
故答案为:B。
3.如图是KNO3和NH4Cl的溶解度曲线,下列叙述错误的是(
??)
A.?t1℃时,KNO3的溶解度与NH4Cl的溶解度相等
B.?t2℃时,KNO3饱和溶液中溶质的质量分数是37.5%
C.?t1℃时,NH4Cl的不饱和溶液降温,肯定无晶体析出
D.?t2℃时,KNO3饱和溶液中溶质的质量分数大于NH4Cl饱和溶液中溶质的质量分数
【答案】
C
【解析】A、如溶解度曲线图所示,t1℃时,KNO3的溶解度与NH4Cl的溶解度曲线相交,此时KNO3的溶解度与NH4Cl的溶解度相等,故说法A不符合题意;
B、t2℃时,KNO3饱和溶液中溶解度为60g,所以此时KNO3饱和溶液中溶质的质量分数为
,故说法B不符合题意;C、如溶解度曲线图所示,NH4Cl的溶解度随着温度的降低而降低,所以给NH4Cl的不饱和溶液降温,可能有晶体析出,故说法C符合题意;
D、如溶解度曲线图所示,t2℃时,KNO3的溶解度大于NH4Cl的溶解度,所以此时KNO3饱和溶液中溶质的质量分数大于NH4Cl饱和溶液中溶质的质量分数,故说法D不符合题意。
故答案为:C。
4.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是(?
)
A.?t1℃时,甲和丙的溶解度相等
B.?降低温度可使丙的不饱和溶液变成饱和溶液
C.?甲中含有少量乙时,可采用降温结晶的方法提纯甲
D.?t2℃时,向80g水中加入20g甲,溶解后其溶质质量分数为20%
【答案】
B
【解析】A、根据图示可知,t1℃时,甲、丙的溶解度相等,故A不符合题意;
B、丙的溶解度随温度降低而升高,所以降低温度时,丙的不饱和溶液还是不饱和溶液,故B符合题意;
C、甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,甲中含有少量乙时,可采用降温结晶的方法提纯甲,故C不符合题意;
D、t2℃时,甲的溶解度为50g,向80g水中加入20g甲能全部溶解,溶解后溶质质量分数为
,故D不符合题意。
故答案为:B。
5.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是(?
)
温度/℃
0
20
40
60
NaCl的溶解度/g
35.7
36.0
36.6
37.3
KNO3的溶解度/g
13.3
31.6
63.9
110
A.?20℃时,100gH2O最多能溶解36.0gNaCl
B.?40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.?可用冷却海水的方法获取大量食盐
D.?其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
【答案】
C
【解析】A、根据表格提供的数据,20℃时NaCl的溶解度是36.0g,固体的溶解度是在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,因此20℃时,100gH2O中最多能溶解36.0gNaCl,选项A不符合题意;
B、根据表格提供的数据,40℃时KNO3的溶解度是63.9g,则40℃时KNO3饱和溶液的溶质质量分数为:
,小于63.9%,选项B不符合题意;
C、根据表格提供的数据,氯化钠的溶解度受温度影响较小,且海水中氯化钠的浓度较低,从海水中获取食盐应该采用蒸发结晶的方法(即海水晒盐),用冷却海水的方法不能获取大量食盐,选项C符合题意;
D、从表中数据可知,硝酸钾的溶解度随温度升高而增大,因此在其他条件不变时,升温可将KNO3饱和溶液变为不饱和溶液,选项D不符合题意。
故答案为:C。
6.盐水选种是把种子放在一定浓度的盐水里,利用浮力把好坏种子分开来。20℃时,技术员将一包氯化钠(20℃,S(NaCl)=36g)放入容器中,分三次加入水,充分搅拌,记录情况如下:
次数
第一次
第二次
第三次
加水质量
1000g
1000g
1000g
烧杯内NaCl晶体剩余情况
有
无
无
则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数ω的范围是(
??)
A.?10.71%<ω≤19.35%??????????B.?12%<ω≤24%??????????C.?10.71%≤ω<21.43%??????????D.?12%≤ω<24%
【答案】
A
【解析】20℃时,NaCl溶解度为36g;此时1000g水中最多可溶解NaCl的质量为360g;
第一次:加入1000g水,食盐固体有剩余,则NaCl的总质量大于360g;
第二次:再加入1000g水,食盐固体没有剩余,则NaCl的总质量小于或等于720g;
则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数ω的范围是
,即10.71%<ω≤19.35%。
故答案为:A。
二、填空题
7.硝酸钾的溶解度曲线如图所示。回答下列问题:
(1)30℃时,硝酸钾的溶解度是________g。
(2)60℃时,在100g水中加入60g硝酸钾固体,充分搅拌,所得溶液是________(填“饱和”或“不饱和”)溶液。
(3)将(2)中所得的溶液从60℃降温至30℃,可析出硝酸钾晶体________g,此时溶液的溶质质量分数________45.8%(填“>”“<”或“=”)。
【答案】
(1)45.8
(2)不饱和
(3)14.2g;<
【解析】(1)根据溶解度曲线可知,30℃时,硝酸钾的溶解度是45.8g。(2)根据溶解度曲线可知,60℃时,硝酸钾的溶解度为110g,根据溶解度概念可知,60℃时,100g水与110g的硝酸钾形成饱和溶液。在100g水中加入60g硝酸钾固体,充分搅拌,所得溶液是不饱和溶液;(3)将(2)中所得的溶液从60℃降温至30℃,溶液中的溶剂质量保持不变,仍为100g,根据溶解度概念可知,此时溶液中可溶的溶质质量为45.8g,可析出硝酸钾晶体的质量60g-45.8=14.2g,此时溶液的溶质质量分数=
,小于45.8%,故填<。
8.请根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)在________℃时,甲、丙两种物质的溶解度相等;
(2)在t2°C时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数为________;
(3)若乙物质中混有少量甲物质,最好采用________(填"降温结晶''或“蒸发结晶")的方法提纯;
(4)t2°C时,甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是________。
【答案】
(1)t1
(2)20%
(3)降温结晶
(4)
【解析】(1)有溶解度曲线可知,在t1℃时,甲、丙两条曲线有交点,故t1℃时甲、丙两种物质的溶解度相等;(2)在t2°C时甲物质的溶解度为25g,即100g水中最多溶解25g甲物质。向盛有25g甲物质的烧杯中加入50g水,甲物质的溶解12.5g,
所得溶液的溶质质量分数为
;(3)由溶解度曲线可知甲、乙的溶解度都随温度的升高而增大,但甲受温度的影响变化较大,乙受温度的影响变化较小,故若乙物质中混有少量甲物质,最好采用降温结晶的方法提纯;(4)由溶解度曲线可知,t2°C时,甲、乙、丙三种物质的溶解度大小关系是
,故t2°C时,甲、乙、丙三种溶液的溶质大小关系是
,因此甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是
。
9.溶液及物质的溶解性对我们的生产生活有重要意义。如图是三种物质的溶解度曲线,请回答:
(1)三种物质中,________的溶解度受温度影响最大。
(2)80℃时硝酸钠的溶解度是________g。
(3)将70°C时三种物质的饱和溶液分别降温至30°C,所得溶液为不饱和溶液的是________溶液。
(4)硝酸钾属于复合肥料,所含营养元素有________,溶质质量分数为3%的硝酸钾溶液常用作无土栽培的营养液,配制这种营养液150kg,需要硝酸钾固体的质量是________kg。
【答案】
(1)硝酸钾(或KNO3)
(2)150
(3)硫酸铈
(4)K、N(或“钾、氮”);4.5
【解析】(1)由图示可知,硝酸钾的溶解度受温度影响最大。(2)由图示可知,80℃时硝酸钠的溶解度为150g。(3)将70℃时三种物质的饱和溶液分别降温至30℃,从图示可以看出,硝酸钾和硝酸钠的溶解度降低,而硫酸铈的溶解度升高,所以硝酸钾和硝酸钠还是饱和溶液,硫酸铈从饱和溶液变为了不饱和溶液,故填硫酸铈。(4)硝酸钾属于复合肥,从其化学式KNO3可以看出含钾元素和氮元素,故填K、N(或“钾、氮”);配置150kg的3%的硝酸钾溶液,需要硝酸钾固体的质量是
,故填4.5。
三、综合题
10.为测定氯化钠和碳酸钠混合物的组成情况,某研究小组进行了如下实验。
(1)实验中发生反应的化学方程式为________。
(2)求解混合物中发生反应物质的质量(x)的比例式为________。
(3)混合物中氯化钠和碳酸钠质量的最简整数比为________。
(4)蒸发后所得溶液的溶质质量分数为________。
(5)若用36.5%的浓盐酸配制实验所用的稀盐酸,需加水的质量________。
(6)上述稀释操作中,需要用到的实验仪器有量筒、烧杯、________。
【答案】
(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)
(3)83:106
(4)10%
(5)80g
(6)胶头滴管、玻璃棒
【解析】【解答】(1)该实验碳酸钠与盐酸反应生成二氧化碳和水和氯化钠,化学方程式为:
;(2)设碳酸钠的质量为x
,
消耗氯化氢的质量为y
,
生成氯化钠的质量为z
,
?x=10.6g
y=7.3g
z=11.7g
混合物中氯化钠和碳酸钠质量的最简整数比:(18.9g﹣10.6g):10.6g=83:106;
蒸发后所得溶液的溶质质量分数为:
答:蒸发后所得溶液的溶质质量分数为10%;
(5)若用36.5%的浓盐酸配制实验所用的稀盐酸,用36.5%的浓盐酸的质量为:7.3g÷36.5%=20g
则加入的水的质量为:100g﹣20g=80g
(6)稀释操作中,需要用到的实验仪器有量筒、烧杯、胶头滴管、玻璃棒。
11.溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是___________(填序号)。
A.硝酸钾??????????????
B.植物油???????????
C.面粉
(2)下列有关溶液的说法中,正确的是_________(填序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
(3)如图为甲、乙、丙三种固体物质的溶解度曲线。
①t1℃时,甲、乙两种物质的溶解度________(填“相等”或“不相等”)。
②t2℃时,甲物质饱和溶液中溶质与溶剂的质量比为________(填最简比)。
③现有t1℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t2℃,所得溶液中溶质质量分数大小关系是________(填序号)。
A.甲>乙>丙???????????
B.甲=乙<丙???????????
C.甲=乙>丙
(4)用固体氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,需要氯化钠的质量为________g。若用已配好的50g溶质质量分数为6%的氯化钠溶液配制溶质质量分数为3%的氯化钠溶液,需要加水的质量为________g。
【答案】
(1)A
(2)B
(3)相等;1:2;C
(4)3;50
【解析】(1)把硝酸钾放入水中充分搅拌,能得到溶液,把植物油放入水中充分搅拌会生成乳浊液,面粉放入水中充分搅拌会形成悬浊液,
故答案为:A。
(2)A、均一的、稳定的液体不一定是溶液,如水,故A选项不正确;B、溶液是均一的、稳定的混合物,故B选项正确;C、溶液不一定是无色的,如硫酸铜溶液是蓝色的,且溶剂不一定是水,如碘酒中溶剂是酒精,故C选项不正确。故答案为:B。
(3)①在t1°C时,甲与乙的溶解度曲线交于一点,表示该温度下二者的溶解度相等。
②据溶解度曲线知,t2°C时甲物质的溶解度为50g,即100g溶剂中溶解50g甲,故t2°C时,甲物质的饱和溶液中溶质与溶剂的质量比为50:
100=1:2。
③t1°C时,甲和乙的溶解度相等,质量分数也相等,丙的溶解度最小,丙的质量分数也最小,所以此时质量分数大小为甲=乙>丙。升高温度后,甲、乙丙溶质质量不变,溶液质量不变,因此溶质质量分数不变,仍然是甲=乙>丙,故答案为:C。
(4)用固体氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,需要氯化钠的质量
;若用已配好的50g溶质质量分数为6%的氯化钠溶液配制溶质质量分数为3%的氯化钠溶液,设3%的氯化钠溶液的质量为
,则
,解得:
,3%的氯化钠溶液质量是100g,则还需要水的质量是100g-50g=50g。
四、计算题
12.铜锌合金又称假黄金。向盛有30g铜锌合金粉末样品的烧杯中逐渐加入稀硫酸,生成氢的质量与加入稀硫酸的质量关系如右图所示,计算:
(1)充分反应后生成氢气的质量为________g。
(2)合金样品中锌的质量为________。
(3)恰好完全反应时,所得溶液溶质的质量分数为________。(结果保留一位小数)
【答案】
(1)0.2
(2)6.5g
(3)15.1%
【解析】(1)由图中信息知,充分反应后生成氢气的质量为0.2g。(2)解∶设合金样品中锌的质量为x,反应生成硫酸锌质量为y
Zn+H2SO4=
ZnSO4+
H2↑
65
161
2
x
y
0.2g
=
,x=6.5g;
=
,y=16.1g。(3)恰好完全反应时,所得溶液溶质的质量分数为∶
×100%=15.1%。
13.为了测定某银、锌合金(假设合金中只含银和锌)中银的质量分数,某同学称取20g银锌合金粉末进行实验,现将125g稀硫酸分五次加入合金粉末中,充分反应后测得生成气体的总质量如表所示:
第1次
第2次
第3次
第4次
第5次
滴入稀硫酸的质量/g
25
25
25
25
25
生成气体的总质量/g
0.05
m
0.15
0.20
0.20
请完成下列问题:
(1)表中m的值为________;
(2)银、锌合金中银的质量分数为________;
(3)所用稀硫酸的溶质质量分数是多少?(写出具体计算过程)
【答案】
(1)0.10
(2)67.5%
(3)解:设硫酸的质量是
,
,解得
=2.45g,所用稀硫酸的溶质质量分数是
。
答:所用稀硫酸的溶质质量分数为9.8%。
【解析】(1)由分析知:m为0.10g;(2)设锌的质量为
,
?,解得
=6.5g,则银、锌合金中银的质量分数为
;
14.实验室用硫酸铜(不含结晶水)作过氧化氢溶液制取氧气的催化剂。现在2.0g硫酸铜中加入34.0g过氧化氢溶液,充分反应后,实验的相关数据如图。(不考虑反应过程中水分的蒸发),请计算:
(1)制得氧气的质量为________g。
(2)过氧化氢溶液中溶质的质量分数为多少?(写出计算过程)。
(3)反应后所得硫酸铜溶液的溶质质量分数为________(精确到0.1%)。
【答案】
(1)0.8
(2)解:设过氧化氢溶液中溶质的质量分数为x
?
x=5%(3)反应后所得硫酸铜溶液的溶质质量分数为
×100%=5.7%。
【解析】根据质量守恒定律可得,生成的氧气的质量为36g﹣35.2g=0.8g
15.过氧化氢溶液俗称双氧水,是一种常见消毒剂。实验员用以下方法制取了少量过氧化氢溶液,在低温下,向56.4g某浓度的稀硫酸中逐渐加入一定量的过氧化钡(BaO2),发生的化学反应为BaO2+H2SO4=BaSO4↓+H2O2,当恰好完全反应时生成23.3g沉淀。计算:
(1)加入BaO2的质量。
(2)反应后所得溶液中溶质质量分数。
(3)医用双氧水常为溶质质量分数为3%的过氧化氢溶液,如果将(2)中所得溶液稀释到医用双氧水浓度,计算需加入水的质量(结果精确到0.1g)。
【答案】
(1)解:设加入BaO2的质量为x,生成的H2O2质量为y。
x=16.9g,
y=3.4g,
答:加入BaO2的质量为16.9g
(2)反应后所得溶液中溶质质量分数=
×100%
=
6.8%
(3)设需加入水的质量为z,则(16.9+56.4-23.3)×6.8%
=(50+z)×3%
,z=63.3g;
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
同课章节目录
