氯气的制取
图片预览



文档简介
(共24张PPT)
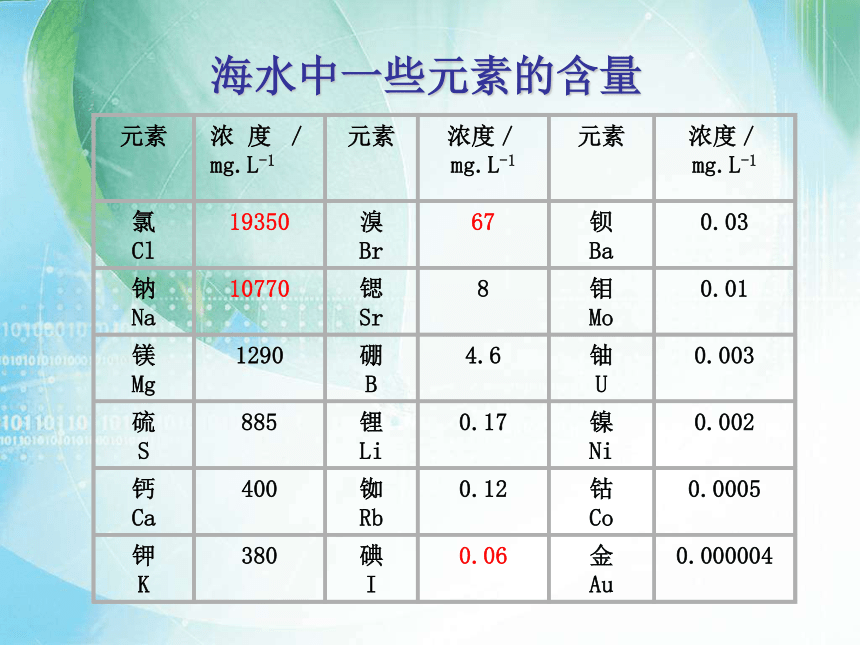
元素
浓度/mg.L-1
元素
浓度/mg.L-1
元素
浓度/mg.L-1
氯
Cl
19350
溴
Br
67
钡
Ba
0.03
钠
Na
10770
锶
Sr
8
钼
Mo
0.01
镁
Mg
1290
硼
B
4.6
铀
U
0.003
硫
S
885
锂
Li
0.17
镍
Ni
0.002
钙
Ca
400
铷
Rb
0.12
钴
Co
0.0005
钾
K
380
碘
I
0.06
金
Au
0.000004
海水中一些元素的含量
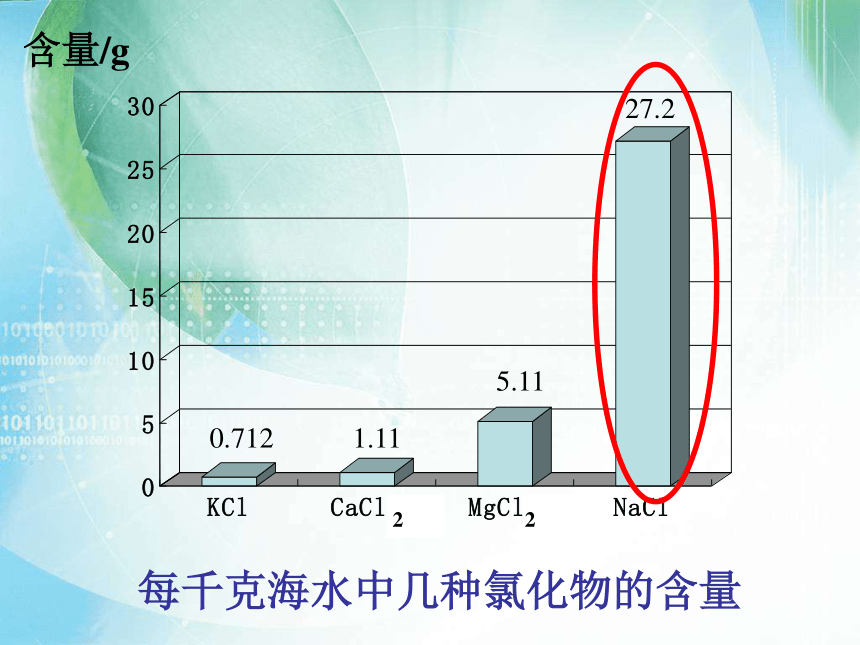
每千克海水中几种氯化物的含量
含量/g
0.712
1.11
5.11
27.2
2
2
2
盐田
扫盐
收集盐
待售的盐
NaCl俗名“食盐”,可作为日常生活的调味剂。医学上将0.9%的食盐水称为 “生理盐水”,给病人补充体液。
那么如何用从海水中获得的粗盐制成我们食用的精盐?
NaCl还有哪些用途?
制取Na
制取Cl2
溶解
除杂
蒸发
过滤
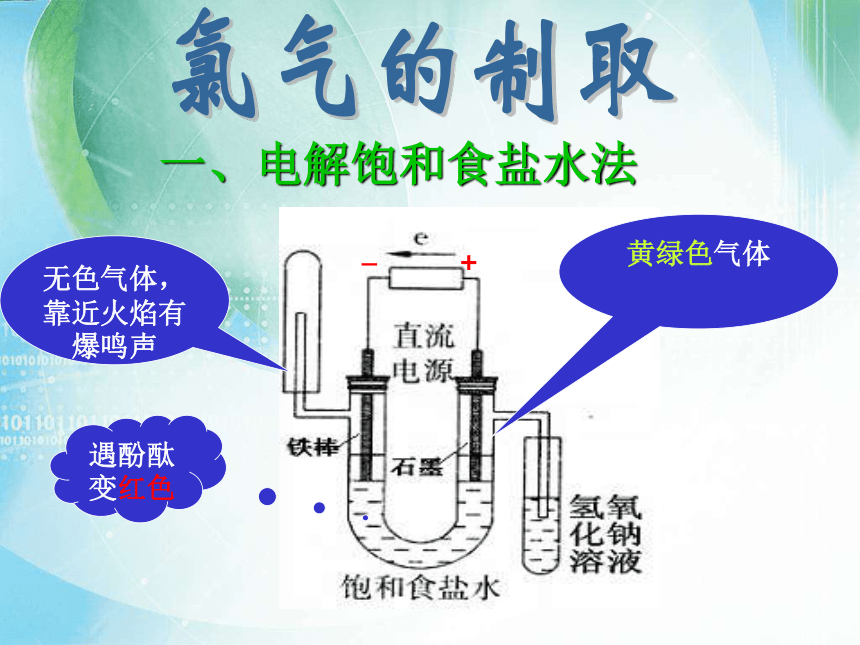
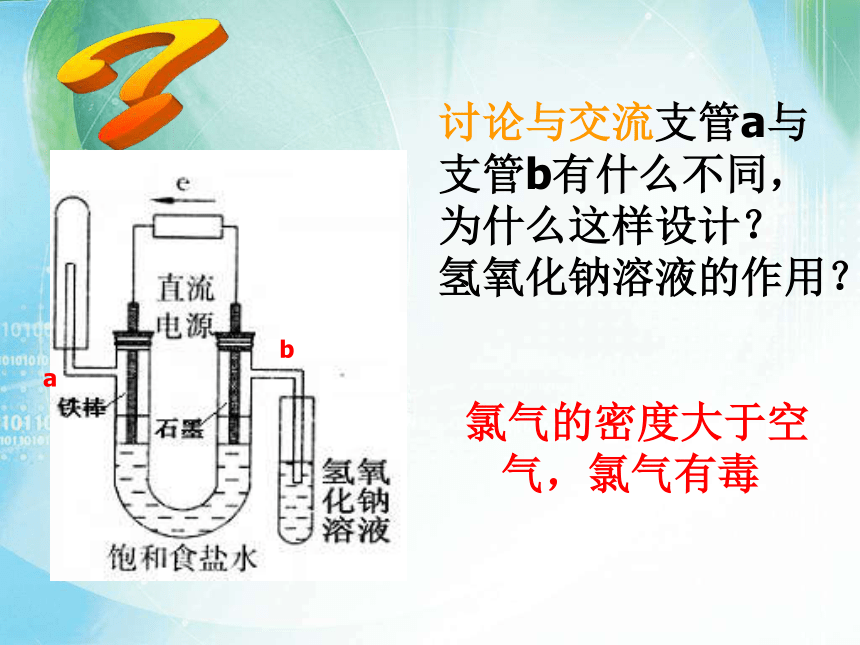
一、电解饱和食盐水法
+
_
黄绿色气体
遇酚酞变红色
无色气体,靠近火焰有爆鸣声
a
b
氯气的密度大于空气,氯气有毒
讨论与交流支管a与支管b有什么不同,为什么这样设计? 氢氧化钠溶液的作用?
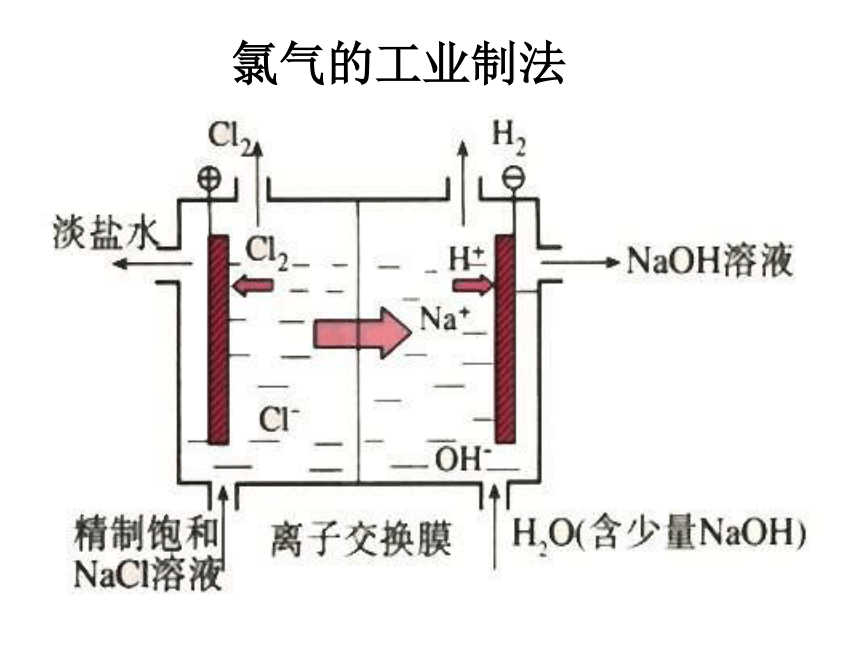
氯气的工业制法
氯气的发现史
1774年,瑞典化学家舍勒发现氯气。
戴维
1810年,英国化学家戴维研究后得出这种气体仅由一种元素组成。我国早年译文将其译成“绿气”,后改为氯气。
MnO2+4HCl(浓) = MnCl2+2H2O+Cl2↑
二、氯气的实验室制法
原料:二氧化锰 (固体)、浓盐酸(液体)
实验原理
MnO2 + 4HCl(浓) = MnCl2 + Cl2 ↑ + 2H2O
你能根据这个反应特点
构建出实验室制
取氯气的实验装置吗?
气体发生装置
依据:反应物状态和反应条件
固体+液体(加热型)
固液不加热型
固固加热型
MnO2+4HCl(浓) == MnCl2+2H2O+Cl2↑
固液加热型
气体收集装置
依据:气体的密度,溶解性
提示:氯气密度比空气大,能溶于水(与水反应)而难溶于饱和食盐水,收集装置有什么特点?
饱和食盐水
MnO2+4HCl(浓) == MnCl2+2H2O+Cl2↑
排水法
向上排空气(长进短出)
进气
出气
尾气处理装置(吸收装置)
依据:气体对空气是否有污染
MnO2+4HCl(浓) == MnCl2+2H2O+Cl2↑
NaOH溶液
除HCl气体
饱和食盐水
除水蒸气
(无水CaCl2)
浓硫酸
气体净化装置
思考:此法制得的氯气纯净吗 可能存在哪些杂质气体 用哪些试剂来除杂,有没有先后顺序?
MnO2+4HCl(浓) == MnCl2+2H2O+Cl2↑
改进后
轻松一刻
电解饱和食盐水时,氯气产生 在电源( )极相连的( )棒,氢气产生于和电源 ( )极相连的( )棒,碱产生( )棒的周围。
正
石墨
负
铁
铁
智力快车
智力快车
实验室用下列两种方法制取氯气:
①用4mol的浓盐酸与足量的MnO2反应
②用1molMnO2与足量的浓盐酸反应
两种方法所得Cl2的物质的量 ( )
A.①比②多
B.②比①多
C.一样多
D.无法比较
B
课堂小结
MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
原理:
MnO2和浓盐酸
装置:
发生
收集
净化
尾气处理
原料:
2NaCl+2H2O
通电
2NaOH+H2↑+Cl2↑
谢谢指导
元素
浓度/mg.L-1
元素
浓度/mg.L-1
元素
浓度/mg.L-1
氯
Cl
19350
溴
Br
67
钡
Ba
0.03
钠
Na
10770
锶
Sr
8
钼
Mo
0.01
镁
Mg
1290
硼
B
4.6
铀
U
0.003
硫
S
885
锂
Li
0.17
镍
Ni
0.002
钙
Ca
400
铷
Rb
0.12
钴
Co
0.0005
钾
K
380
碘
I
0.06
金
Au
0.000004
海水中一些元素的含量
每千克海水中几种氯化物的含量
含量/g
0.712
1.11
5.11
27.2
2
2
2
盐田
扫盐
收集盐
待售的盐
NaCl俗名“食盐”,可作为日常生活的调味剂。医学上将0.9%的食盐水称为 “生理盐水”,给病人补充体液。
那么如何用从海水中获得的粗盐制成我们食用的精盐?
NaCl还有哪些用途?
制取Na
制取Cl2
溶解
除杂
蒸发
过滤
一、电解饱和食盐水法
+
_
黄绿色气体
遇酚酞变红色
无色气体,靠近火焰有爆鸣声
a
b
氯气的密度大于空气,氯气有毒
讨论与交流支管a与支管b有什么不同,为什么这样设计? 氢氧化钠溶液的作用?
氯气的工业制法
氯气的发现史
1774年,瑞典化学家舍勒发现氯气。
戴维
1810年,英国化学家戴维研究后得出这种气体仅由一种元素组成。我国早年译文将其译成“绿气”,后改为氯气。
MnO2+4HCl(浓) = MnCl2+2H2O+Cl2↑
二、氯气的实验室制法
原料:二氧化锰 (固体)、浓盐酸(液体)
实验原理
MnO2 + 4HCl(浓) = MnCl2 + Cl2 ↑ + 2H2O
你能根据这个反应特点
构建出实验室制
取氯气的实验装置吗?
气体发生装置
依据:反应物状态和反应条件
固体+液体(加热型)
固液不加热型
固固加热型
MnO2+4HCl(浓) == MnCl2+2H2O+Cl2↑
固液加热型
气体收集装置
依据:气体的密度,溶解性
提示:氯气密度比空气大,能溶于水(与水反应)而难溶于饱和食盐水,收集装置有什么特点?
饱和食盐水
MnO2+4HCl(浓) == MnCl2+2H2O+Cl2↑
排水法
向上排空气(长进短出)
进气
出气
尾气处理装置(吸收装置)
依据:气体对空气是否有污染
MnO2+4HCl(浓) == MnCl2+2H2O+Cl2↑
NaOH溶液
除HCl气体
饱和食盐水
除水蒸气
(无水CaCl2)
浓硫酸
气体净化装置
思考:此法制得的氯气纯净吗 可能存在哪些杂质气体 用哪些试剂来除杂,有没有先后顺序?
MnO2+4HCl(浓) == MnCl2+2H2O+Cl2↑
改进后
轻松一刻
电解饱和食盐水时,氯气产生 在电源( )极相连的( )棒,氢气产生于和电源 ( )极相连的( )棒,碱产生( )棒的周围。
正
石墨
负
铁
铁
智力快车
智力快车
实验室用下列两种方法制取氯气:
①用4mol的浓盐酸与足量的MnO2反应
②用1molMnO2与足量的浓盐酸反应
两种方法所得Cl2的物质的量 ( )
A.①比②多
B.②比①多
C.一样多
D.无法比较
B
课堂小结
MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
原理:
MnO2和浓盐酸
装置:
发生
收集
净化
尾气处理
原料:
2NaCl+2H2O
通电
2NaOH+H2↑+Cl2↑
谢谢指导
