苏教版化学必修1同步练习 二氧化硫的性质和作用
文档属性
| 名称 | 苏教版化学必修1同步练习 二氧化硫的性质和作用 |

|
|
| 格式 | zip | ||
| 文件大小 | 52.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-20 00:00:00 | ||
图片预览


文档简介
专题4 硫 氮和可持续发展
第一单元 含硫化合物的性质和应用
第一课时 二氧化硫的性质和作用
基础梳理
一、二氧化硫的性质
1.物理性质:二氧化硫是一种无色,有刺激性气味,有毒的气体,易液化(-10℃),易溶于水(1 : 40)密度比空气大。
2.化学性质:
(1)酸性氧化物:可与水发生反应生成相应酸-——亚硫酸(亚硫酸为中强酸);可与碱反应生成盐和水;SO2+H2OH2SO3 (H2SO3为二元中强酸);SO2+2NaOH=Na2SO3+H2O。
SO2+Na2SO3+H2O2NaHSO3
即 SO2+NaOHNaHSO3
(2)强还原性:SO2中的硫元素的化合价为+4价,处于硫元素的中间价态,具有还原性(强),可与过氧化氢、氧气、卤素单质、高锰酸钾等反应:
SO2+H2O2H2SO4 或 H2SO3+H2O2 H2O+H2SO4;
SO2+Br2 + 2H2OH2SO4+2HBr 。
(3)弱氧化性:SO2具有氧化性(弱),可以氧化硫化氢生成单质S:SO2+2H2S3S+2H2O。
(4)漂白性:二氧化硫具有漂白性,可使品红溶液褪色,能漂白纸浆、丝、毛、草制品等。SO2的漂白原理与Na2O2、H2O2、O3、HClO、漂白粉等不同,是SO2与有色物质化合生成不稳定的无色物质,这些无色物质容易分解而恢复原色,故SO2的漂白是暂时性的,过程是可逆的。
Na2O2、H2O2、O3、HClO、漂白粉等的漂白性是由于它们的强氧化性,且漂白后颜色不再恢复,是永久的漂白,过程是不可逆的。
说明:二氧化硫具有漂白性,但是不能漂白酸碱指示剂;Na2O2、H2O2、O3、HClO、漂白粉等物质会使酸碱指示剂先变色后褪色。
3.空气中SO2的主要来源:
SO2是大气污染的主要有害物质之一,消除污染的重要途径是减少SO2向空气中的排放,工业规定含SO2大于0.2mg/L必须进行处理。处理方法通常用碱液吸收(NaOH溶液或氨水)。空气中SO2的主要来源是化石燃料的燃烧;含硫金属矿物的冶炼;生产硫酸等产生的废气。
二、酸雨的形成与防治
1.雨水的pH
正常雨水: pH<7,约在6左右。是由于大气中的CO2溶解在雨水里形成碳酸的缘故,降水的微弱酸性可以促进土壤里养分的溶解,便于植物吸收,是有益的。
酸雨:pH小于5.6的雨水称为酸雨,包括雨、雪、雾、雹等降水过程。形成原因是由于大量硫和氮的氧化物被雨水吸收。
2.硫酸型酸雨的形成与防治
形成原因:化石燃料及其产品的燃烧、含硫金属矿石的冶炼和硫酸的生产等产生的废气中含有二氧化硫酸雨的防治:开发新能源,对含硫燃烧进行脱硫处理,提高环境保护意识。
重点提示:正常雨水的pH<7,显酸性的雨水并不都一定是酸雨,只有pH小于5.6的雨水才被称为酸雨;整理硫酸型酸雨的形成原理。
例题解析
例1.我国三峡工程所提供的水电,相当于每年燃烧3000万吨原煤的火力发电站生的电能,因此三峡工程有助于控制( )
A.温室效应 B.白色污染
C.酸雨产生 D.农药、化肥污染
思路分析:煤的主要成分是碳,还有少量硫、氮等,它燃烧时产生CO2气体是温室气体,产生的SO2和氮的氧化物易形成酸雨。所以水电代替煤燃烧有利于控制温室效应和酸雨的形成。
解题:A、C
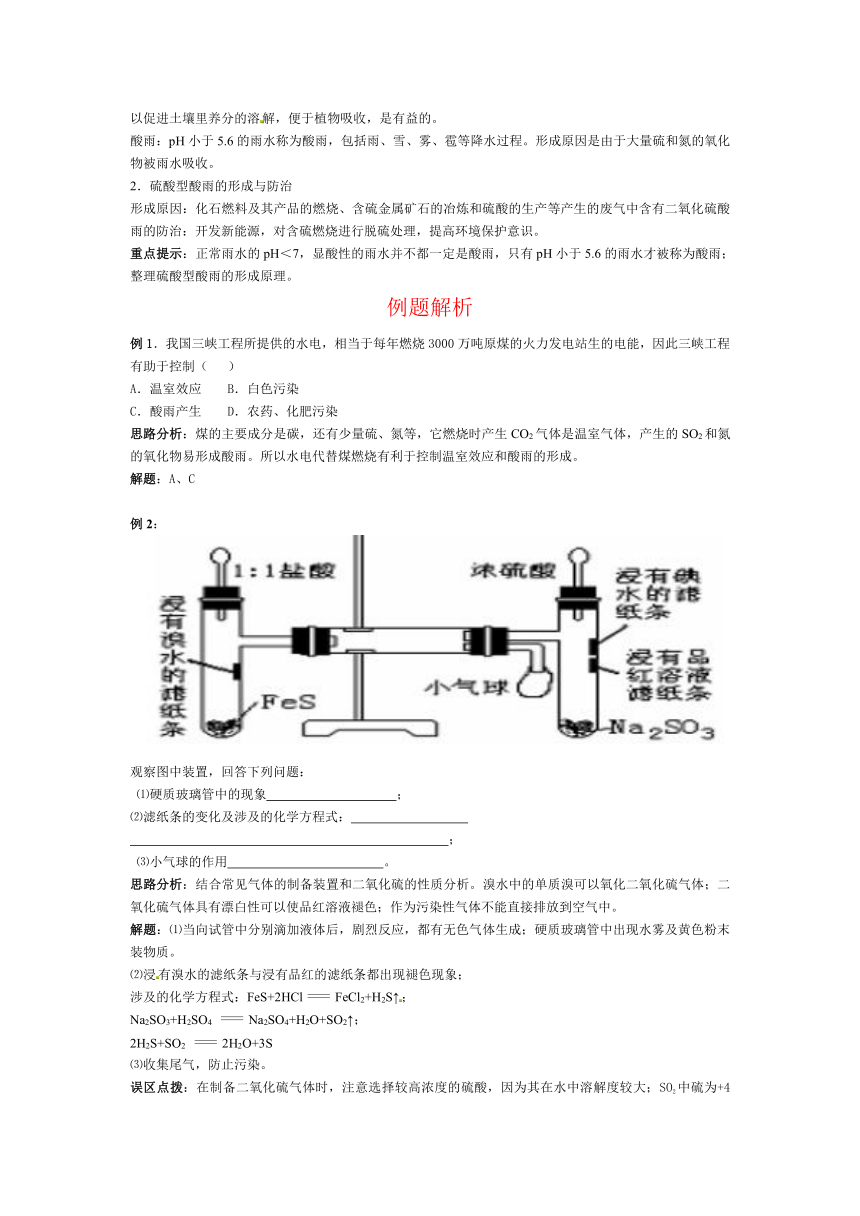
例2:
观察图中装置,回答下列问题:
⑴硬质玻璃管中的现象 ;
⑵滤纸条的变化及涉及的化学方程式:
;
⑶小气球的作用 。
思路分析:结合常见气体的制备装置和二氧化硫的性质分析。溴水中的单质溴可以氧化二氧化硫气体;二氧化硫气体具有漂白性可以使品红溶液褪色;作为污染性气体不能直接排放到空气中。
解题:⑴当向试管中分别滴加液体后,剧烈反应,都有无色气体生成;硬质玻璃管中出现水雾及黄色粉末装物质。
⑵浸有溴水的滤纸条与浸有品红的滤纸条都出现褪色现象;
涉及的化学方程式:FeS+2HClFeCl2+H2S↑;
Na2SO3+H2SO4 Na2SO4+H2O+SO2↑;
2H2S+SO2 2H2O+3S
⑶收集尾气,防止污染。
误区点拨:在制备二氧化硫气体时,注意选择较高浓度的硫酸,因为其在水中溶解度较大;SO2中硫为+4价,处于硫元素化合价的中间价态,能被许多强氧化剂氧化,但是不会被浓硫酸改变。21世纪教育网
基础训练
一、选择题(每小题仅有一个正确答案)
1.全球环境问题按其相对的严重性排在前三位的是
A 全球增温问题,臭氧空洞问题,酸雨问题
B 海洋污染问题,土壤荒漠化问题,物种灭绝
C 森林面积减少,饮用水污染问题,有害废弃物越境迁移
D 饮用水污染问题,土壤荒漠化问题,噪声污染问题
2.煤燃烧生成的气体中能形成酸雨的是
①一氧化碳 ②二氧化碳 ③二氧化硫 ④二氧化氮
A ①② B ①③ C ③④ D ②④
3.下面判断不正确的是
A二氧化硫是可燃性气体,因它能与O2反应
B H2SO4不是离子化合物,在水中却能电离
C 重晶石是硫酸盐[来源:21世纪教育网]
D 洒落在地上的汞可在其表面撒硫磺除去
4.下列物质中,能在空气中稳定保存的是
A NaOH固体 B稀H2SO4
C Na2SO3晶体 D 氢硫酸
5.下列各组气体中,一经混合即能迅速发生反应的是
A H2和O2 B H2和Cl2 [来源:21世纪教育网]
C H2S和SO2 D H2S和O2
6.下列关于氢硫酸、亚硫酸、硫酸的说法中正确的是
A它们都有酸性,电离出的H+有弱氧化性
B它们都是酸,彼此之间不发生反应
C亚硫酸易分解放出SO2,所以它是挥发性酸
D在空气中放置,它们都会因氧化而变质
7.下列物质的不饱和溶液能通过加热蒸发的方法使之变成饱和溶液的是
A NaBr B Ca(HCO3) 2 C H2SO3 D H2S
8.下列有关浓硫酸和亚硫酸钠混和放出的气体的说法中不正确的是 ( )
A它与氧气接触即转变为SO3 B亚硫酸钙能溶解于它的水溶液中
C它的密度比空气小,且不易液化 D它的水溶液是酸性,且能被强氧化剂氧化
9.将H2S、SO2、SO3各0.01mol,依次溶解于1L水中,最后得到的溶液具有( )
A中性,漂白性 B酸性,漂白性 C只有酸性 D只有漂白性
10将二氧化硫通入溴水中发生如下的反应:SO2+Br2+2H2O=2HBr+H2SO4 ,反应中转移的电子数和还原剂是 ( )
A 2e-,H2SO4 B 4e-,SO2 C 2e-,Br2 D 2e-,SO2
二、填空题21世纪教育网
11完成下列变化的化学方程式:
(1)氢硫酸在空气中放置变浑浊: ;
(2)亚硫酸钠在空气中变质: ;
12某酸B与钠盐A反应生成刺激性气体C ,C可在一定条件下被氧化为D,D溶于水生成酸B ,C与苛性钠液反应生成A 。则满足条件的物质的化学式可以是:[来源:21世纪教育网]
A B C D
13.只用一种试剂就能鉴别出NaNO3、BaCl2、Na2SO3、Ba(HCO3)2四种溶液。该试剂是________,相关的离子方程为__________________________________________,__________________________________________________________,___________________________________________________________。
14将某黑色固体A加热至红热,放入热的浓H2SO4中,反应时放出的两种气体皆为酸性氧化物,反应的化学方程式为_____________________________________,此反应证明浓H2SO4具有_____________性,若有agA参加反应,放出的气体在标况下占____________L,转移的电子的物质的量是_____________;被还原H2SO4为_____________mol。
15.新能源的开发应用是当今全球性的一个重大研究课题,发展氢能源有着广阔的前景,有研究人员提出了“利用太阳能,以水为原料,大量生产氢气,并用作各种机械的动力燃料”这一设想。试回答下列问题:
(1)你认为这一设想能否实现?若认为能,请写出有关的两个化学方程式。
。
(2)氢气作为燃料与现在广泛应用的化石燃料相比有什么优点(要求答出其中两点)?
① 。
② 。
16.浓H2SO4与炭反应,产物成分可用下图装置来确认:
(1)请用1、2…等标号,写出整套装置的连接顺序: ;
(2)装置 C 的作用是 ,E 中盛放的试剂是____________,作用是___________________ ;
(3) B 装置中反应的离子方程式 。[来源:21世纪教育网]
17.现有物质的量浓度为18.4mol/L的浓硫酸20.0mL,加入铜屑共热一段时间后,冷却,滤去多余的铜屑,将滤液加水到100.0mL,测得溶液中SO42-的物质的量浓度为3.18mol/L。试求该100mL溶液中硫酸铜的物质的量浓度。
[来源:21世纪教育网]
[来源:21世纪教育网]
答案:1.A 2.C 3.A 4.B 5.C 6.A 7.A 8.C 9.B 10.D
11.⑴2H2S+O2==S↓+2H2O ⑵Na2SO3+O2==2Na2SO4
12.A. Na2SO3或NaHSO3 B.Na2SO4 C.SO2 D.SO3
13.稀H2SO4 Ba2++SO42-==BaSO4↓ SO32-+2H+==SO2↑+2H2O
Ba2++2HCO3-+SO42-+2H+==BaSO4↓+2CO2↑+2H2O
14.C+2H2SO4(浓)===CO2↑+2SO2↑+2H2O
强氧化性 5.6 a/3 mol a/6 mol
15.能;(1)2H2O ====2H2↑+O2↑,2H2+O2 ===2H2O;(2)①来源广泛 ②产物是水,无污染 ③燃烧时放出的热量多
16.⑴17865432
⑵除去SO2 无水CuSO4 验证生成的水
⑶Ba2++2OH-+CO2==BaCO3↓+H2O
17.0.5mol/L
△
电解
点燃
第一单元 含硫化合物的性质和应用
第一课时 二氧化硫的性质和作用
基础梳理
一、二氧化硫的性质
1.物理性质:二氧化硫是一种无色,有刺激性气味,有毒的气体,易液化(-10℃),易溶于水(1 : 40)密度比空气大。
2.化学性质:
(1)酸性氧化物:可与水发生反应生成相应酸-——亚硫酸(亚硫酸为中强酸);可与碱反应生成盐和水;SO2+H2OH2SO3 (H2SO3为二元中强酸);SO2+2NaOH=Na2SO3+H2O。
SO2+Na2SO3+H2O2NaHSO3
即 SO2+NaOHNaHSO3
(2)强还原性:SO2中的硫元素的化合价为+4价,处于硫元素的中间价态,具有还原性(强),可与过氧化氢、氧气、卤素单质、高锰酸钾等反应:
SO2+H2O2H2SO4 或 H2SO3+H2O2 H2O+H2SO4;
SO2+Br2 + 2H2OH2SO4+2HBr 。
(3)弱氧化性:SO2具有氧化性(弱),可以氧化硫化氢生成单质S:SO2+2H2S3S+2H2O。
(4)漂白性:二氧化硫具有漂白性,可使品红溶液褪色,能漂白纸浆、丝、毛、草制品等。SO2的漂白原理与Na2O2、H2O2、O3、HClO、漂白粉等不同,是SO2与有色物质化合生成不稳定的无色物质,这些无色物质容易分解而恢复原色,故SO2的漂白是暂时性的,过程是可逆的。
Na2O2、H2O2、O3、HClO、漂白粉等的漂白性是由于它们的强氧化性,且漂白后颜色不再恢复,是永久的漂白,过程是不可逆的。
说明:二氧化硫具有漂白性,但是不能漂白酸碱指示剂;Na2O2、H2O2、O3、HClO、漂白粉等物质会使酸碱指示剂先变色后褪色。
3.空气中SO2的主要来源:
SO2是大气污染的主要有害物质之一,消除污染的重要途径是减少SO2向空气中的排放,工业规定含SO2大于0.2mg/L必须进行处理。处理方法通常用碱液吸收(NaOH溶液或氨水)。空气中SO2的主要来源是化石燃料的燃烧;含硫金属矿物的冶炼;生产硫酸等产生的废气。
二、酸雨的形成与防治
1.雨水的pH
正常雨水: pH<7,约在6左右。是由于大气中的CO2溶解在雨水里形成碳酸的缘故,降水的微弱酸性可以促进土壤里养分的溶解,便于植物吸收,是有益的。
酸雨:pH小于5.6的雨水称为酸雨,包括雨、雪、雾、雹等降水过程。形成原因是由于大量硫和氮的氧化物被雨水吸收。
2.硫酸型酸雨的形成与防治
形成原因:化石燃料及其产品的燃烧、含硫金属矿石的冶炼和硫酸的生产等产生的废气中含有二氧化硫酸雨的防治:开发新能源,对含硫燃烧进行脱硫处理,提高环境保护意识。
重点提示:正常雨水的pH<7,显酸性的雨水并不都一定是酸雨,只有pH小于5.6的雨水才被称为酸雨;整理硫酸型酸雨的形成原理。
例题解析
例1.我国三峡工程所提供的水电,相当于每年燃烧3000万吨原煤的火力发电站生的电能,因此三峡工程有助于控制( )
A.温室效应 B.白色污染
C.酸雨产生 D.农药、化肥污染
思路分析:煤的主要成分是碳,还有少量硫、氮等,它燃烧时产生CO2气体是温室气体,产生的SO2和氮的氧化物易形成酸雨。所以水电代替煤燃烧有利于控制温室效应和酸雨的形成。
解题:A、C
例2:
观察图中装置,回答下列问题:
⑴硬质玻璃管中的现象 ;
⑵滤纸条的变化及涉及的化学方程式:
;
⑶小气球的作用 。
思路分析:结合常见气体的制备装置和二氧化硫的性质分析。溴水中的单质溴可以氧化二氧化硫气体;二氧化硫气体具有漂白性可以使品红溶液褪色;作为污染性气体不能直接排放到空气中。
解题:⑴当向试管中分别滴加液体后,剧烈反应,都有无色气体生成;硬质玻璃管中出现水雾及黄色粉末装物质。
⑵浸有溴水的滤纸条与浸有品红的滤纸条都出现褪色现象;
涉及的化学方程式:FeS+2HClFeCl2+H2S↑;
Na2SO3+H2SO4 Na2SO4+H2O+SO2↑;
2H2S+SO2 2H2O+3S
⑶收集尾气,防止污染。
误区点拨:在制备二氧化硫气体时,注意选择较高浓度的硫酸,因为其在水中溶解度较大;SO2中硫为+4价,处于硫元素化合价的中间价态,能被许多强氧化剂氧化,但是不会被浓硫酸改变。21世纪教育网
基础训练
一、选择题(每小题仅有一个正确答案)
1.全球环境问题按其相对的严重性排在前三位的是
A 全球增温问题,臭氧空洞问题,酸雨问题
B 海洋污染问题,土壤荒漠化问题,物种灭绝
C 森林面积减少,饮用水污染问题,有害废弃物越境迁移
D 饮用水污染问题,土壤荒漠化问题,噪声污染问题
2.煤燃烧生成的气体中能形成酸雨的是
①一氧化碳 ②二氧化碳 ③二氧化硫 ④二氧化氮
A ①② B ①③ C ③④ D ②④
3.下面判断不正确的是
A二氧化硫是可燃性气体,因它能与O2反应
B H2SO4不是离子化合物,在水中却能电离
C 重晶石是硫酸盐[来源:21世纪教育网]
D 洒落在地上的汞可在其表面撒硫磺除去
4.下列物质中,能在空气中稳定保存的是
A NaOH固体 B稀H2SO4
C Na2SO3晶体 D 氢硫酸
5.下列各组气体中,一经混合即能迅速发生反应的是
A H2和O2 B H2和Cl2 [来源:21世纪教育网]
C H2S和SO2 D H2S和O2
6.下列关于氢硫酸、亚硫酸、硫酸的说法中正确的是
A它们都有酸性,电离出的H+有弱氧化性
B它们都是酸,彼此之间不发生反应
C亚硫酸易分解放出SO2,所以它是挥发性酸
D在空气中放置,它们都会因氧化而变质
7.下列物质的不饱和溶液能通过加热蒸发的方法使之变成饱和溶液的是
A NaBr B Ca(HCO3) 2 C H2SO3 D H2S
8.下列有关浓硫酸和亚硫酸钠混和放出的气体的说法中不正确的是 ( )
A它与氧气接触即转变为SO3 B亚硫酸钙能溶解于它的水溶液中
C它的密度比空气小,且不易液化 D它的水溶液是酸性,且能被强氧化剂氧化
9.将H2S、SO2、SO3各0.01mol,依次溶解于1L水中,最后得到的溶液具有( )
A中性,漂白性 B酸性,漂白性 C只有酸性 D只有漂白性
10将二氧化硫通入溴水中发生如下的反应:SO2+Br2+2H2O=2HBr+H2SO4 ,反应中转移的电子数和还原剂是 ( )
A 2e-,H2SO4 B 4e-,SO2 C 2e-,Br2 D 2e-,SO2
二、填空题21世纪教育网
11完成下列变化的化学方程式:
(1)氢硫酸在空气中放置变浑浊: ;
(2)亚硫酸钠在空气中变质: ;
12某酸B与钠盐A反应生成刺激性气体C ,C可在一定条件下被氧化为D,D溶于水生成酸B ,C与苛性钠液反应生成A 。则满足条件的物质的化学式可以是:[来源:21世纪教育网]
A B C D
13.只用一种试剂就能鉴别出NaNO3、BaCl2、Na2SO3、Ba(HCO3)2四种溶液。该试剂是________,相关的离子方程为__________________________________________,__________________________________________________________,___________________________________________________________。
14将某黑色固体A加热至红热,放入热的浓H2SO4中,反应时放出的两种气体皆为酸性氧化物,反应的化学方程式为_____________________________________,此反应证明浓H2SO4具有_____________性,若有agA参加反应,放出的气体在标况下占____________L,转移的电子的物质的量是_____________;被还原H2SO4为_____________mol。
15.新能源的开发应用是当今全球性的一个重大研究课题,发展氢能源有着广阔的前景,有研究人员提出了“利用太阳能,以水为原料,大量生产氢气,并用作各种机械的动力燃料”这一设想。试回答下列问题:
(1)你认为这一设想能否实现?若认为能,请写出有关的两个化学方程式。
。
(2)氢气作为燃料与现在广泛应用的化石燃料相比有什么优点(要求答出其中两点)?
① 。
② 。
16.浓H2SO4与炭反应,产物成分可用下图装置来确认:
(1)请用1、2…等标号,写出整套装置的连接顺序: ;
(2)装置 C 的作用是 ,E 中盛放的试剂是____________,作用是___________________ ;
(3) B 装置中反应的离子方程式 。[来源:21世纪教育网]
17.现有物质的量浓度为18.4mol/L的浓硫酸20.0mL,加入铜屑共热一段时间后,冷却,滤去多余的铜屑,将滤液加水到100.0mL,测得溶液中SO42-的物质的量浓度为3.18mol/L。试求该100mL溶液中硫酸铜的物质的量浓度。
[来源:21世纪教育网]
[来源:21世纪教育网]
答案:1.A 2.C 3.A 4.B 5.C 6.A 7.A 8.C 9.B 10.D
11.⑴2H2S+O2==S↓+2H2O ⑵Na2SO3+O2==2Na2SO4
12.A. Na2SO3或NaHSO3 B.Na2SO4 C.SO2 D.SO3
13.稀H2SO4 Ba2++SO42-==BaSO4↓ SO32-+2H+==SO2↑+2H2O
Ba2++2HCO3-+SO42-+2H+==BaSO4↓+2CO2↑+2H2O
14.C+2H2SO4(浓)===CO2↑+2SO2↑+2H2O
强氧化性 5.6 a/3 mol a/6 mol
15.能;(1)2H2O ====2H2↑+O2↑,2H2+O2 ===2H2O;(2)①来源广泛 ②产物是水,无污染 ③燃烧时放出的热量多
16.⑴17865432
⑵除去SO2 无水CuSO4 验证生成的水
⑶Ba2++2OH-+CO2==BaCO3↓+H2O
17.0.5mol/L
△
电解
点燃
