苏教版化学必修1同步练习 氧化还原反应
文档属性
| 名称 | 苏教版化学必修1同步练习 氧化还原反应 |
|
|
| 格式 | zip | ||
| 文件大小 | 125.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-20 00:00:00 | ||
图片预览


文档简介
第四课时 氧化还原反应
基础梳理
氧化还原反应
1.定义:
(1)从氧化还原反应的特征把其定义为:有元素化合价发生变化的反应称之为氧化还原反应。
(2)从氧化还原反应的本质把其定义为:有电子转移的化学反应称为氧化还原反应。
要点提示:
氧化还原反应的判断方法:凡是反应前后有元素化合价变化的化学反应就是氧化还原反应;凡是反应前后没有元素化合价变化的化学反应就是非氧化还原反应。[来源:21世纪教育网]
2.氧化还原反应的本质:电子转移; 氧化还原反应的特征:元素化合价变化[来源:21世纪教育网]
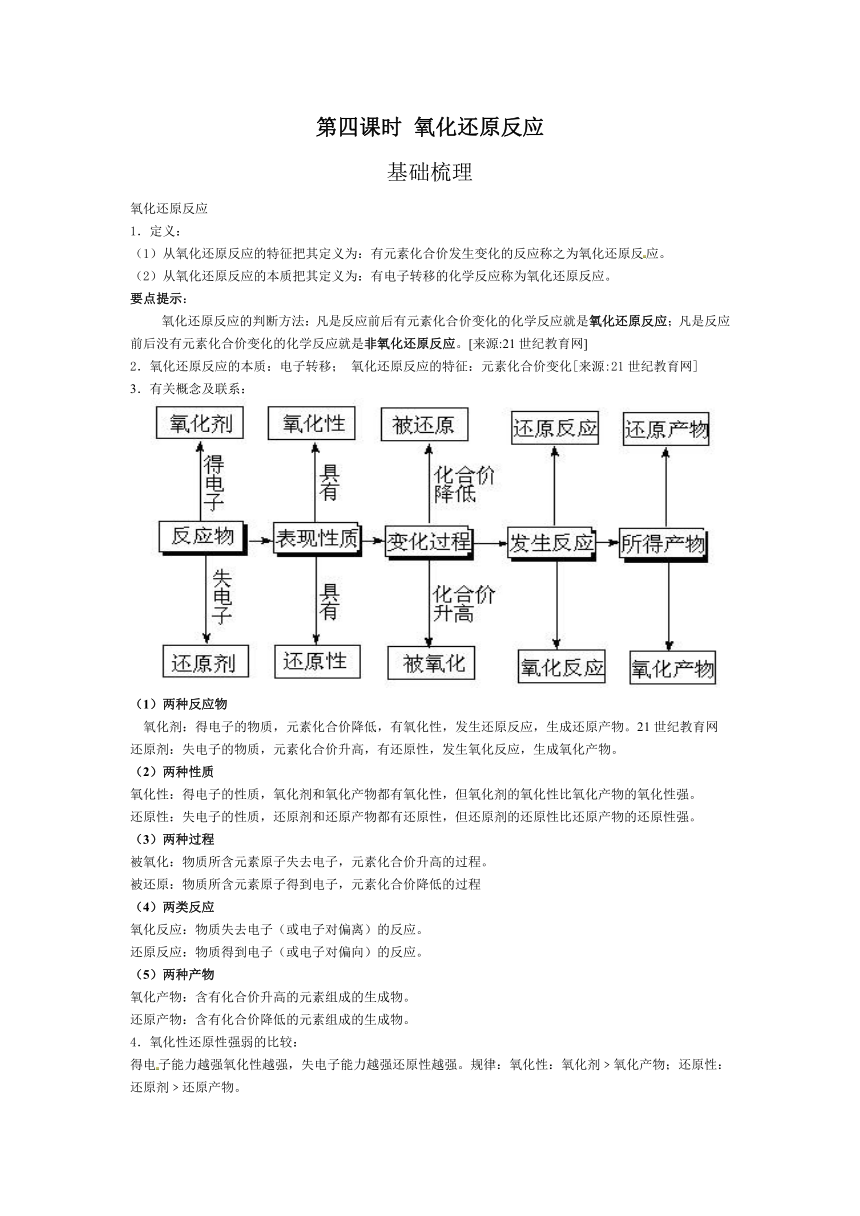
3.有关概念及联系:
(1)两种反应物
氧化剂:得电子的物质,元素化合价降低,有氧化性,发生还原反应,生成还原产物。21世纪教育网
还原剂:失电子的物质,元素化合价升高,有还原性,发生氧化反应,生成氧化产物。
(2)两种性质
氧化性:得电子的性质,氧化剂和氧化产物都有氧化性,但氧化剂的氧化性比氧化产物的氧化性强。
还原性:失电子的性质,还原剂和还原产物都有还原性,但还原剂的还原性比还原产物的还原性强。
(3)两种过程
被氧化:物质所含元素原子失去电子,元素化合价升高的过程。
被还原:物质所含元素原子得到电子,元素化合价降低的过程
(4)两类反应
氧化反应:物质失去电子(或电子对偏离)的反应。
还原反应:物质得到电子(或电子对偏向)的反应。
(5)两种产物
氧化产物:含有化合价升高的元素组成的生成物。
还原产物:含有化合价降低的元素组成的生成物。
4.氧化性还原性强弱的比较:
得电子能力越强氧化性越强,失电子能力越强还原性越强。规律:氧化性:氧化剂﹥氧化产物;还原性:还原剂﹥还原产物。
得电子能力并不是得电子数目,不能认为得电子数目越多得电子能力就越强,同理,失电子能力并不是失电子数目,不能认为失去电子的数目越多失电子能力就越强。同样得到一个电子,由于得电子能力不同,氧化性强弱顺序为F2﹥Cl2﹥Br2﹥I2;同样失去一个电子,由于失电子能力不同,还原性强弱顺序为I- ﹥Br- ﹥Cl-﹥F-。[来源:21世纪教育网]
5.用“双线桥”法表示电子转移的方向和数目的书写步骤:
(1)首先标出变价元素的化合价。
(2)用双箭号表示,箭号从反应物指向生成物,且起止为同一元素。
(3)在线桥上要注明“失去”或“得到”电子的总数,且得失电子的数目应该相等。
例题解析
例1.(2006年广东卷)下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )
A.O3+2KI+H2O2KOH+I2+O2
B.2CH3COOH+Ca(ClO)22HClO+Ca(CH3COO)2
C.I2+2NaClO32NaIO3+Cl2
D.4HCl+MnO2MnCl2+Cl2↑+H2O
思路分析:A中O3作氧化剂,KI作还原剂,其物质的量之比为1:2;B为非氧化还原反应;C中氧化剂与还原剂之比为2:1;
D中起还原剂作用的HCl占参加反应的HCl的1/2。
解题:AD[来源:21世纪教育网]
例2. 已知:
2Fe3++2I-2Fe2++ I2①
Br2+Fe2+2Fe3++2Br-②21世纪教育网
判断I- 、Fe2+、Br-三者的还原性强弱 。21世纪教育网
思路分析:根据还原性强弱规律:还原剂﹥还原产物,由方程式①得I-是还原剂,Fe2+是还原产物,故I- ﹥Fe2+;由方程式②得Fe2+是还原剂,Br-是还原产物,故Fe2+﹥Br-。
解题:还原性强弱为I- ﹥Fe2+﹥Br-。
基础训练
1、氧化还原反应的实质是( )
A、元素化合价发生变化 B、反应中有氧原子的得失
C、反应中有电子得失或电子对的偏移 D、反应后生成新物质
2、下列反应一定是氧化还原反应的是( )
A、化合反应 B、分解反应 C、复分解反应 D、置换反应
3、下列反应中,不属于氧化还原反应的是( )
A、3Cl2+6KOH==5KCl+KClO3+3H2O B、2FeBr2+3Cl2==2FeCl3+2Br221世纪教育网
C、SnCl4+2H2O==SnO2+4HCl D、Ca (OH ) 2+CO2==CaCO3↓+H2O
4、下列反应中,水作还原剂的是( )
A、2Na+2H2O==2NaOH+H2↑ B、Cl2+H2OHCl+HClO
C、2F2+2H2O==4HF+O2 D、SO2+H2OH2SO3
5、从海水中可以提取溴,主要反应为:2Br-+Cl2=2Cl-+Br2,下列说法正确的是( )
A、溴离子具有氧化性 B、氯气是还原剂
C、该反应属于复分解反应 D、氯气是氧化剂
6、在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氧化剂与还原剂物质的量之比为( )
A、1︰2 B、1︰1 C、 2︰1 D、 3︰2
7、在下列各反应中,盐酸既表现出酸性又表现出氧化性的是
HCI+NaOH=NaCl+H2O B、Zn+2HCl=ZnCl2+H2↑
C、HCl+AgNO3=AgCl↓+HNO3 D、MnO2+4HCI(浓)=MnCl2+C12↑+2H2O
8、下列物质的用途,利用氧化还原反应的是( )
A、用氯气消毒自来水 B、用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3)
C、用食盐腌渍食物 D、用小苏打治疗胃酸过多21世纪教育网
9、选用下列物质:氯气、铁、次氯酸、溴化钾溶液、氢氧化钠溶液,写出符合下列要求的化学方程式。并请标出各方程式中电子转移的方向与数目。
⑴一种单质氧化另一种单质 。
⑵一种单质氧化一种化合物中的阴离子 。
⑶同一种物质中两种元素间发生氧化还原反应 。
⑷氯气在反应中既是还原剂又是氧化剂 。
10、鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色(Fe3+)。这个变色的过程中的Fe2+被 (填“氧化”或“还原”)。若榨汁时加入适量的维生素C,可有效防止这种现象的发生。这说明维生素C具有 性。
11、为防止碘缺乏病,通常在食盐中添加少量碘酸钾(KIO3),碘酸钾和碘化钾在酸性溶液中能发生下列反应。请标出方程式中电子转移的方向与数目,并指出氧化剂和还原剂。
5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O
此反应中,氧化剂是 ,还原剂是 。氧化剂和还原剂的物质的量之比是 。
12、某课外活动小组利用下列装置迅速制备少量氯气。提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体。(2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O)
试回答:[来源:21世纪教育网]
⑴装置H中盛放的试剂是 。
⑵尾气处理时关闭弹簧夹a和弹簧夹 ,打开弹簧夹 。
⑶处理尾气时,发生反应的化学方程式是 。
⑷此反应不需要加热,而且对盐酸的浓度要求不高。此反应中的氧化剂是____________,
若参加反应的氧化剂的物质的量是1mol,则产生的氯气在标准状况下的体积为________,被氧化的还原剂的物质的量为___________。
13、向溶有24.9gKI的溶液中先加入8g溴单质,再通入足量的氯气。
求反应中:⑴被溴单质氧化的KI的质量
⑵被还原的氯气的质量
1、C 2、D 3、CD 4、C 5、D 6、B 7、A C 8、A
9、⑴2Fe+3Cl2△ 2FeCl3 ⑵ Cl2+2KBr == 2KCl+Br2 ⑶2HClO==2HCl+O2↑
⑷Cl2+2NaOH == NaCl+NaClO+H2O(电子转移略)
10、氧化 还原
11、
5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O KIO3 KI 1:5
12、⑴ 饱和食盐水 ⑵ b,c⑶ 2NaOH +Cl2 == NaCl + NaClO+H2O ⑷KMnO4 56 L 5 mol
13、⑴被溴单质氧化的KI质量为16.6g ⑵被还原的氯气的质量为5.325g
光
得5e-
失5×e-
基础梳理
氧化还原反应
1.定义:
(1)从氧化还原反应的特征把其定义为:有元素化合价发生变化的反应称之为氧化还原反应。
(2)从氧化还原反应的本质把其定义为:有电子转移的化学反应称为氧化还原反应。
要点提示:
氧化还原反应的判断方法:凡是反应前后有元素化合价变化的化学反应就是氧化还原反应;凡是反应前后没有元素化合价变化的化学反应就是非氧化还原反应。[来源:21世纪教育网]
2.氧化还原反应的本质:电子转移; 氧化还原反应的特征:元素化合价变化[来源:21世纪教育网]
3.有关概念及联系:
(1)两种反应物
氧化剂:得电子的物质,元素化合价降低,有氧化性,发生还原反应,生成还原产物。21世纪教育网
还原剂:失电子的物质,元素化合价升高,有还原性,发生氧化反应,生成氧化产物。
(2)两种性质
氧化性:得电子的性质,氧化剂和氧化产物都有氧化性,但氧化剂的氧化性比氧化产物的氧化性强。
还原性:失电子的性质,还原剂和还原产物都有还原性,但还原剂的还原性比还原产物的还原性强。
(3)两种过程
被氧化:物质所含元素原子失去电子,元素化合价升高的过程。
被还原:物质所含元素原子得到电子,元素化合价降低的过程
(4)两类反应
氧化反应:物质失去电子(或电子对偏离)的反应。
还原反应:物质得到电子(或电子对偏向)的反应。
(5)两种产物
氧化产物:含有化合价升高的元素组成的生成物。
还原产物:含有化合价降低的元素组成的生成物。
4.氧化性还原性强弱的比较:
得电子能力越强氧化性越强,失电子能力越强还原性越强。规律:氧化性:氧化剂﹥氧化产物;还原性:还原剂﹥还原产物。
得电子能力并不是得电子数目,不能认为得电子数目越多得电子能力就越强,同理,失电子能力并不是失电子数目,不能认为失去电子的数目越多失电子能力就越强。同样得到一个电子,由于得电子能力不同,氧化性强弱顺序为F2﹥Cl2﹥Br2﹥I2;同样失去一个电子,由于失电子能力不同,还原性强弱顺序为I- ﹥Br- ﹥Cl-﹥F-。[来源:21世纪教育网]
5.用“双线桥”法表示电子转移的方向和数目的书写步骤:
(1)首先标出变价元素的化合价。
(2)用双箭号表示,箭号从反应物指向生成物,且起止为同一元素。
(3)在线桥上要注明“失去”或“得到”电子的总数,且得失电子的数目应该相等。
例题解析
例1.(2006年广东卷)下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )
A.O3+2KI+H2O2KOH+I2+O2
B.2CH3COOH+Ca(ClO)22HClO+Ca(CH3COO)2
C.I2+2NaClO32NaIO3+Cl2
D.4HCl+MnO2MnCl2+Cl2↑+H2O
思路分析:A中O3作氧化剂,KI作还原剂,其物质的量之比为1:2;B为非氧化还原反应;C中氧化剂与还原剂之比为2:1;
D中起还原剂作用的HCl占参加反应的HCl的1/2。
解题:AD[来源:21世纪教育网]
例2. 已知:
2Fe3++2I-2Fe2++ I2①
Br2+Fe2+2Fe3++2Br-②21世纪教育网
判断I- 、Fe2+、Br-三者的还原性强弱 。21世纪教育网
思路分析:根据还原性强弱规律:还原剂﹥还原产物,由方程式①得I-是还原剂,Fe2+是还原产物,故I- ﹥Fe2+;由方程式②得Fe2+是还原剂,Br-是还原产物,故Fe2+﹥Br-。
解题:还原性强弱为I- ﹥Fe2+﹥Br-。
基础训练
1、氧化还原反应的实质是( )
A、元素化合价发生变化 B、反应中有氧原子的得失
C、反应中有电子得失或电子对的偏移 D、反应后生成新物质
2、下列反应一定是氧化还原反应的是( )
A、化合反应 B、分解反应 C、复分解反应 D、置换反应
3、下列反应中,不属于氧化还原反应的是( )
A、3Cl2+6KOH==5KCl+KClO3+3H2O B、2FeBr2+3Cl2==2FeCl3+2Br221世纪教育网
C、SnCl4+2H2O==SnO2+4HCl D、Ca (OH ) 2+CO2==CaCO3↓+H2O
4、下列反应中,水作还原剂的是( )
A、2Na+2H2O==2NaOH+H2↑ B、Cl2+H2OHCl+HClO
C、2F2+2H2O==4HF+O2 D、SO2+H2OH2SO3
5、从海水中可以提取溴,主要反应为:2Br-+Cl2=2Cl-+Br2,下列说法正确的是( )
A、溴离子具有氧化性 B、氯气是还原剂
C、该反应属于复分解反应 D、氯气是氧化剂
6、在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氧化剂与还原剂物质的量之比为( )
A、1︰2 B、1︰1 C、 2︰1 D、 3︰2
7、在下列各反应中,盐酸既表现出酸性又表现出氧化性的是
HCI+NaOH=NaCl+H2O B、Zn+2HCl=ZnCl2+H2↑
C、HCl+AgNO3=AgCl↓+HNO3 D、MnO2+4HCI(浓)=MnCl2+C12↑+2H2O
8、下列物质的用途,利用氧化还原反应的是( )
A、用氯气消毒自来水 B、用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3)
C、用食盐腌渍食物 D、用小苏打治疗胃酸过多21世纪教育网
9、选用下列物质:氯气、铁、次氯酸、溴化钾溶液、氢氧化钠溶液,写出符合下列要求的化学方程式。并请标出各方程式中电子转移的方向与数目。
⑴一种单质氧化另一种单质 。
⑵一种单质氧化一种化合物中的阴离子 。
⑶同一种物质中两种元素间发生氧化还原反应 。
⑷氯气在反应中既是还原剂又是氧化剂 。
10、鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色(Fe3+)。这个变色的过程中的Fe2+被 (填“氧化”或“还原”)。若榨汁时加入适量的维生素C,可有效防止这种现象的发生。这说明维生素C具有 性。
11、为防止碘缺乏病,通常在食盐中添加少量碘酸钾(KIO3),碘酸钾和碘化钾在酸性溶液中能发生下列反应。请标出方程式中电子转移的方向与数目,并指出氧化剂和还原剂。
5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O
此反应中,氧化剂是 ,还原剂是 。氧化剂和还原剂的物质的量之比是 。
12、某课外活动小组利用下列装置迅速制备少量氯气。提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体。(2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O)
试回答:[来源:21世纪教育网]
⑴装置H中盛放的试剂是 。
⑵尾气处理时关闭弹簧夹a和弹簧夹 ,打开弹簧夹 。
⑶处理尾气时,发生反应的化学方程式是 。
⑷此反应不需要加热,而且对盐酸的浓度要求不高。此反应中的氧化剂是____________,
若参加反应的氧化剂的物质的量是1mol,则产生的氯气在标准状况下的体积为________,被氧化的还原剂的物质的量为___________。
13、向溶有24.9gKI的溶液中先加入8g溴单质,再通入足量的氯气。
求反应中:⑴被溴单质氧化的KI的质量
⑵被还原的氯气的质量
1、C 2、D 3、CD 4、C 5、D 6、B 7、A C 8、A
9、⑴2Fe+3Cl2△ 2FeCl3 ⑵ Cl2+2KBr == 2KCl+Br2 ⑶2HClO==2HCl+O2↑
⑷Cl2+2NaOH == NaCl+NaClO+H2O(电子转移略)
10、氧化 还原
11、
5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O KIO3 KI 1:5
12、⑴ 饱和食盐水 ⑵ b,c⑶ 2NaOH +Cl2 == NaCl + NaClO+H2O ⑷KMnO4 56 L 5 mol
13、⑴被溴单质氧化的KI质量为16.6g ⑵被还原的氯气的质量为5.325g
光
得5e-
失5×e-
