苏教版化学必修1同步练习 氯气的生产原理
文档属性
| 名称 | 苏教版化学必修1同步练习 氯气的生产原理 |

|
|
| 格式 | zip | ||
| 文件大小 | 513.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-20 00:00:00 | ||
图片预览

文档简介
专题二 从海水中获得的化学物质
第一单元 氯、溴、碘、及其化合物
第一课时 氯气的生产原理
基础梳理
1.氯气的工业制法
工业上制取氯气大多采用电解食盐水(一般为净化后的饱和食盐水)的方法,人们把以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”。
要点提示:①电解饱和食盐水的原理:
;
溶液中存在四种离子:Na+、 Cl-、H+、OH-,通电后,氯离子在正极失电子生成氯气,氢离子在负极得电子生成氢气,溶液中剩下氢氧化钠。
②实验现象及结论:
实验现象 结论
铁棒和碳棒上通电后有气泡产生 通电后有新的气体物质生成
铁棒周围的溶液变红色 有碱性物质(NaOH)生成
将铁棒上方收集到的气体靠近火焰,有爆鸣声 有氢气生成
用手轻轻扇动在碳棒上方收集到的黄绿色气体,闻到有刺激性气味且该气体能使湿润的淀粉碘化钾试纸变蓝 有黄色刺激性气味的气体(Cl2)生成
③与电源正极相连的电极称之为阳极,产生氯气,发生的反应:2Cl--2eCl2↑;
与电源负极相连的电极称之为阴极,产生氢气,发生的反应:2H++2eH2↑。
④a口收集的气体是氢气,b口收集的气体是氯气。因为氯气有毒,直接排放会造成空气的污染,所以b口排出的气体应该通入氢氧化钠溶液中,目的是为了吸收氯气。 Cl2 + 2NaOH NaCl + NaClO + H2O(化学实验中,凡是有毒的或易燃易爆的尾气,都要进行收集或转化处理,使之无害化,切不可随意向空气中排放)。
⑤滴加酚酞先在铁棒(负极)处变红:因为H+在负极得到电子变成H2跑出,负极处的H+不断减少,OH-相应增多,溶液显碱性,酚酞遇碱变红。
注意:⑴反应物除了NaCl之外还有H2O;
⑵在电源的正极得到黄绿色的氯气,在电源的负极得到无色氢气,在溶液中得到了氢氧化钠,所以该反应的方程式为2NaCl+2H2OH2↑+Cl2↑+2NaOH。由方程式可知在两电极上方得到气体的体积比为1:1。
电解产物探究,分析过程如下:
(1)从气体的颜色和气味可知在电极上产生了两种不同的气体。
(2)从滴有酚酞的氯化钠溶液变红可知电解过程中有氢氧化钠生成。
(3)从反应物为H2O和NaCl,可分析产生的气体为O2、C12和H2中的两种。21世纪教育网
(4)从一支试管中产生的气体为黄绿色、有刺激性气味,可知该气体不可能是氢气或氧气。
(5)检验生成的气体,仔细分析现象,可知一个电极上生成了氢气。
(6)综合归纳上述分析,可写出电解饱和氯化钠溶液的化学方程式。
2.氯气的实验室制法
实验室常用二氧化锰(MnO2)、KMnO4等氧化剂和浓盐酸共热来制取氯气。
要点提示:21世纪教育网
①实验原理:MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑;
2KMnO4+16HCl2KCl+2MnCl2+8H2O+5Cl2 ↑;
KClO3+6HClKCl+3H2O+3Cl2 ↑
②MnO2和稀盐酸不反应,所以必须用浓盐酸,而且此反应必须加热,因为在常温下二氧化锰与盐酸几乎不反应。
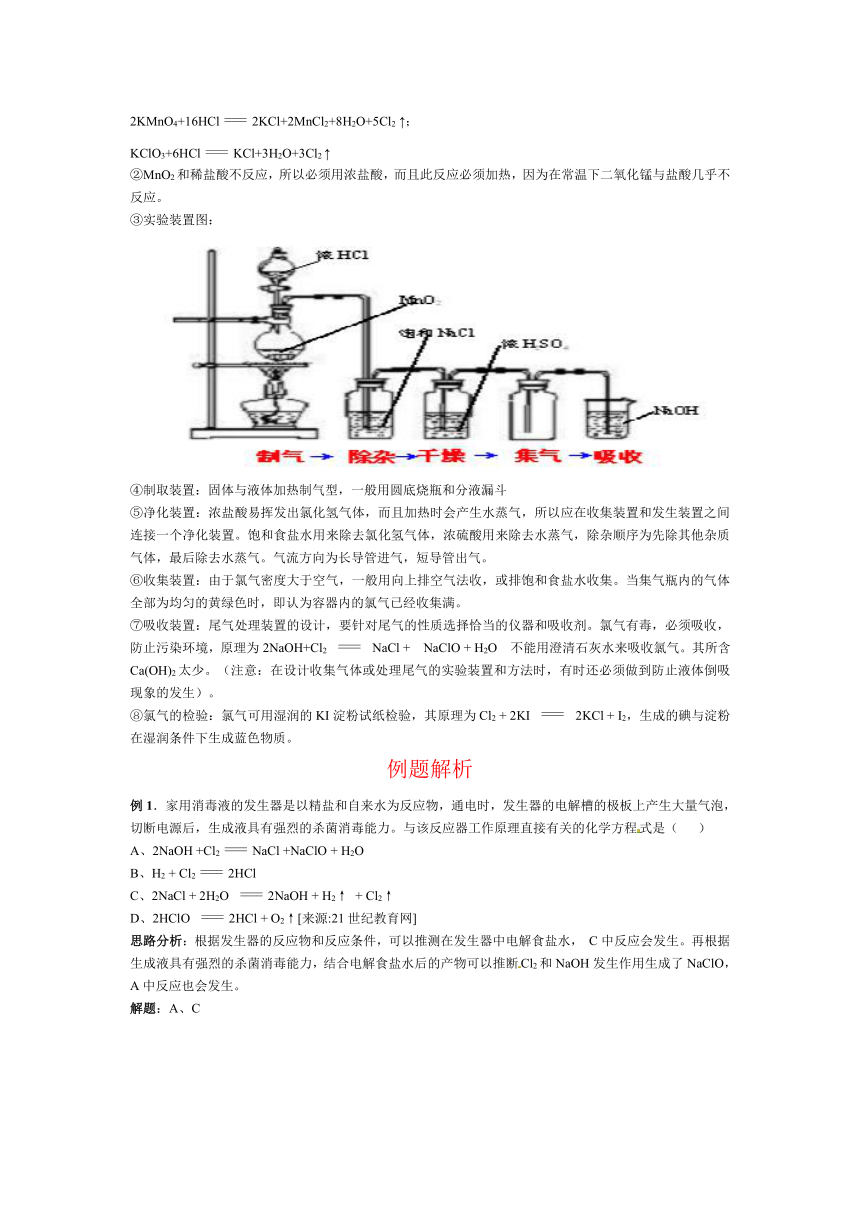
③实验装置图:
④制取装置:固体与液体加热制气型,一般用圆底烧瓶和分液漏斗
⑤净化装置:浓盐酸易挥发出氯化氢气体,而且加热时会产生水蒸气,所以应在收集装置和发生装置之间连接一个净化装置。饱和食盐水用来除去氯化氢气体,浓硫酸用来除去水蒸气,除杂顺序为先除其他杂质气体,最后除去水蒸气。气流方向为长导管进气,短导管出气。
⑥收集装置:由于氯气密度大于空气,一般用向上排空气法收,或排饱和食盐水收集。当集气瓶内的气体全部为均匀的黄绿色时,即认为容器内的氯气已经收集满。
⑦吸收装置:尾气处理装置的设计,要针对尾气的性质选择恰当的仪器和吸收剂。氯气有毒,必须吸收,防止污染环境,原理为2NaOH+Cl2 NaCl + NaClO + H2O 不能用澄清石灰水来吸收氯气。其所含Ca(OH)2太少。(注意:在设计收集气体或处理尾气的实验装置和方法时,有时还必须做到防止液体倒吸现象的发生)。
⑧氯气的检验:氯气可用湿润的KI淀粉试纸检验,其原理为Cl2 + 2KI 2KCl + I2,生成的碘与淀粉在湿润条件下生成蓝色物质。
例题解析
例1.家用消毒液的发生器是以精盐和自来水为反应物,通电时,发生器的电解槽的极板上产生大量气泡,切断电源后,生成液具有强烈的杀菌消毒能力。与该反应器工作原理直接有关的化学方程式是( )
A、2NaOH +Cl2NaCl +NaClO + H2O
B、H2 + Cl22HCl
C、2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑
D、2HClO 2HCl + O2↑[来源:21世纪教育网]
思路分析:根据发生器的反应物和反应条件,可以推测在发生器中电解食盐水, C中反应会发生。再根据生成液具有强烈的杀菌消毒能力,结合电解食盐水后的产物可以推断Cl2和NaOH发生作用生成了NaClO,A中反应也会发生。
解题:A、C
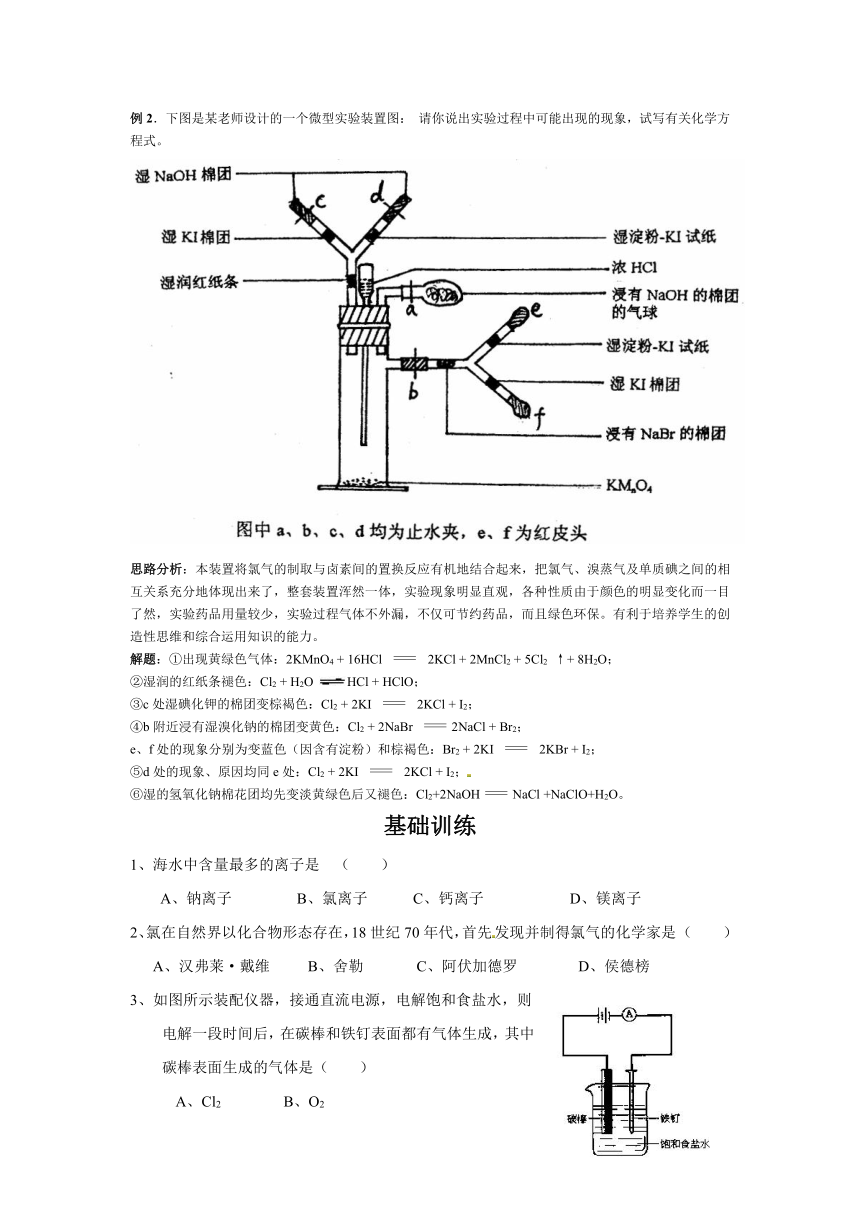
例2.下图是某老师设计的一个微型实验装置图: 请你说出实验过程中可能出现的现象,试写有关化学方程式。
思路分析:本装置将氯气的制取与卤素间的置换反应有机地结合起来,把氯气、溴蒸气及单质碘之间的相互关系充分地体现出来了,整套装置浑然一体,实验现象明显直观,各种性质由于颜色的明显变化而一目了然,实验药品用量较少,实验过程气体不外漏,不仅可节约药品,而且绿色环保。有利于培养学生的创造性思维和综合运用知识的能力。
解题:①出现黄绿色气体:2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 ↑+ 8H2O;
②湿润的红纸条褪色:Cl2 + H2O HCl + HClO;
③c处湿碘化钾的棉团变棕褐色:Cl2 + 2KI 2KCl + I2;
④b附近浸有湿溴化钠的棉团变黄色:Cl2 + 2NaBr 2NaCl + Br2;
e、f处的现象分别为变蓝色(因含有淀粉)和棕褐色:Br2 + 2KI 2KBr + I2;
⑤d处的现象、原因均同e处:Cl2 + 2KI 2KCl + I2;
⑥湿的氢氧化钠棉花团均先变淡黄绿色后又褪色:Cl2+2NaOHNaCl +NaClO+H2O。
基础训练
1、海水中含量最多的离子是 ( )
A、钠离子 B、氯离子 C、钙离子 D、镁离子
2、氯在自然界以化合物形态存在,18世纪70年代,首先发现并制得氯气的化学家是 ( )
A、汉弗莱·戴维 B、舍勒 C、阿伏加德罗 D、侯德榜
3、如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是( )
A、Cl2 B、O2
C、H2 D、HCl
4、若上题中电解的是未精制的饱和食盐水,结果很快在某一电 [来源:21世纪教育网]
极附近出现浑浊现象。造成浑浊的难溶物主要是 ( )
A、碳酸镁 B、硫酸钡
C、氢氧化镁 D、碳酸钡
5、在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是 ( )
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸
④加过量的碳酸钠溶液 ⑤加过量的氯化钡溶液
A、①④②⑤③ B、④①②⑤③
C、②⑤④①③ D、⑤②④③①
6、下列选项中,与氯气用途无关的是 ( )
A、消毒杀菌 B、制漂白粉 C、制盐酸 D、从海水中提取食盐
7、用下列两种方法制取氯气:①用含氯化氢146克的浓盐酸与足量的二氧化锰反应②用87克二氧化锰与足量的浓盐酸反应,则所得氯气 ( )21世纪教育网
A、②比①多 B、①比②多 C、一样多 D、无法比较21世纪教育网
8、为了在实验室制得不含氯化氢的干燥的氯气,正确的净化顺序是 ( )
A、第一步通过浓硫酸,第二步通过无水氯化钙21世纪教育网
B、第一步通过水,第二步通过氧化钙
C、第一步通过饱和食盐水, 第二步通过无水氯化钙
D、第一步通过碱石灰,第二步通过浓硫酸
9、实验室制取氯气可以有以下途径,用化学方程式表示如下。若制取等质量的氯气,消耗盐酸最少的是( )
A、8HCl+K2Cr2O7==2KCl+Cr2O3+4H2O+3Cl2↑
B、16HCl+2KMnO4==2MnCl2+8H2O+2KCl+5Cl2↑
C、4HCl+MnO2 △MnCl2+2H2O+Cl2↑
D、6HCl+KClO3==KCl+3H2O+3Cl2↑
10、目前我国工业上大多采用离子交换膜法电解食盐水制烧碱和氯气。如图:电解槽中用石墨或钛作阳极与电源正极相接,用铁网作阴极与电源负极相接,中间设特殊的离子交换膜。
21世纪教育网
[21世纪教育网
试分析:从a进入的液体是 ,从b流出的液体是 ;图中的离子交换膜只允许_____离子通过,该离子交换膜的作用是
。
你认为这种制碱的方法存在的缺点是________(填序号)
A、消耗大量的电能 B、产品中氢气和氯气用途不大,造成浪费
C、食盐不易获取 D、生产过程中若处理不当易造成环境污染
11、右图表示在没有通风橱的条件下制备氯气时设计的装置, 图中a、b是可控制的弹簧铁夹。(氯气在饱和氯化钠溶液中的溶解度较小。)
⑴仪器A的名称是 ;水槽中应盛放的
是 ;烧杯中盛放的是 ;
烧瓶中反应的化学方程式 ;
⑵在收集氯气时,应 。当氯气收集完毕时
应 。(填如何控制a、b)
⑶ 若要制得标准状况下的Cl2 0.672L,理论上需要MnO2的物质的量是多少?
12、某氯碱厂打算利用电解食盐水所得气体生产盐酸。
⑴写出电解食盐水制取H2、Cl2的化学方程式: 。
⑵若该氯碱厂日产50% NaOH溶液3000 kg。如果把同时生产的Cl2和H2都制成38%的盐酸,试计算理论上每天可生产盐酸的质量。
1、B 2、B 3、A 4、C 5、C 6、D 7、A 8、C 9、D
10、精制饱和食盐水,氢氧化钠溶液;Na+ ,防止阴极产生的氢气和阳极产生的氯气相混合而引起爆炸,又能避免氯气和氢氧化钠作用生成次氯酸钠。 A D
11、⑴ 分液漏斗 饱和食盐水 氢氧化钠溶液 MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O
⑵ 打开a关闭b 打开b关闭a ⑶理论上需要0.03mol MnO2
12、⑴2NaCl+2H2O===H2↑+Cl2↑+2NaOH ⑵ 3601.97 kg
1、B 2、B 3、A 4、C 5、C 6、D 7、A 8、C 9、D
10、精制饱和食盐水,氢氧化钠溶液;Na+ ,防止阴极产生的氢气和阳极产生的氯气相混合而引起爆炸,又能避免氯气和氢氧化钠作用生成次氯酸钠。 A D
11、⑴ 分液漏斗 饱和食盐水 氢氧化钠溶液 MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O
⑵ 打开a关闭b 打开b关闭a ⑶理论上需要0.03mol MnO2
12、⑴2NaCl+2H2O===H2↑+Cl2↑+2NaOH ⑵ 3601.97 kg
21世纪教育网
a
b
通电
通电
第一单元 氯、溴、碘、及其化合物
第一课时 氯气的生产原理
基础梳理
1.氯气的工业制法
工业上制取氯气大多采用电解食盐水(一般为净化后的饱和食盐水)的方法,人们把以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”。
要点提示:①电解饱和食盐水的原理:
;
溶液中存在四种离子:Na+、 Cl-、H+、OH-,通电后,氯离子在正极失电子生成氯气,氢离子在负极得电子生成氢气,溶液中剩下氢氧化钠。
②实验现象及结论:
实验现象 结论
铁棒和碳棒上通电后有气泡产生 通电后有新的气体物质生成
铁棒周围的溶液变红色 有碱性物质(NaOH)生成
将铁棒上方收集到的气体靠近火焰,有爆鸣声 有氢气生成
用手轻轻扇动在碳棒上方收集到的黄绿色气体,闻到有刺激性气味且该气体能使湿润的淀粉碘化钾试纸变蓝 有黄色刺激性气味的气体(Cl2)生成
③与电源正极相连的电极称之为阳极,产生氯气,发生的反应:2Cl--2eCl2↑;
与电源负极相连的电极称之为阴极,产生氢气,发生的反应:2H++2eH2↑。
④a口收集的气体是氢气,b口收集的气体是氯气。因为氯气有毒,直接排放会造成空气的污染,所以b口排出的气体应该通入氢氧化钠溶液中,目的是为了吸收氯气。 Cl2 + 2NaOH NaCl + NaClO + H2O(化学实验中,凡是有毒的或易燃易爆的尾气,都要进行收集或转化处理,使之无害化,切不可随意向空气中排放)。
⑤滴加酚酞先在铁棒(负极)处变红:因为H+在负极得到电子变成H2跑出,负极处的H+不断减少,OH-相应增多,溶液显碱性,酚酞遇碱变红。
注意:⑴反应物除了NaCl之外还有H2O;
⑵在电源的正极得到黄绿色的氯气,在电源的负极得到无色氢气,在溶液中得到了氢氧化钠,所以该反应的方程式为2NaCl+2H2OH2↑+Cl2↑+2NaOH。由方程式可知在两电极上方得到气体的体积比为1:1。
电解产物探究,分析过程如下:
(1)从气体的颜色和气味可知在电极上产生了两种不同的气体。
(2)从滴有酚酞的氯化钠溶液变红可知电解过程中有氢氧化钠生成。
(3)从反应物为H2O和NaCl,可分析产生的气体为O2、C12和H2中的两种。21世纪教育网
(4)从一支试管中产生的气体为黄绿色、有刺激性气味,可知该气体不可能是氢气或氧气。
(5)检验生成的气体,仔细分析现象,可知一个电极上生成了氢气。
(6)综合归纳上述分析,可写出电解饱和氯化钠溶液的化学方程式。
2.氯气的实验室制法
实验室常用二氧化锰(MnO2)、KMnO4等氧化剂和浓盐酸共热来制取氯气。
要点提示:21世纪教育网
①实验原理:MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑;
2KMnO4+16HCl2KCl+2MnCl2+8H2O+5Cl2 ↑;
KClO3+6HClKCl+3H2O+3Cl2 ↑
②MnO2和稀盐酸不反应,所以必须用浓盐酸,而且此反应必须加热,因为在常温下二氧化锰与盐酸几乎不反应。
③实验装置图:
④制取装置:固体与液体加热制气型,一般用圆底烧瓶和分液漏斗
⑤净化装置:浓盐酸易挥发出氯化氢气体,而且加热时会产生水蒸气,所以应在收集装置和发生装置之间连接一个净化装置。饱和食盐水用来除去氯化氢气体,浓硫酸用来除去水蒸气,除杂顺序为先除其他杂质气体,最后除去水蒸气。气流方向为长导管进气,短导管出气。
⑥收集装置:由于氯气密度大于空气,一般用向上排空气法收,或排饱和食盐水收集。当集气瓶内的气体全部为均匀的黄绿色时,即认为容器内的氯气已经收集满。
⑦吸收装置:尾气处理装置的设计,要针对尾气的性质选择恰当的仪器和吸收剂。氯气有毒,必须吸收,防止污染环境,原理为2NaOH+Cl2 NaCl + NaClO + H2O 不能用澄清石灰水来吸收氯气。其所含Ca(OH)2太少。(注意:在设计收集气体或处理尾气的实验装置和方法时,有时还必须做到防止液体倒吸现象的发生)。
⑧氯气的检验:氯气可用湿润的KI淀粉试纸检验,其原理为Cl2 + 2KI 2KCl + I2,生成的碘与淀粉在湿润条件下生成蓝色物质。
例题解析
例1.家用消毒液的发生器是以精盐和自来水为反应物,通电时,发生器的电解槽的极板上产生大量气泡,切断电源后,生成液具有强烈的杀菌消毒能力。与该反应器工作原理直接有关的化学方程式是( )
A、2NaOH +Cl2NaCl +NaClO + H2O
B、H2 + Cl22HCl
C、2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑
D、2HClO 2HCl + O2↑[来源:21世纪教育网]
思路分析:根据发生器的反应物和反应条件,可以推测在发生器中电解食盐水, C中反应会发生。再根据生成液具有强烈的杀菌消毒能力,结合电解食盐水后的产物可以推断Cl2和NaOH发生作用生成了NaClO,A中反应也会发生。
解题:A、C
例2.下图是某老师设计的一个微型实验装置图: 请你说出实验过程中可能出现的现象,试写有关化学方程式。
思路分析:本装置将氯气的制取与卤素间的置换反应有机地结合起来,把氯气、溴蒸气及单质碘之间的相互关系充分地体现出来了,整套装置浑然一体,实验现象明显直观,各种性质由于颜色的明显变化而一目了然,实验药品用量较少,实验过程气体不外漏,不仅可节约药品,而且绿色环保。有利于培养学生的创造性思维和综合运用知识的能力。
解题:①出现黄绿色气体:2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 ↑+ 8H2O;
②湿润的红纸条褪色:Cl2 + H2O HCl + HClO;
③c处湿碘化钾的棉团变棕褐色:Cl2 + 2KI 2KCl + I2;
④b附近浸有湿溴化钠的棉团变黄色:Cl2 + 2NaBr 2NaCl + Br2;
e、f处的现象分别为变蓝色(因含有淀粉)和棕褐色:Br2 + 2KI 2KBr + I2;
⑤d处的现象、原因均同e处:Cl2 + 2KI 2KCl + I2;
⑥湿的氢氧化钠棉花团均先变淡黄绿色后又褪色:Cl2+2NaOHNaCl +NaClO+H2O。
基础训练
1、海水中含量最多的离子是 ( )
A、钠离子 B、氯离子 C、钙离子 D、镁离子
2、氯在自然界以化合物形态存在,18世纪70年代,首先发现并制得氯气的化学家是 ( )
A、汉弗莱·戴维 B、舍勒 C、阿伏加德罗 D、侯德榜
3、如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是( )
A、Cl2 B、O2
C、H2 D、HCl
4、若上题中电解的是未精制的饱和食盐水,结果很快在某一电 [来源:21世纪教育网]
极附近出现浑浊现象。造成浑浊的难溶物主要是 ( )
A、碳酸镁 B、硫酸钡
C、氢氧化镁 D、碳酸钡
5、在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是 ( )
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸
④加过量的碳酸钠溶液 ⑤加过量的氯化钡溶液
A、①④②⑤③ B、④①②⑤③
C、②⑤④①③ D、⑤②④③①
6、下列选项中,与氯气用途无关的是 ( )
A、消毒杀菌 B、制漂白粉 C、制盐酸 D、从海水中提取食盐
7、用下列两种方法制取氯气:①用含氯化氢146克的浓盐酸与足量的二氧化锰反应②用87克二氧化锰与足量的浓盐酸反应,则所得氯气 ( )21世纪教育网
A、②比①多 B、①比②多 C、一样多 D、无法比较21世纪教育网
8、为了在实验室制得不含氯化氢的干燥的氯气,正确的净化顺序是 ( )
A、第一步通过浓硫酸,第二步通过无水氯化钙21世纪教育网
B、第一步通过水,第二步通过氧化钙
C、第一步通过饱和食盐水, 第二步通过无水氯化钙
D、第一步通过碱石灰,第二步通过浓硫酸
9、实验室制取氯气可以有以下途径,用化学方程式表示如下。若制取等质量的氯气,消耗盐酸最少的是( )
A、8HCl+K2Cr2O7==2KCl+Cr2O3+4H2O+3Cl2↑
B、16HCl+2KMnO4==2MnCl2+8H2O+2KCl+5Cl2↑
C、4HCl+MnO2 △MnCl2+2H2O+Cl2↑
D、6HCl+KClO3==KCl+3H2O+3Cl2↑
10、目前我国工业上大多采用离子交换膜法电解食盐水制烧碱和氯气。如图:电解槽中用石墨或钛作阳极与电源正极相接,用铁网作阴极与电源负极相接,中间设特殊的离子交换膜。
21世纪教育网
[21世纪教育网
试分析:从a进入的液体是 ,从b流出的液体是 ;图中的离子交换膜只允许_____离子通过,该离子交换膜的作用是
。
你认为这种制碱的方法存在的缺点是________(填序号)
A、消耗大量的电能 B、产品中氢气和氯气用途不大,造成浪费
C、食盐不易获取 D、生产过程中若处理不当易造成环境污染
11、右图表示在没有通风橱的条件下制备氯气时设计的装置, 图中a、b是可控制的弹簧铁夹。(氯气在饱和氯化钠溶液中的溶解度较小。)
⑴仪器A的名称是 ;水槽中应盛放的
是 ;烧杯中盛放的是 ;
烧瓶中反应的化学方程式 ;
⑵在收集氯气时,应 。当氯气收集完毕时
应 。(填如何控制a、b)
⑶ 若要制得标准状况下的Cl2 0.672L,理论上需要MnO2的物质的量是多少?
12、某氯碱厂打算利用电解食盐水所得气体生产盐酸。
⑴写出电解食盐水制取H2、Cl2的化学方程式: 。
⑵若该氯碱厂日产50% NaOH溶液3000 kg。如果把同时生产的Cl2和H2都制成38%的盐酸,试计算理论上每天可生产盐酸的质量。
1、B 2、B 3、A 4、C 5、C 6、D 7、A 8、C 9、D
10、精制饱和食盐水,氢氧化钠溶液;Na+ ,防止阴极产生的氢气和阳极产生的氯气相混合而引起爆炸,又能避免氯气和氢氧化钠作用生成次氯酸钠。 A D
11、⑴ 分液漏斗 饱和食盐水 氢氧化钠溶液 MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O
⑵ 打开a关闭b 打开b关闭a ⑶理论上需要0.03mol MnO2
12、⑴2NaCl+2H2O===H2↑+Cl2↑+2NaOH ⑵ 3601.97 kg
1、B 2、B 3、A 4、C 5、C 6、D 7、A 8、C 9、D
10、精制饱和食盐水,氢氧化钠溶液;Na+ ,防止阴极产生的氢气和阳极产生的氯气相混合而引起爆炸,又能避免氯气和氢氧化钠作用生成次氯酸钠。 A D
11、⑴ 分液漏斗 饱和食盐水 氢氧化钠溶液 MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O
⑵ 打开a关闭b 打开b关闭a ⑶理论上需要0.03mol MnO2
12、⑴2NaCl+2H2O===H2↑+Cl2↑+2NaOH ⑵ 3601.97 kg
21世纪教育网
a
b
通电
通电
