苏教版化学必修1同步练习 硫酸的制备与性质
文档属性
| 名称 | 苏教版化学必修1同步练习 硫酸的制备与性质 |

|
|
| 格式 | zip | ||
| 文件大小 | 53.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-20 16:02:25 | ||
图片预览



文档简介
第二课时 硫酸的制备与性质
基础梳理
1.硫酸的工业制法
(1)燃烧硫或金属硫化物等原料来制取二氧化硫,使二氧化硫在适当的温度和催化剂的作用下氧化成三氧化硫,再使三氧化硫跟水化合而生成硫酸。
接触法制硫酸的反应原理、生产阶段、典型设备、归纳成下表:
化学反应原理 生产阶段 典型设备
4FeS2+11O2 2Fe2O3+8SO2 二氧化硫的制取和净化 沸腾炉
2SO2+O2 2SO3 二氧化硫氧化成三氧化硫 接触室(转化器)
SO3+H2OH2SO4 三氧化硫吸收和硫酸生成 吸收塔
(2)提高原料利用率的方法
①矿石粉碎得较小,跟空气接触面大、燃烧充分、烧得也快,提高了原料的利用率。
在接触室中,两次催化氧化。[来源:21世纪教育网]
在吸收塔中,利用逆向操作,增加吸收时间提高吸收效率。
二氧化硫的回收再利用。
2.硫酸的物理性质
硫酸是一种无色粘稠的油状液体,常见的浓硫酸质量分数为98.3%,沸点为338℃,难挥发,能与水混溶,密度比水大,溶于水时放出大量的热。
3.稀硫酸的化学性质
稀硫酸是一种二元强酸,具有酸的通性:
①与酸碱指示剂的作用:稀硫酸使紫色石蕊试液变红。
②与碱溶液反应:2NaOH+H2SO4Na2SO4+2H2O;
③与碱性氧化物反应:CuO+ H2SO4CuSO4+H2O;
④与某些弱酸盐反应:Na2CO3+H2SO4Na2SO4+H2O+CO2↑;
⑤与活泼金属的反应:Fe+H2SO4FeSO4+H2↑。
4.浓硫酸的三大特性:
浓硫酸中存在大量未电离的H2SO4分子,表现出一些特性:吸水性、脱水性、强氧化性。
①吸水性:是浓H2SO4所具有的吸收游离水分的性能。这里的游离水分包括空气中所含的水蒸气及物质中的湿存水等。浓硫酸之所以能吸收游离的水分,是因为浓硫酸和水可以结合形成相当稳定的水合物:H2SO4+xH2OH2SO4·xH2O(x=1,2,4等)。
这些水合物在低温时甚至可以以晶体的形式从溶液中析出。由于硫酸与水结合形成的水合物很稳定,故在工厂和实验室中,浓硫酸是一种理想的干燥剂。浓硫酸可以用来干燥O2、H2、CO、CO2、Cl2、HCl、N2、CH4等气体。对于那些具有还原性及碱性的气体,如HI、HBr、H2S、NH3等,则不能用浓硫酸来干燥,因为它与这些气体均可发生化学反应。
②脱水性:是指浓H2SO4将许多有机化合物(特别是糖类)中的H、O原子按照水分子中H、O原子个数比夺取出来的性质。例如,在蔗糖中滴加一定量的浓H2SO4,可以发现蔗糖的颜色变深,最后呈黑色,这是因为浓H2SO4以H和O原子个数比为2∶1的比例夺取了蔗糖中的H和O,从而使碳游离出来:C12H22O11 12C+11H2O。
③强氧化性:浓硫酸是强氧化性酸,可以氧化大多数金属(除Pt和Au)和其他还原性物质(H2S、HBr、HI、Fe2+等)。如21世纪教育网
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(氧化性、酸性)
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(氧化性)
2HBr+H2SO4(浓) SO2↑+Br2+2H2O(氧化性)
2FeSO4+2H2SO4(浓) Fe2(SO4)3+SO2↑+2H2O(氧化性)
H2S+H2SO4(浓) S↓+SO2↑+2H2O(氧化性)
在以上反应中,浓硫酸一般被还原为SO2。常温时,Al、Fe在浓硫酸中钝化,其实质是浓H2SO4使Al、Fe氧化生成致密的氧化物保护膜。
特别提示:①浓硫酸有强氧化性,包括还原性很弱的银在内的很多物质,都能在一定条件下被浓硫酸氧化。硫酸之所以能有如此强的氧化性,一个原因是在高浓度下硫酸以分子的形式存在,另一个原因是硫酸中含有非金属性较强且又呈最高价态(+6)的硫元素。
②浓硫酸在作氧化剂时,主要是+6价硫的原子得电子,被还原为含低价硫元素的物质,一般不会有+1价氢被还原,即一般不会生成氢气。浓硫酸在作氧化剂时,硫元素被还原的程度是一个较复杂的问题,中学化学中常见的还原产物为SO2。
[来源:21世纪教育网]
5.浓硫酸与稀硫酸的性质、应用的比较:
21世纪教育网 浓硫酸 稀硫酸
酸性21世纪教育网[来源:21世纪教育网]21世纪教育网 方程式[来源:21世纪教育网] 2NaCl+H2SO4(浓)[来源:21世纪教育网]Na2SO4+2HCl 2NaOH+H2SO4Na2SO4+2H2O
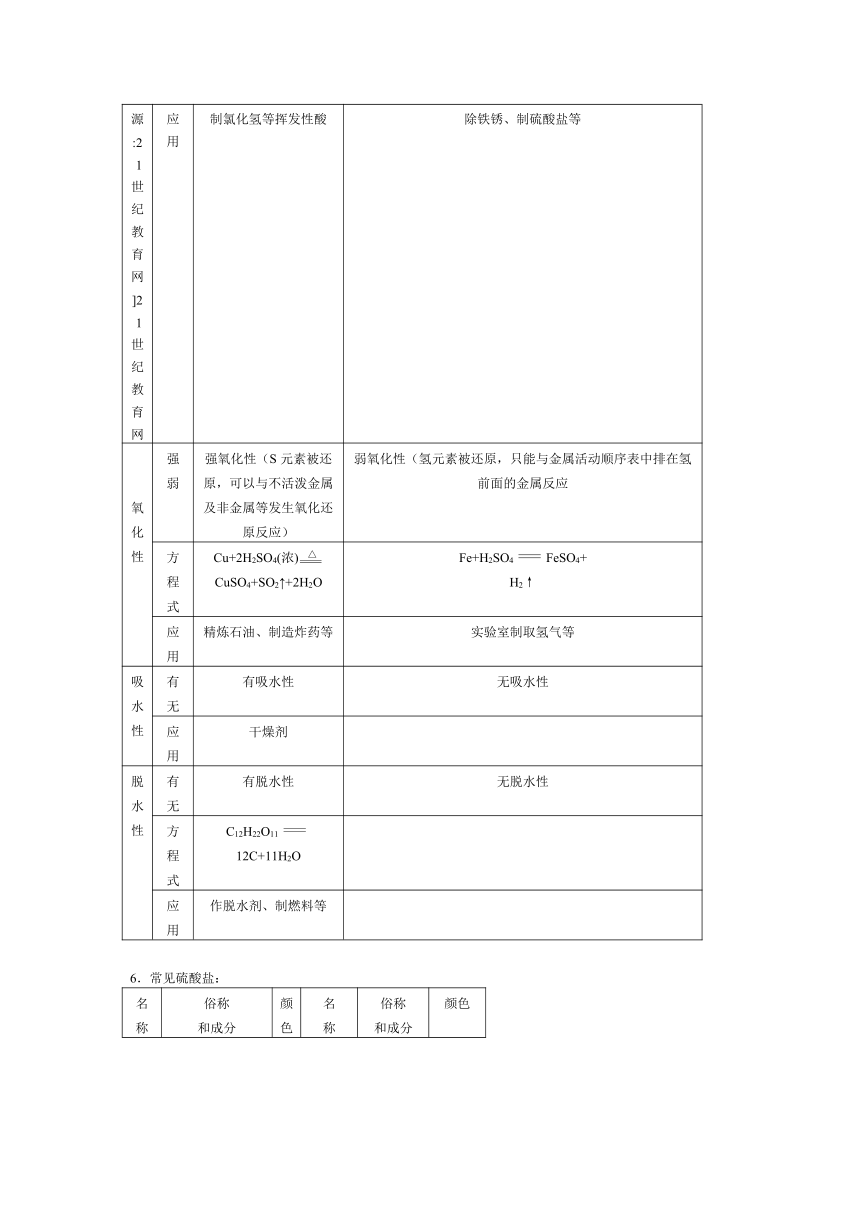
应用 制氯化氢等挥发性酸 除铁锈、制硫酸盐等
氧化性 强弱 强氧化性(S元素被还原,可以与不活泼金属及非金属等发生氧化还原反应) 弱氧化性(氢元素被还原,只能与金属活动顺序表中排在氢前面的金属反应
方程式 Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O Fe+H2SO4FeSO4+H2↑
应用 精炼石油、制造炸药等 实验室制取氢气等
吸水性 有无 有吸水性 无吸水性
应用 干燥剂
脱水性 有无 有脱水性 无脱水性
方程式 C12H22O11 12C+11H2O
应用 作脱水剂、制燃料等
6.常见硫酸盐:
名称 俗称和成分 颜色 名称 俗称和成分 颜色
硫酸钙 石膏CaSO4 2H2O熟石膏2CaSO4 H2O 白色 硫酸钡 重晶石BaSO4 白色
硫酸亚铁 绿矾FeSO4 7H2O 绿色 硫酸钠 芒硝Na2SO4 10H2O 白色
硫酸铜 胆(蓝)矾CuSO4 7H2O 蓝色 硫酸锌 皓矾ZnSO4 7H2O 白色
例题解析
例3:把浓硫酸滴入浓盐酸中,会有氯化氢气体逸出,对此现象的合理解释是( )
A.氯化氢难溶于水
B.浓硫酸有脱水性
C.浓硫酸是一种高沸点的酸
D.浓硫酸溶于水放出大量的热,降低了氯化氢的溶解度
思路分析:抓住盐酸与硫酸的共性与特性,思考气体逸出受到何种因素的影响;根据盐酸性质可知,氯化氢极易溶与水,所以A是错误的;在这个过程中没有从有机物中脱去氢氧原子形成水的过程,与浓硫酸的脱水性无关;浓硫酸溶与水,放出大量的热,使HCl的溶解能力降低,这是有氯化氢气体形成的原因。
解题:D
基础训练
一、选择题(每小题仅有一个正确选项)
1. 目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及( )
A、SO2 B、NO2 C、CO2 D、可吸入颗粒物
2. 绿色化学实验是在绿色化学的思想指导下,对常规实验进行改革而形成的实验的新方法。它能极大地减少或消除实验中的“三废”、污染和浪费等。下列符合绿色化学实验的操作是 ( )
A.将一氧化碳还原氧化铜的尾气直接排入空气中
B.将锌和稀硫酸反应后的废液直接倒入下水道中
C.将跟氧气反应后剩余的硫磺放在空气里燃烧完
D.将氯酸钾和二氧化锰共热残余物回收分离
3.工业上常用稀硫酸清洗铁表面的锈层,这是利用硫酸的 ( )
A 强氧化性 B不挥发性 C酸性 D吸水性
4.下列物质在一定条件下能够与硫黄发生反应,且硫做还原剂的是
A、O2 B、Fe C、H2 D、Zn
5.50mL18mol/L的H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为( )
A. <0.45mol B. 0.45mol C. 0.45-0.90mol之间 D. >0.90mol
6.下列说法中,不正确的是
A 硫既可做氧化剂,又可做还原剂
B SO3只有氧化性,SO2只有还原性
C可以用铁罐贮运冷的浓H2SO4
D氢硫酸既有氧化性又有还原性
7.除去SO2中混有的HC1气体,可选用的试剂是
A 石灰水 B浓硫酸 C饱和NaHSO3溶液 D饱和Na2SO3溶液
8.既不能用浓硫酸干燥,又不能用碱石灰干燥的气体是 ( )
A Cl2 B H2S C SO2 D CO2
9.下列各组离子能大量共存的是 ?A.Na+、Ba2+、S2-、SO3 2-
B.H+、K+、HS-、SO42-?
C.Fe2+、H+、Cl-、NO3-
D.K+、NH4+、SO42-、NO3-?
10.在一定条件下,还原性顺序为Cl- <Br-< Fe2+<I-<SO2<H2S,由此判断下列反应不能发生的是
A 2Fe3++SO2+2H2O==2Fe2++SO42-+4H+
B.2Fe3++H2S==2Fe2++S+2H+
C I2+SO2+2H2O==2I-+SO42-+4H+
D2Br-+ SO42-+4H+==Br2+SO2+2H2O
11.将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO4======Fe2O3+SO2↑+SO3↑,如将生成的混合气体通过BaCl2溶液,应发生的现象有 ( )
(A)一定产生BaSO4沉淀 (B)一定产生BaSO3沉淀
(C)一定有SO2逸出 (D)一定有SO3逸出
二、填空题
12.汞蒸气有毒。①万一把汞洒出,可以在有微细汞滴的部位撒一层硫磺粉,这时发生反应的化学方程式是_____________________________________________。
②室内有汞蒸气时应进行通风以降低汞蒸气浓度,这时通风口装在墙的________(填“上”或“下”)部的效率高。
13.工业制CuSO4时,不是直接用铜跟浓H2SO4在加热条件下反应,而是将铜丝浸入稀H2SO4中,再不断由容器下部吹入细小的空气泡。请从原料的用量以及环境保护的角度说明这样做的好处是① _____________________________________ ,
②_____________________________________________________。
14.有两种白色钾盐(正盐)粉末A、B ,加入稀盐酸后分别生成无色气体D和E 。D和E通入氢氧化钡溶液都能使其浑浊;D、E通入品红溶液只有D使其褪色;D还能使溴水褪色生成两种酸的混合溶液。
① 请写出两种盐的名称:A为 ,B ;
② 完成下列化学方程式:
1) A + H2SO4 :
2) E+ Ca(OH)2 :
3) D + Br2 + H2O
15.燃煤锅炉将排放大量SO2,污染大气造成公害,常采用两种方法消除燃煤SO2的污染。
(1)使排放的烟气通过氨水洗涤,化学方程式是 。 或
生成物最终成为_____________________________是很好的化肥.
(2)在煤中加适量石灰,使SO2与石灰反应,化学方程式为
,
该生成物仍可被氧化而成稳定的石膏,化学方程式为
。
三、实验题
16.已知:①FeS不溶解于水;②实验室制取H2S、SO2气体的原理是:FeS+H2SO4=FeSO4+H2S↑,Na2SO3+H2SO4=Na2SO4+H2O+SO2;③硫化氢与二氧化硫气体相遇会发生反应:2H2S+SO2=3S↓+2H2O。
根据下图中A~D的实验装置和试剂进行实验,回答下列问题:
⑴装置A是由双孔塞、玻璃导管及 和 组装起来的。?
⑵组装一套制取SO2气体的装置,并证明SO2既有氧化性、又有还原性和漂白性。?
①按实验装置连接顺序,把af各导管口连接起 来,正确的顺序有 。
A.befcda B.adcefb C.acdfeb D.acdefb
②若C装置中的溶液为 ,反应后该溶液变为无色,说明SO2具有还原性;?③若C装置中的溶液为 ,反应后该溶液变为无色,说明SO2具有漂白性;
④当D中产生 现象时,说明SO2具有氧化性;
(3)D装置烧杯中NaOH溶液的作用 。
答案:1.C 2.D 3.C 4.A 5.A 6.B 7.C 8.B 9.D 10.D 11.A
12 ①Hg+SHgS②下
13 ①减少硫酸用量;②不会产生对大气污染的SO2。
14 ①亚硫酸钾 碳酸钾肥 ②略
15 (1)SO2+2NH3+H2O=(NH4)2SO3 SO2+NH3+H2O=NH4HSO3
(NH4)2SO4 或 NH4HSO4
(2)CaO+SO2=CaSO3; 2CaSO3+O2 +4H2O=2 (CaSO4·2H2O)
16.⑴分液漏斗、圆底烧瓶
⑵ ①AB ②酸性KMnO4溶液或溴水、碘水等
③品红溶液 ④有淡黄色固体析出
(3)吸收未反应的H2S或SO2气体,以免污染空气
强热
基础梳理
1.硫酸的工业制法
(1)燃烧硫或金属硫化物等原料来制取二氧化硫,使二氧化硫在适当的温度和催化剂的作用下氧化成三氧化硫,再使三氧化硫跟水化合而生成硫酸。
接触法制硫酸的反应原理、生产阶段、典型设备、归纳成下表:
化学反应原理 生产阶段 典型设备
4FeS2+11O2 2Fe2O3+8SO2 二氧化硫的制取和净化 沸腾炉
2SO2+O2 2SO3 二氧化硫氧化成三氧化硫 接触室(转化器)
SO3+H2OH2SO4 三氧化硫吸收和硫酸生成 吸收塔
(2)提高原料利用率的方法
①矿石粉碎得较小,跟空气接触面大、燃烧充分、烧得也快,提高了原料的利用率。
在接触室中,两次催化氧化。[来源:21世纪教育网]
在吸收塔中,利用逆向操作,增加吸收时间提高吸收效率。
二氧化硫的回收再利用。
2.硫酸的物理性质
硫酸是一种无色粘稠的油状液体,常见的浓硫酸质量分数为98.3%,沸点为338℃,难挥发,能与水混溶,密度比水大,溶于水时放出大量的热。
3.稀硫酸的化学性质
稀硫酸是一种二元强酸,具有酸的通性:
①与酸碱指示剂的作用:稀硫酸使紫色石蕊试液变红。
②与碱溶液反应:2NaOH+H2SO4Na2SO4+2H2O;
③与碱性氧化物反应:CuO+ H2SO4CuSO4+H2O;
④与某些弱酸盐反应:Na2CO3+H2SO4Na2SO4+H2O+CO2↑;
⑤与活泼金属的反应:Fe+H2SO4FeSO4+H2↑。
4.浓硫酸的三大特性:
浓硫酸中存在大量未电离的H2SO4分子,表现出一些特性:吸水性、脱水性、强氧化性。
①吸水性:是浓H2SO4所具有的吸收游离水分的性能。这里的游离水分包括空气中所含的水蒸气及物质中的湿存水等。浓硫酸之所以能吸收游离的水分,是因为浓硫酸和水可以结合形成相当稳定的水合物:H2SO4+xH2OH2SO4·xH2O(x=1,2,4等)。
这些水合物在低温时甚至可以以晶体的形式从溶液中析出。由于硫酸与水结合形成的水合物很稳定,故在工厂和实验室中,浓硫酸是一种理想的干燥剂。浓硫酸可以用来干燥O2、H2、CO、CO2、Cl2、HCl、N2、CH4等气体。对于那些具有还原性及碱性的气体,如HI、HBr、H2S、NH3等,则不能用浓硫酸来干燥,因为它与这些气体均可发生化学反应。
②脱水性:是指浓H2SO4将许多有机化合物(特别是糖类)中的H、O原子按照水分子中H、O原子个数比夺取出来的性质。例如,在蔗糖中滴加一定量的浓H2SO4,可以发现蔗糖的颜色变深,最后呈黑色,这是因为浓H2SO4以H和O原子个数比为2∶1的比例夺取了蔗糖中的H和O,从而使碳游离出来:C12H22O11 12C+11H2O。
③强氧化性:浓硫酸是强氧化性酸,可以氧化大多数金属(除Pt和Au)和其他还原性物质(H2S、HBr、HI、Fe2+等)。如21世纪教育网
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(氧化性、酸性)
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(氧化性)
2HBr+H2SO4(浓) SO2↑+Br2+2H2O(氧化性)
2FeSO4+2H2SO4(浓) Fe2(SO4)3+SO2↑+2H2O(氧化性)
H2S+H2SO4(浓) S↓+SO2↑+2H2O(氧化性)
在以上反应中,浓硫酸一般被还原为SO2。常温时,Al、Fe在浓硫酸中钝化,其实质是浓H2SO4使Al、Fe氧化生成致密的氧化物保护膜。
特别提示:①浓硫酸有强氧化性,包括还原性很弱的银在内的很多物质,都能在一定条件下被浓硫酸氧化。硫酸之所以能有如此强的氧化性,一个原因是在高浓度下硫酸以分子的形式存在,另一个原因是硫酸中含有非金属性较强且又呈最高价态(+6)的硫元素。
②浓硫酸在作氧化剂时,主要是+6价硫的原子得电子,被还原为含低价硫元素的物质,一般不会有+1价氢被还原,即一般不会生成氢气。浓硫酸在作氧化剂时,硫元素被还原的程度是一个较复杂的问题,中学化学中常见的还原产物为SO2。
[来源:21世纪教育网]
5.浓硫酸与稀硫酸的性质、应用的比较:
21世纪教育网 浓硫酸 稀硫酸
酸性21世纪教育网[来源:21世纪教育网]21世纪教育网 方程式[来源:21世纪教育网] 2NaCl+H2SO4(浓)[来源:21世纪教育网]Na2SO4+2HCl 2NaOH+H2SO4Na2SO4+2H2O
应用 制氯化氢等挥发性酸 除铁锈、制硫酸盐等
氧化性 强弱 强氧化性(S元素被还原,可以与不活泼金属及非金属等发生氧化还原反应) 弱氧化性(氢元素被还原,只能与金属活动顺序表中排在氢前面的金属反应
方程式 Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O Fe+H2SO4FeSO4+H2↑
应用 精炼石油、制造炸药等 实验室制取氢气等
吸水性 有无 有吸水性 无吸水性
应用 干燥剂
脱水性 有无 有脱水性 无脱水性
方程式 C12H22O11 12C+11H2O
应用 作脱水剂、制燃料等
6.常见硫酸盐:
名称 俗称和成分 颜色 名称 俗称和成分 颜色
硫酸钙 石膏CaSO4 2H2O熟石膏2CaSO4 H2O 白色 硫酸钡 重晶石BaSO4 白色
硫酸亚铁 绿矾FeSO4 7H2O 绿色 硫酸钠 芒硝Na2SO4 10H2O 白色
硫酸铜 胆(蓝)矾CuSO4 7H2O 蓝色 硫酸锌 皓矾ZnSO4 7H2O 白色
例题解析
例3:把浓硫酸滴入浓盐酸中,会有氯化氢气体逸出,对此现象的合理解释是( )
A.氯化氢难溶于水
B.浓硫酸有脱水性
C.浓硫酸是一种高沸点的酸
D.浓硫酸溶于水放出大量的热,降低了氯化氢的溶解度
思路分析:抓住盐酸与硫酸的共性与特性,思考气体逸出受到何种因素的影响;根据盐酸性质可知,氯化氢极易溶与水,所以A是错误的;在这个过程中没有从有机物中脱去氢氧原子形成水的过程,与浓硫酸的脱水性无关;浓硫酸溶与水,放出大量的热,使HCl的溶解能力降低,这是有氯化氢气体形成的原因。
解题:D
基础训练
一、选择题(每小题仅有一个正确选项)
1. 目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及( )
A、SO2 B、NO2 C、CO2 D、可吸入颗粒物
2. 绿色化学实验是在绿色化学的思想指导下,对常规实验进行改革而形成的实验的新方法。它能极大地减少或消除实验中的“三废”、污染和浪费等。下列符合绿色化学实验的操作是 ( )
A.将一氧化碳还原氧化铜的尾气直接排入空气中
B.将锌和稀硫酸反应后的废液直接倒入下水道中
C.将跟氧气反应后剩余的硫磺放在空气里燃烧完
D.将氯酸钾和二氧化锰共热残余物回收分离
3.工业上常用稀硫酸清洗铁表面的锈层,这是利用硫酸的 ( )
A 强氧化性 B不挥发性 C酸性 D吸水性
4.下列物质在一定条件下能够与硫黄发生反应,且硫做还原剂的是
A、O2 B、Fe C、H2 D、Zn
5.50mL18mol/L的H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为( )
A. <0.45mol B. 0.45mol C. 0.45-0.90mol之间 D. >0.90mol
6.下列说法中,不正确的是
A 硫既可做氧化剂,又可做还原剂
B SO3只有氧化性,SO2只有还原性
C可以用铁罐贮运冷的浓H2SO4
D氢硫酸既有氧化性又有还原性
7.除去SO2中混有的HC1气体,可选用的试剂是
A 石灰水 B浓硫酸 C饱和NaHSO3溶液 D饱和Na2SO3溶液
8.既不能用浓硫酸干燥,又不能用碱石灰干燥的气体是 ( )
A Cl2 B H2S C SO2 D CO2
9.下列各组离子能大量共存的是 ?A.Na+、Ba2+、S2-、SO3 2-
B.H+、K+、HS-、SO42-?
C.Fe2+、H+、Cl-、NO3-
D.K+、NH4+、SO42-、NO3-?
10.在一定条件下,还原性顺序为Cl- <Br-< Fe2+<I-<SO2<H2S,由此判断下列反应不能发生的是
A 2Fe3++SO2+2H2O==2Fe2++SO42-+4H+
B.2Fe3++H2S==2Fe2++S+2H+
C I2+SO2+2H2O==2I-+SO42-+4H+
D2Br-+ SO42-+4H+==Br2+SO2+2H2O
11.将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO4======Fe2O3+SO2↑+SO3↑,如将生成的混合气体通过BaCl2溶液,应发生的现象有 ( )
(A)一定产生BaSO4沉淀 (B)一定产生BaSO3沉淀
(C)一定有SO2逸出 (D)一定有SO3逸出
二、填空题
12.汞蒸气有毒。①万一把汞洒出,可以在有微细汞滴的部位撒一层硫磺粉,这时发生反应的化学方程式是_____________________________________________。
②室内有汞蒸气时应进行通风以降低汞蒸气浓度,这时通风口装在墙的________(填“上”或“下”)部的效率高。
13.工业制CuSO4时,不是直接用铜跟浓H2SO4在加热条件下反应,而是将铜丝浸入稀H2SO4中,再不断由容器下部吹入细小的空气泡。请从原料的用量以及环境保护的角度说明这样做的好处是① _____________________________________ ,
②_____________________________________________________。
14.有两种白色钾盐(正盐)粉末A、B ,加入稀盐酸后分别生成无色气体D和E 。D和E通入氢氧化钡溶液都能使其浑浊;D、E通入品红溶液只有D使其褪色;D还能使溴水褪色生成两种酸的混合溶液。
① 请写出两种盐的名称:A为 ,B ;
② 完成下列化学方程式:
1) A + H2SO4 :
2) E+ Ca(OH)2 :
3) D + Br2 + H2O
15.燃煤锅炉将排放大量SO2,污染大气造成公害,常采用两种方法消除燃煤SO2的污染。
(1)使排放的烟气通过氨水洗涤,化学方程式是 。 或
生成物最终成为_____________________________是很好的化肥.
(2)在煤中加适量石灰,使SO2与石灰反应,化学方程式为
,
该生成物仍可被氧化而成稳定的石膏,化学方程式为
。
三、实验题
16.已知:①FeS不溶解于水;②实验室制取H2S、SO2气体的原理是:FeS+H2SO4=FeSO4+H2S↑,Na2SO3+H2SO4=Na2SO4+H2O+SO2;③硫化氢与二氧化硫气体相遇会发生反应:2H2S+SO2=3S↓+2H2O。
根据下图中A~D的实验装置和试剂进行实验,回答下列问题:
⑴装置A是由双孔塞、玻璃导管及 和 组装起来的。?
⑵组装一套制取SO2气体的装置,并证明SO2既有氧化性、又有还原性和漂白性。?
①按实验装置连接顺序,把af各导管口连接起 来,正确的顺序有 。
A.befcda B.adcefb C.acdfeb D.acdefb
②若C装置中的溶液为 ,反应后该溶液变为无色,说明SO2具有还原性;?③若C装置中的溶液为 ,反应后该溶液变为无色,说明SO2具有漂白性;
④当D中产生 现象时,说明SO2具有氧化性;
(3)D装置烧杯中NaOH溶液的作用 。
答案:1.C 2.D 3.C 4.A 5.A 6.B 7.C 8.B 9.D 10.D 11.A
12 ①Hg+SHgS②下
13 ①减少硫酸用量;②不会产生对大气污染的SO2。
14 ①亚硫酸钾 碳酸钾肥 ②略
15 (1)SO2+2NH3+H2O=(NH4)2SO3 SO2+NH3+H2O=NH4HSO3
(NH4)2SO4 或 NH4HSO4
(2)CaO+SO2=CaSO3; 2CaSO3+O2 +4H2O=2 (CaSO4·2H2O)
16.⑴分液漏斗、圆底烧瓶
⑵ ①AB ②酸性KMnO4溶液或溴水、碘水等
③品红溶液 ④有淡黄色固体析出
(3)吸收未反应的H2S或SO2气体,以免污染空气
强热
