2020-2021学年江苏省淮安市高中校协作体高三(上)期中化学试卷(含解析)
文档属性
| 名称 | 2020-2021学年江苏省淮安市高中校协作体高三(上)期中化学试卷(含解析) | 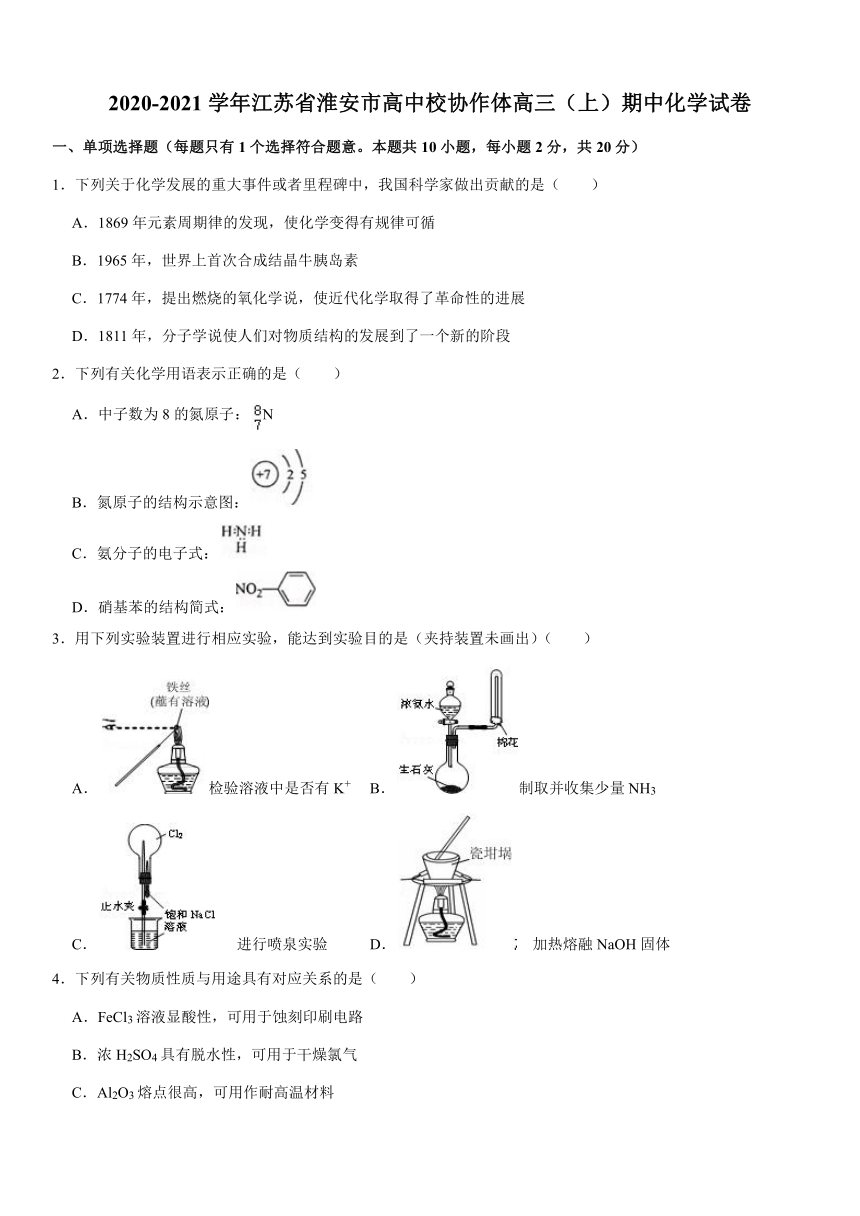 | |
| 格式 | zip | ||
| 文件大小 | 233.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-30 10:59:20 | ||
图片预览





文档简介
2020-2021学年江苏省淮安市高中校协作体高三(上)期中化学试卷
一、单项选择题(每题只有1个选择符合题意。本题共10小题,每小题2分,共20分)
1.下列关于化学发展的重大事件或者里程碑中,我国科学家做出贡献的是( )
A.1869年元素周期律的发现,使化学变得有规律可循
B.1965年,世界上首次合成结晶牛胰岛素
C.1774年,提出燃烧的氧化学说,使近代化学取得了革命性的进展
D.1811年,分子学说使人们对物质结构的发展到了一个新的阶段
2.下列有关化学用语表示正确的是( )
A.中子数为8的氮原子:N
B.氮原子的结构示意图:
C.氨分子的电子式:
D.硝基苯的结构简式:
3.用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)( )
A.检验溶液中是否有K+
B.制取并收集少量NH3
C.
进行喷泉实验
D.
加热熔融NaOH固体
4.下列有关物质性质与用途具有对应关系的是( )
A.FeCl3溶液显酸性,可用于蚀刻印刷电路
B.浓H2SO4具有脱水性,可用于干燥氯气
C.Al2O3熔点很高,可用作耐高温材料
D.SiO2具有导电性,可用于制作光导纤维
5.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.NH3NO2HNO3
B.Fe2O3FeFeCl3
C.SiO2H2SiO3(aq)Na2SiO3
D.CuCl2(aq)Cu(OH)2Cu2O
6.下列反应的离子方程式的书写正确的是( )
A.钠与水反应:Na+H2O═Na++OH﹣+H2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3?H2O═AlO2﹣+4NH4++2H2O
C.FeCl3溶液净水原理:Fe3++3H2O═Fe(OH)3↓+3H+
D.向硫酸氢钠溶液滴加氢氧化钡溶液至中性:2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O
7.下列说法
正确的是( )
A.一定条件下3mol
H2和1mol
N2充分反应生成NH3转移的电子数目小于6×6.02×1023
B.在酶催化淀粉水解反应中,温度越高,淀粉水解速度越快
C.室温下,Na在空气中反应生成Na2O2
D.沸点:H2O>H2S
8.短周期主族元素X、Y、Z、W、Q原子序数依次增大,X、Z同主族且与Y处于不同周期,Y、W同主族且W的原子序数是Y的两倍,以下说法正确的( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.Y的简单气态氢化物的稳定性比W的强
C.W元素最高价氧化物对应的水化物的酸性比Q的强
D.Y、Z、W的第一电离能顺序为:Z>W>Y
9.下列措施可使H2的生成速率减小的是( )
A.Na与H2O反应制取H2,增加H2O的用量
B.Al与稀硫酸反应制取H2,向稀硫酸中加入K2SO4溶液
C.Mg与H2O反应制取H2,将冷水改为热水
D.碳粉与H2O(g)反应制取H2,增加碳粉的用量
10.下列说法正确的是( )
A.钢铁锈蚀时,Fe失去电子成为Fe3+
B.铅蓄电池(如图)在放电过程中,负极质量减小,正极质量增加
C.将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀
D.铅蓄电池和碱性锌锰电池都属于二次电池
二、不定项选择题(每题有1-2个选项符合题意,全部正确得4分,部分正确得2分,选错得0分,本题共5小题,共20分)
11.合成氨工业中,原料气中的杂质CO在进入合成塔之前需经过铜氨液处理,其反应为Cu(NH3)2++CO+NH3?[Cu(NH3)3CO]+△H<0,吸收CO后的醋酸铜氨溶液经过适当处理又可再生,再生的适宜条件是( )
A.高温低压
B.高温高压
C.低温低压
D.低温高压
12.根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向久置Na2SO3溶液中,加入足量稀硝酸,再加入足量BaCl2溶液,出现白色沉淀
久置Na2SO3已部分被氧化
B
C2H5OH与浓硫酸共热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去
反应生成了乙烯
C
卤代烃Y与KOH水溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生淡黄色沉淀
卤代烃Y中含有溴原子
D
向20%麦芽糖溶液中加入少量稀硫酸、加热,再加入氢氧化钠调节至碱性,再加入银氨溶液,水浴加热,出现银镜
麦芽糖水解产物具有还原性
A.A
B.B
C.C
D.D
13.下列关于0.1mol/L
Ba(NO3)2溶液正确的说法是( )
A.该溶液可由1L水中溶解0.1mol
Ba(NO3)2制得
B.1L溶液中含有Ba+和NO3﹣离子总数为0.3×6.02×1023
C.0.5L溶液中Ba2+离子的物质的量浓度为0.2mol/L
D.0.5L溶液中NO3﹣离子的物质的量浓度为0.2mol/L
14.室温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:NH4+、Fe3+、Cl﹣、SCN﹣
B.0.1mol?L﹣1BaCl2溶液中:K+、Na+、OH﹣、NO3﹣
C.能使甲基橙变红的溶液中:Cu2+、Na+、CH3COO﹣、NO3﹣
D.pH=13的溶液中:NH4+、NO3﹣、K+、SO42﹣
15.合物Y具有抗菌、消炎作用,可由X制得。下列有关化合物X、Y的说法正确的是( )
A.X、Y均可作为合成聚合物的单体
B.Y与乙醇发生酯化反应可得到X
C.X、Y均能与酸性KMnO4溶液反应
D.室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数目不相等
三、解答题(共5小题,满分0分)
16.按要求完成下列各题内容:
(1)写出下列物质的电子式或结构式:
①NH3的电子式:
,②CO2的结构式:
。
(2)写出下列符合要求的离子方程式:
①钠和水反应:
。
②过量的二氧化碳通入氢氧化钠溶液中:
。
③Al与NaOH溶液反应:
。
④印刷电路板是由高分子材料和铜箔复合而成。刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,请写出反应的离子方程式
。
(3)实验室需要0.2mol/L的硫酸铜溶液480mL,现用胆矾晶体来配制该溶液,回答下列问题:
①实验中用到的玻璃仪器有量筒、玻璃棒、烧杯、托盘天平、胶头滴管,还缺少的仪器为
。(填仪器名称)
②应称量胆矾晶体的质量为
克。
17.以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如图:
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0
mol?L﹣1计算)。
开始沉淀的pH
沉淀完全的pH
Ni2+
6.7
9.5
Fe3+
1.1
3.2
Fe2+
5.8
8.8
Cu2+
4.2
7.2
(1)“酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80℃的原因是
。
(2)“氧化”时,Fe2+参加反应的离子方程式为
。
(3)“除铁”时需控制溶液的pH范围为
。
(4)“滤渣”的主要成分为
(填化学式)。
(5)“沉镍”时得到碱式碳酸镍[用xNiCO3?yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为
。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是
。
18.天然气是重要的燃料和化工原料(主要成分为CH4,含少量C2H6等烃类)。
(1)乙烷在一定条件可发生如下反应:C2H6(g)?C2H4(g)+H2(g)△H1,相关物质的燃烧热数据如表所示:
物质
C2H6(g)
C2H4(g)
H2(g)
燃烧热△H/(kJ?mol﹣1)
﹣1560
﹣1411
﹣286
①△H1=
kJ?mol﹣1。
②提高该反应平衡转化率的方法有
。(至少写出两种方法)。
③体积为VL容器中通入1mol乙烷、1mol氢气,乙烷的平衡转化率为α。反应的平衡常数K=
。
(2)CH4和CO2都是比较稳定的分子,科学家利用电解装置实现两种分子的耦合转化,其原理如图所示。
电极A为
,写出电极B上生成C2H6的电极反应式:
。
19.化合物G是药物平康新的中间体,其合成路线如图。
(1)D中含氧官能团的名称为
和
。
(2)F→G的反应类型为
。
(3)X的分子式为C3H9NO,写出X的结构简式:
。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
。(写出一种)
①能与FeCl3溶液发生显色反应,能发生银镜反应;
②分子中只有4种不同化学环境的氢原子。
20.铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1)铜与N2O4在一定条件下可制备无水Cu(NO3)2。
①基态Cu2+的电子排布式为
。
②与NO3﹣互为等电子体的一种分子为
(填化学式)。
(2)邻氨基吡啶()的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图1所示。
①C、N、O三种元素的第一电离能由大到小的顺序为
。
②邻氨基吡啶的铜配合物中,C原子轨道杂化类型为
。
③1mol中含有σ键的数目为
mol。
(3)铜的某种氯化物的链状结构如图2所示。该氯化物的化学式为
。
2020-2021学年江苏省淮安市高中校协作体高三(上)期中化学试卷
参考答案
一、单项选择题(每题只有1个选择符合题意。本题共10小题,每小题2分,共20分)
1.解:A.元素周期律是俄国的门捷列夫发现的,故A错误;
B.1965年,我国科学家首次合成结晶牛胰岛素,故B正确;
C.法国拉瓦锡提出燃烧的氧化学说,故C错误;
D.意大利的阿伏伽德罗提出分子学说,故D错误;
故选:B。
2.解:A、中子数为8的氮原子的质量数为7+8=15,核素符号为N,故A错误;
B、氮原子的质子数和核外电子数均为7,排列于两个电子层上,电子层上电子数分别为2、5,其原子结构示意图为,故B正确;
C、氨气为共价化合物,分子中含有3个N﹣H键,N原子最外层达到8电子稳定结构,其正确的电子式为,故C错误;
D、硝基写在苯环的左边时,应该表示为O2N﹣,硝基苯正确的结构简式为,故D错误;
故选:B。
3.解:A.由于黄色可遮挡紫光,应透过蓝色钴玻璃观察钾的焰色反应,易滤去黄光,故A错误;
B.生石灰与水反应放热,促进氨气的挥发,氨气密度比空气小,用向下排空法收集,故B正确;
C.氯气难溶于饱和食盐水,不能形成喷泉,引用氢氧化钠溶液代替饱和食盐水,故C错误;
D.瓷坩埚中含有二氧化硅,高温条件下可与氢氧化钠反应,则用瓷坩埚加热氢氧化钠,易导致坩埚炸裂,故D错误。
故选:B。
4.解:A.FeCl3溶液具有强的氧化性,能够氧化铜单质,可用于蚀刻印刷电路,故A错误;
B.浓H2SO4可用于干燥氯气,体现其吸水性,故B错误;
C.Al2O3熔点很高,可用作耐高温材料,故C正确;
D.二氧化硅不导电,具有良好的光学特性,所以可以用于制造光导纤维,故D错误。
故选:C。
5.解:A.氨气催化氧化生成一氧化氮,不能生成二氧化氮,则不能实现,故A错误;
B.三氧化铁和铝发生铝热反应生成铁单质,铁单质氯气中燃烧生成氯化铁,转化均能实现,故B正确;
C.二氧化硅不与水反应,则不能实现,故C错误;
D.蔗糖中不含醛基,不能被新制氢氧化铜氧化,则不能实现,故D错误;
故选:B。
6.解:A.钠与水反应的离子方程式为:2Na+2H2O═2Na++2OH﹣+H2↑,故A错误;
B.向AlCl3溶液中加入过量氨水,离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故B错误;
C.FeCl3溶液净水原理是铁离子水解生成氢氧化铁胶体,离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,故C错误;
D.向硫酸氢钠溶液滴加氢氧化钡溶液至中性,离子方程式为:2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O,故D正确;
故选:D。
7.解:A.该反应为可逆反应,生成氨气的物质的量小于2mol,转移电子小于6mol,转移电子的数目小于6×6.02×1023,故A正确;
B.温度高,蛋白质会发生变性,会使酶失去催化作用,所以温度太高,淀粉水解速度会变慢,故B错误;
C.室温下,Na与氧气反应生成氧化钠,钠在加热条件下与氧气反应生成过氧化钠,故C错误;
D.水分子间存在氢键,氢键大于范德华力,含有氢键的沸点较高,所以沸点:H2O>H2S,故D正确。
故选:AD。
8.解:由上述分析可知,X为H、Y为O、Z为Na、W为S、Q为Cl,
A.电子层越多、原子半径越大,同周期从左向右原子半径减小,则原子半径:r(Z)>r(W)>r(Y)>r(X),故A错误;
B.非金属性越强,对应简单氢化物越稳定,则Y的简单气态氢化物的稳定性比W的强,故B正确;
C.非金属性越强,对应最高价含氧酸的酸性越强,则W元素最高价氧化物对应的水化物的酸性比Q的弱,故C错误;
D.非金属性越强,第一电离能越大,则Y、Z、W的第一电离能顺序为:Z<W<Y,故D错误;
故选:B。
9.解:A.Na与水反应时,增大水的用量,水是纯液体,量变浓度不变,故A错误;
B.往稀硫酸中加入K2SO4溶液,溶液体积增大,浓度减小,反应速率减小,故B正确;
C.将冷水改为热水,溶液的温度升高,反应速率加快,故C错误;
D.碳粉是固体,增加其用量,反应速率不变,故D错误;
故选:B。
10.解:A.钢铁锈蚀时,Fe作负极,铁失去电子生成Fe2+,故A错误;
B.铅蓄电池在放电过程中,负极Pb失电子后与电解质反应生成PbSO4,质量增大,故B错误;
C.将海水中钢铁闸门与电源的负极相连,此时钢铁闸门作阴极,可阻止钢铁闸门中的铁失电子,从而防止闸门被腐蚀,故C正确;
D.碱性锌锰电池在放电后不能进行充电,属于一次电池,故D错误;
故选:C。
二、不定项选择题(每题有1-2个选项符合题意,全部正确得4分,部分正确得2分,选错得0分,本题共5小题,共20分)
11.解:醋酸铜氨溶液经过适当处理又可再生,说明使平衡逆向移动。
A.高温低压,平衡逆向移动,故A正确;
B.高温使平衡逆向移动,高压平衡正向移动,故B错误;
C.低温平衡正向移动,低压平衡逆向移动,故C错误;
D.低温平衡正向移动,高压平衡正向移动,故D错误;
故选:A。
12.解:A.硝酸具有氧化性,可氧化亚硫酸钠生成硫酸钠,不能鉴别亚硫酸钠是否变质,故A错误;
B.乙醇易挥发,生成的乙烯中混有乙醇,乙醇、乙烯都可被酸性高锰酸钾溶液氧化,不能证明是否生成乙烯,故B错误;
C.卤代烃在碱性条件下水解,酸化后加入硝酸银,产生淡黄色沉淀,为AgBr,可证明卤代烃Y中含有溴原子,故C正确;
D.麦芽糖、葡萄糖都是还原性糖,都可发生银镜反应,不能证明是否发生水解,故D错误。
故选:C。
13.解:A.由1L水中溶解0.1mol
Ba(NO3)2,所得溶液体积不是1L,溶液浓度不是0.1mol/L,故A错误;
B.1L硝酸钡溶液中硝酸钡的物质的量为n=cV=0.1mol?L﹣1×1L=0.1mol,则Ba+和NO3﹣离子总数为0.3×6.02×1023,故B正确;
C.Ba2+浓度与溶液体积无关,0.5L硝酸钡溶液中钡离子浓度仍然为0.1mol/L,故C错误;
D.NO3﹣浓度是Ba(NO3)2溶液的2倍,则0.5L溶液中NO3﹣离子的物质的量浓度为0.2mol/L,故D正确;
故选:BD。
14.解:A.Fe3+在溶液中显黄色,故A错误;
B.0.1mol?L﹣1BaCl2溶液中:Ba2+、Cl﹣、K+、Na+、OH﹣、NO3﹣相互不反应,可以大量共存,故B正确;
C.能使甲基橙变红的溶液呈酸性,H+与CH3COO﹣反应,不能大量共存,故C错误;
D.pH=13的溶液呈碱性,NH4+与OH﹣反应,不能大量共存,故D错误。
故选:B。
15.解:A.X、Y均含碳碳双键,Y含﹣OH、﹣COOH,则均可发生加聚反应生成聚合物,Y也可发生缩聚反应生成高聚物,故A正确;
B.Y含﹣COOH、﹣OH,Y与乙酸发生酯化反应生成X,故B错误;
C.均含碳碳双键,则均能与酸性KMnO4溶液反应,故C正确;
D.只有碳碳双键与溴发生加成反应,连接4个不同基团的C为手性碳,加成的产物分子中手性碳原子数目相同,故D错误;
故选:AC。
三、解答题(共5小题,满分0分)
16.解:(1)①氨气为共价化合物,氨气中存在3个氮氢键,氮原子最外层达到8电子稳定结构,氨气的电子式为,
故答案为:;
②二氧化碳分子中存在两个碳氧双键,二氧化碳的电子式为:,结构式为O=C=O,
故答案为:O=C=O;
(2)①钠和水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O=2Na++2OH﹣+H2↑,
故答案为:2Na+2H2O=2Na++2OH﹣+H2↑;
②过量的二氧化碳通入氢氧化钠溶液中,反应生成碳酸氢钠,反应的离子方程式为CO2+OH﹣=HCO3﹣,
故答案为:CO2+OH﹣=HCO3﹣;
③Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
故答案为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
④FeCl3溶液作为“腐蚀液”,与铜反应生成CuCl2和FeCl2.反应的离子方程式为Cu+2Fe3+=2Fe2++Cu2+,
故答案为:Cu+2Fe3+=2Fe2++Cu2+;
(3)①配制一定物质的量浓度的溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等,需要下列仪器需要用到的仪器除量筒、玻璃棒、烧杯、托盘天平(带砝码)、胶头滴管外,还需要用到得仪器是500mL容量瓶,
故答案为:500mL容量瓶;
②实验室需用480mL0.1mol/L的硫酸铜溶液,因为没有480mL的容量瓶,应选择500mL容量瓶,所以需要溶质的质量m(CuSO4?5H2O)=0.2mol/L×0.5L×250g/mol=25.0g,
故答案为:25.0。
17.解:(1)“酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80℃,原因是温度低于70℃,反应速率降低,温度高于80℃,HNO3分解(或挥发)加快,
故答案为:温度低于70℃,反应速率降低,温度高于80℃,HNO3分解(或挥发)加快;
(2)“氧化”时,Fe2+参加反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)“除铁”时,应使铁完全沉淀,且避免生成氢氧化铜,由表中数据可知,需控制溶液的pH范围为3.2≤pH<4.2,
故答案为:3.2≤pH<4.2;
(4)由以上分析可知通入硫化氢生成CuS沉淀,故答案为:CuS;
(5)①在隔绝空气条件下,“煅烧”xNiCO3?yNi(OH)2得到NiO,该反应的化学方程式为xNiCO3?yNi(OH)2(x+y)NiO+xCO2↑+yH2O,
故答案为:xNiCO3?yNi(OH)2(x+y)NiO+xCO2↑+yH2O;
②“沉镍”时,溶液pH增大,可生成Ni(OH)2,导致碱式碳酸镍中Ni(OH)2比例增大,而Ni(OH)2中Ni含量高于NiCO3,则碱式碳酸镍中Ni元素含量会增加,
故答案为:Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大。
18.解:(1)①由表中燃烧热数值可得燃烧的热化学方程式为:
a.C2H6(g)+O2(g)=2CO2(g)+3H2O(l)△H1=﹣1560kJ?mol﹣1
b.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H2=﹣1411kJ?mol﹣1
c.H2(g)+O2(g)=H2O(l)△H3=﹣286kJ?mol﹣1
由盖斯定律可知,a﹣b﹣c可得C2H6(g)=C2H4(g)+H2(g),则△H=△H1﹣△H2﹣△H3=(﹣1560kJ?mol﹣1)﹣(﹣1411kJ?mol﹣1)﹣(﹣286kJ?mol﹣1)=+137kJ?mol﹣1,
故答案为:+137;
②该反应为气体体积增大的吸热反应,升高温度、减小压强、将产物及时从容器中分离等措施能使平衡向正反应方向移动,提高乙烷的平衡转化率,
故答案为:升高温度或减小压强(增大体积)或将产物及时从容器中分离;
③起始时加入的乙烷和氢气各为1mol,由题意可建立如下三段式:
C2H6(g)?C2H4(g)+H2(g)
(单位:mol)
起始量:1
1
0
转化量:ααα
平衡量:1﹣α
1+αα
平衡常数K===,
故答案为:;
(2)由图可知,二氧化碳转化为一氧化碳时,碳元素的化合价降低被还原,二氧化碳发生还原反应,则通入二氧化碳的A极为电解池的阴极,B极为阳极,甲烷在阳极上失去电子发生氧化反应生成乙烷或乙烯,生成乙烷的电极反应式为2CH4﹣2e﹣+O2﹣=C2H6+H2O,
故答案为:阴极;2CH4﹣2e﹣+O2﹣=C2H6+H2O。
19.解:(1)D的结构简式为,分子结构中含氧官能团的名称为羰基和羧基,
故答案为:羰基;羧基;
(2)F用LiAlH4还原得到G,则F→G的反应类型为还原反应,
故答案为:还原反应;
(3)由分析知X的结构简式为CH3NHCH2CH2OH,
故答案为:CH3NHCH2CH2OH;
(4)B的结构简式为,其分子式为C8H6O4,其一种同分异构体具有:
①能与FeCl3溶液发生显色反应、能发生银镜反应,说明分子结构中含有酚羟基和醛基;
②分子中只有4种不同化学环境的氢原子,说明分子结构有对称性;该同分异构体的结构简式为:或等,
故答案为:或等。
20.解:(1)①Cu原子核外有29个电子,Cu失去4s轨道上一个电子、3d轨道上一个电子生成Cu2+,根据构造原理书写铜离子核外电子排布式为1s22s22p63s22p63d9或[Ar]3d9,
故答案为:1s22s22p63s22p63d9或[Ar]3d9;
②根据等电子体概念可知,原子数和价电子数都相等
的微粒互为等电子体,NO3﹣离子中有四个原子,价电子数为24,所以与NO3﹣离子互为等电子体的一种分子为BF3、SO3、COCl2等,故答案为:BF3、SO3、COCl2等;
(2)①同周期主族元素随原子序数增大第一电离能呈增大趋势,氮元素原子2p轨道为半充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C,
故答案为:N>O>C;
②形成配位键的N原子,没有孤电子对,杂化轨道数目为3,N原子采取sp2杂化,而氨基中N原子形成3个σ键、还有1对孤电子对,N原子杂化轨道数目为4,N原子采取sp3杂化,
故答案为:sp2、sp3;
③分子中含有4个C﹣H键、2个N﹣H键,2个C﹣N键,1个C═N键,2个C﹣C键,2个C═C键,分子中含有13个σ键,1mol含有σ键的数目为13mol,
故答案为:13;
(3)由链状结构可知每个Cu与4个Cl成键,每个Cl与2个Cu成键,则Cu与Cl的原子个数比为1:4×=1:2,化学式为CuCl2,
故答案为:CuCl2。
一、单项选择题(每题只有1个选择符合题意。本题共10小题,每小题2分,共20分)
1.下列关于化学发展的重大事件或者里程碑中,我国科学家做出贡献的是( )
A.1869年元素周期律的发现,使化学变得有规律可循
B.1965年,世界上首次合成结晶牛胰岛素
C.1774年,提出燃烧的氧化学说,使近代化学取得了革命性的进展
D.1811年,分子学说使人们对物质结构的发展到了一个新的阶段
2.下列有关化学用语表示正确的是( )
A.中子数为8的氮原子:N
B.氮原子的结构示意图:
C.氨分子的电子式:
D.硝基苯的结构简式:
3.用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)( )
A.检验溶液中是否有K+
B.制取并收集少量NH3
C.
进行喷泉实验
D.
加热熔融NaOH固体
4.下列有关物质性质与用途具有对应关系的是( )
A.FeCl3溶液显酸性,可用于蚀刻印刷电路
B.浓H2SO4具有脱水性,可用于干燥氯气
C.Al2O3熔点很高,可用作耐高温材料
D.SiO2具有导电性,可用于制作光导纤维
5.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.NH3NO2HNO3
B.Fe2O3FeFeCl3
C.SiO2H2SiO3(aq)Na2SiO3
D.CuCl2(aq)Cu(OH)2Cu2O
6.下列反应的离子方程式的书写正确的是( )
A.钠与水反应:Na+H2O═Na++OH﹣+H2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3?H2O═AlO2﹣+4NH4++2H2O
C.FeCl3溶液净水原理:Fe3++3H2O═Fe(OH)3↓+3H+
D.向硫酸氢钠溶液滴加氢氧化钡溶液至中性:2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O
7.下列说法
正确的是( )
A.一定条件下3mol
H2和1mol
N2充分反应生成NH3转移的电子数目小于6×6.02×1023
B.在酶催化淀粉水解反应中,温度越高,淀粉水解速度越快
C.室温下,Na在空气中反应生成Na2O2
D.沸点:H2O>H2S
8.短周期主族元素X、Y、Z、W、Q原子序数依次增大,X、Z同主族且与Y处于不同周期,Y、W同主族且W的原子序数是Y的两倍,以下说法正确的( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.Y的简单气态氢化物的稳定性比W的强
C.W元素最高价氧化物对应的水化物的酸性比Q的强
D.Y、Z、W的第一电离能顺序为:Z>W>Y
9.下列措施可使H2的生成速率减小的是( )
A.Na与H2O反应制取H2,增加H2O的用量
B.Al与稀硫酸反应制取H2,向稀硫酸中加入K2SO4溶液
C.Mg与H2O反应制取H2,将冷水改为热水
D.碳粉与H2O(g)反应制取H2,增加碳粉的用量
10.下列说法正确的是( )
A.钢铁锈蚀时,Fe失去电子成为Fe3+
B.铅蓄电池(如图)在放电过程中,负极质量减小,正极质量增加
C.将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀
D.铅蓄电池和碱性锌锰电池都属于二次电池
二、不定项选择题(每题有1-2个选项符合题意,全部正确得4分,部分正确得2分,选错得0分,本题共5小题,共20分)
11.合成氨工业中,原料气中的杂质CO在进入合成塔之前需经过铜氨液处理,其反应为Cu(NH3)2++CO+NH3?[Cu(NH3)3CO]+△H<0,吸收CO后的醋酸铜氨溶液经过适当处理又可再生,再生的适宜条件是( )
A.高温低压
B.高温高压
C.低温低压
D.低温高压
12.根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向久置Na2SO3溶液中,加入足量稀硝酸,再加入足量BaCl2溶液,出现白色沉淀
久置Na2SO3已部分被氧化
B
C2H5OH与浓硫酸共热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去
反应生成了乙烯
C
卤代烃Y与KOH水溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生淡黄色沉淀
卤代烃Y中含有溴原子
D
向20%麦芽糖溶液中加入少量稀硫酸、加热,再加入氢氧化钠调节至碱性,再加入银氨溶液,水浴加热,出现银镜
麦芽糖水解产物具有还原性
A.A
B.B
C.C
D.D
13.下列关于0.1mol/L
Ba(NO3)2溶液正确的说法是( )
A.该溶液可由1L水中溶解0.1mol
Ba(NO3)2制得
B.1L溶液中含有Ba+和NO3﹣离子总数为0.3×6.02×1023
C.0.5L溶液中Ba2+离子的物质的量浓度为0.2mol/L
D.0.5L溶液中NO3﹣离子的物质的量浓度为0.2mol/L
14.室温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:NH4+、Fe3+、Cl﹣、SCN﹣
B.0.1mol?L﹣1BaCl2溶液中:K+、Na+、OH﹣、NO3﹣
C.能使甲基橙变红的溶液中:Cu2+、Na+、CH3COO﹣、NO3﹣
D.pH=13的溶液中:NH4+、NO3﹣、K+、SO42﹣
15.合物Y具有抗菌、消炎作用,可由X制得。下列有关化合物X、Y的说法正确的是( )
A.X、Y均可作为合成聚合物的单体
B.Y与乙醇发生酯化反应可得到X
C.X、Y均能与酸性KMnO4溶液反应
D.室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数目不相等
三、解答题(共5小题,满分0分)
16.按要求完成下列各题内容:
(1)写出下列物质的电子式或结构式:
①NH3的电子式:
,②CO2的结构式:
。
(2)写出下列符合要求的离子方程式:
①钠和水反应:
。
②过量的二氧化碳通入氢氧化钠溶液中:
。
③Al与NaOH溶液反应:
。
④印刷电路板是由高分子材料和铜箔复合而成。刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,请写出反应的离子方程式
。
(3)实验室需要0.2mol/L的硫酸铜溶液480mL,现用胆矾晶体来配制该溶液,回答下列问题:
①实验中用到的玻璃仪器有量筒、玻璃棒、烧杯、托盘天平、胶头滴管,还缺少的仪器为
。(填仪器名称)
②应称量胆矾晶体的质量为
克。
17.以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如图:
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0
mol?L﹣1计算)。
开始沉淀的pH
沉淀完全的pH
Ni2+
6.7
9.5
Fe3+
1.1
3.2
Fe2+
5.8
8.8
Cu2+
4.2
7.2
(1)“酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80℃的原因是
。
(2)“氧化”时,Fe2+参加反应的离子方程式为
。
(3)“除铁”时需控制溶液的pH范围为
。
(4)“滤渣”的主要成分为
(填化学式)。
(5)“沉镍”时得到碱式碳酸镍[用xNiCO3?yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为
。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是
。
18.天然气是重要的燃料和化工原料(主要成分为CH4,含少量C2H6等烃类)。
(1)乙烷在一定条件可发生如下反应:C2H6(g)?C2H4(g)+H2(g)△H1,相关物质的燃烧热数据如表所示:
物质
C2H6(g)
C2H4(g)
H2(g)
燃烧热△H/(kJ?mol﹣1)
﹣1560
﹣1411
﹣286
①△H1=
kJ?mol﹣1。
②提高该反应平衡转化率的方法有
。(至少写出两种方法)。
③体积为VL容器中通入1mol乙烷、1mol氢气,乙烷的平衡转化率为α。反应的平衡常数K=
。
(2)CH4和CO2都是比较稳定的分子,科学家利用电解装置实现两种分子的耦合转化,其原理如图所示。
电极A为
,写出电极B上生成C2H6的电极反应式:
。
19.化合物G是药物平康新的中间体,其合成路线如图。
(1)D中含氧官能团的名称为
和
。
(2)F→G的反应类型为
。
(3)X的分子式为C3H9NO,写出X的结构简式:
。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
。(写出一种)
①能与FeCl3溶液发生显色反应,能发生银镜反应;
②分子中只有4种不同化学环境的氢原子。
20.铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1)铜与N2O4在一定条件下可制备无水Cu(NO3)2。
①基态Cu2+的电子排布式为
。
②与NO3﹣互为等电子体的一种分子为
(填化学式)。
(2)邻氨基吡啶()的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图1所示。
①C、N、O三种元素的第一电离能由大到小的顺序为
。
②邻氨基吡啶的铜配合物中,C原子轨道杂化类型为
。
③1mol中含有σ键的数目为
mol。
(3)铜的某种氯化物的链状结构如图2所示。该氯化物的化学式为
。
2020-2021学年江苏省淮安市高中校协作体高三(上)期中化学试卷
参考答案
一、单项选择题(每题只有1个选择符合题意。本题共10小题,每小题2分,共20分)
1.解:A.元素周期律是俄国的门捷列夫发现的,故A错误;
B.1965年,我国科学家首次合成结晶牛胰岛素,故B正确;
C.法国拉瓦锡提出燃烧的氧化学说,故C错误;
D.意大利的阿伏伽德罗提出分子学说,故D错误;
故选:B。
2.解:A、中子数为8的氮原子的质量数为7+8=15,核素符号为N,故A错误;
B、氮原子的质子数和核外电子数均为7,排列于两个电子层上,电子层上电子数分别为2、5,其原子结构示意图为,故B正确;
C、氨气为共价化合物,分子中含有3个N﹣H键,N原子最外层达到8电子稳定结构,其正确的电子式为,故C错误;
D、硝基写在苯环的左边时,应该表示为O2N﹣,硝基苯正确的结构简式为,故D错误;
故选:B。
3.解:A.由于黄色可遮挡紫光,应透过蓝色钴玻璃观察钾的焰色反应,易滤去黄光,故A错误;
B.生石灰与水反应放热,促进氨气的挥发,氨气密度比空气小,用向下排空法收集,故B正确;
C.氯气难溶于饱和食盐水,不能形成喷泉,引用氢氧化钠溶液代替饱和食盐水,故C错误;
D.瓷坩埚中含有二氧化硅,高温条件下可与氢氧化钠反应,则用瓷坩埚加热氢氧化钠,易导致坩埚炸裂,故D错误。
故选:B。
4.解:A.FeCl3溶液具有强的氧化性,能够氧化铜单质,可用于蚀刻印刷电路,故A错误;
B.浓H2SO4可用于干燥氯气,体现其吸水性,故B错误;
C.Al2O3熔点很高,可用作耐高温材料,故C正确;
D.二氧化硅不导电,具有良好的光学特性,所以可以用于制造光导纤维,故D错误。
故选:C。
5.解:A.氨气催化氧化生成一氧化氮,不能生成二氧化氮,则不能实现,故A错误;
B.三氧化铁和铝发生铝热反应生成铁单质,铁单质氯气中燃烧生成氯化铁,转化均能实现,故B正确;
C.二氧化硅不与水反应,则不能实现,故C错误;
D.蔗糖中不含醛基,不能被新制氢氧化铜氧化,则不能实现,故D错误;
故选:B。
6.解:A.钠与水反应的离子方程式为:2Na+2H2O═2Na++2OH﹣+H2↑,故A错误;
B.向AlCl3溶液中加入过量氨水,离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故B错误;
C.FeCl3溶液净水原理是铁离子水解生成氢氧化铁胶体,离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,故C错误;
D.向硫酸氢钠溶液滴加氢氧化钡溶液至中性,离子方程式为:2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O,故D正确;
故选:D。
7.解:A.该反应为可逆反应,生成氨气的物质的量小于2mol,转移电子小于6mol,转移电子的数目小于6×6.02×1023,故A正确;
B.温度高,蛋白质会发生变性,会使酶失去催化作用,所以温度太高,淀粉水解速度会变慢,故B错误;
C.室温下,Na与氧气反应生成氧化钠,钠在加热条件下与氧气反应生成过氧化钠,故C错误;
D.水分子间存在氢键,氢键大于范德华力,含有氢键的沸点较高,所以沸点:H2O>H2S,故D正确。
故选:AD。
8.解:由上述分析可知,X为H、Y为O、Z为Na、W为S、Q为Cl,
A.电子层越多、原子半径越大,同周期从左向右原子半径减小,则原子半径:r(Z)>r(W)>r(Y)>r(X),故A错误;
B.非金属性越强,对应简单氢化物越稳定,则Y的简单气态氢化物的稳定性比W的强,故B正确;
C.非金属性越强,对应最高价含氧酸的酸性越强,则W元素最高价氧化物对应的水化物的酸性比Q的弱,故C错误;
D.非金属性越强,第一电离能越大,则Y、Z、W的第一电离能顺序为:Z<W<Y,故D错误;
故选:B。
9.解:A.Na与水反应时,增大水的用量,水是纯液体,量变浓度不变,故A错误;
B.往稀硫酸中加入K2SO4溶液,溶液体积增大,浓度减小,反应速率减小,故B正确;
C.将冷水改为热水,溶液的温度升高,反应速率加快,故C错误;
D.碳粉是固体,增加其用量,反应速率不变,故D错误;
故选:B。
10.解:A.钢铁锈蚀时,Fe作负极,铁失去电子生成Fe2+,故A错误;
B.铅蓄电池在放电过程中,负极Pb失电子后与电解质反应生成PbSO4,质量增大,故B错误;
C.将海水中钢铁闸门与电源的负极相连,此时钢铁闸门作阴极,可阻止钢铁闸门中的铁失电子,从而防止闸门被腐蚀,故C正确;
D.碱性锌锰电池在放电后不能进行充电,属于一次电池,故D错误;
故选:C。
二、不定项选择题(每题有1-2个选项符合题意,全部正确得4分,部分正确得2分,选错得0分,本题共5小题,共20分)
11.解:醋酸铜氨溶液经过适当处理又可再生,说明使平衡逆向移动。
A.高温低压,平衡逆向移动,故A正确;
B.高温使平衡逆向移动,高压平衡正向移动,故B错误;
C.低温平衡正向移动,低压平衡逆向移动,故C错误;
D.低温平衡正向移动,高压平衡正向移动,故D错误;
故选:A。
12.解:A.硝酸具有氧化性,可氧化亚硫酸钠生成硫酸钠,不能鉴别亚硫酸钠是否变质,故A错误;
B.乙醇易挥发,生成的乙烯中混有乙醇,乙醇、乙烯都可被酸性高锰酸钾溶液氧化,不能证明是否生成乙烯,故B错误;
C.卤代烃在碱性条件下水解,酸化后加入硝酸银,产生淡黄色沉淀,为AgBr,可证明卤代烃Y中含有溴原子,故C正确;
D.麦芽糖、葡萄糖都是还原性糖,都可发生银镜反应,不能证明是否发生水解,故D错误。
故选:C。
13.解:A.由1L水中溶解0.1mol
Ba(NO3)2,所得溶液体积不是1L,溶液浓度不是0.1mol/L,故A错误;
B.1L硝酸钡溶液中硝酸钡的物质的量为n=cV=0.1mol?L﹣1×1L=0.1mol,则Ba+和NO3﹣离子总数为0.3×6.02×1023,故B正确;
C.Ba2+浓度与溶液体积无关,0.5L硝酸钡溶液中钡离子浓度仍然为0.1mol/L,故C错误;
D.NO3﹣浓度是Ba(NO3)2溶液的2倍,则0.5L溶液中NO3﹣离子的物质的量浓度为0.2mol/L,故D正确;
故选:BD。
14.解:A.Fe3+在溶液中显黄色,故A错误;
B.0.1mol?L﹣1BaCl2溶液中:Ba2+、Cl﹣、K+、Na+、OH﹣、NO3﹣相互不反应,可以大量共存,故B正确;
C.能使甲基橙变红的溶液呈酸性,H+与CH3COO﹣反应,不能大量共存,故C错误;
D.pH=13的溶液呈碱性,NH4+与OH﹣反应,不能大量共存,故D错误。
故选:B。
15.解:A.X、Y均含碳碳双键,Y含﹣OH、﹣COOH,则均可发生加聚反应生成聚合物,Y也可发生缩聚反应生成高聚物,故A正确;
B.Y含﹣COOH、﹣OH,Y与乙酸发生酯化反应生成X,故B错误;
C.均含碳碳双键,则均能与酸性KMnO4溶液反应,故C正确;
D.只有碳碳双键与溴发生加成反应,连接4个不同基团的C为手性碳,加成的产物分子中手性碳原子数目相同,故D错误;
故选:AC。
三、解答题(共5小题,满分0分)
16.解:(1)①氨气为共价化合物,氨气中存在3个氮氢键,氮原子最外层达到8电子稳定结构,氨气的电子式为,
故答案为:;
②二氧化碳分子中存在两个碳氧双键,二氧化碳的电子式为:,结构式为O=C=O,
故答案为:O=C=O;
(2)①钠和水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O=2Na++2OH﹣+H2↑,
故答案为:2Na+2H2O=2Na++2OH﹣+H2↑;
②过量的二氧化碳通入氢氧化钠溶液中,反应生成碳酸氢钠,反应的离子方程式为CO2+OH﹣=HCO3﹣,
故答案为:CO2+OH﹣=HCO3﹣;
③Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
故答案为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
④FeCl3溶液作为“腐蚀液”,与铜反应生成CuCl2和FeCl2.反应的离子方程式为Cu+2Fe3+=2Fe2++Cu2+,
故答案为:Cu+2Fe3+=2Fe2++Cu2+;
(3)①配制一定物质的量浓度的溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等,需要下列仪器需要用到的仪器除量筒、玻璃棒、烧杯、托盘天平(带砝码)、胶头滴管外,还需要用到得仪器是500mL容量瓶,
故答案为:500mL容量瓶;
②实验室需用480mL0.1mol/L的硫酸铜溶液,因为没有480mL的容量瓶,应选择500mL容量瓶,所以需要溶质的质量m(CuSO4?5H2O)=0.2mol/L×0.5L×250g/mol=25.0g,
故答案为:25.0。
17.解:(1)“酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80℃,原因是温度低于70℃,反应速率降低,温度高于80℃,HNO3分解(或挥发)加快,
故答案为:温度低于70℃,反应速率降低,温度高于80℃,HNO3分解(或挥发)加快;
(2)“氧化”时,Fe2+参加反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)“除铁”时,应使铁完全沉淀,且避免生成氢氧化铜,由表中数据可知,需控制溶液的pH范围为3.2≤pH<4.2,
故答案为:3.2≤pH<4.2;
(4)由以上分析可知通入硫化氢生成CuS沉淀,故答案为:CuS;
(5)①在隔绝空气条件下,“煅烧”xNiCO3?yNi(OH)2得到NiO,该反应的化学方程式为xNiCO3?yNi(OH)2(x+y)NiO+xCO2↑+yH2O,
故答案为:xNiCO3?yNi(OH)2(x+y)NiO+xCO2↑+yH2O;
②“沉镍”时,溶液pH增大,可生成Ni(OH)2,导致碱式碳酸镍中Ni(OH)2比例增大,而Ni(OH)2中Ni含量高于NiCO3,则碱式碳酸镍中Ni元素含量会增加,
故答案为:Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大。
18.解:(1)①由表中燃烧热数值可得燃烧的热化学方程式为:
a.C2H6(g)+O2(g)=2CO2(g)+3H2O(l)△H1=﹣1560kJ?mol﹣1
b.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H2=﹣1411kJ?mol﹣1
c.H2(g)+O2(g)=H2O(l)△H3=﹣286kJ?mol﹣1
由盖斯定律可知,a﹣b﹣c可得C2H6(g)=C2H4(g)+H2(g),则△H=△H1﹣△H2﹣△H3=(﹣1560kJ?mol﹣1)﹣(﹣1411kJ?mol﹣1)﹣(﹣286kJ?mol﹣1)=+137kJ?mol﹣1,
故答案为:+137;
②该反应为气体体积增大的吸热反应,升高温度、减小压强、将产物及时从容器中分离等措施能使平衡向正反应方向移动,提高乙烷的平衡转化率,
故答案为:升高温度或减小压强(增大体积)或将产物及时从容器中分离;
③起始时加入的乙烷和氢气各为1mol,由题意可建立如下三段式:
C2H6(g)?C2H4(g)+H2(g)
(单位:mol)
起始量:1
1
0
转化量:ααα
平衡量:1﹣α
1+αα
平衡常数K===,
故答案为:;
(2)由图可知,二氧化碳转化为一氧化碳时,碳元素的化合价降低被还原,二氧化碳发生还原反应,则通入二氧化碳的A极为电解池的阴极,B极为阳极,甲烷在阳极上失去电子发生氧化反应生成乙烷或乙烯,生成乙烷的电极反应式为2CH4﹣2e﹣+O2﹣=C2H6+H2O,
故答案为:阴极;2CH4﹣2e﹣+O2﹣=C2H6+H2O。
19.解:(1)D的结构简式为,分子结构中含氧官能团的名称为羰基和羧基,
故答案为:羰基;羧基;
(2)F用LiAlH4还原得到G,则F→G的反应类型为还原反应,
故答案为:还原反应;
(3)由分析知X的结构简式为CH3NHCH2CH2OH,
故答案为:CH3NHCH2CH2OH;
(4)B的结构简式为,其分子式为C8H6O4,其一种同分异构体具有:
①能与FeCl3溶液发生显色反应、能发生银镜反应,说明分子结构中含有酚羟基和醛基;
②分子中只有4种不同化学环境的氢原子,说明分子结构有对称性;该同分异构体的结构简式为:或等,
故答案为:或等。
20.解:(1)①Cu原子核外有29个电子,Cu失去4s轨道上一个电子、3d轨道上一个电子生成Cu2+,根据构造原理书写铜离子核外电子排布式为1s22s22p63s22p63d9或[Ar]3d9,
故答案为:1s22s22p63s22p63d9或[Ar]3d9;
②根据等电子体概念可知,原子数和价电子数都相等
的微粒互为等电子体,NO3﹣离子中有四个原子,价电子数为24,所以与NO3﹣离子互为等电子体的一种分子为BF3、SO3、COCl2等,故答案为:BF3、SO3、COCl2等;
(2)①同周期主族元素随原子序数增大第一电离能呈增大趋势,氮元素原子2p轨道为半充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C,
故答案为:N>O>C;
②形成配位键的N原子,没有孤电子对,杂化轨道数目为3,N原子采取sp2杂化,而氨基中N原子形成3个σ键、还有1对孤电子对,N原子杂化轨道数目为4,N原子采取sp3杂化,
故答案为:sp2、sp3;
③分子中含有4个C﹣H键、2个N﹣H键,2个C﹣N键,1个C═N键,2个C﹣C键,2个C═C键,分子中含有13个σ键,1mol含有σ键的数目为13mol,
故答案为:13;
(3)由链状结构可知每个Cu与4个Cl成键,每个Cl与2个Cu成键,则Cu与Cl的原子个数比为1:4×=1:2,化学式为CuCl2,
故答案为:CuCl2。
同课章节目录
