2020-2021学年上海市杨浦区九年级(上)第三次月考化学试卷(12月份)(解析版)
文档属性
| 名称 | 2020-2021学年上海市杨浦区九年级(上)第三次月考化学试卷(12月份)(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 202.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-30 21:41:37 | ||
图片预览




文档简介
2020-2021学年上海市杨浦区九年级(上)第三次月考化学试卷(12月份)
一、选择题(共20分)
1.(1分)物质的名称、俗名、化学式不一致的是( )
A.二氧化碳、干冰、CO2
B.碳酸钠、纯碱、Na2CO3
C.汞、水银、Hg
D.硫酸铜、胆矾、CuSO4
2.(1分)下列生活中的物质属于溶液的是( )
A.牛奶
B.蒸馏水
C.油水
D.矿泉水
3.(1分)K2Cr2O7中铬元素的化合价为( )
A.﹣3
B.+1
C.+3
D.+6
4.(1分)化学用语表示错误的是( )
A.钡元素:Ba
B.铵根:NH3
C.2个氯原子:2Cl
D.氧化铝:Al2O3
5.(1分)不属于绿色能源的是( )
A.汽油
B.潮汐能
C.风能
D.太阳能
6.(1分)图示中的“错误实验操作”与可能产生的后果不一致的是( )
A.滤液飞溅
B.量取液体的实际体积偏大
C.弄脏滴管污染试剂
D.液体或晶体向外飞溅
7.(1分)物质中氯元素以游离态形式存在的是( )
A.Cl2
B.FeCl3
C.NH4Cl
D.HCl
8.(1分)“含氟牙膏”中的“氟”指的是( )
A.元素
B.原子
C.化合物
D.单质
9.(1分)下列实验操作的叙述错误的是( )
A.制取气体时应先检查装置的气密性再装药品
B.点燃可燃性气体之前必须先检验气体纯度
C.CO还原CuO实验,实验前应先通CO
再加热
D.蒸发时,蒸发皿必须垫上石棉网,用酒精灯外焰加热
10.(1分)关于物质在空气中燃烧的现象描述正确的是( )
A.木炭:发出白光
B.铁丝:火星四射
C.红磷:大量白雾
D.硫粉:淡蓝色火焰
11.(1分)互为同素异形体的是( )
A.水和过氧化氢
B.铜片和铜丝
C.金刚石和C6o
D.木炭和石墨
12.(1分)将少量的生石灰加到一定质量的饱和石灰水中,溶液的温度升高,再恢复到室温(不考虑水的蒸发)。下列四位同学对变化后溶液的分析错误的是( )
A.
B.
C.
D.
13.(1分)某化学反应的微观过程如图所示,其中不同的圆球代表不同的原子,正确的说法是( )
A.生成物中的元素都是化合态
B.反应物的物质的量之比为3:2
C.此反应为化合反应
D.反应物可能都是氧化物
14.(1分)下列物质的用途,是利用其化学性质的是( )
A.活性炭除去冰箱内异味
B.金刚石刻划玻璃
C.稀有气体作焊接金属的保护气
D.干冰进行人工降雨
15.(2分)向盛有固体的广口瓶中滴加分液漏斗中的液体,可观察到U形管中的红墨水液面左降右升,该固体和液体试剂不可能是( )
A.大理石和稀硫酸
B.生石灰和水
C.硝酸钾和水
D.双氧水和二氧化锰
16.(2分)偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空,该化学方程式为C2H8N2+2N2O4═2X↑+3N2↑+4H2O↑,下列说法正确的是( )
A.X的化学式为CO
B.偏二甲肼中碳的质量分数为40%
C.每个N2O4分子中含有2个氮原子
D.偏二甲肼是由碳原子、氢原子、氮原子构成
17.(2分)下列除去杂质的方法中,正确的是( )
物质(括号内为少量杂质)
除去杂质的方法
A
CO2(CO)
通入氧气点燃
B
H2O(H2O2)
加入MnO2,过滤
C
CaO(CaCO3)
加水溶解,过滤
D
CuO(C)
在氧气流中加热
A.A
B.B
C.C
D.D
二、填空题(每格1分,共15分)
18.(4分)现有H、C、O、S、Ca五种元素,选用其中的元素写出符合下列要求的物质的化学式:
①式量最小的氧化物是
;
②通常用于灭火的气体是
;
③能导致酸雨的气体是
;
④可用于作干燥剂的是
;
⑤可作“绿色燃料”的是
;
⑥天然气的主要成分是
.
19.(3分)某品牌补铁剂主要成分是富马酸亚铁(C4H2FeO4),富马酸亚铁有
种元素组成,其摩尔质量是
,该分子中各原子的个数比为
,
mol的C4H2FeO4中约含有6.02×1023个氢原子。一个C4H2FeO4分子的质量(单位:克)的计算表达式是
(列式即可)。
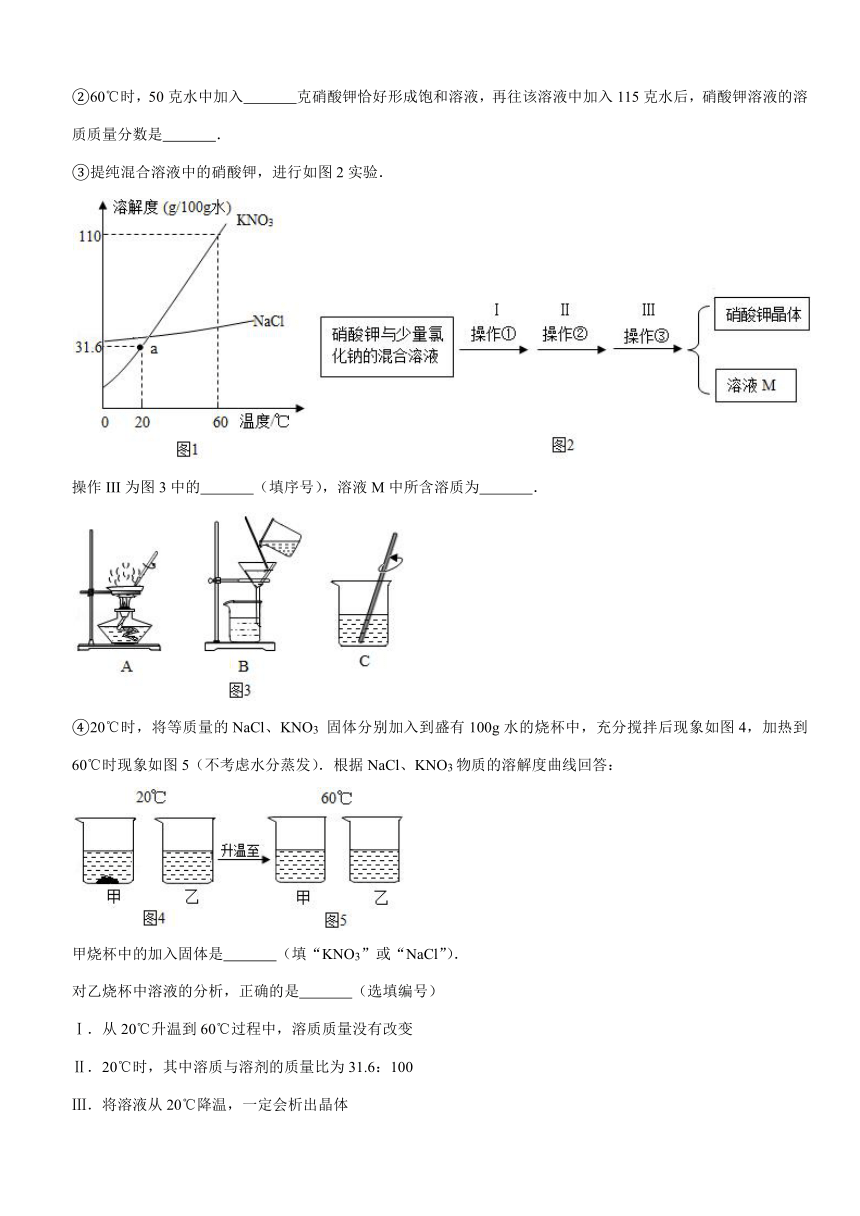
20.(8分)NaCl、KNO3物质的溶解度曲线如图1,
①a点表示的意义是20℃时,在
中最多溶解硝酸钾31.6克.
②60℃时,50克水中加入
克硝酸钾恰好形成饱和溶液,再往该溶液中加入115克水后,硝酸钾溶液的溶质质量分数是
.
③提纯混合溶液中的硝酸钾,进行如图2实验.
操作III为图3中的
(填序号),溶液M中所含溶质为
.
④20℃时,将等质量的NaCl、KNO3
固体分别加入到盛有100g水的烧杯中,充分搅拌后现象如图4,加热到60℃时现象如图5(不考虑水分蒸发).根据NaCl、KNO3物质的溶解度曲线回答:
甲烧杯中的加入固体是
(填“KNO3”或“NaCl”).
对乙烧杯中溶液的分析,正确的是
(选填编号)
Ⅰ.从20℃升温到60℃过程中,溶质质量没有改变
Ⅱ.20℃时,其中溶质与溶剂的质量比为31.6:100
Ⅲ.将溶液从20℃降温,一定会析出晶体
Ⅳ.60℃时,乙烧杯中溶液一定是不饱和溶液.
三、简答题:(共20分)
21.(10分)现有下列实验装置,如图所示。回答问题:
(1)若用B装置制气体,加入液体的位置在
处(填装置中的字母),理由是
。
(2)实验室用铁锈替代二氧化锰与3%的双氧水溶液反应,发现也能快速产生气体,且反应结束后过滤出的铁锈可重复使用。请写出该反应的化学方程式
,此反应类型是
。3%的双氧水溶液,“3%”的含义是
。铁锈在该反应中的作用是
,该反应的制取装置是
,选择该发生装置的理由是
。
(3)用装置E收集氧气,气体收集完毕时,应先
(填“从水中取出导气管”或“熄灭酒精灯”),用此法收集的氧气若测得其纯度明显偏低,原因可能是
(填序号)。
Ⅰ.装置的气密性不好
Ⅱ.收集前,集气瓶中未注满水
Ⅲ.收集后,集气瓶中仍有少量水
Ⅳ.未见气泡连续均匀冒出时就开始收集
22.(10分)一氧化碳、木炭还原氧化铜是初中化学中两个重要实验,请根据所学知识作答。
(1)如图1实验,实验开始时,先进行的是通一氧化碳,目的是
;实验结束后先撤去酒精灯,继续通入一氧化碳的目的是
。该装置存在的主要问题是
,改进的具体措施是
。
(2)对图2实验的分析正确的是
(填编号)。
a.C中的试管口略向下倾斜是为了防止冷凝水倒流
b.实验结束时先熄灭C处酒精喷灯,再将导管移出D中试管
c.D中增加的质量一定等于C中固体减少的质量
d.实验结束后待C中固体冷却后再倒出粉末,目的是防止灼热的铜被氧化
(3)图1、图2实验过程中,观察到A、C装置中相同的现象是
,A、C中反应的化学方程式分别为
、
。两反应中氧化铜都失去氧元素,发生了
反应(填“氧化”或“还原”),B中加足量石灰水的目的是
。
四、计算题(共5分)
23.(5分)在电解水的实验中,为了加快电解的速度,可先向水里加入少量H2SO4,混匀后注入水电解装置。
(1)H2SO4的摩尔质量是
。
(2)若水电解装置中盛有4.82%的H2SO4溶液100g,通电一段时间后切断电源,水的质量减少了3.6g。(已知通电时H2SO4不发生变化,其他损失忽略不计。)
Ⅰ.计算生成O2的物质的量(根据化学方程式列式计算)。
Ⅱ.此时溶液中溶质H2SO4的质量分数为
。
2020-2021学年上海市杨浦区九年级(上)第三次月考化学试卷(12月份)
参考答案
一、选择题(共20分)
1.解:A、固态的二氧化碳俗称干冰,其化学式为CO2,其名称、俗名、化学式一致。
B、碳酸钠俗称纯碱、苏打,其化学式为Na2CO3,其名称、俗名、化学式一致。
C、汞的俗称是水银,其化学式为Hg,其名称、俗名、化学式一致。
D、胆矾是五水合硫酸铜的俗称,其化学式为CuSO4?5H2O,其名称、俗名、化学式不一致。
故选:D。
2.解:A、牛奶不均一不稳定,属于乳浊液,不属于溶液,故A错;
B、蒸馏水属于纯净物,溶液必须是混合物,故B错;
C、油不溶于水,与水混合形成的是乳浊液,故C错;
D、矿泉水属于均一、稳定的混合物,属于溶液,故D正确。
故选:D。
3.解:钾元素显+1价,氧元素显﹣2价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+2x+(﹣2)×7=0,则x=+6价。
故选:D。
4.解:A、钡元素的元素符号为Ba,故选项化学用语书写正确。
B、铵根的符号为NH4,故选项化学用语书写错误。
C、由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故2Cl可表示2个氯原子,故选项化学用语书写正确。
D、氧化铝中铝元素显+3价,氧元素显﹣2价,其化学式为:Al2O3,故选项化学用语书写正确。
故选:B。
5.解:A、汽油燃烧时产生大量的二氧化碳,会造成温室效应,不属于绿色能源,故选项正确。
B、潮汐能的使用,不产生环境的污染物,属于绿色能源,故选项错误。
C、风能的使用,不产生环境的污染物,属于绿色能源,故选项错误。
D、太阳能是取之不尽,用之不竭的新能源,使用后不会对环境造成污染,属于绿色能源,故选项错误。
故选:A。
6.解:
A、漏斗下端口紧靠烧杯内壁,滤液溅出,图示“错误操作”与图中“可能产生的后果”一致,故正确;
B、读取液体体积,视线没与液体的凹液面最低处保持水平,量取液体的实际体积偏小,读数不正确;图示的“错误操作”与相对应选项的“量取液体的实际体积偏大”不一致,故错误;
C、胶头滴管伸入试管内,没有悬空在试管口上方;故造成后果为:会沾污滴管或造成药品的污染。图示“错误操作”与图中“可能产生的后果”一致,故正确;
D、没有用玻璃棒搅拌,沸腾的液体会溅出,所以图示“错误操作”与图中“可能产生的后果”一致,故正确。
故选:B。
7.解:元素以游离态存在即是以单质形式存在。
A、Cl2是由一种元素组成的纯净物,属于单质,氯元素以游离态形式存在,故选项正确。
B、FeCl3是由不同种元素组成的纯净物,属于化合物,氯元素以化合态形式存在,故选项错误。
C、NH4Cl是由不同种元素组成的纯净物,属于化合物,氯元素以化合态形式存在,故选项错误。
D、HCl是由不同种元素组成的纯净物,属于化合物,氯元素以化合态形式存在,故选项错误。
故选:A。
8.解:含氟的牙膏有利于预防龋齿,这里的“氟”指的是氟元素,与具体形态无关。
故选:A。
9.解:A、实验室制取气体时,组装好装置后,应在向容器中装入药品前检查装置的气密性,然后再装入药品,以避免装入药品后发现装置气密性不好,更换部分仪器而浪费药品,故选项说法正确。
B、可燃性气体与空气混合后点燃可能发生爆炸,为防止发生爆炸,点燃可燃性气体之前必须检验气体的纯度,故选项说法正确。
C、CO还原CuO实验,实验前应先通CO,排尽装置内的空气,再加热,以防止发生爆炸,故选项说法正确。
D、蒸发时,蒸发皿无需垫上石棉网,故选项说法错误。
故选:D。
10.解:A、木炭在空气中燃烧,只能烧至红热,不会发出白光,故选项说法错误。
B、铁丝在空气中只能烧至发红,不会产生火星,故选项说法错误。
C、红磷在空气中燃烧,产生大量的白烟,而不是白雾,故选项说法错误。
D、硫在空气中燃烧,产生淡蓝色火焰,故选项说法正确。
故选:D。
11.解:判断同素异形体的关键把握两点:①同种元素形成,②不同单质。
A、水与双氧水均是化合物,不属于同素异形体,故选项错误。
B、铜片和铜丝是金属铜的不同形状,不属于同素异形体,故选项错误。
C、金刚石和C6o均是碳元素形成的不同单质,互为同素异形体,故选项正确。
D、木炭的主要成分是碳,属于混合物,与金刚石不属于同素异形体,故选项错误。
故选:C。
12.解:A、由于向饱和石灰水中加入生石灰,生石灰会和石灰水中的一部分水发生反应,从而导致饱和溶液失去一部分溶剂,溶液中有晶体析出,溶液仍旧是原温度下的饱和溶液,因此溶质的质量分数和原来相同,故A正确;
B、由于生石灰会和石灰水中的一部分水发生反应,因此剩余溶液中的水比原来少了,故B正确;
C、饱和溶液失去一部分溶剂后,原来溶解在这部分溶剂中的溶质就会结晶析出,因此剩余溶液中的溶质比原来也少了,故C正确;D、由于加入生石灰后溶液中会有新的晶体析出,即溶液不能继续溶解这部分溶质,因此溶液仍旧是饱和溶液,故D错误;
故选:D。
13.解:根据微观过程可知,各物质反应的微粒个数关系是:
A、由上述图示可知,生成物中有一种物质的分子是由同种的原子构成的,属于单质,不是化合态,故选项错误;
B、由上述图示可知,反应物之间的物质的量之比为1:1;故选项错误;
C、由上述图示可知,此反应是两种物质生成两种新物质,不是化合反应,故选项错误;
D、加反应的是两种化合物,并且都是由两种元素组成,可能都是氧化物,故选项正确。
故选:D。
14.解:A、活性炭除去冰箱内异味是利用活性炭的吸附性,属于物理性质。
B、金刚石用于划玻璃利用了金刚石的硬度大的性质,属于物理性质。
C、稀有气体作保护气,利用了稀有气体的化学性质不活泼,属于化学性质。
D、干冰用于人工降雨,利用了干冰的易升华的性质,属于物理性质。
故选:C。
15.解:A、大理石和稀硫酸反应会生成二氧化碳气体,使广口瓶中的压强增大,U形管中红墨水的液面左低右高;
B、生石灰和水反应会放热,使广口瓶中的压强增大,U形管中红墨水的液面左低右高;
C、硝酸钾放入水中既不反应也不放热,U形管中红墨水的液面不变;
D、双氧水和二氧化锰接触反应会生成氧气,使广口瓶中的压强增大,U形管中红墨水的液面左低右高;
故选:C。
16.解:A、反应前碳原子是2个,反应后应该是2个,包含在2X中,反应前后氢原子都是8个,氮原子都是6个,反应前氧原子是8个,反应后应该是8个,其中4个包含在2X中,X的化学式为CO2,该选项说法不正确;
B、偏二甲肼中碳的质量分数为:×100%=40%,该选项说法正确;
C、每个N2O4分子中含有2个氮原子,该选项说法正确;
D、偏二甲肼分子是由碳原子、氢原子、氮原子构成的,该选项说法不正确。
故选:BC。
17.解:A、除去二氧化碳中的一氧化碳不能够通氧气点燃,这是因为除去气体中的气体杂质不能使用气体,否则会引入新的气体杂质,故选项所采取的方法错误。
B、过氧化氢在二氧化锰的催化作用下生成水和氧气,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
C、CaO能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
D、C在氧气流中加热生成二氧化碳气体,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选:BD。
二、填空题(每格1分,共15分)
18.解:①式量(相对分子质量)最小的氧化物是水,其化学式为:H2O.
②二氧化碳不能燃烧、不能支持燃烧,通常用于灭火,其化学式为:CO2.
③二氧化硫是能导致酸雨的气体,其化学式为:SO2.
④氧化钙能与水反应生成氢氧化钙,可用于作干燥剂,其化学式为:CaO(合理即可).
⑤氢气燃烧产物是水,可作“绿色燃料”,其化学式为:H2.
⑥天然气的主要成分是甲烷,其化学式为:CH4.
故答案为:①H2O;②CO2;③SO2;④CaO(合理即可);⑤H2;⑥CH4.
19.解:由富马酸亚铁的化学式C4H2FeO4可知,它是由C、H、Fe、O这四种元素组成,富马酸亚铁的相对分子质量为12×4+1×2+56+16×4=170,则C4H2FeO4的摩尔质量为170g/mol;由富马酸亚铁的化学式C4H2FeO4可知,其中C、H、Fe、O元素的原子个数比为4:2:1:4,1molC4H2FeO4中含有2mol氢原子,则0.5molC4H2FeO4中含有1mol氢原子,约含有6.02×1023个氢原子。1molC4H2FeO4中含有含有6.02×1023个C4H2FeO4分子,则一个C4H2FeO4分子的质量(单位:克)的计算表达式是:。
故答案为:4;170g/mol;C:H:Fe:O=4:2:1:4;0.5;。
20.解:①a点表示20℃时硝酸钾的溶解度是31.6g,即在100g水
中最多溶解硝酸钾31.6克;
②60℃时硝酸钾的溶解度是110g,则50克水中加入55克硝酸钾恰好形成饱和溶液,再往该溶液中加入115克水后,溶质的质量不变,硝酸钾溶液的溶质质量分数是:
×100%=25%;
③硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,提纯硝酸钾可用冷却热饱和溶液的方法,操作Ⅲ是将硝酸钾晶体和溶液分开,固液分离用过滤,滤液中的溶质是硝酸钾和氯化钠;
④20℃时氯化钠的溶解度大于硝酸钾的溶解度,所以20℃时,将等质量的NaCl、KNO3
固体分别加入到盛有100g水的烧杯中,充分搅拌后有剩余固体的
是硝酸钾;
Ⅰ.由图示可知:20℃时乙烧杯中氯化钠完全溶解,而氯化钠的溶解度随温度升高而增大,所以从20℃升温到60℃过程中,溶质质量没有改变,正确;
Ⅱ.20℃时,甲烧杯中固体有剩余,说明加入溶质的质量一定小于31.6g,故其中溶质与溶剂的质量比不是31.6:100,故错误;
Ⅲ.将溶液从20℃降温,氯化钠的溶解度基本不变,依然大于31.6g,故降温不会析出晶体,故错误;
Ⅳ.氯化钠的溶解度随温度升高而增大,所以升温到60℃时,乙烧杯中溶液一定是不饱和溶液,正确;
故答案为:①100克水;
②55;
25%;
③B;KNO3、NaCl;
④KNO3;Ⅰ、Ⅳ.
三、简答题:(共20分)
21.解:(1)为了防止产生的气体从长颈漏斗下端逸出,加入液体的位置在b处,即液体应该浸没长颈漏斗末端,但是加入的液体也不能太多;
(2)过氧化氢在铁锈的催化作用下生成水和氧气,反应的化学方程式为:2H2O22H2O+O2↑;该反应符合“一变多”的特点,属于分解反应;3%的双氧水溶液,“3%”的含义是100g3%的双氧水溶液中含有溶质的质量是3g;铁锈在该反应中加快了过氧化氢的分解速率,起催化作用;该反应属于固、液常温型,适合用装置B作发生装置;
(3)用排水法收集气体时,为了防止水槽中的水倒吸,炸裂试管,气体收集完毕时应先从水中取出导气管;用此法收集的氧气若测得其纯度明显偏低,原因可能是:收集前,集气瓶中未注满水、未见气泡连续均匀冒出时就开始收集等。
故答案为:
(1)b;防止产生的气体从长颈漏斗下端逸出;
(2)2H2O22H2O+O2↑;分解反应;100g3%的双氧水溶液中含有溶质的质量是3g;催化作用;固体和液体反应,不需要加热;
(3)从水中取出导气管;收集前,集气瓶中未注满水、未见气泡连续均匀冒出时就开始收集等,故选:Ⅱ、Ⅳ。
22.解:(1)图1实验中,实验开始时,先进行的是通一氧化碳,是为了排尽装置内的空气,防止加热时产生爆炸;实验结束后先撤去酒精灯,继续通入一氧化碳是为了防止生成的铜重新被氧化。该装置没有进行尾气处理,会造成空气污染,需要在B后面加一盏燃着的酒精灯处理未反应的一氧化碳,故填:排尽装置内的空气,防止加热时产生爆炸;防止生成的铜重新被氧化;没有进行尾气处理;在B后面加一盏燃着的酒精灯;
(2)a.C中的试管口略向下倾斜是为了防止冷凝水倒流,说法正确;
b.实验结束时先将导管移出D中试管,再熄灭C处酒精喷灯,防止水倒流引起试管炸裂,说法错误;
c.D中增加的质量不一定等于C中固体减少的质量,因为C中含有空气中的二氧化碳也会被澄清的石灰水吸收,说法错误;
d.实验结束后待C中固体冷却后再倒出粉末,目的是防止灼热的铜被氧化,说法正确;
故填:ad;
(3)图1、图2实验过程中,氧化铜被还原为铜,故观察到A、C装置中相同的现象是黑色固体变成红色,A、C中反应的化学方程式分别为CO+CuOCu+CO2、C+2CuO2Cu+CO2↑。两反应中氧化铜都失去氧元素,发生了还原反应,B中加足量石灰水是为了吸收生成的二氧化碳,故填:黑色固体变成红色;CO+CuOCu+CO2;C+2CuO2Cu+CO2↑;还原;吸收生成的二氧化碳。
四、计算题(共5分)
23.解:(1)硫酸的化学式为H2SO4
H2SO4的摩尔质量=1×2+32+16×4=98g/mol
(2)Ⅰ.水的质量减少了3.6g,则有3.6g水,0.2mol水被电解
设电解3.6g水可生成氧气的物质的量为n
2H2O2H2↑+O2↑
2
1
0.2mol
n
解之得
n=0.1mol
答:生成O2的物质的量为0.1mol
Ⅱ.电解水,溶液中硫酸的质量不变
此时溶液中溶质H2SO4的质量分数==5.00%
故答案为:5.00%
一、选择题(共20分)
1.(1分)物质的名称、俗名、化学式不一致的是( )
A.二氧化碳、干冰、CO2
B.碳酸钠、纯碱、Na2CO3
C.汞、水银、Hg
D.硫酸铜、胆矾、CuSO4
2.(1分)下列生活中的物质属于溶液的是( )
A.牛奶
B.蒸馏水
C.油水
D.矿泉水
3.(1分)K2Cr2O7中铬元素的化合价为( )
A.﹣3
B.+1
C.+3
D.+6
4.(1分)化学用语表示错误的是( )
A.钡元素:Ba
B.铵根:NH3
C.2个氯原子:2Cl
D.氧化铝:Al2O3
5.(1分)不属于绿色能源的是( )
A.汽油
B.潮汐能
C.风能
D.太阳能
6.(1分)图示中的“错误实验操作”与可能产生的后果不一致的是( )
A.滤液飞溅
B.量取液体的实际体积偏大
C.弄脏滴管污染试剂
D.液体或晶体向外飞溅
7.(1分)物质中氯元素以游离态形式存在的是( )
A.Cl2
B.FeCl3
C.NH4Cl
D.HCl
8.(1分)“含氟牙膏”中的“氟”指的是( )
A.元素
B.原子
C.化合物
D.单质
9.(1分)下列实验操作的叙述错误的是( )
A.制取气体时应先检查装置的气密性再装药品
B.点燃可燃性气体之前必须先检验气体纯度
C.CO还原CuO实验,实验前应先通CO
再加热
D.蒸发时,蒸发皿必须垫上石棉网,用酒精灯外焰加热
10.(1分)关于物质在空气中燃烧的现象描述正确的是( )
A.木炭:发出白光
B.铁丝:火星四射
C.红磷:大量白雾
D.硫粉:淡蓝色火焰
11.(1分)互为同素异形体的是( )
A.水和过氧化氢
B.铜片和铜丝
C.金刚石和C6o
D.木炭和石墨
12.(1分)将少量的生石灰加到一定质量的饱和石灰水中,溶液的温度升高,再恢复到室温(不考虑水的蒸发)。下列四位同学对变化后溶液的分析错误的是( )
A.
B.
C.
D.
13.(1分)某化学反应的微观过程如图所示,其中不同的圆球代表不同的原子,正确的说法是( )
A.生成物中的元素都是化合态
B.反应物的物质的量之比为3:2
C.此反应为化合反应
D.反应物可能都是氧化物
14.(1分)下列物质的用途,是利用其化学性质的是( )
A.活性炭除去冰箱内异味
B.金刚石刻划玻璃
C.稀有气体作焊接金属的保护气
D.干冰进行人工降雨
15.(2分)向盛有固体的广口瓶中滴加分液漏斗中的液体,可观察到U形管中的红墨水液面左降右升,该固体和液体试剂不可能是( )
A.大理石和稀硫酸
B.生石灰和水
C.硝酸钾和水
D.双氧水和二氧化锰
16.(2分)偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空,该化学方程式为C2H8N2+2N2O4═2X↑+3N2↑+4H2O↑,下列说法正确的是( )
A.X的化学式为CO
B.偏二甲肼中碳的质量分数为40%
C.每个N2O4分子中含有2个氮原子
D.偏二甲肼是由碳原子、氢原子、氮原子构成
17.(2分)下列除去杂质的方法中,正确的是( )
物质(括号内为少量杂质)
除去杂质的方法
A
CO2(CO)
通入氧气点燃
B
H2O(H2O2)
加入MnO2,过滤
C
CaO(CaCO3)
加水溶解,过滤
D
CuO(C)
在氧气流中加热
A.A
B.B
C.C
D.D
二、填空题(每格1分,共15分)
18.(4分)现有H、C、O、S、Ca五种元素,选用其中的元素写出符合下列要求的物质的化学式:
①式量最小的氧化物是
;
②通常用于灭火的气体是
;
③能导致酸雨的气体是
;
④可用于作干燥剂的是
;
⑤可作“绿色燃料”的是
;
⑥天然气的主要成分是
.
19.(3分)某品牌补铁剂主要成分是富马酸亚铁(C4H2FeO4),富马酸亚铁有
种元素组成,其摩尔质量是
,该分子中各原子的个数比为
,
mol的C4H2FeO4中约含有6.02×1023个氢原子。一个C4H2FeO4分子的质量(单位:克)的计算表达式是
(列式即可)。
20.(8分)NaCl、KNO3物质的溶解度曲线如图1,
①a点表示的意义是20℃时,在
中最多溶解硝酸钾31.6克.
②60℃时,50克水中加入
克硝酸钾恰好形成饱和溶液,再往该溶液中加入115克水后,硝酸钾溶液的溶质质量分数是
.
③提纯混合溶液中的硝酸钾,进行如图2实验.
操作III为图3中的
(填序号),溶液M中所含溶质为
.
④20℃时,将等质量的NaCl、KNO3
固体分别加入到盛有100g水的烧杯中,充分搅拌后现象如图4,加热到60℃时现象如图5(不考虑水分蒸发).根据NaCl、KNO3物质的溶解度曲线回答:
甲烧杯中的加入固体是
(填“KNO3”或“NaCl”).
对乙烧杯中溶液的分析,正确的是
(选填编号)
Ⅰ.从20℃升温到60℃过程中,溶质质量没有改变
Ⅱ.20℃时,其中溶质与溶剂的质量比为31.6:100
Ⅲ.将溶液从20℃降温,一定会析出晶体
Ⅳ.60℃时,乙烧杯中溶液一定是不饱和溶液.
三、简答题:(共20分)
21.(10分)现有下列实验装置,如图所示。回答问题:
(1)若用B装置制气体,加入液体的位置在
处(填装置中的字母),理由是
。
(2)实验室用铁锈替代二氧化锰与3%的双氧水溶液反应,发现也能快速产生气体,且反应结束后过滤出的铁锈可重复使用。请写出该反应的化学方程式
,此反应类型是
。3%的双氧水溶液,“3%”的含义是
。铁锈在该反应中的作用是
,该反应的制取装置是
,选择该发生装置的理由是
。
(3)用装置E收集氧气,气体收集完毕时,应先
(填“从水中取出导气管”或“熄灭酒精灯”),用此法收集的氧气若测得其纯度明显偏低,原因可能是
(填序号)。
Ⅰ.装置的气密性不好
Ⅱ.收集前,集气瓶中未注满水
Ⅲ.收集后,集气瓶中仍有少量水
Ⅳ.未见气泡连续均匀冒出时就开始收集
22.(10分)一氧化碳、木炭还原氧化铜是初中化学中两个重要实验,请根据所学知识作答。
(1)如图1实验,实验开始时,先进行的是通一氧化碳,目的是
;实验结束后先撤去酒精灯,继续通入一氧化碳的目的是
。该装置存在的主要问题是
,改进的具体措施是
。
(2)对图2实验的分析正确的是
(填编号)。
a.C中的试管口略向下倾斜是为了防止冷凝水倒流
b.实验结束时先熄灭C处酒精喷灯,再将导管移出D中试管
c.D中增加的质量一定等于C中固体减少的质量
d.实验结束后待C中固体冷却后再倒出粉末,目的是防止灼热的铜被氧化
(3)图1、图2实验过程中,观察到A、C装置中相同的现象是
,A、C中反应的化学方程式分别为
、
。两反应中氧化铜都失去氧元素,发生了
反应(填“氧化”或“还原”),B中加足量石灰水的目的是
。
四、计算题(共5分)
23.(5分)在电解水的实验中,为了加快电解的速度,可先向水里加入少量H2SO4,混匀后注入水电解装置。
(1)H2SO4的摩尔质量是
。
(2)若水电解装置中盛有4.82%的H2SO4溶液100g,通电一段时间后切断电源,水的质量减少了3.6g。(已知通电时H2SO4不发生变化,其他损失忽略不计。)
Ⅰ.计算生成O2的物质的量(根据化学方程式列式计算)。
Ⅱ.此时溶液中溶质H2SO4的质量分数为
。
2020-2021学年上海市杨浦区九年级(上)第三次月考化学试卷(12月份)
参考答案
一、选择题(共20分)
1.解:A、固态的二氧化碳俗称干冰,其化学式为CO2,其名称、俗名、化学式一致。
B、碳酸钠俗称纯碱、苏打,其化学式为Na2CO3,其名称、俗名、化学式一致。
C、汞的俗称是水银,其化学式为Hg,其名称、俗名、化学式一致。
D、胆矾是五水合硫酸铜的俗称,其化学式为CuSO4?5H2O,其名称、俗名、化学式不一致。
故选:D。
2.解:A、牛奶不均一不稳定,属于乳浊液,不属于溶液,故A错;
B、蒸馏水属于纯净物,溶液必须是混合物,故B错;
C、油不溶于水,与水混合形成的是乳浊液,故C错;
D、矿泉水属于均一、稳定的混合物,属于溶液,故D正确。
故选:D。
3.解:钾元素显+1价,氧元素显﹣2价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+2x+(﹣2)×7=0,则x=+6价。
故选:D。
4.解:A、钡元素的元素符号为Ba,故选项化学用语书写正确。
B、铵根的符号为NH4,故选项化学用语书写错误。
C、由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故2Cl可表示2个氯原子,故选项化学用语书写正确。
D、氧化铝中铝元素显+3价,氧元素显﹣2价,其化学式为:Al2O3,故选项化学用语书写正确。
故选:B。
5.解:A、汽油燃烧时产生大量的二氧化碳,会造成温室效应,不属于绿色能源,故选项正确。
B、潮汐能的使用,不产生环境的污染物,属于绿色能源,故选项错误。
C、风能的使用,不产生环境的污染物,属于绿色能源,故选项错误。
D、太阳能是取之不尽,用之不竭的新能源,使用后不会对环境造成污染,属于绿色能源,故选项错误。
故选:A。
6.解:
A、漏斗下端口紧靠烧杯内壁,滤液溅出,图示“错误操作”与图中“可能产生的后果”一致,故正确;
B、读取液体体积,视线没与液体的凹液面最低处保持水平,量取液体的实际体积偏小,读数不正确;图示的“错误操作”与相对应选项的“量取液体的实际体积偏大”不一致,故错误;
C、胶头滴管伸入试管内,没有悬空在试管口上方;故造成后果为:会沾污滴管或造成药品的污染。图示“错误操作”与图中“可能产生的后果”一致,故正确;
D、没有用玻璃棒搅拌,沸腾的液体会溅出,所以图示“错误操作”与图中“可能产生的后果”一致,故正确。
故选:B。
7.解:元素以游离态存在即是以单质形式存在。
A、Cl2是由一种元素组成的纯净物,属于单质,氯元素以游离态形式存在,故选项正确。
B、FeCl3是由不同种元素组成的纯净物,属于化合物,氯元素以化合态形式存在,故选项错误。
C、NH4Cl是由不同种元素组成的纯净物,属于化合物,氯元素以化合态形式存在,故选项错误。
D、HCl是由不同种元素组成的纯净物,属于化合物,氯元素以化合态形式存在,故选项错误。
故选:A。
8.解:含氟的牙膏有利于预防龋齿,这里的“氟”指的是氟元素,与具体形态无关。
故选:A。
9.解:A、实验室制取气体时,组装好装置后,应在向容器中装入药品前检查装置的气密性,然后再装入药品,以避免装入药品后发现装置气密性不好,更换部分仪器而浪费药品,故选项说法正确。
B、可燃性气体与空气混合后点燃可能发生爆炸,为防止发生爆炸,点燃可燃性气体之前必须检验气体的纯度,故选项说法正确。
C、CO还原CuO实验,实验前应先通CO,排尽装置内的空气,再加热,以防止发生爆炸,故选项说法正确。
D、蒸发时,蒸发皿无需垫上石棉网,故选项说法错误。
故选:D。
10.解:A、木炭在空气中燃烧,只能烧至红热,不会发出白光,故选项说法错误。
B、铁丝在空气中只能烧至发红,不会产生火星,故选项说法错误。
C、红磷在空气中燃烧,产生大量的白烟,而不是白雾,故选项说法错误。
D、硫在空气中燃烧,产生淡蓝色火焰,故选项说法正确。
故选:D。
11.解:判断同素异形体的关键把握两点:①同种元素形成,②不同单质。
A、水与双氧水均是化合物,不属于同素异形体,故选项错误。
B、铜片和铜丝是金属铜的不同形状,不属于同素异形体,故选项错误。
C、金刚石和C6o均是碳元素形成的不同单质,互为同素异形体,故选项正确。
D、木炭的主要成分是碳,属于混合物,与金刚石不属于同素异形体,故选项错误。
故选:C。
12.解:A、由于向饱和石灰水中加入生石灰,生石灰会和石灰水中的一部分水发生反应,从而导致饱和溶液失去一部分溶剂,溶液中有晶体析出,溶液仍旧是原温度下的饱和溶液,因此溶质的质量分数和原来相同,故A正确;
B、由于生石灰会和石灰水中的一部分水发生反应,因此剩余溶液中的水比原来少了,故B正确;
C、饱和溶液失去一部分溶剂后,原来溶解在这部分溶剂中的溶质就会结晶析出,因此剩余溶液中的溶质比原来也少了,故C正确;D、由于加入生石灰后溶液中会有新的晶体析出,即溶液不能继续溶解这部分溶质,因此溶液仍旧是饱和溶液,故D错误;
故选:D。
13.解:根据微观过程可知,各物质反应的微粒个数关系是:
A、由上述图示可知,生成物中有一种物质的分子是由同种的原子构成的,属于单质,不是化合态,故选项错误;
B、由上述图示可知,反应物之间的物质的量之比为1:1;故选项错误;
C、由上述图示可知,此反应是两种物质生成两种新物质,不是化合反应,故选项错误;
D、加反应的是两种化合物,并且都是由两种元素组成,可能都是氧化物,故选项正确。
故选:D。
14.解:A、活性炭除去冰箱内异味是利用活性炭的吸附性,属于物理性质。
B、金刚石用于划玻璃利用了金刚石的硬度大的性质,属于物理性质。
C、稀有气体作保护气,利用了稀有气体的化学性质不活泼,属于化学性质。
D、干冰用于人工降雨,利用了干冰的易升华的性质,属于物理性质。
故选:C。
15.解:A、大理石和稀硫酸反应会生成二氧化碳气体,使广口瓶中的压强增大,U形管中红墨水的液面左低右高;
B、生石灰和水反应会放热,使广口瓶中的压强增大,U形管中红墨水的液面左低右高;
C、硝酸钾放入水中既不反应也不放热,U形管中红墨水的液面不变;
D、双氧水和二氧化锰接触反应会生成氧气,使广口瓶中的压强增大,U形管中红墨水的液面左低右高;
故选:C。
16.解:A、反应前碳原子是2个,反应后应该是2个,包含在2X中,反应前后氢原子都是8个,氮原子都是6个,反应前氧原子是8个,反应后应该是8个,其中4个包含在2X中,X的化学式为CO2,该选项说法不正确;
B、偏二甲肼中碳的质量分数为:×100%=40%,该选项说法正确;
C、每个N2O4分子中含有2个氮原子,该选项说法正确;
D、偏二甲肼分子是由碳原子、氢原子、氮原子构成的,该选项说法不正确。
故选:BC。
17.解:A、除去二氧化碳中的一氧化碳不能够通氧气点燃,这是因为除去气体中的气体杂质不能使用气体,否则会引入新的气体杂质,故选项所采取的方法错误。
B、过氧化氢在二氧化锰的催化作用下生成水和氧气,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
C、CaO能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
D、C在氧气流中加热生成二氧化碳气体,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选:BD。
二、填空题(每格1分,共15分)
18.解:①式量(相对分子质量)最小的氧化物是水,其化学式为:H2O.
②二氧化碳不能燃烧、不能支持燃烧,通常用于灭火,其化学式为:CO2.
③二氧化硫是能导致酸雨的气体,其化学式为:SO2.
④氧化钙能与水反应生成氢氧化钙,可用于作干燥剂,其化学式为:CaO(合理即可).
⑤氢气燃烧产物是水,可作“绿色燃料”,其化学式为:H2.
⑥天然气的主要成分是甲烷,其化学式为:CH4.
故答案为:①H2O;②CO2;③SO2;④CaO(合理即可);⑤H2;⑥CH4.
19.解:由富马酸亚铁的化学式C4H2FeO4可知,它是由C、H、Fe、O这四种元素组成,富马酸亚铁的相对分子质量为12×4+1×2+56+16×4=170,则C4H2FeO4的摩尔质量为170g/mol;由富马酸亚铁的化学式C4H2FeO4可知,其中C、H、Fe、O元素的原子个数比为4:2:1:4,1molC4H2FeO4中含有2mol氢原子,则0.5molC4H2FeO4中含有1mol氢原子,约含有6.02×1023个氢原子。1molC4H2FeO4中含有含有6.02×1023个C4H2FeO4分子,则一个C4H2FeO4分子的质量(单位:克)的计算表达式是:。
故答案为:4;170g/mol;C:H:Fe:O=4:2:1:4;0.5;。
20.解:①a点表示20℃时硝酸钾的溶解度是31.6g,即在100g水
中最多溶解硝酸钾31.6克;
②60℃时硝酸钾的溶解度是110g,则50克水中加入55克硝酸钾恰好形成饱和溶液,再往该溶液中加入115克水后,溶质的质量不变,硝酸钾溶液的溶质质量分数是:
×100%=25%;
③硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,提纯硝酸钾可用冷却热饱和溶液的方法,操作Ⅲ是将硝酸钾晶体和溶液分开,固液分离用过滤,滤液中的溶质是硝酸钾和氯化钠;
④20℃时氯化钠的溶解度大于硝酸钾的溶解度,所以20℃时,将等质量的NaCl、KNO3
固体分别加入到盛有100g水的烧杯中,充分搅拌后有剩余固体的
是硝酸钾;
Ⅰ.由图示可知:20℃时乙烧杯中氯化钠完全溶解,而氯化钠的溶解度随温度升高而增大,所以从20℃升温到60℃过程中,溶质质量没有改变,正确;
Ⅱ.20℃时,甲烧杯中固体有剩余,说明加入溶质的质量一定小于31.6g,故其中溶质与溶剂的质量比不是31.6:100,故错误;
Ⅲ.将溶液从20℃降温,氯化钠的溶解度基本不变,依然大于31.6g,故降温不会析出晶体,故错误;
Ⅳ.氯化钠的溶解度随温度升高而增大,所以升温到60℃时,乙烧杯中溶液一定是不饱和溶液,正确;
故答案为:①100克水;
②55;
25%;
③B;KNO3、NaCl;
④KNO3;Ⅰ、Ⅳ.
三、简答题:(共20分)
21.解:(1)为了防止产生的气体从长颈漏斗下端逸出,加入液体的位置在b处,即液体应该浸没长颈漏斗末端,但是加入的液体也不能太多;
(2)过氧化氢在铁锈的催化作用下生成水和氧气,反应的化学方程式为:2H2O22H2O+O2↑;该反应符合“一变多”的特点,属于分解反应;3%的双氧水溶液,“3%”的含义是100g3%的双氧水溶液中含有溶质的质量是3g;铁锈在该反应中加快了过氧化氢的分解速率,起催化作用;该反应属于固、液常温型,适合用装置B作发生装置;
(3)用排水法收集气体时,为了防止水槽中的水倒吸,炸裂试管,气体收集完毕时应先从水中取出导气管;用此法收集的氧气若测得其纯度明显偏低,原因可能是:收集前,集气瓶中未注满水、未见气泡连续均匀冒出时就开始收集等。
故答案为:
(1)b;防止产生的气体从长颈漏斗下端逸出;
(2)2H2O22H2O+O2↑;分解反应;100g3%的双氧水溶液中含有溶质的质量是3g;催化作用;固体和液体反应,不需要加热;
(3)从水中取出导气管;收集前,集气瓶中未注满水、未见气泡连续均匀冒出时就开始收集等,故选:Ⅱ、Ⅳ。
22.解:(1)图1实验中,实验开始时,先进行的是通一氧化碳,是为了排尽装置内的空气,防止加热时产生爆炸;实验结束后先撤去酒精灯,继续通入一氧化碳是为了防止生成的铜重新被氧化。该装置没有进行尾气处理,会造成空气污染,需要在B后面加一盏燃着的酒精灯处理未反应的一氧化碳,故填:排尽装置内的空气,防止加热时产生爆炸;防止生成的铜重新被氧化;没有进行尾气处理;在B后面加一盏燃着的酒精灯;
(2)a.C中的试管口略向下倾斜是为了防止冷凝水倒流,说法正确;
b.实验结束时先将导管移出D中试管,再熄灭C处酒精喷灯,防止水倒流引起试管炸裂,说法错误;
c.D中增加的质量不一定等于C中固体减少的质量,因为C中含有空气中的二氧化碳也会被澄清的石灰水吸收,说法错误;
d.实验结束后待C中固体冷却后再倒出粉末,目的是防止灼热的铜被氧化,说法正确;
故填:ad;
(3)图1、图2实验过程中,氧化铜被还原为铜,故观察到A、C装置中相同的现象是黑色固体变成红色,A、C中反应的化学方程式分别为CO+CuOCu+CO2、C+2CuO2Cu+CO2↑。两反应中氧化铜都失去氧元素,发生了还原反应,B中加足量石灰水是为了吸收生成的二氧化碳,故填:黑色固体变成红色;CO+CuOCu+CO2;C+2CuO2Cu+CO2↑;还原;吸收生成的二氧化碳。
四、计算题(共5分)
23.解:(1)硫酸的化学式为H2SO4
H2SO4的摩尔质量=1×2+32+16×4=98g/mol
(2)Ⅰ.水的质量减少了3.6g,则有3.6g水,0.2mol水被电解
设电解3.6g水可生成氧气的物质的量为n
2H2O2H2↑+O2↑
2
1
0.2mol
n
解之得
n=0.1mol
答:生成O2的物质的量为0.1mol
Ⅱ.电解水,溶液中硫酸的质量不变
此时溶液中溶质H2SO4的质量分数==5.00%
故答案为:5.00%
同课章节目录
