鲁教版五四制九年级化学第二单元酸的化学性质课件(ppt 15张)
文档属性
| 名称 | 鲁教版五四制九年级化学第二单元酸的化学性质课件(ppt 15张) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-31 09:17:46 | ||
图片预览



文档简介
(共15张PPT)
酸的化学性质
情景导入
在日常生活中,我们已经接触了一些酸,如食醋、胃酸、硫酸等。并且知道了浓盐酸和浓硫酸的一些性质。大家还想知道酸的其它性质吗?本节课我们来探究酸的化学性质。
通过实验探究稀盐酸的化学性质;
01
熟练掌握有关化学方程式的书写;
02
通过化学实验,体验化学探究的乐趣及重要性。
03
学习目标:
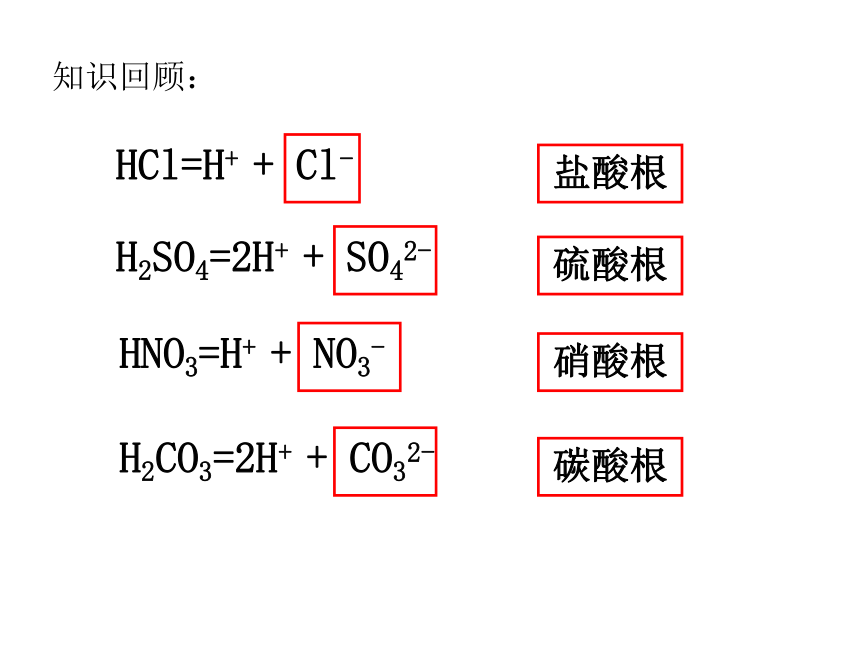
HCl=H+
+
Cl-
H2SO4=2H+
+
SO42-
HNO3=H+
+
NO3-
硫酸根
硝酸根
盐酸根
H2CO3=2H+
+
CO32-
碳酸根
知识回顾:
探究一
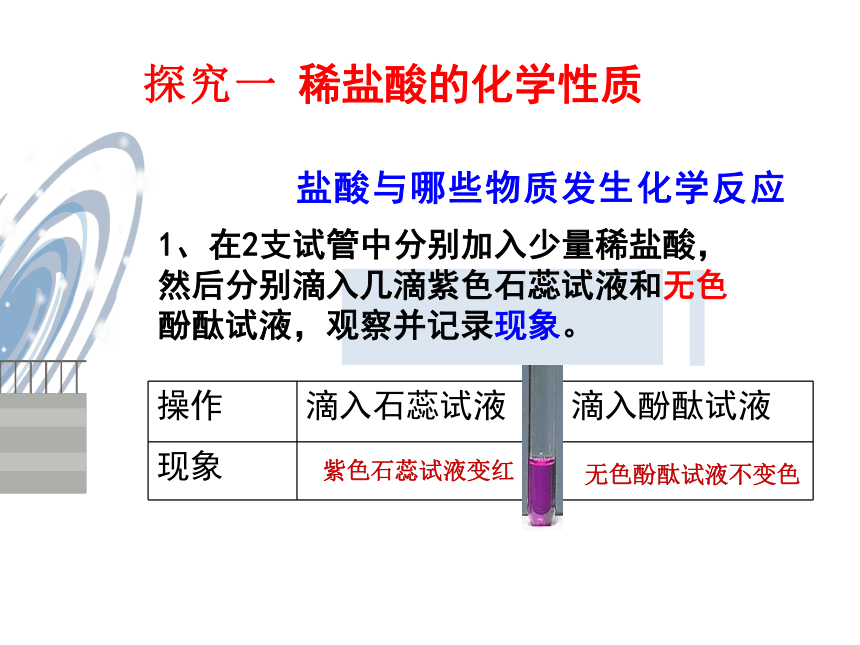
盐酸与哪些物质发生化学反应
1、在2支试管中分别加入少量稀盐酸,然后分别滴入几滴紫色石蕊试液和无色酚酞试液,观察并记录现象。
操作
滴入石蕊试液
滴入酚酞试液
现象
稀盐酸的化学性质
紫色石蕊试液变红
无色酚酞试液不变色
Part
01
单击此处添加标题
单击此处添加副标题内容
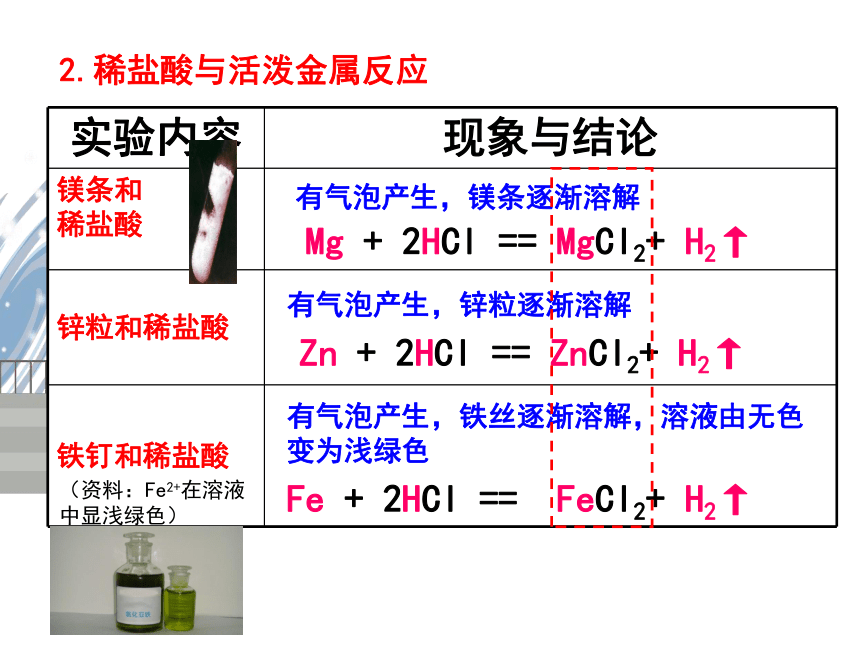
实验内容
现象与结论
镁条和
稀盐酸
锌粒和稀盐酸
铁钉和稀盐酸
有气泡产生,镁条逐渐溶解
Mg
+
2HCl
==
MgCl2+
H2↑
有气泡产生,锌粒逐渐溶解
Zn
+
2HCl
==
ZnCl2+
H2↑
有气泡产生,铁丝逐渐溶解,溶液由无色变为浅绿色
Fe
+
2HCl
==
FeCl2+
H2↑
2.稀盐酸与活泼金属反应
(资料:Fe2+在溶液中显浅绿色)
3.稀盐酸与金属氧化物
实验内容
现象与结论
生锈的铁丝
和稀盐酸
红色的铁锈逐渐溶解,溶液由无色变成黄色
Fe2O3
+
6HCl
=
2FeCl3
+
3H2O
过一会,铁钉表面有气泡冒出
Fe+
2HCl
==
FeCl2
+
H2↑
(资料:Fe3+在溶液中显黄色)
4.稀盐酸与某些盐
实验内容
现象与结论
大理石和
稀盐酸
碳酸钠溶液
和稀盐酸
有气泡产生
CaCO3+2HCl
==CaCl2+H2O+CO2↑
有气泡产生
Na2CO3+2HCl==2NaCl+H2O+CO2↑
盐的概念:由金属阳离子或铵根离子和酸根阴离子构成的化合物。
像
BaCl2
MgCl2
FeCl2
Na2CO3
CuSO4
NH4NO3等是盐。
如果把上述实验中的稀盐酸换成稀硫酸,
你认为是否会产生类似的实验现象?
请试着写出这些反应的化学方程式。
Mg
+
H2SO4
=
Fe
+
H2SO4
=
Fe2O3
+
H2SO4
=
MgSO4
+
H2↑
FeSO4
+
H2
↑
3
Fe2(SO4)3
+
3H2O
自主学习:为什么酸具有相似的化学性质呢?
HCl
=
H+
+
Cl-
H2SO4
=
2H+
+
SO42-
注意:不同的酸溶于水时解离出的酸根阴离子不同,其性质也存在差异。
酸的性质实际上是氢离子的性质。
1.酸溶液能使紫色石蕊试液变红,不能使无色酚酞试液变色。
2.酸+金属
Fe+2HCl=FeCl2+H2↑
Mg+2HCl=MgCl2+H2↑
3.酸+金属氧化物
Fe2O3+6HCl=2FeCl3+3H2O
4.酸+盐
CaCO3+2HCl=CaCl2+CO2↑+H2O
盐+氢气
盐+水
新盐+新酸
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
酸
的
通
性
常见酸的用途
浓硫酸:用于生产化肥等,用作干燥剂
浓盐酸:制药、作除锈剂等
浓硝酸:生产化肥、炸药等
酸能使紫色的石蕊变红,无色酚酞不变色。
01
酸与某些金属反应
02
酸与某些金属氧化物反应
03
酸与部分盐反应
04
小结:
谢谢聆听
单击此处添加文本具体内容
Fe2O3+
6HCl
==
2FeCl3
+3H2O
观察下列化学方程式,你发现它们有何特点?
A
+
C
AB+CD
B
D
化合物
化合物
两种化合物互相交换成分,生成另外两种化合物,这样的反应就叫做复分解反应。
复分解反应
下列化学反应是复分解反应吗?
1.Fe+2HCl=FeCl2+H2↑
2.Fe2O3+6HCl=2FeCl3+3H2O
3.CaCO3+2HCl=CaCl2+CO2↑+H2O
H2CO3
基本
反应
类型
酸的化学性质
情景导入
在日常生活中,我们已经接触了一些酸,如食醋、胃酸、硫酸等。并且知道了浓盐酸和浓硫酸的一些性质。大家还想知道酸的其它性质吗?本节课我们来探究酸的化学性质。
通过实验探究稀盐酸的化学性质;
01
熟练掌握有关化学方程式的书写;
02
通过化学实验,体验化学探究的乐趣及重要性。
03
学习目标:
HCl=H+
+
Cl-
H2SO4=2H+
+
SO42-
HNO3=H+
+
NO3-
硫酸根
硝酸根
盐酸根
H2CO3=2H+
+
CO32-
碳酸根
知识回顾:
探究一
盐酸与哪些物质发生化学反应
1、在2支试管中分别加入少量稀盐酸,然后分别滴入几滴紫色石蕊试液和无色酚酞试液,观察并记录现象。
操作
滴入石蕊试液
滴入酚酞试液
现象
稀盐酸的化学性质
紫色石蕊试液变红
无色酚酞试液不变色
Part
01
单击此处添加标题
单击此处添加副标题内容
实验内容
现象与结论
镁条和
稀盐酸
锌粒和稀盐酸
铁钉和稀盐酸
有气泡产生,镁条逐渐溶解
Mg
+
2HCl
==
MgCl2+
H2↑
有气泡产生,锌粒逐渐溶解
Zn
+
2HCl
==
ZnCl2+
H2↑
有气泡产生,铁丝逐渐溶解,溶液由无色变为浅绿色
Fe
+
2HCl
==
FeCl2+
H2↑
2.稀盐酸与活泼金属反应
(资料:Fe2+在溶液中显浅绿色)
3.稀盐酸与金属氧化物
实验内容
现象与结论
生锈的铁丝
和稀盐酸
红色的铁锈逐渐溶解,溶液由无色变成黄色
Fe2O3
+
6HCl
=
2FeCl3
+
3H2O
过一会,铁钉表面有气泡冒出
Fe+
2HCl
==
FeCl2
+
H2↑
(资料:Fe3+在溶液中显黄色)
4.稀盐酸与某些盐
实验内容
现象与结论
大理石和
稀盐酸
碳酸钠溶液
和稀盐酸
有气泡产生
CaCO3+2HCl
==CaCl2+H2O+CO2↑
有气泡产生
Na2CO3+2HCl==2NaCl+H2O+CO2↑
盐的概念:由金属阳离子或铵根离子和酸根阴离子构成的化合物。
像
BaCl2
MgCl2
FeCl2
Na2CO3
CuSO4
NH4NO3等是盐。
如果把上述实验中的稀盐酸换成稀硫酸,
你认为是否会产生类似的实验现象?
请试着写出这些反应的化学方程式。
Mg
+
H2SO4
=
Fe
+
H2SO4
=
Fe2O3
+
H2SO4
=
MgSO4
+
H2↑
FeSO4
+
H2
↑
3
Fe2(SO4)3
+
3H2O
自主学习:为什么酸具有相似的化学性质呢?
HCl
=
H+
+
Cl-
H2SO4
=
2H+
+
SO42-
注意:不同的酸溶于水时解离出的酸根阴离子不同,其性质也存在差异。
酸的性质实际上是氢离子的性质。
1.酸溶液能使紫色石蕊试液变红,不能使无色酚酞试液变色。
2.酸+金属
Fe+2HCl=FeCl2+H2↑
Mg+2HCl=MgCl2+H2↑
3.酸+金属氧化物
Fe2O3+6HCl=2FeCl3+3H2O
4.酸+盐
CaCO3+2HCl=CaCl2+CO2↑+H2O
盐+氢气
盐+水
新盐+新酸
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
酸
的
通
性
常见酸的用途
浓硫酸:用于生产化肥等,用作干燥剂
浓盐酸:制药、作除锈剂等
浓硝酸:生产化肥、炸药等
酸能使紫色的石蕊变红,无色酚酞不变色。
01
酸与某些金属反应
02
酸与某些金属氧化物反应
03
酸与部分盐反应
04
小结:
谢谢聆听
单击此处添加文本具体内容
Fe2O3+
6HCl
==
2FeCl3
+3H2O
观察下列化学方程式,你发现它们有何特点?
A
+
C
AB+CD
B
D
化合物
化合物
两种化合物互相交换成分,生成另外两种化合物,这样的反应就叫做复分解反应。
复分解反应
下列化学反应是复分解反应吗?
1.Fe+2HCl=FeCl2+H2↑
2.Fe2O3+6HCl=2FeCl3+3H2O
3.CaCO3+2HCl=CaCl2+CO2↑+H2O
H2CO3
基本
反应
类型
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
