2011年高二化学同步测试:2.4化学反应条件的优化——工业合成氨(鲁科版选修4)
文档属性
| 名称 | 2011年高二化学同步测试:2.4化学反应条件的优化——工业合成氨(鲁科版选修4) |

|
|
| 格式 | zip | ||
| 文件大小 | 144.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-21 00:00:00 | ||
图片预览



文档简介
第2章 第4节
(45分钟 100分)
一、选择题(本题包括10小题,每小题5分,共50分)
1.合成氨反应的特点是( )
①可逆 ②不可逆 ③正反应放热 ④正反应吸热 ⑤正反应气体总体积增大 ⑥正反应气体总体积缩小
A.①③⑤ B.②④⑥
C.①③⑥ D.④⑤⑥
答案: C
2.合成氨工业上采用了循环操作,主要原因是( )
A.加快反应速率 B.提高NH3的平衡浓度
C.降低NH3的沸点 D.提高N2和H2的利用率
解析: 合成氨是可逆反应,在中压工艺条件下合成氨厂出口气中的氨含量一般为13%~14%,循环使用可提高N2和H2的利用率。
答案: D
3.(2010·上海高考)1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是( )
A.①②③ B.②④⑤
C.①③⑤ D.②③④
解析: 合成氨反应为N2(g)+3H2(g)??2NH3(g) ΔH<0,加压、降温、减小NH3的浓度均有利于平衡向正反应方向移动,②、④正确;将原料气循环利用也可提高原料的转化率,⑤正确。
答案: B
4.下列有关合成氨工业的说法中,正确的是( )
A.从合成塔出来的混合气体,其中氨气只占13%~14%,所以生产氨的工厂效率都很低
B.由于氨易液化,N2(g)、H2(g)是循环使用的,总体来讲氨的产率比较高
C.合成氨反应温度控制在500 ℃左右,目的是使化学平衡向正反应方向移动
D.合成氨采用的压强是2×107~5×107Pa,因为该压强下铁触媒的活性最大
解析: 虽然从合成塔出来的混合气体中氨气只占13%~14%,但由于氮气、氢气是循环使用的,总体来讲氨的产率比较高;合成氨是放热反应,选择高温不利于氨气的合成,选择500 ℃左右的温度在于提高化学反应速率和增大催化剂的活性;催化剂的活性取决于温度的大小,而不是取决于压强的高低。
答案: B
5.(2011·汕头高二质检)合成氨反应达到平衡时NH3的体积分数与温度、压强的关系如图所示。根据此图分析合成氨工业最有前途的研究方向是( )
A.提高分离技术
B.研制耐高压的合成塔
C.研制低温催化剂
D.探索不用N2和H2合成氨的新途径
解析: 由图可知:φ(NH3)随着温度的升高而显著下降,故要提高φ(NH3)必须降低温度,但目前所用催化剂——铁触媒活性最好时的温度在700 K左右。故最有前途的研究方向为研制低温催化剂。
答案: C
6.高温下,某反应达平衡,平衡常数K=。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2OCO2+H2
解析: 由平衡常数表达式写出可逆反应为CO2(g)+H2(g)??CO(g)+H2O(g),D项错误;由于升高温度,H2浓度减小,说明升温平衡向正反应方向进行,因此正反应是吸热的,焓变为正值,A项正确;由于反应前后气体体积相等,增大压强平衡不移动,但若通入H2其浓度会增大,B项错误;升高温度,正逆反应速率都会增大,C项错误。
答案: A
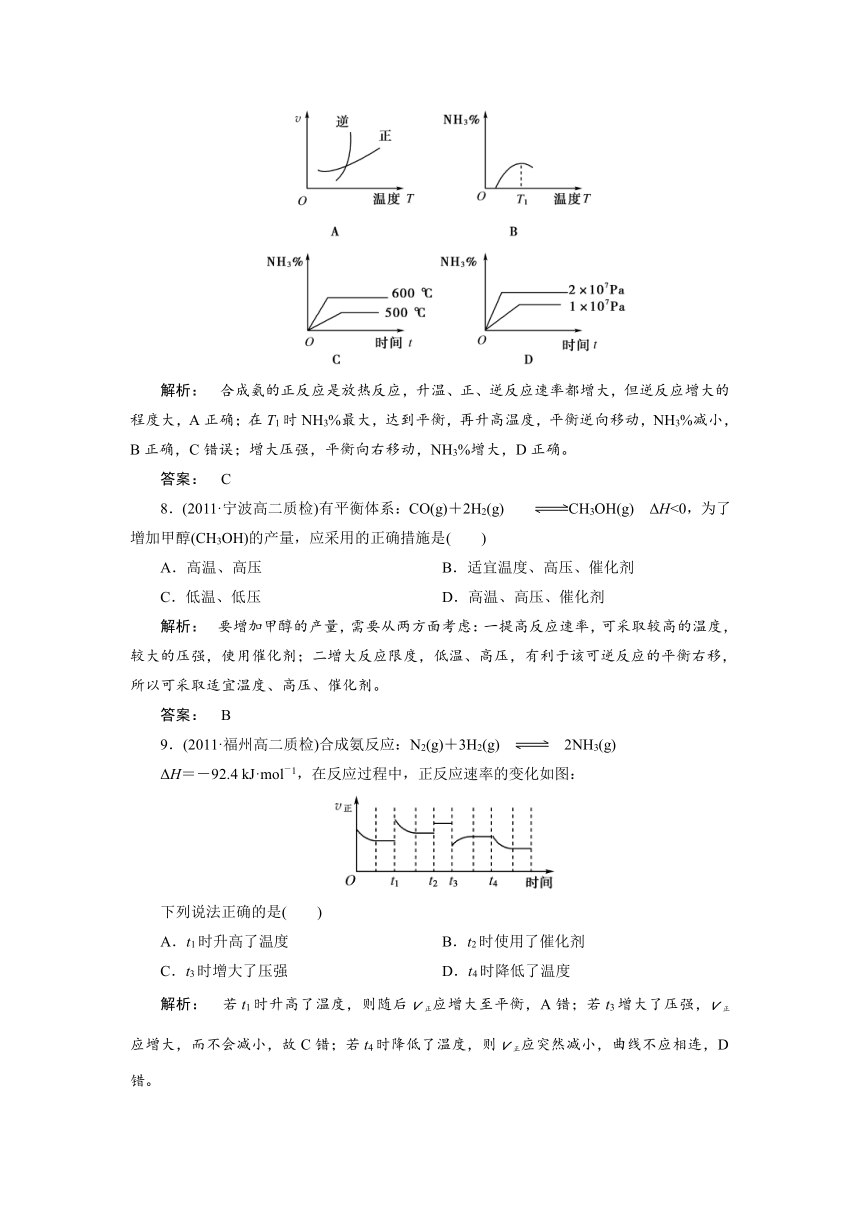
7.工业合成氨的正反应是放热反应,下列关于N2(g)+3H2(g)??2NH3(g)反应的图象中,错误的是( )
解析: 合成氨的正反应是放热反应,升温、正、逆反应速率都增大,但逆反应增大的程度大,A正确;在T1时NH3%最大,达到平衡,再升高温度,平衡逆向移动,NH3%减小,B正确,C错误;增大压强,平衡向右移动,NH3%增大,D正确。
答案: C
8.(2011·宁波高二质检)有平衡体系:CO(g)+2H2(g)??CH3OH(g) ΔH<0,为了增加甲醇(CH3OH)的产量,应采用的正确措施是( )
A.高温、高压 B.适宜温度、高压、催化剂
C.低温、低压 D.高温、高压、催化剂
解析: 要增加甲醇的产量,需要从两方面考虑:一提高反应速率,可采取较高的温度,较大的压强,使用催化剂;二增大反应限度,低温、高压,有利于该可逆反应的平衡右移,所以可采取适宜温度、高压、催化剂。
答案: B
9.(2011·福州高二质检)合成氨反应:N2(g)+3H2(g)??2NH3(g)
ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图:
下列说法正确的是( )
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
解析: 若t1时升高了温度,则随后v正应增大至平衡,A错;若t3增大了压强,v正应增大,而不会减小,故C错;若t4时降低了温度,则v正应突然减小,曲线不应相连,D错。
答案: B
10.在密闭容器内,N2、H2起始的物质的量分别为10 mol、30 mol,达到平衡时N2的转化率为25%。若从NH3开始,在相同条件下欲使平衡时各成分的百分含量相同,则应加入NH3的物质的量及NH3的转化率为( )
A.15 mol和25% B.20 mol和50%
C.20 mol和75% D.40 mol和80%
解析: 以N2、H2为起始时,N2为10 mol,H2为30 mol,要以NH3开始反应,并且平衡时百分含量与前者相同,取NH3的量必须是20 mol,故A和D是错误的。
设以NH3开始反应时,氨转化的物质的量为x,那么有20 mol-x=2×10 mol×25%,x=15 mol
氨的转化率:×100%=75%。
答案: C
二、非选择题(本题包括4小题,共50分)
11.(12分)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)??2NH3(g) ΔH=-92.44 kJ·mol-1,其部分工艺流程如图所示:
反应体系中各组分的部分性质见下表
气体 氮气 氢气 氨
熔点/℃ -210.01 -252.77 -77.74
沸点/℃ -195.79 -259.23 -33.42
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=________________________________ ________________________________________。
随着温度升高,K值________(填“增大”、“减小”或“不变”)。
(2)K值越大,表明________(填字母)。
A.其他条件相同时N2的转化率越高 B.其他条件相同时NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)在工业上采取气体循环的流程,即反应后通过把混合气体的温度降低到________使________分离出来;继续循环的气体是________。
解析: (1)由化学方程式N2(g)+3H2(g)??2NH3(g)不难写出:K=,此反应ΔH<0,说明正反应为放热反应,升高温度,平衡向吸热方向移动,即向左移动,[NH3]减小,[N2]和[H2]增大,故K减小。(2)K值越大,说明[NH3]越大,[N2]和[H2]就越小,说明反应进行的程度大,故其他条件相同时N2的转化率就越高,NH3的产率就越大。(3)根据气体的熔、沸点可知,氨气容易液化,使其分离可使平衡正向移动,剩余N2和H2循环使用,以提高产率。
答案: (1) 减小 (2)AB
(3)-33.42 ℃ 氨 N2和H2
12.(12分)下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。
达到平衡时平衡混合物中NH3的含量(体积分数)[入料V(N2)∶V(H2)=1∶3]
0.1 10 20 30 60 100
200 ℃ 15.3 81.5 86.4 89.9 95.4 98.8
300 ℃ 2.2 52.0 64.2 71.0 84.2 92.6
400 ℃ 0.4 25.1 38.2 47.0 65.2 79.8
500 ℃ 0.1 10.6 19.1 26.4 42.2 57.5
600 ℃ 0.05 4.5 9.1 13.8 23.1 31.4
(1)比较200 ℃和300 ℃时的数据,可判断升高温度,平衡向________方向移动,正反应方向为________(填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨适宜的条件是________。
A.高温高压 B.高温低压
C.低温高压 D.低温低压
(3)计算500 ℃,30 MPa时N2的转化率________。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施:__________________________________________________________。
解析: (1)由表中数据可以看出,在1个标准大气压下,200 ℃ NH3的百分含量比300 ℃中NH3的百分含量高,故知升高温度平衡向左(或逆向)移动,进而据平衡移动原理判断出正反应方向为放热反应。
(2)由表中数据知,在相同压强下,温度越高,NH3的百分含量越低;相同温度时,压强越大,NH3的百分含量越高,故合成氨适宜条件是低温高压。
(3) N2 + 3H2 ?? 2NH3
起始 1 3 0
转化 n 3n 2n
平衡 1-n 3-3n 2n
×100%=26.4%
n=0.417 7
故N2的转化率为×100%=41.77%。
答案: (1)左(或逆反应) 放热 (2)C (3)41.77%
(4)加入过量的N2(或及时从平衡混合物中移走NH3)
13.(12分)(2011·南通高二质检)对于2X??Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如右图所示(实线上的任何一点为对应温度下的平衡状态。)
(1)该反应的正反应方向是一个____反应(填“吸热”或“放热”)。
(2)A、B、C、D、E各状态中,v(正)(3)维持t1不变,E→A所需时间为x,维持t2不变,D→C所需时间为y,则x______y(填“<”“>”或“=”)。
(4)欲要求使E状态从水平方向到C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是____________________________________________________。
解析: 由图可知,随着温度的升高,w(Y)逐渐减少,说明平衡逆向移动,则正反应方向是放热反应。A、B、C、D、E中A、B、C在平衡曲线上,则A、B、C都处于各自的平衡状态中,D、E两点不在平衡曲线上,即它们没有达到化学平衡,因为E状态的w(Y)比该温度下平衡时的小,所以平衡正向移动,v(正)>v(逆),D状态的w(Y)比该温度下的平衡状态时的大,平衡逆向移动,此时v(逆)>v(正)。D、E要达到各自温度下的平衡状态所转化的Y的物质的量,因为D处的温度比E处的温度高,D处反应速率快,所以D处达到平衡所需时间短。E→C,要满足w(Y)不变,温度升高,只有采取突然升温,C→A的变化符合平衡曲线,意味着要经过无数个温度下的平衡状态的点后,C才能到达A,所以只有采取无限缓慢地降温。
答案: (1)放热 (2)D (3)> (4)先突然升温到t2,然后无限缓慢地降低温度到t1
14.(16分)(2011·深圳高二质检)科学家一直致力于“人工固氮”的新方法研究。
(1)目前合成氨技术原理为:N2(g)+3H2(g)??2NH3(g)
ΔH=-92.2 kJ·mol-1
①673 K,30 MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是________。
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n(N2)相同
D.773 K,30 MPa下,t2时刻也是该反应的平衡点,则n(NH3)比图中e点的值大
②在容积为2.0 L恒容的密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),反应在673 K、30 MPa下进行,达到平衡时,NH3的体积分数为20%。该条件下反应N2(g)+3H2(g)??2NH3(g)的平衡常数K=________。
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(l)??2NH3(g)+O2(g) ΔH=a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
T/K 303 313 323
NH3生成量/(10-6 mol) 4.8 5.9 6.0
①此合成反应的a________0;ΔS________0。(填“>”、“<”或“=”)
②已知:N2(g)+3H2(g)??2NH3(g) ΔH=-92.2 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
则N2(g)+3H2O(l)??2NH3(g)+O2(g) ΔH=____________kJ·mol-1。
解析: (1)①a、b两点均未达到平衡,正反应速率大于逆反应速率,且正反应速率逐渐减小,逆反应速率逐渐增大,则点a的正反应速率比点b的大;点c处,[H2]=[NH3],相等并不是不变,此点未达到平衡;点d(t1时刻)和点e(t2时刻)处都是处在平衡状态,n(N2)或[N2]不变;温度升高,合成氨的可逆反应平衡逆向移动,n(H2)或[H2]增大,n(NH3)减小。
②设在反应过程中N2的物质的量的变化为x。
3H2 + N2 ?? 2NH3
始/mol 1.60 0.80 0
变/mol 3x x 2x
平/mol 1.6-3x 0.8-x 2x
×100%=20%,
解得x=0.2。
K=== mol-2·L2。
(2)①温度升高,NH3的生成量增多,平衡右移,故正反应吸热,ΔH>0,即a>0;由于原反应中反应后气体的物质的量增大,故ΔS>0。
②由2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1可得,3H2O(l)===3H2(g)+O2(g) ΔH=+857.4 kJ·mol-1,再与N2(g)+3H2(g)??2NH3(g) ΔH=-92.2 kJ·mol-1相加,可得N2(g)+3H2O(l)??2NH3(g)+O2(g) ΔH=+765.2 kJ·mol-1。
答案: (1)①A、C ② mol-2·L2(或1.07 mol-2·L2或1.1 mol-2·L2)
(2)①> > ②+765.2
(45分钟 100分)
一、选择题(本题包括10小题,每小题5分,共50分)
1.合成氨反应的特点是( )
①可逆 ②不可逆 ③正反应放热 ④正反应吸热 ⑤正反应气体总体积增大 ⑥正反应气体总体积缩小
A.①③⑤ B.②④⑥
C.①③⑥ D.④⑤⑥
答案: C
2.合成氨工业上采用了循环操作,主要原因是( )
A.加快反应速率 B.提高NH3的平衡浓度
C.降低NH3的沸点 D.提高N2和H2的利用率
解析: 合成氨是可逆反应,在中压工艺条件下合成氨厂出口气中的氨含量一般为13%~14%,循环使用可提高N2和H2的利用率。
答案: D
3.(2010·上海高考)1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是( )
A.①②③ B.②④⑤
C.①③⑤ D.②③④
解析: 合成氨反应为N2(g)+3H2(g)??2NH3(g) ΔH<0,加压、降温、减小NH3的浓度均有利于平衡向正反应方向移动,②、④正确;将原料气循环利用也可提高原料的转化率,⑤正确。
答案: B
4.下列有关合成氨工业的说法中,正确的是( )
A.从合成塔出来的混合气体,其中氨气只占13%~14%,所以生产氨的工厂效率都很低
B.由于氨易液化,N2(g)、H2(g)是循环使用的,总体来讲氨的产率比较高
C.合成氨反应温度控制在500 ℃左右,目的是使化学平衡向正反应方向移动
D.合成氨采用的压强是2×107~5×107Pa,因为该压强下铁触媒的活性最大
解析: 虽然从合成塔出来的混合气体中氨气只占13%~14%,但由于氮气、氢气是循环使用的,总体来讲氨的产率比较高;合成氨是放热反应,选择高温不利于氨气的合成,选择500 ℃左右的温度在于提高化学反应速率和增大催化剂的活性;催化剂的活性取决于温度的大小,而不是取决于压强的高低。
答案: B
5.(2011·汕头高二质检)合成氨反应达到平衡时NH3的体积分数与温度、压强的关系如图所示。根据此图分析合成氨工业最有前途的研究方向是( )
A.提高分离技术
B.研制耐高压的合成塔
C.研制低温催化剂
D.探索不用N2和H2合成氨的新途径
解析: 由图可知:φ(NH3)随着温度的升高而显著下降,故要提高φ(NH3)必须降低温度,但目前所用催化剂——铁触媒活性最好时的温度在700 K左右。故最有前途的研究方向为研制低温催化剂。
答案: C
6.高温下,某反应达平衡,平衡常数K=。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2OCO2+H2
解析: 由平衡常数表达式写出可逆反应为CO2(g)+H2(g)??CO(g)+H2O(g),D项错误;由于升高温度,H2浓度减小,说明升温平衡向正反应方向进行,因此正反应是吸热的,焓变为正值,A项正确;由于反应前后气体体积相等,增大压强平衡不移动,但若通入H2其浓度会增大,B项错误;升高温度,正逆反应速率都会增大,C项错误。
答案: A
7.工业合成氨的正反应是放热反应,下列关于N2(g)+3H2(g)??2NH3(g)反应的图象中,错误的是( )
解析: 合成氨的正反应是放热反应,升温、正、逆反应速率都增大,但逆反应增大的程度大,A正确;在T1时NH3%最大,达到平衡,再升高温度,平衡逆向移动,NH3%减小,B正确,C错误;增大压强,平衡向右移动,NH3%增大,D正确。
答案: C
8.(2011·宁波高二质检)有平衡体系:CO(g)+2H2(g)??CH3OH(g) ΔH<0,为了增加甲醇(CH3OH)的产量,应采用的正确措施是( )
A.高温、高压 B.适宜温度、高压、催化剂
C.低温、低压 D.高温、高压、催化剂
解析: 要增加甲醇的产量,需要从两方面考虑:一提高反应速率,可采取较高的温度,较大的压强,使用催化剂;二增大反应限度,低温、高压,有利于该可逆反应的平衡右移,所以可采取适宜温度、高压、催化剂。
答案: B
9.(2011·福州高二质检)合成氨反应:N2(g)+3H2(g)??2NH3(g)
ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图:
下列说法正确的是( )
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
解析: 若t1时升高了温度,则随后v正应增大至平衡,A错;若t3增大了压强,v正应增大,而不会减小,故C错;若t4时降低了温度,则v正应突然减小,曲线不应相连,D错。
答案: B
10.在密闭容器内,N2、H2起始的物质的量分别为10 mol、30 mol,达到平衡时N2的转化率为25%。若从NH3开始,在相同条件下欲使平衡时各成分的百分含量相同,则应加入NH3的物质的量及NH3的转化率为( )
A.15 mol和25% B.20 mol和50%
C.20 mol和75% D.40 mol和80%
解析: 以N2、H2为起始时,N2为10 mol,H2为30 mol,要以NH3开始反应,并且平衡时百分含量与前者相同,取NH3的量必须是20 mol,故A和D是错误的。
设以NH3开始反应时,氨转化的物质的量为x,那么有20 mol-x=2×10 mol×25%,x=15 mol
氨的转化率:×100%=75%。
答案: C
二、非选择题(本题包括4小题,共50分)
11.(12分)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)??2NH3(g) ΔH=-92.44 kJ·mol-1,其部分工艺流程如图所示:
反应体系中各组分的部分性质见下表
气体 氮气 氢气 氨
熔点/℃ -210.01 -252.77 -77.74
沸点/℃ -195.79 -259.23 -33.42
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=________________________________ ________________________________________。
随着温度升高,K值________(填“增大”、“减小”或“不变”)。
(2)K值越大,表明________(填字母)。
A.其他条件相同时N2的转化率越高 B.其他条件相同时NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)在工业上采取气体循环的流程,即反应后通过把混合气体的温度降低到________使________分离出来;继续循环的气体是________。
解析: (1)由化学方程式N2(g)+3H2(g)??2NH3(g)不难写出:K=,此反应ΔH<0,说明正反应为放热反应,升高温度,平衡向吸热方向移动,即向左移动,[NH3]减小,[N2]和[H2]增大,故K减小。(2)K值越大,说明[NH3]越大,[N2]和[H2]就越小,说明反应进行的程度大,故其他条件相同时N2的转化率就越高,NH3的产率就越大。(3)根据气体的熔、沸点可知,氨气容易液化,使其分离可使平衡正向移动,剩余N2和H2循环使用,以提高产率。
答案: (1) 减小 (2)AB
(3)-33.42 ℃ 氨 N2和H2
12.(12分)下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。
达到平衡时平衡混合物中NH3的含量(体积分数)[入料V(N2)∶V(H2)=1∶3]
0.1 10 20 30 60 100
200 ℃ 15.3 81.5 86.4 89.9 95.4 98.8
300 ℃ 2.2 52.0 64.2 71.0 84.2 92.6
400 ℃ 0.4 25.1 38.2 47.0 65.2 79.8
500 ℃ 0.1 10.6 19.1 26.4 42.2 57.5
600 ℃ 0.05 4.5 9.1 13.8 23.1 31.4
(1)比较200 ℃和300 ℃时的数据,可判断升高温度,平衡向________方向移动,正反应方向为________(填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨适宜的条件是________。
A.高温高压 B.高温低压
C.低温高压 D.低温低压
(3)计算500 ℃,30 MPa时N2的转化率________。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施:__________________________________________________________。
解析: (1)由表中数据可以看出,在1个标准大气压下,200 ℃ NH3的百分含量比300 ℃中NH3的百分含量高,故知升高温度平衡向左(或逆向)移动,进而据平衡移动原理判断出正反应方向为放热反应。
(2)由表中数据知,在相同压强下,温度越高,NH3的百分含量越低;相同温度时,压强越大,NH3的百分含量越高,故合成氨适宜条件是低温高压。
(3) N2 + 3H2 ?? 2NH3
起始 1 3 0
转化 n 3n 2n
平衡 1-n 3-3n 2n
×100%=26.4%
n=0.417 7
故N2的转化率为×100%=41.77%。
答案: (1)左(或逆反应) 放热 (2)C (3)41.77%
(4)加入过量的N2(或及时从平衡混合物中移走NH3)
13.(12分)(2011·南通高二质检)对于2X??Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如右图所示(实线上的任何一点为对应温度下的平衡状态。)
(1)该反应的正反应方向是一个____反应(填“吸热”或“放热”)。
(2)A、B、C、D、E各状态中,v(正)
(4)欲要求使E状态从水平方向到C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是____________________________________________________。
解析: 由图可知,随着温度的升高,w(Y)逐渐减少,说明平衡逆向移动,则正反应方向是放热反应。A、B、C、D、E中A、B、C在平衡曲线上,则A、B、C都处于各自的平衡状态中,D、E两点不在平衡曲线上,即它们没有达到化学平衡,因为E状态的w(Y)比该温度下平衡时的小,所以平衡正向移动,v(正)>v(逆),D状态的w(Y)比该温度下的平衡状态时的大,平衡逆向移动,此时v(逆)>v(正)。D、E要达到各自温度下的平衡状态所转化的Y的物质的量,因为D处的温度比E处的温度高,D处反应速率快,所以D处达到平衡所需时间短。E→C,要满足w(Y)不变,温度升高,只有采取突然升温,C→A的变化符合平衡曲线,意味着要经过无数个温度下的平衡状态的点后,C才能到达A,所以只有采取无限缓慢地降温。
答案: (1)放热 (2)D (3)> (4)先突然升温到t2,然后无限缓慢地降低温度到t1
14.(16分)(2011·深圳高二质检)科学家一直致力于“人工固氮”的新方法研究。
(1)目前合成氨技术原理为:N2(g)+3H2(g)??2NH3(g)
ΔH=-92.2 kJ·mol-1
①673 K,30 MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是________。
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n(N2)相同
D.773 K,30 MPa下,t2时刻也是该反应的平衡点,则n(NH3)比图中e点的值大
②在容积为2.0 L恒容的密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),反应在673 K、30 MPa下进行,达到平衡时,NH3的体积分数为20%。该条件下反应N2(g)+3H2(g)??2NH3(g)的平衡常数K=________。
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(l)??2NH3(g)+O2(g) ΔH=a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
T/K 303 313 323
NH3生成量/(10-6 mol) 4.8 5.9 6.0
①此合成反应的a________0;ΔS________0。(填“>”、“<”或“=”)
②已知:N2(g)+3H2(g)??2NH3(g) ΔH=-92.2 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
则N2(g)+3H2O(l)??2NH3(g)+O2(g) ΔH=____________kJ·mol-1。
解析: (1)①a、b两点均未达到平衡,正反应速率大于逆反应速率,且正反应速率逐渐减小,逆反应速率逐渐增大,则点a的正反应速率比点b的大;点c处,[H2]=[NH3],相等并不是不变,此点未达到平衡;点d(t1时刻)和点e(t2时刻)处都是处在平衡状态,n(N2)或[N2]不变;温度升高,合成氨的可逆反应平衡逆向移动,n(H2)或[H2]增大,n(NH3)减小。
②设在反应过程中N2的物质的量的变化为x。
3H2 + N2 ?? 2NH3
始/mol 1.60 0.80 0
变/mol 3x x 2x
平/mol 1.6-3x 0.8-x 2x
×100%=20%,
解得x=0.2。
K=== mol-2·L2。
(2)①温度升高,NH3的生成量增多,平衡右移,故正反应吸热,ΔH>0,即a>0;由于原反应中反应后气体的物质的量增大,故ΔS>0。
②由2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1可得,3H2O(l)===3H2(g)+O2(g) ΔH=+857.4 kJ·mol-1,再与N2(g)+3H2(g)??2NH3(g) ΔH=-92.2 kJ·mol-1相加,可得N2(g)+3H2O(l)??2NH3(g)+O2(g) ΔH=+765.2 kJ·mol-1。
答案: (1)①A、C ② mol-2·L2(或1.07 mol-2·L2或1.1 mol-2·L2)
(2)①> > ②+765.2
