京改版九年级化学下册9.3 溶解度 课件(共44张PPT)
文档属性
| 名称 | 京改版九年级化学下册9.3 溶解度 课件(共44张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-03 11:00:51 | ||
图片预览










文档简介
课题
溶解度
实验探究1
操作
向1g NaCl中加入4mL蒸馏水,充分振荡
再加入1g氯化钠,搅拌
现象
结论
能全溶
不能全溶
物质不能无限制地溶解在一定量的水中
【实验探究2】 在上述不能溶的NaCl的试管中,加入3mL蒸馏水,充分振荡。
能否溶解与溶剂的量有关
实验探究3
操作
现象
结论
改加1gKNO3
再加1gKNO3
加热
再加1gKNO3
冷却
能全溶
不能全溶
能全溶
能全溶
有固体析出
温度改变时,物质在水里溶解性不相同。
热的溶液冷却后,已溶解在溶液中的硝酸钾以晶体的形式析出,这一过程叫结晶。
一、饱和溶液和不饱和溶液
1、饱和溶液:一定温度下一定量的溶剂中
不能再溶解某种物质的溶液
2、不饱和溶液:一定温度下一定量的溶剂中
能继续溶解某种物质的溶液
当温度确定、溶剂量确定时,某溶液的饱和状态表示溶质溶解的最大值。
只有指明“在一定量溶剂里”和“在一定温度下”,溶液的“饱和”和“不饱和”才有意义。
实验探究4
KMnO4固体
饱和食盐水
结论:
某种溶质的饱和溶液还可能溶解其它物质。
练习:
20℃时,将33g食盐加入100g水中,
食盐全部溶解,此时溶液的质量为
,再向此溶液中加入3g食盐
又恰好全部溶解,则刚才的溶液为
溶液,现在溶液恰好饱和,
溶液的质量为 ,再向此溶液
中加入3g食盐,溶液的质量为 。
思考:饱和溶液和不饱和溶液怎样
相互转化?
饱和溶液
不饱和溶液
①升高温度(通常情况下)
②加入溶剂
①降低温度(通常情况下)
②蒸发溶剂
③加入溶质
思考:如何判断一定条件下某溶液
是否为饱和溶液?
(1)加少量溶质,看是否还能溶解;
(3)稍微降温,看是否有固体析出
(溶解度随温度升高而增大的物质)
(2)蒸发少量溶剂(温度不变),看是否
有固体析出;
二、浓溶液和稀溶液
在一定量的溶液中,含溶质的量较多的是浓溶液,含溶质的量较少的是稀溶液
思考:
(1)浓溶液是否一定为饱和溶液?稀溶液是否
一定为不饱和溶液?
(2) 饱和溶液是否一定比不饱和溶液浓度大?
同种溶液,同一温度下可比较
饱和
溶液
不饱和
溶液
稀
溶液
浓
溶液
Ⅰ
Ⅱ
Ⅲ
Ⅳ
饱和
溶液
不饱和
溶液
浓溶液
稀溶液
小结
1、物质的溶解性
决定因素:
溶质和溶剂的性质
温度、压强等外界条件
二、溶解度
一种物质溶解在另
一种物质里的能力
回忆:碘在水和汽油中溶解性的比较。
NaCl
KNO3
我溶解能力强,20℃时,50克水中最多可溶解18克。
那有什么了不起,我 10 ℃时,100克水中最多可溶解20.9克。
哼!我才用了50克水,你呢!100克…
我比你强!
也不想想你的温度比我高呀!
我在60 ℃,50克水最多溶解55克…
食盐与硝酸钾比,谁在水中的溶解能力更强……
KNO3
NaCl
讨论:如何比较NaCl、KNO3的溶解性大小?
20℃
40℃
应该在同一温度下
NaCl
KNO3
不行
能否说明KNO3 比NaCl 易溶与水呢?
20℃,20g水
20℃,100g水
溶剂量应该相同
不行
能否说明KNO3 比NaCl 易溶与水呢?
20℃,100g水
20℃,100g水
10gNaCl
10gKNO3
不行
应该达到饱和状态
能否说明KNO3 比NaCl 易溶与水呢?
36gNaCl
31.6gKNO3
20℃ ,
100g水,饱和
20℃,
100g水,饱和
能否说明KNO3 比NaCl 易溶与水呢?
可行
2、固体的溶解度 (溶解性的定量描述)
(1)定义:
在一定温度下,某固态物质在100g溶剂里达到饱和状态所能溶解的溶质质量(g),叫做这种物质在这种溶剂里的溶解度。
问题:固体物质的溶解度受哪些因素
的影响?
溶解度的大小与温度有关
(2)溶解度和溶解性的关系
溶解性分类
易溶
可溶
微溶
难溶
20 ℃溶解度
(g)
>10
1~10
0.01~1
<0.01
举例
KNO3
KClO3
Ca(OH)2
CaCO3
[问题1]
溶解度在生产和科研中非常重要,那么溶解度是怎样测定的呢?近似测定NaCl在室温下的溶解度。
.
.
.
.
溶解度/
g
?
?
?
?
?
?
?
?
?
?
200
?
100
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
.
硝酸钾
.
.
.
.
温度/℃
0
10
20
30
40
50
60
70
80
90
100
溶解度/g
31.6
85.5
13.3
20.9
45.8
63.9
110
138
169
202
246
横坐标表示温度(℃)
纵坐标表示溶解度(克)
[问题2] 在非测定温度下的溶解度如何获得?
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
.a
.b
练习:
通过书上的溶解度曲线完成下列问题
(1)50℃时,氯化铵的溶解度是_____,
80℃时硝酸钠的溶解度是_______。
(2)在70℃时,比较氯化钠、氯化钾、
氯化铵、硝酸钾的溶解度大小。
(3) 时,硝酸钠和硝酸钾的
溶解度相等; 时,硝酸钠
的溶解度大于硝酸钾的溶解度;
时,硝酸钠的溶解度小于
硝酸钾的溶解度。
N
M
温度/℃
溶解度\克
t1
t2
0
●
b
●
●
a
两曲线的交点:
表示两物质在交点所示的温度下的溶解度相等;
表示在交点所示的温度下两物质的饱和溶液质量分数相等。
●
c
溶解度曲线含义
曲线下方的点:
不饱和溶液
曲线上方的点:
形成饱和溶液
并有物质剩余。
10
20
曲线上的点:
表示物质在
该点所示温度
下的溶解度。
1.表示某物质在不同温度下的溶解度
2.表示温度的变化对物质溶解度的影响(斜率)
3.比较不同物质在相同温度下或某一温度范围内
溶解度的大小。
4.确定不饱和溶液和饱和溶液相互转化的方法
②
③极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2 。
①大多数固体物质的溶解度随温度的升高而增大,如KNO3 。
少数固体物质的溶解度随温度的升高变化不显著,如NaCl。
溶解度曲线的含义
结晶方法:
冷却热饱和溶液--------溶解度随温度变化较大
蒸发溶剂------溶解度随温度变化较小
粗盐提纯
步骤:
(1)溶解 → (2)过滤 → (3)蒸发
活动与探究
在溶解、过滤、蒸发中都用到了玻璃棒,它的作用分别是什么?
溶解:搅拌,加速固体的溶解;
过滤:引流,防止液体溅出;
蒸发:搅拌,防止液体受热不均匀,液滴飞溅
P69
溶解粗盐/g
蒸发得到的精盐/g
精盐产率/%
产率的计算:
X
2.2
———×100% =
2.2 g
Xg
思考:
1.当打开汽水瓶盖后,为什么常常
有大量气泡冒出?
2.喝汽水以后,为什么会打嗝?
气体溶解度随温度的升高而降低,随压强的增大而增大。
3、气体的溶解度
定义:某气体在一个标准大气压下,一定温度时,溶解在1体积水中达到饱和状态时的气体体积数。
思考:
①能不能用刚凉好的凉白开养鱼?
②给冷水加热的时候,在沸腾以
前,水中为什么会出现很多气泡?
当某物质在一定温度下溶解度为
S时,饱和溶液中有以下关系:
M质表示溶质的质量,
M剂表示溶剂的质量,
M液表示溶液的质量。
*固体物质溶解度的基本计算
练习
1、将某固体物质的不饱和溶液转变
为饱和溶液,最可靠的方法是( )
A、升高温度 B、降低温度
C、加入溶质 D、加入溶剂
C
2、20℃,往50g硝酸钾溶液中加入5g
硝酸钾晶体,充分搅拌后,尚有部分
晶体未溶解,稍加热后,晶体全部溶
解。下列说法正确的是 ( )
A、搅拌后加热前一定是饱和溶液
B、搅拌后加热前一定是不饱和溶液
C、加热后一定是饱和溶液
D、加热后一定是不饱和溶液
A
3、将40℃时的硝酸钾饱和溶液冷却到20℃,在温度变化前后,溶液中保持不变的是( )
A、溶质质量 B、溶液质量
C、溶剂质量 D、溶液浓度
4、在一定温度下,向100g硝酸钾饱和溶液中加入10g硝酸钾晶体后,溶液的质量为( )
A、100g B、90g
C、110g D、无法判断
C
A
5、判断下列语句的正误:
(1)同一种物质的饱和溶液一定比不饱和溶液浓
(2)同一种物质一定温度下的饱和溶液一定比不
饱和溶液中的溶质多。
(3)两种不同溶质的饱和溶液混合,依然是
饱和溶液。
(4)不饱和溶液变为饱和溶液浓度一定变大。
练习:
1、判断下列语句正误:
(1)在20℃时向氯化钠饱和溶液中加入1g氯化
钠,溶液的质量增大;
(2)随水量增大,能溶解的物质增多,所以溶
解度随溶剂量的增大而增大;
(3)将氢氧化钙的不饱和溶液变为饱和溶液,
可用加溶质、降温的方法。
(4)一定温度下,100g氯化钾饱和溶液中有氯
化钾10g,则该温度下氯化钾的溶解度为10g。
2、20℃时,食盐的溶解度为36g。在此温度下,50g水中加入了20g食盐,充分溶解后所形成溶液的质量为 ( )
A、70g B、60g
C、68g D、136g
3、现有60℃的硝酸钾溶液500g,保持温度不变,蒸发掉10g水,则溶液中一定保持不变的是 ( )
A、溶质的质量 B、溶液的质量
C、溶剂的质量 D、硝酸钾的溶解度
4、20℃时,A、B、C三种物质在下述情况恰好形成饱和溶液
(1)0.2gA溶于1g水中;
(2)150gB溶于1000g水中;
(3)50gC溶于300g水中;
其中溶解度最大的是哪种物质?
5、将50g20℃时的饱和硝酸钾溶液蒸干得到12g硝酸钾晶体(不含结晶水),求该温度下硝酸钾的溶解度。
练习:下列说法是否正确?
(1)食盐在水里的溶解度是36g,
(2)20℃时,硝酸钾的溶解度为31.6,
(3)20℃时,50g水中加入18g食盐后溶液恰好饱和,因此,20℃时,食盐在水中的溶解度为18g,
(4)10℃时,100g水里溶解了10g蔗糖, 所以10℃时,蔗糖在水中的溶解度为10g。
溶解度
实验探究1
操作
向1g NaCl中加入4mL蒸馏水,充分振荡
再加入1g氯化钠,搅拌
现象
结论
能全溶
不能全溶
物质不能无限制地溶解在一定量的水中
【实验探究2】 在上述不能溶的NaCl的试管中,加入3mL蒸馏水,充分振荡。
能否溶解与溶剂的量有关
实验探究3
操作
现象
结论
改加1gKNO3
再加1gKNO3
加热
再加1gKNO3
冷却
能全溶
不能全溶
能全溶
能全溶
有固体析出
温度改变时,物质在水里溶解性不相同。
热的溶液冷却后,已溶解在溶液中的硝酸钾以晶体的形式析出,这一过程叫结晶。
一、饱和溶液和不饱和溶液
1、饱和溶液:一定温度下一定量的溶剂中
不能再溶解某种物质的溶液
2、不饱和溶液:一定温度下一定量的溶剂中
能继续溶解某种物质的溶液
当温度确定、溶剂量确定时,某溶液的饱和状态表示溶质溶解的最大值。
只有指明“在一定量溶剂里”和“在一定温度下”,溶液的“饱和”和“不饱和”才有意义。
实验探究4
KMnO4固体
饱和食盐水
结论:
某种溶质的饱和溶液还可能溶解其它物质。
练习:
20℃时,将33g食盐加入100g水中,
食盐全部溶解,此时溶液的质量为
,再向此溶液中加入3g食盐
又恰好全部溶解,则刚才的溶液为
溶液,现在溶液恰好饱和,
溶液的质量为 ,再向此溶液
中加入3g食盐,溶液的质量为 。
思考:饱和溶液和不饱和溶液怎样
相互转化?
饱和溶液
不饱和溶液
①升高温度(通常情况下)
②加入溶剂
①降低温度(通常情况下)
②蒸发溶剂
③加入溶质
思考:如何判断一定条件下某溶液
是否为饱和溶液?
(1)加少量溶质,看是否还能溶解;
(3)稍微降温,看是否有固体析出
(溶解度随温度升高而增大的物质)
(2)蒸发少量溶剂(温度不变),看是否
有固体析出;
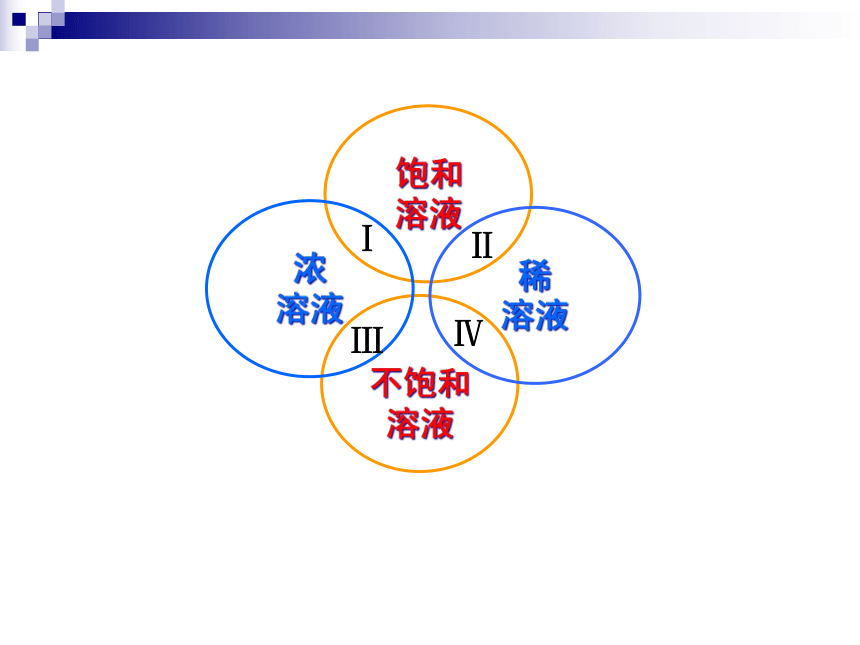
二、浓溶液和稀溶液
在一定量的溶液中,含溶质的量较多的是浓溶液,含溶质的量较少的是稀溶液
思考:
(1)浓溶液是否一定为饱和溶液?稀溶液是否
一定为不饱和溶液?
(2) 饱和溶液是否一定比不饱和溶液浓度大?
同种溶液,同一温度下可比较
饱和
溶液
不饱和
溶液
稀
溶液
浓
溶液
Ⅰ
Ⅱ
Ⅲ
Ⅳ
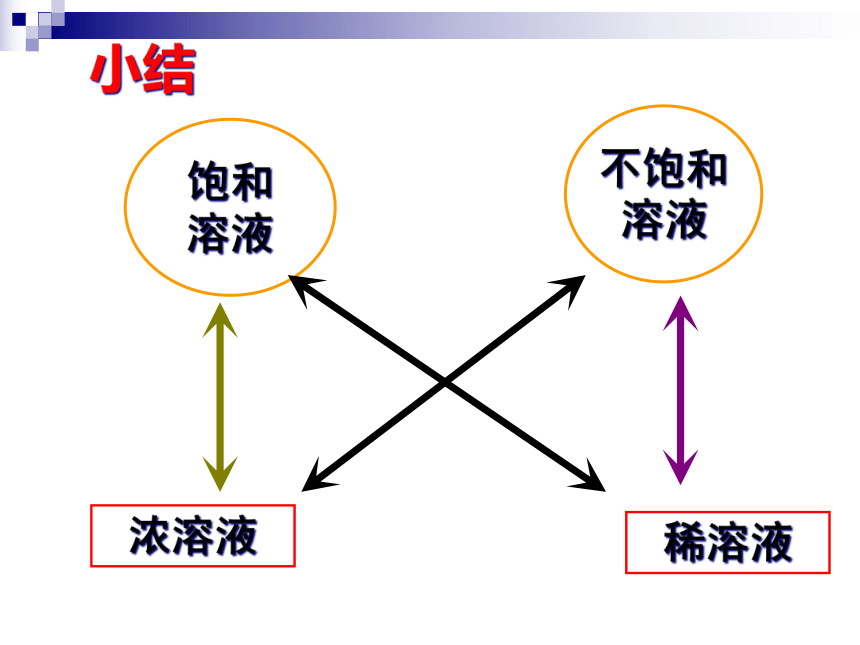
饱和
溶液
不饱和
溶液
浓溶液
稀溶液
小结
1、物质的溶解性
决定因素:
溶质和溶剂的性质
温度、压强等外界条件
二、溶解度
一种物质溶解在另
一种物质里的能力
回忆:碘在水和汽油中溶解性的比较。
NaCl
KNO3
我溶解能力强,20℃时,50克水中最多可溶解18克。
那有什么了不起,我 10 ℃时,100克水中最多可溶解20.9克。
哼!我才用了50克水,你呢!100克…
我比你强!
也不想想你的温度比我高呀!
我在60 ℃,50克水最多溶解55克…
食盐与硝酸钾比,谁在水中的溶解能力更强……
KNO3
NaCl
讨论:如何比较NaCl、KNO3的溶解性大小?
20℃
40℃
应该在同一温度下
NaCl
KNO3
不行
能否说明KNO3 比NaCl 易溶与水呢?
20℃,20g水
20℃,100g水
溶剂量应该相同
不行
能否说明KNO3 比NaCl 易溶与水呢?
20℃,100g水
20℃,100g水
10gNaCl
10gKNO3
不行
应该达到饱和状态
能否说明KNO3 比NaCl 易溶与水呢?
36gNaCl
31.6gKNO3
20℃ ,
100g水,饱和
20℃,
100g水,饱和
能否说明KNO3 比NaCl 易溶与水呢?
可行
2、固体的溶解度 (溶解性的定量描述)
(1)定义:
在一定温度下,某固态物质在100g溶剂里达到饱和状态所能溶解的溶质质量(g),叫做这种物质在这种溶剂里的溶解度。
问题:固体物质的溶解度受哪些因素
的影响?
溶解度的大小与温度有关
(2)溶解度和溶解性的关系
溶解性分类
易溶
可溶
微溶
难溶
20 ℃溶解度
(g)
>10
1~10
0.01~1
<0.01
举例
KNO3
KClO3
Ca(OH)2
CaCO3
[问题1]
溶解度在生产和科研中非常重要,那么溶解度是怎样测定的呢?近似测定NaCl在室温下的溶解度。
.
.
.
.
溶解度/
g
?
?
?
?
?
?
?
?
?
?
200
?
100
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
.
硝酸钾
.
.
.
.
温度/℃
0
10
20
30
40
50
60
70
80
90
100
溶解度/g
31.6
85.5
13.3
20.9
45.8
63.9
110
138
169
202
246
横坐标表示温度(℃)
纵坐标表示溶解度(克)
[问题2] 在非测定温度下的溶解度如何获得?
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
.a
.b
练习:
通过书上的溶解度曲线完成下列问题
(1)50℃时,氯化铵的溶解度是_____,
80℃时硝酸钠的溶解度是_______。
(2)在70℃时,比较氯化钠、氯化钾、
氯化铵、硝酸钾的溶解度大小。
(3) 时,硝酸钠和硝酸钾的
溶解度相等; 时,硝酸钠
的溶解度大于硝酸钾的溶解度;
时,硝酸钠的溶解度小于
硝酸钾的溶解度。
N
M
温度/℃
溶解度\克
t1
t2
0
●
b
●
●
a
两曲线的交点:
表示两物质在交点所示的温度下的溶解度相等;
表示在交点所示的温度下两物质的饱和溶液质量分数相等。
●
c
溶解度曲线含义
曲线下方的点:
不饱和溶液
曲线上方的点:
形成饱和溶液
并有物质剩余。
10
20
曲线上的点:
表示物质在
该点所示温度
下的溶解度。
1.表示某物质在不同温度下的溶解度
2.表示温度的变化对物质溶解度的影响(斜率)
3.比较不同物质在相同温度下或某一温度范围内
溶解度的大小。
4.确定不饱和溶液和饱和溶液相互转化的方法
②
③极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2 。
①大多数固体物质的溶解度随温度的升高而增大,如KNO3 。
少数固体物质的溶解度随温度的升高变化不显著,如NaCl。
溶解度曲线的含义
结晶方法:
冷却热饱和溶液--------溶解度随温度变化较大
蒸发溶剂------溶解度随温度变化较小
粗盐提纯
步骤:
(1)溶解 → (2)过滤 → (3)蒸发
活动与探究
在溶解、过滤、蒸发中都用到了玻璃棒,它的作用分别是什么?
溶解:搅拌,加速固体的溶解;
过滤:引流,防止液体溅出;
蒸发:搅拌,防止液体受热不均匀,液滴飞溅
P69
溶解粗盐/g
蒸发得到的精盐/g
精盐产率/%
产率的计算:
X
2.2
———×100% =
2.2 g
Xg
思考:
1.当打开汽水瓶盖后,为什么常常
有大量气泡冒出?
2.喝汽水以后,为什么会打嗝?
气体溶解度随温度的升高而降低,随压强的增大而增大。
3、气体的溶解度
定义:某气体在一个标准大气压下,一定温度时,溶解在1体积水中达到饱和状态时的气体体积数。
思考:
①能不能用刚凉好的凉白开养鱼?
②给冷水加热的时候,在沸腾以
前,水中为什么会出现很多气泡?
当某物质在一定温度下溶解度为
S时,饱和溶液中有以下关系:
M质表示溶质的质量,
M剂表示溶剂的质量,
M液表示溶液的质量。
*固体物质溶解度的基本计算
练习
1、将某固体物质的不饱和溶液转变
为饱和溶液,最可靠的方法是( )
A、升高温度 B、降低温度
C、加入溶质 D、加入溶剂
C
2、20℃,往50g硝酸钾溶液中加入5g
硝酸钾晶体,充分搅拌后,尚有部分
晶体未溶解,稍加热后,晶体全部溶
解。下列说法正确的是 ( )
A、搅拌后加热前一定是饱和溶液
B、搅拌后加热前一定是不饱和溶液
C、加热后一定是饱和溶液
D、加热后一定是不饱和溶液
A
3、将40℃时的硝酸钾饱和溶液冷却到20℃,在温度变化前后,溶液中保持不变的是( )
A、溶质质量 B、溶液质量
C、溶剂质量 D、溶液浓度
4、在一定温度下,向100g硝酸钾饱和溶液中加入10g硝酸钾晶体后,溶液的质量为( )
A、100g B、90g
C、110g D、无法判断
C
A
5、判断下列语句的正误:
(1)同一种物质的饱和溶液一定比不饱和溶液浓
(2)同一种物质一定温度下的饱和溶液一定比不
饱和溶液中的溶质多。
(3)两种不同溶质的饱和溶液混合,依然是
饱和溶液。
(4)不饱和溶液变为饱和溶液浓度一定变大。
练习:
1、判断下列语句正误:
(1)在20℃时向氯化钠饱和溶液中加入1g氯化
钠,溶液的质量增大;
(2)随水量增大,能溶解的物质增多,所以溶
解度随溶剂量的增大而增大;
(3)将氢氧化钙的不饱和溶液变为饱和溶液,
可用加溶质、降温的方法。
(4)一定温度下,100g氯化钾饱和溶液中有氯
化钾10g,则该温度下氯化钾的溶解度为10g。
2、20℃时,食盐的溶解度为36g。在此温度下,50g水中加入了20g食盐,充分溶解后所形成溶液的质量为 ( )
A、70g B、60g
C、68g D、136g
3、现有60℃的硝酸钾溶液500g,保持温度不变,蒸发掉10g水,则溶液中一定保持不变的是 ( )
A、溶质的质量 B、溶液的质量
C、溶剂的质量 D、硝酸钾的溶解度
4、20℃时,A、B、C三种物质在下述情况恰好形成饱和溶液
(1)0.2gA溶于1g水中;
(2)150gB溶于1000g水中;
(3)50gC溶于300g水中;
其中溶解度最大的是哪种物质?
5、将50g20℃时的饱和硝酸钾溶液蒸干得到12g硝酸钾晶体(不含结晶水),求该温度下硝酸钾的溶解度。
练习:下列说法是否正确?
(1)食盐在水里的溶解度是36g,
(2)20℃时,硝酸钾的溶解度为31.6,
(3)20℃时,50g水中加入18g食盐后溶液恰好饱和,因此,20℃时,食盐在水中的溶解度为18g,
(4)10℃时,100g水里溶解了10g蔗糖, 所以10℃时,蔗糖在水中的溶解度为10g。
