人教版九年级下册化学 9.2溶解度 同步测试(含解析)
文档属性
| 名称 | 人教版九年级下册化学 9.2溶解度 同步测试(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 82.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-03 21:15:23 | ||
图片预览


文档简介
11391900117983009.2溶解度 同步测试
一.选择题
1.下列关于溶液的说法,不正确的是( )
A.溶液各部分性质相同,是一种高级混合物
B.氯化钠的饱和溶液不能再继续溶解氯化钠,但可以继续溶解硝酸钾等其他溶质
C.接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态
D.20℃,氯化钠的溶解度为36g,则20℃时100g氯化钠饱和溶液含有氯化钠36g
2.下列说法正确的是( )
A.饱和溶液是包含其底部未溶解的溶质的混合物
B.一定温度下,100g的食盐饱和溶液中加入3g食盐,用力搅拌后可得到103g食盐溶液
C.一定温度下,向饱和食盐水中加入白糖,白糖不会溶解
D.饱和溶液不一定是浓溶液
3.某温度下,将饱和NaCl溶液取出10g和15g,分别装入甲、乙两支试管中,然后往甲试管中加入5g NaCl固体,充分振荡,则此时甲、乙两支试管里溶液的质量之比为( )
A.1:2 B.2:1 C.2:3 D.无法确定
4.有一杯t℃时的硝酸钾溶液,在该溶液中加入27克硝酸钾晶体,充分搅拌后有11克没有溶解;若将原溶液加热蒸发掉40克水再冷却至原温度,溶液恰好达到饱和,则t℃时硝酸钾的溶解度为( )
A.50 克 B.28 克 C.36克 D.40克
5.氢氧化钙(俗名熟石灰)在不同温度时的溶解度如下表:
温度/℃
0
20
40
60
80
溶解度/g
0.18
0.16
0.14
0.11
0.09
根据表中信息,判断下列说法不正确的是( )
A.氢氧化钙在水中的溶解性是微溶
B.20℃时,氢氧化钙的溶解度为0.16g
C.40℃时,降低氢氧化钙饱和溶液温度会析出溶质
D.60℃时,向50g水中加入0.05g氢氧化钙充分搅拌,固体完全溶解
6.如图所示是A、B两种物质的溶解度曲线。下列说法正确的是( )
A.A物质的溶解度大于B物质
B.A物质中含有少量B物质时,可用蒸发溶剂的方法提纯A物质
C.将t2℃时A物质的不饱和溶液降温到t1℃,溶液一定会变饱和
D.t1℃时,两种物质的饱和溶液中,溶质质量分数一定相等
7.已知20℃时KNO3的溶解度为31.6g。下列关于对它的理解正确的是( )
A.20℃,100g水中最多能溶解31.6g KNO3固体
B.20℃时,100g KNO3溶液中溶解31.6g KNO3固体
C.100g水中溶解了31.6g KNO3固体达到饱和
D.20℃时,31.6g KNO3固体溶于水形成饱和溶液
8.甲、乙两种固体物质的溶解度曲线如图I所示。在常温下,先分别向装有适量甲、乙物质的两支试管里加入等量的蒸馏水,充分振荡后,两支试管底部均有未溶解的固体;再将两支试管放进盛有冰水混合物的烧杯里,如图Ⅱ所示。关于该实验,下列说法中正确的是( )
A.乙溶液中溶质的质量分数减小
B.装有甲物质的试管中剩余的固体减少
C.甲、乙溶液在放入冰水前后均为饱和状态
D.两支试管里剩余的固体都增多
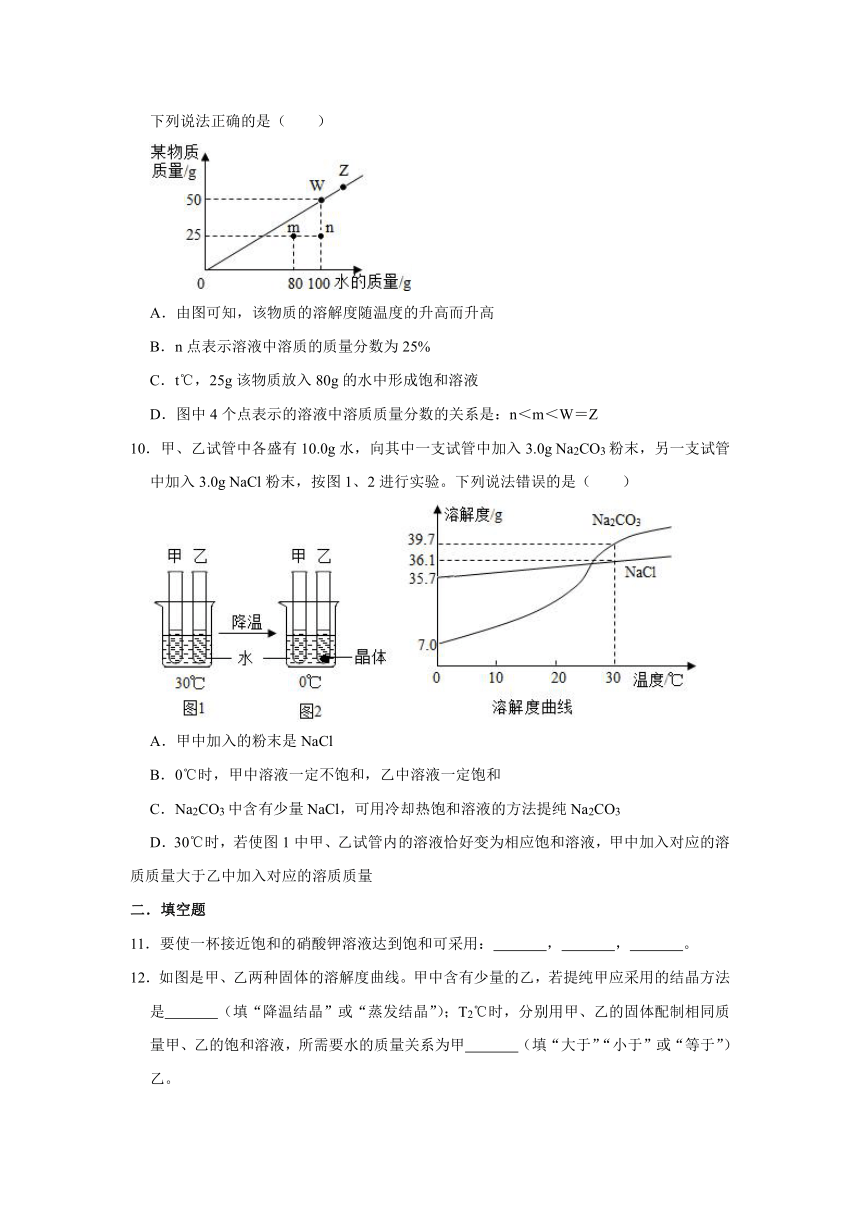
9.t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解的质量绘制成如图中的斜线。下列说法正确的是( )
A.由图可知,该物质的溶解度随温度的升高而升高
B.n点表示溶液中溶质的质量分数为25%
C.t℃,25g该物质放入80g的水中形成饱和溶液
D.图中4个点表示的溶液中溶质质量分数的关系是:n<m<W=Z
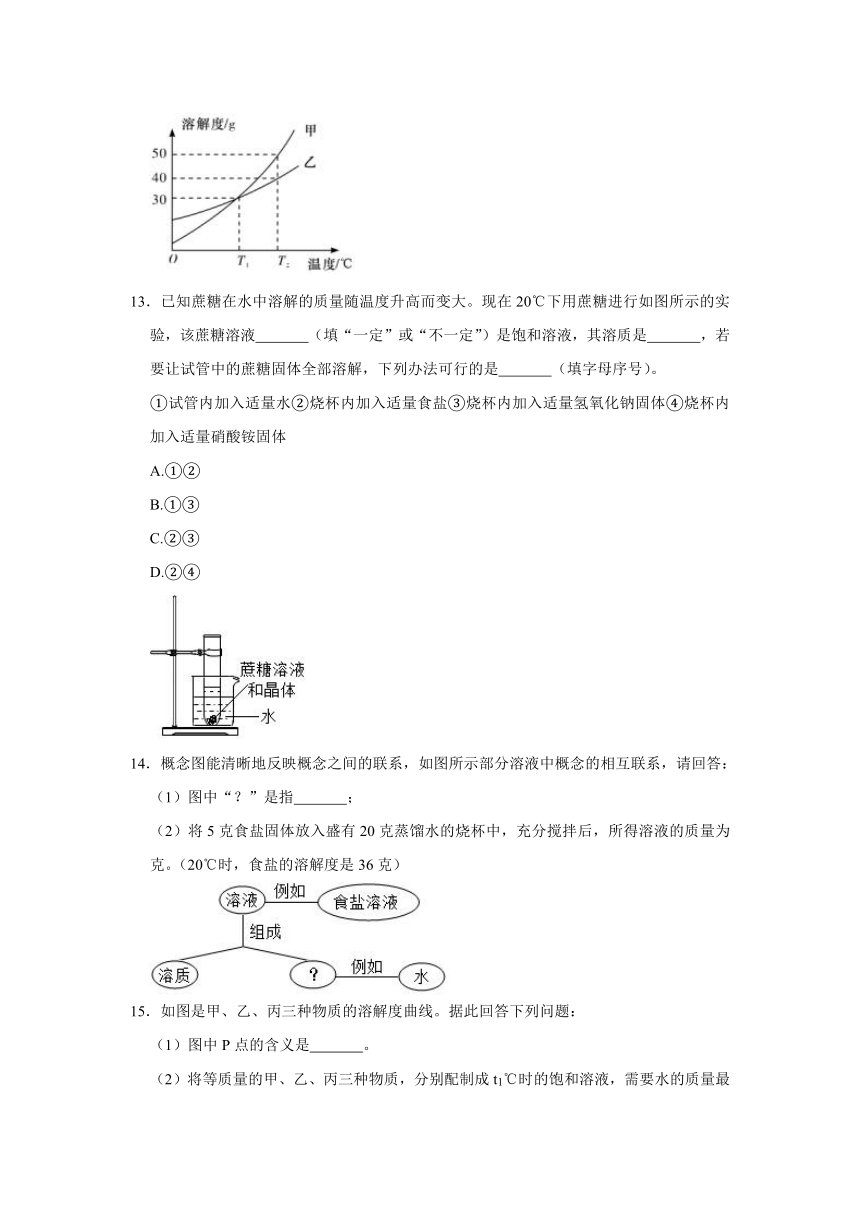
10.甲、乙试管中各盛有10.0g水,向其中一支试管中加入3.0g Na2CO3粉末,另一支试管中加入3.0g NaCl粉末,按图1、2进行实验。下列说法错误的是( )
A.甲中加入的粉末是NaCl
B.0℃时,甲中溶液一定不饱和,乙中溶液一定饱和
C.Na2CO3中含有少量NaCl,可用冷却热饱和溶液的方法提纯Na2CO3
D.30℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
二.填空题
11.要使一杯接近饱和的硝酸钾溶液达到饱和可采用: , , 。
12.如图是甲、乙两种固体的溶解度曲线。甲中含有少量的乙,若提纯甲应采用的结晶方法是 (填“降温结晶”或“蒸发结晶”);T2℃时,分别用甲、乙的固体配制相同质量甲、乙的饱和溶液,所需要水的质量关系为甲 (填“大于”“小于”或“等于”)乙。
13.已知蔗糖在水中溶解的质量随温度升高而变大。现在20℃下用蔗糖进行如图所示的实验,该蔗糖溶液 (填“一定”或“不一定”)是饱和溶液,其溶质是 ,若要让试管中的蔗糖固体全部溶解,下列办法可行的是 (填字母序号)。
①试管内加入适量水②烧杯内加入适量食盐③烧杯内加入适量氢氧化钠固体④烧杯内加入适量硝酸铵固体
A.①②
B.①③
C.②③
D.②④
14.概念图能清晰地反映概念之间的联系,如图所示部分溶液中概念的相互联系,请回答:
(1)图中“?”是指 ;
(2)将5克食盐固体放入盛有20克蒸馏水的烧杯中,充分搅拌后,所得溶液的质量为 克。(20℃时,食盐的溶解度是36克)
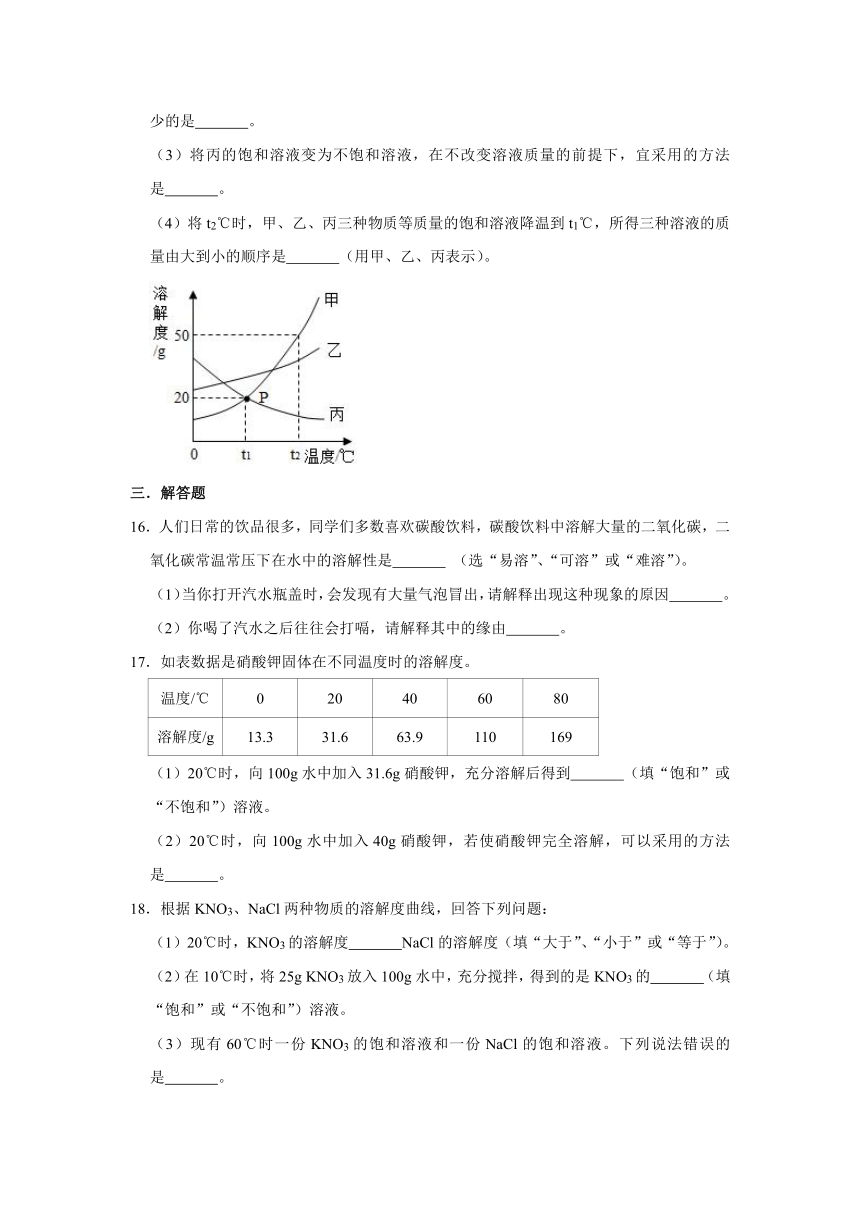
15.如图是甲、乙、丙三种物质的溶解度曲线。据此回答下列问题:
(1)图中P点的含义是 。
(2)将等质量的甲、乙、丙三种物质,分别配制成t1℃时的饱和溶液,需要水的质量最少的是 。
(3)将丙的饱和溶液变为不饱和溶液,在不改变溶液质量的前提下,宜采用的方法是 。
(4)将t2℃时,甲、乙、丙三种物质等质量的饱和溶液降温到t1℃,所得三种溶液的质量由大到小的顺序是 (用甲、乙、丙表示)。
三.解答题
16.人们日常的饮品很多,同学们多数喜欢碳酸饮料,碳酸饮料中溶解大量的二氧化碳,二氧化碳常温常压下在水中的溶解性是 (选“易溶”、“可溶”或“难溶”)。
(1)当你打开汽水瓶盖时,会发现有大量气泡冒出,请解释出现这种现象的原因 。
(2)你喝了汽水之后往往会打嗝,请解释其中的缘由 。
17.如表数据是硝酸钾固体在不同温度时的溶解度。
温度/℃
0
20
40
60
80
溶解度/g
13.3
31.6
63.9
110
169
(1)20℃时,向100g水中加入31.6g硝酸钾,充分溶解后得到 (填“饱和”或“不饱和”)溶液。
(2)20℃时,向100g水中加入40g硝酸钾,若使硝酸钾完全溶解,可以采用的方法是 。
18.根据KNO3、NaCl两种物质的溶解度曲线,回答下列问题:
(1)20℃时,KNO3的溶解度 NaCl的溶解度(填“大于”、“小于”或“等于”)。
(2)在10℃时,将25g KNO3放入100g水中,充分搅拌,得到的是KNO3的 (填“饱和”或“不饱和”)溶液。
(3)现有60℃时一份KNO3的饱和溶液和一份NaCl的饱和溶液。下列说法错误的是 。
A.60℃时,对两份溶液分别恒温蒸发等量溶剂,析出的固体质量相等
B.两份溶液分别升温到80℃,溶质的质量分数不变(不考虑水蒸发)
C.两份溶液分别降温到20℃,析出KNO3的质量大于析出NaCl的质量
参考答案
一.选择题
1.解:A、溶液中各部分性质相同,是一种高级混合物,故A正确;
B、氯化钠的饱和溶液不能再继续溶解氯化钠,但可以继续溶解硝酸钾等其他溶质,故B正确;
C、接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态,故C正确;
D、20℃,氯化钠的溶解度为36g,此时对应的应该是100g水,溶液的质量为136g.所以20℃时100g氯化钠饱和溶液中含有氯化钠的质量小于36g,故D错误。
故选:D。
2.解:A、饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液,不包括其底部未溶解的物质,故选项说法错误。
B、一定温度下,100g的食盐饱和溶液中加入3g食盐,用力搅拌后加入的食盐不溶解,溶液质量仍为100g,故选项说法错误。
C、一定温度下,向饱和食盐水中加入白糖,白糖能溶解,故选项说法错误。
D、饱和溶液与溶液浓稀没有必然的联系,饱和溶液不一定是浓溶液,稀溶液不一定是不饱和溶液,故选项说法正确。
故选:D。
3.解:因为溶液的均一性所以该饱和NaCl溶液不管是10g还是15g,它们的溶质质量分数是相同的;由于饱和溶液特征可知,不管加入多少NaCl固体,它都不会溶解,即溶液中溶剂质量不变,溶质的质量不变,所以甲、乙两支试管里溶液的质量之比=10:15=2:3。
故选:C。
4.解:有一杯t℃时的硝酸钾溶液,在该溶液中加入27克硝酸钾晶体,充分搅拌后有11克没有溶解,说明溶解了16g;若将原溶液加热蒸发掉40克水再冷却至原温度,溶液恰好达到饱和,说明了将16g硝酸钾加入到40克水中,恰好达到饱和,所以设t℃时硝酸钾的溶解度为x=则:x=40克,所以℃时硝酸钾的溶解度为40克。
故选:D。
5.解:A、微溶物质是指20℃溶解度在0.01g~1g之间的物质,20℃时,氢氧化钙的溶解度为0.16g,所以氢氧化钙在水中的溶解性是微溶,故A正确;
B、根据图表可知20℃时,氢氧化钙的溶解度为0.16g,故B正确;
C、氢氧化钙的溶解度随温度的降低而增大,所以40℃时,降低氢氧化钙饱和溶液温度不会析出溶质,故C错误;
D、60℃时氢氧化钙的溶解度为0.11g,即60℃时100g水中最多溶解0.11g氢氧化钙,所以60℃时,向50g水中加入0.05g氢氧化钙充分搅拌,固体完全溶解,故D正确。
故选:C。
6.解:A、A物质的溶解度大于B物质错误,因为没有指明温度;故选项错误;
B、A物质中含有少量B物质时,可用降温结晶的方法提纯A物质,蒸发溶剂的方法提纯A物质错误;故选项错误;
C、将t2℃时A物质的不饱和溶液降温到t1℃,溶液一定会变饱和错误,可能饱和;故选项错误;
D、t1℃时,两种物质的饱和溶液中,溶质质量分数一定相等正确,因为它们有交点;故选项正确;
故选:D。
7.解:A、符合溶解度的定义,故A正确;
B、是131.6克饱和溶液中含有31.6g硝酸钾,故B错误;
C、没有指明温度,故C错误;
D、没有指明溶剂质量,故D错误。
故选:A。
8.解:A、乙物质的溶解度曲线表明,温度降低物质的溶解度变大,所以放入冰水后,随温度降低乙物质的溶解度变大,试管底部固体物质乙继续溶解,溶液的溶质质量分数增大,故A错误;
B、甲物质的溶解度曲线表明,温度降低物质的溶解度减小,所以放入冰水后,随温度降低甲物质的溶解度变小,试管内饱和溶液析出晶体,底部固体物质甲增加,故B错误;
C、甲、乙溶液在放入冰水前后均有未溶解的固体,所以均为饱和状态,故C正确;
D、综合以上A、B两项的分析可得,盛甲物质的试管内固体物质增加,而盛乙物质的试管内固体物质减少,故D错误。
故选:C。
9.解:A、图示表示的是t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解的质量,由图无法确定该物质的溶解度随温度的升高而升高,故选项说法错误。
B、n点表示溶液中溶质为25g,溶剂为100g,溶质的质量分数为×100%=20%,故选项说法错误。
C、t℃,80g水中最多能溶解某物质的质量大于25g,t℃,25g该物质放入80g的水中形成不饱和溶液,故选项说法错误。
D、w、z均是这一温度的饱和溶液,故此溶液溶质质量分数相等,m与n溶质的质量相同,溶剂的质量不同,则n<m,由于温度相同时饱和溶液最浓,可知它们的关系是n<m<w=z,故选项说法正确。
故选:D。
10.解:A、0℃时,碳酸钠的溶解度是7g,所以10g水中可以溶解0.7g,乙烧杯底部有固体剩余,所以甲中加入的粉末是氯化钠,故A正确;
B、通过推导可知,甲是氯化钠,0℃时,氯化钠的溶解度是35.7g,所以甲中溶液一定不饱和,乙中溶液一定饱和,故B正确;
C、碳酸钠的溶解度受温度变化影响较大,所以Na2CO3中含有少量NaCl,可用冷却热饱和溶液的方法提纯碳酸钠,故C正确;
D、30℃时,碳酸钠的溶解度大于氯化钠的溶解度,所以若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量小于乙中加入对应的溶质质量,故D错误。
故选:D。
二.填空题
11.解:硝酸钾的溶解度随温度升高而增大,所以要使一杯接近饱和的硝酸钾溶液达到饱和,常用的方法有:再加入硝酸钾,蒸发水,降低温度。
故答案为:再加入硝酸钾;蒸发水;降低温度。
12.解:甲物质的溶解度受温度变化影响较大,所以甲中含有少量的乙,若提纯甲应采用的结晶方法是:降温结晶;T2℃时,甲物质的溶解度大于乙物质的溶解度,甲物质饱和溶液的质量分数大于乙物质,分别用甲、乙的固体配制相同质量甲、乙的饱和溶液,甲物质的溶质质量大于乙物质,所需要水的质量关系为甲小于乙。
故答案为:降温结晶;小于。
13.解:由图示可知,20℃下蔗糖溶液中有未溶解的蔗糖,所以该蔗糖溶液一定是饱和溶液,其溶质是蔗糖。
①试管内加入适量水,能溶解蔗糖,故符合题意;
②烧杯内加入适量食盐固体,食盐溶于水能量变化不明显,所以不能溶解蔗糖,故不符合题意;
③烧杯内加入适量氢氧化钠固体,氢氧化钠溶于水放出大量的热,蔗糖的溶解度随温度的升高而增大,所以能继续溶解蔗糖,故符合题意;
④烧杯内加入适量硝酸铵固体,硝酸铵溶于水吸热,温度降低,蔗糖的溶解度随温度的升高而增大,所以会析出的蔗糖,故不符合题意。
故答案为:一定; 蔗糖;B。
14.解:(1)溶液包含溶质和溶剂两部分,所以图中“?”是指溶剂;
(2)20℃时,食盐的溶解度是36克,在该温度下,100g水中最多溶解36g食盐,所以20g水中最多溶解7.2g,将5克食盐固体放入盛有20克蒸馏水的烧杯中,全部溶解,所得溶液的质量为:5克+20克=25克。
故答案为:(1)溶剂;
(2)25.
15.解:(1)通过分析溶解度曲线可知,图中P点的含义是t1℃时,甲、丙两种物质的溶解度相等;
(2)t1℃时,乙物质的溶解度最大,所以将等质量的甲、乙、丙三种物质,分别配制成t1℃时的饱和溶液,需要水的质量最少的是乙;
(3)丙物质的溶解度随温度的将而增大,所以将丙的饱和溶液变为不饱和溶液,在不改变溶液质量的前提下,宜采用的方法是降低温度;
(4)将t2℃时,甲、乙、丙三种物质等质量的饱和溶液降温到t1℃,丙物质的溶解度增大,不会析出晶体,甲物质的溶解度受温度变化影响较大,析出较多的晶体,所以所得三种溶液的质量由大到小的顺序是丙>乙>甲。
故答案为:(1)t1℃时,甲、丙两种物质的溶解度相等;
(2)乙;
(3)降低温度;
(4)丙>乙>甲。
三.解答题
16.解:根据二氧化碳的物理性质,二氧化碳常温常压下可溶于水;
(1)汽水是将二氧化碳气体加压之后制成的,打开汽水瓶盖,压强变小,二氧化碳的溶解度减小,故有大量气泡从瓶口逸出,说明了气体的溶解度随压强的减小而减小,气体的溶解度随压强的增大而增大;
(2)喝了汽水以后常常会打嗝,是由于胃内的温度高二氧化碳的溶解度变小而导致的.
故答案为:可溶;(1)打开汽水瓶盖,压强变小,二氧化碳的溶解度减小;(2)温度升高,气体的溶解度减小,气体逸出.
17.解:(1)20℃时硝酸钾溶解度是31.6g,向100g水中加入31.6g硝酸钾,充分溶解后得到饱和溶液。
故填:饱和。
(2)20℃时,向100g水中加入40g硝酸钾,若使硝酸钾完全溶解,可以采用的方法是升高温度,是因为硝酸钾溶解度随着温度升高而增大。
故填:升高温度。
18.解:(1)20℃时,KNO3的溶解度小于NaCl的溶解度;故答案为:小于;
(2)在10℃时,将25gKNO3放入100g水中,充分搅拌,得到的是KNO3的饱和溶液,因为该温度下硝酸钾的溶解度是20g;故答案为:饱和;
(3)A.60℃时,对两份溶液分别恒温蒸发等量溶剂,析出的固体质量不相等,相等错误,因为该温度下,它们的溶解度不同;故选项错误;
B.两份溶液分别升温到80℃,溶质的质量分数不变(不考虑水蒸发)正确,因为KNO3、NaCl两种固体物质的溶解度,都是随温度升高而增大;故选项正确;
C.两份溶液分别降温到20℃,析出KNO3的质量大于析出NaCl的质量错误,因为没有指明溶液的质量;故选项错误;
故答案为:AC。
一.选择题
1.下列关于溶液的说法,不正确的是( )
A.溶液各部分性质相同,是一种高级混合物
B.氯化钠的饱和溶液不能再继续溶解氯化钠,但可以继续溶解硝酸钾等其他溶质
C.接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态
D.20℃,氯化钠的溶解度为36g,则20℃时100g氯化钠饱和溶液含有氯化钠36g
2.下列说法正确的是( )
A.饱和溶液是包含其底部未溶解的溶质的混合物
B.一定温度下,100g的食盐饱和溶液中加入3g食盐,用力搅拌后可得到103g食盐溶液
C.一定温度下,向饱和食盐水中加入白糖,白糖不会溶解
D.饱和溶液不一定是浓溶液
3.某温度下,将饱和NaCl溶液取出10g和15g,分别装入甲、乙两支试管中,然后往甲试管中加入5g NaCl固体,充分振荡,则此时甲、乙两支试管里溶液的质量之比为( )
A.1:2 B.2:1 C.2:3 D.无法确定
4.有一杯t℃时的硝酸钾溶液,在该溶液中加入27克硝酸钾晶体,充分搅拌后有11克没有溶解;若将原溶液加热蒸发掉40克水再冷却至原温度,溶液恰好达到饱和,则t℃时硝酸钾的溶解度为( )
A.50 克 B.28 克 C.36克 D.40克
5.氢氧化钙(俗名熟石灰)在不同温度时的溶解度如下表:
温度/℃
0
20
40
60
80
溶解度/g
0.18
0.16
0.14
0.11
0.09
根据表中信息,判断下列说法不正确的是( )
A.氢氧化钙在水中的溶解性是微溶
B.20℃时,氢氧化钙的溶解度为0.16g
C.40℃时,降低氢氧化钙饱和溶液温度会析出溶质
D.60℃时,向50g水中加入0.05g氢氧化钙充分搅拌,固体完全溶解
6.如图所示是A、B两种物质的溶解度曲线。下列说法正确的是( )
A.A物质的溶解度大于B物质
B.A物质中含有少量B物质时,可用蒸发溶剂的方法提纯A物质
C.将t2℃时A物质的不饱和溶液降温到t1℃,溶液一定会变饱和
D.t1℃时,两种物质的饱和溶液中,溶质质量分数一定相等
7.已知20℃时KNO3的溶解度为31.6g。下列关于对它的理解正确的是( )
A.20℃,100g水中最多能溶解31.6g KNO3固体
B.20℃时,100g KNO3溶液中溶解31.6g KNO3固体
C.100g水中溶解了31.6g KNO3固体达到饱和
D.20℃时,31.6g KNO3固体溶于水形成饱和溶液
8.甲、乙两种固体物质的溶解度曲线如图I所示。在常温下,先分别向装有适量甲、乙物质的两支试管里加入等量的蒸馏水,充分振荡后,两支试管底部均有未溶解的固体;再将两支试管放进盛有冰水混合物的烧杯里,如图Ⅱ所示。关于该实验,下列说法中正确的是( )
A.乙溶液中溶质的质量分数减小
B.装有甲物质的试管中剩余的固体减少
C.甲、乙溶液在放入冰水前后均为饱和状态
D.两支试管里剩余的固体都增多
9.t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解的质量绘制成如图中的斜线。下列说法正确的是( )
A.由图可知,该物质的溶解度随温度的升高而升高
B.n点表示溶液中溶质的质量分数为25%
C.t℃,25g该物质放入80g的水中形成饱和溶液
D.图中4个点表示的溶液中溶质质量分数的关系是:n<m<W=Z
10.甲、乙试管中各盛有10.0g水,向其中一支试管中加入3.0g Na2CO3粉末,另一支试管中加入3.0g NaCl粉末,按图1、2进行实验。下列说法错误的是( )
A.甲中加入的粉末是NaCl
B.0℃时,甲中溶液一定不饱和,乙中溶液一定饱和
C.Na2CO3中含有少量NaCl,可用冷却热饱和溶液的方法提纯Na2CO3
D.30℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
二.填空题
11.要使一杯接近饱和的硝酸钾溶液达到饱和可采用: , , 。
12.如图是甲、乙两种固体的溶解度曲线。甲中含有少量的乙,若提纯甲应采用的结晶方法是 (填“降温结晶”或“蒸发结晶”);T2℃时,分别用甲、乙的固体配制相同质量甲、乙的饱和溶液,所需要水的质量关系为甲 (填“大于”“小于”或“等于”)乙。
13.已知蔗糖在水中溶解的质量随温度升高而变大。现在20℃下用蔗糖进行如图所示的实验,该蔗糖溶液 (填“一定”或“不一定”)是饱和溶液,其溶质是 ,若要让试管中的蔗糖固体全部溶解,下列办法可行的是 (填字母序号)。
①试管内加入适量水②烧杯内加入适量食盐③烧杯内加入适量氢氧化钠固体④烧杯内加入适量硝酸铵固体
A.①②
B.①③
C.②③
D.②④
14.概念图能清晰地反映概念之间的联系,如图所示部分溶液中概念的相互联系,请回答:
(1)图中“?”是指 ;
(2)将5克食盐固体放入盛有20克蒸馏水的烧杯中,充分搅拌后,所得溶液的质量为 克。(20℃时,食盐的溶解度是36克)
15.如图是甲、乙、丙三种物质的溶解度曲线。据此回答下列问题:
(1)图中P点的含义是 。
(2)将等质量的甲、乙、丙三种物质,分别配制成t1℃时的饱和溶液,需要水的质量最少的是 。
(3)将丙的饱和溶液变为不饱和溶液,在不改变溶液质量的前提下,宜采用的方法是 。
(4)将t2℃时,甲、乙、丙三种物质等质量的饱和溶液降温到t1℃,所得三种溶液的质量由大到小的顺序是 (用甲、乙、丙表示)。
三.解答题
16.人们日常的饮品很多,同学们多数喜欢碳酸饮料,碳酸饮料中溶解大量的二氧化碳,二氧化碳常温常压下在水中的溶解性是 (选“易溶”、“可溶”或“难溶”)。
(1)当你打开汽水瓶盖时,会发现有大量气泡冒出,请解释出现这种现象的原因 。
(2)你喝了汽水之后往往会打嗝,请解释其中的缘由 。
17.如表数据是硝酸钾固体在不同温度时的溶解度。
温度/℃
0
20
40
60
80
溶解度/g
13.3
31.6
63.9
110
169
(1)20℃时,向100g水中加入31.6g硝酸钾,充分溶解后得到 (填“饱和”或“不饱和”)溶液。
(2)20℃时,向100g水中加入40g硝酸钾,若使硝酸钾完全溶解,可以采用的方法是 。
18.根据KNO3、NaCl两种物质的溶解度曲线,回答下列问题:
(1)20℃时,KNO3的溶解度 NaCl的溶解度(填“大于”、“小于”或“等于”)。
(2)在10℃时,将25g KNO3放入100g水中,充分搅拌,得到的是KNO3的 (填“饱和”或“不饱和”)溶液。
(3)现有60℃时一份KNO3的饱和溶液和一份NaCl的饱和溶液。下列说法错误的是 。
A.60℃时,对两份溶液分别恒温蒸发等量溶剂,析出的固体质量相等
B.两份溶液分别升温到80℃,溶质的质量分数不变(不考虑水蒸发)
C.两份溶液分别降温到20℃,析出KNO3的质量大于析出NaCl的质量
参考答案
一.选择题
1.解:A、溶液中各部分性质相同,是一种高级混合物,故A正确;
B、氯化钠的饱和溶液不能再继续溶解氯化钠,但可以继续溶解硝酸钾等其他溶质,故B正确;
C、接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态,故C正确;
D、20℃,氯化钠的溶解度为36g,此时对应的应该是100g水,溶液的质量为136g.所以20℃时100g氯化钠饱和溶液中含有氯化钠的质量小于36g,故D错误。
故选:D。
2.解:A、饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液,不包括其底部未溶解的物质,故选项说法错误。
B、一定温度下,100g的食盐饱和溶液中加入3g食盐,用力搅拌后加入的食盐不溶解,溶液质量仍为100g,故选项说法错误。
C、一定温度下,向饱和食盐水中加入白糖,白糖能溶解,故选项说法错误。
D、饱和溶液与溶液浓稀没有必然的联系,饱和溶液不一定是浓溶液,稀溶液不一定是不饱和溶液,故选项说法正确。
故选:D。
3.解:因为溶液的均一性所以该饱和NaCl溶液不管是10g还是15g,它们的溶质质量分数是相同的;由于饱和溶液特征可知,不管加入多少NaCl固体,它都不会溶解,即溶液中溶剂质量不变,溶质的质量不变,所以甲、乙两支试管里溶液的质量之比=10:15=2:3。
故选:C。
4.解:有一杯t℃时的硝酸钾溶液,在该溶液中加入27克硝酸钾晶体,充分搅拌后有11克没有溶解,说明溶解了16g;若将原溶液加热蒸发掉40克水再冷却至原温度,溶液恰好达到饱和,说明了将16g硝酸钾加入到40克水中,恰好达到饱和,所以设t℃时硝酸钾的溶解度为x=则:x=40克,所以℃时硝酸钾的溶解度为40克。
故选:D。
5.解:A、微溶物质是指20℃溶解度在0.01g~1g之间的物质,20℃时,氢氧化钙的溶解度为0.16g,所以氢氧化钙在水中的溶解性是微溶,故A正确;
B、根据图表可知20℃时,氢氧化钙的溶解度为0.16g,故B正确;
C、氢氧化钙的溶解度随温度的降低而增大,所以40℃时,降低氢氧化钙饱和溶液温度不会析出溶质,故C错误;
D、60℃时氢氧化钙的溶解度为0.11g,即60℃时100g水中最多溶解0.11g氢氧化钙,所以60℃时,向50g水中加入0.05g氢氧化钙充分搅拌,固体完全溶解,故D正确。
故选:C。
6.解:A、A物质的溶解度大于B物质错误,因为没有指明温度;故选项错误;
B、A物质中含有少量B物质时,可用降温结晶的方法提纯A物质,蒸发溶剂的方法提纯A物质错误;故选项错误;
C、将t2℃时A物质的不饱和溶液降温到t1℃,溶液一定会变饱和错误,可能饱和;故选项错误;
D、t1℃时,两种物质的饱和溶液中,溶质质量分数一定相等正确,因为它们有交点;故选项正确;
故选:D。
7.解:A、符合溶解度的定义,故A正确;
B、是131.6克饱和溶液中含有31.6g硝酸钾,故B错误;
C、没有指明温度,故C错误;
D、没有指明溶剂质量,故D错误。
故选:A。
8.解:A、乙物质的溶解度曲线表明,温度降低物质的溶解度变大,所以放入冰水后,随温度降低乙物质的溶解度变大,试管底部固体物质乙继续溶解,溶液的溶质质量分数增大,故A错误;
B、甲物质的溶解度曲线表明,温度降低物质的溶解度减小,所以放入冰水后,随温度降低甲物质的溶解度变小,试管内饱和溶液析出晶体,底部固体物质甲增加,故B错误;
C、甲、乙溶液在放入冰水前后均有未溶解的固体,所以均为饱和状态,故C正确;
D、综合以上A、B两项的分析可得,盛甲物质的试管内固体物质增加,而盛乙物质的试管内固体物质减少,故D错误。
故选:C。
9.解:A、图示表示的是t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解的质量,由图无法确定该物质的溶解度随温度的升高而升高,故选项说法错误。
B、n点表示溶液中溶质为25g,溶剂为100g,溶质的质量分数为×100%=20%,故选项说法错误。
C、t℃,80g水中最多能溶解某物质的质量大于25g,t℃,25g该物质放入80g的水中形成不饱和溶液,故选项说法错误。
D、w、z均是这一温度的饱和溶液,故此溶液溶质质量分数相等,m与n溶质的质量相同,溶剂的质量不同,则n<m,由于温度相同时饱和溶液最浓,可知它们的关系是n<m<w=z,故选项说法正确。
故选:D。
10.解:A、0℃时,碳酸钠的溶解度是7g,所以10g水中可以溶解0.7g,乙烧杯底部有固体剩余,所以甲中加入的粉末是氯化钠,故A正确;
B、通过推导可知,甲是氯化钠,0℃时,氯化钠的溶解度是35.7g,所以甲中溶液一定不饱和,乙中溶液一定饱和,故B正确;
C、碳酸钠的溶解度受温度变化影响较大,所以Na2CO3中含有少量NaCl,可用冷却热饱和溶液的方法提纯碳酸钠,故C正确;
D、30℃时,碳酸钠的溶解度大于氯化钠的溶解度,所以若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量小于乙中加入对应的溶质质量,故D错误。
故选:D。
二.填空题
11.解:硝酸钾的溶解度随温度升高而增大,所以要使一杯接近饱和的硝酸钾溶液达到饱和,常用的方法有:再加入硝酸钾,蒸发水,降低温度。
故答案为:再加入硝酸钾;蒸发水;降低温度。
12.解:甲物质的溶解度受温度变化影响较大,所以甲中含有少量的乙,若提纯甲应采用的结晶方法是:降温结晶;T2℃时,甲物质的溶解度大于乙物质的溶解度,甲物质饱和溶液的质量分数大于乙物质,分别用甲、乙的固体配制相同质量甲、乙的饱和溶液,甲物质的溶质质量大于乙物质,所需要水的质量关系为甲小于乙。
故答案为:降温结晶;小于。
13.解:由图示可知,20℃下蔗糖溶液中有未溶解的蔗糖,所以该蔗糖溶液一定是饱和溶液,其溶质是蔗糖。
①试管内加入适量水,能溶解蔗糖,故符合题意;
②烧杯内加入适量食盐固体,食盐溶于水能量变化不明显,所以不能溶解蔗糖,故不符合题意;
③烧杯内加入适量氢氧化钠固体,氢氧化钠溶于水放出大量的热,蔗糖的溶解度随温度的升高而增大,所以能继续溶解蔗糖,故符合题意;
④烧杯内加入适量硝酸铵固体,硝酸铵溶于水吸热,温度降低,蔗糖的溶解度随温度的升高而增大,所以会析出的蔗糖,故不符合题意。
故答案为:一定; 蔗糖;B。
14.解:(1)溶液包含溶质和溶剂两部分,所以图中“?”是指溶剂;
(2)20℃时,食盐的溶解度是36克,在该温度下,100g水中最多溶解36g食盐,所以20g水中最多溶解7.2g,将5克食盐固体放入盛有20克蒸馏水的烧杯中,全部溶解,所得溶液的质量为:5克+20克=25克。
故答案为:(1)溶剂;
(2)25.
15.解:(1)通过分析溶解度曲线可知,图中P点的含义是t1℃时,甲、丙两种物质的溶解度相等;
(2)t1℃时,乙物质的溶解度最大,所以将等质量的甲、乙、丙三种物质,分别配制成t1℃时的饱和溶液,需要水的质量最少的是乙;
(3)丙物质的溶解度随温度的将而增大,所以将丙的饱和溶液变为不饱和溶液,在不改变溶液质量的前提下,宜采用的方法是降低温度;
(4)将t2℃时,甲、乙、丙三种物质等质量的饱和溶液降温到t1℃,丙物质的溶解度增大,不会析出晶体,甲物质的溶解度受温度变化影响较大,析出较多的晶体,所以所得三种溶液的质量由大到小的顺序是丙>乙>甲。
故答案为:(1)t1℃时,甲、丙两种物质的溶解度相等;
(2)乙;
(3)降低温度;
(4)丙>乙>甲。
三.解答题
16.解:根据二氧化碳的物理性质,二氧化碳常温常压下可溶于水;
(1)汽水是将二氧化碳气体加压之后制成的,打开汽水瓶盖,压强变小,二氧化碳的溶解度减小,故有大量气泡从瓶口逸出,说明了气体的溶解度随压强的减小而减小,气体的溶解度随压强的增大而增大;
(2)喝了汽水以后常常会打嗝,是由于胃内的温度高二氧化碳的溶解度变小而导致的.
故答案为:可溶;(1)打开汽水瓶盖,压强变小,二氧化碳的溶解度减小;(2)温度升高,气体的溶解度减小,气体逸出.
17.解:(1)20℃时硝酸钾溶解度是31.6g,向100g水中加入31.6g硝酸钾,充分溶解后得到饱和溶液。
故填:饱和。
(2)20℃时,向100g水中加入40g硝酸钾,若使硝酸钾完全溶解,可以采用的方法是升高温度,是因为硝酸钾溶解度随着温度升高而增大。
故填:升高温度。
18.解:(1)20℃时,KNO3的溶解度小于NaCl的溶解度;故答案为:小于;
(2)在10℃时,将25gKNO3放入100g水中,充分搅拌,得到的是KNO3的饱和溶液,因为该温度下硝酸钾的溶解度是20g;故答案为:饱和;
(3)A.60℃时,对两份溶液分别恒温蒸发等量溶剂,析出的固体质量不相等,相等错误,因为该温度下,它们的溶解度不同;故选项错误;
B.两份溶液分别升温到80℃,溶质的质量分数不变(不考虑水蒸发)正确,因为KNO3、NaCl两种固体物质的溶解度,都是随温度升高而增大;故选项正确;
C.两份溶液分别降温到20℃,析出KNO3的质量大于析出NaCl的质量错误,因为没有指明溶液的质量;故选项错误;
故答案为:AC。
同课章节目录
