离子键
图片预览



文档简介
(共10张PPT)
化学键与分子结构
第一课时离子键
一、化学键
2、分类
1、定义
相邻的原子间的强烈的相互作用。
(1)要是相邻的原子间的
(2)这种作用很强烈
化学键
离子键
共价键
金属键
极性共价键
非极性共价键
注意:
钠在氯气中燃烧
观看视频
有何现象
产生这种剧烈反应现象的原因
1、剧烈反应
2、产生白烟
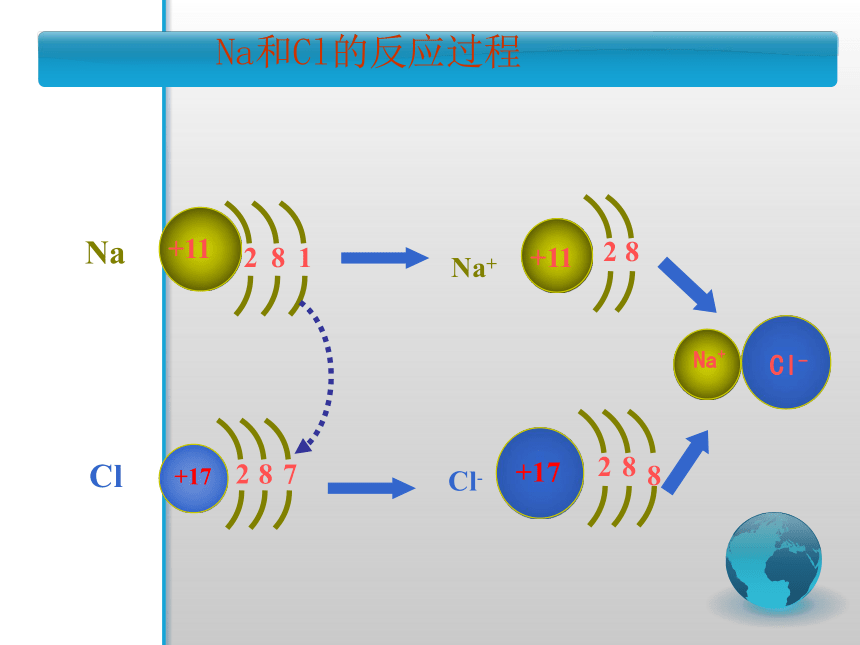
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
Na和Cl的反应过程
+11
8
2
+17
8
8
2
Na+
Cl-
二、离子键
1、定义
要点:
由阴阳离子间通过静电作用所形成的化学键叫离子键。
1、成键微粒:阴阳离子
2、相互作用:静电作用(静电引力和斥力)
3、成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
2、特征
(1)没有方向性
(2)没有饱和性
三、 离子化合物
1、定义
2、判断
含有离子键的化合物就是离子化合物。
a.活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)形成的化合物。
如:KCl、Na2O、Na2S、MgCl2等(除AlCl3)
b.强碱、大部分金属氧化物 、大部分盐:
如:NaOH、KOH、
MgO、Na2O2、
K2SO4、Na2CO3、Mg(NO3)2
NH4Cl、(NH4)2SO4、(NH4)2S等
四、电子式
1、含义
在元素符号周围用小黑点(或×)来表示原子的最外层电子的式子叫做电子式。
2、写法
原子:
H
O
Cl
Mg
Na
离子:
Mg
2
Cl
O
2-
Na
离子化合物:
Cl
Na
Na
O
2-
Na
Cl
Mg
2
Cl
AB型
A2B型
AB2型
五、用电子式表示物质的形成过程:
练习:
用电子式表示Na2O、 MgF2的形成过程
S
K
K
S
2-
K
K
Cl
Mg
Cl
Mg
2
Cl
Cl
注意:离子符号; 阴离子要加括号; 不写”=”; 不合写。
阴离子
阳离子
用电子式表示
离子晶体
离子化合物
活泼金属原子
活泼非金属原子
失去电子
得到电子
静电作用
离子键
本节课小结:
课后思考
1、在氯化钠晶体中,Na+和Cl- 间存在哪些力?
Na+离子和Cl-离子间的静电相互吸引作用
不可能!因阴阳离子接近到某一定距离时,
吸引和排斥作用达到平衡,阴阳离子间形成
稳定的化学键。
2、阴阳离子结合在一起,彼此电荷是否会中和呢?
阴阳离子间电子与电子、原子核与原子核间的相互排斥作用
化学键与分子结构
第一课时离子键
一、化学键
2、分类
1、定义
相邻的原子间的强烈的相互作用。
(1)要是相邻的原子间的
(2)这种作用很强烈
化学键
离子键
共价键
金属键
极性共价键
非极性共价键
注意:
钠在氯气中燃烧
观看视频
有何现象
产生这种剧烈反应现象的原因
1、剧烈反应
2、产生白烟
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
Na和Cl的反应过程
+11
8
2
+17
8
8
2
Na+
Cl-
二、离子键
1、定义
要点:
由阴阳离子间通过静电作用所形成的化学键叫离子键。
1、成键微粒:阴阳离子
2、相互作用:静电作用(静电引力和斥力)
3、成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
2、特征
(1)没有方向性
(2)没有饱和性
三、 离子化合物
1、定义
2、判断
含有离子键的化合物就是离子化合物。
a.活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)形成的化合物。
如:KCl、Na2O、Na2S、MgCl2等(除AlCl3)
b.强碱、大部分金属氧化物 、大部分盐:
如:NaOH、KOH、
MgO、Na2O2、
K2SO4、Na2CO3、Mg(NO3)2
NH4Cl、(NH4)2SO4、(NH4)2S等
四、电子式
1、含义
在元素符号周围用小黑点(或×)来表示原子的最外层电子的式子叫做电子式。
2、写法
原子:
H
O
Cl
Mg
Na
离子:
Mg
2
Cl
O
2-
Na
离子化合物:
Cl
Na
Na
O
2-
Na
Cl
Mg
2
Cl
AB型
A2B型
AB2型
五、用电子式表示物质的形成过程:
练习:
用电子式表示Na2O、 MgF2的形成过程
S
K
K
S
2-
K
K
Cl
Mg
Cl
Mg
2
Cl
Cl
注意:离子符号; 阴离子要加括号; 不写”=”; 不合写。
阴离子
阳离子
用电子式表示
离子晶体
离子化合物
活泼金属原子
活泼非金属原子
失去电子
得到电子
静电作用
离子键
本节课小结:
课后思考
1、在氯化钠晶体中,Na+和Cl- 间存在哪些力?
Na+离子和Cl-离子间的静电相互吸引作用
不可能!因阴阳离子接近到某一定距离时,
吸引和排斥作用达到平衡,阴阳离子间形成
稳定的化学键。
2、阴阳离子结合在一起,彼此电荷是否会中和呢?
阴阳离子间电子与电子、原子核与原子核间的相互排斥作用
