晶体的基本类型课件
图片预览



文档简介
(共17张PPT)
3、化学键与分子结构
3.4晶体的基本类型
一、固体分类
晶体
非晶体
分类
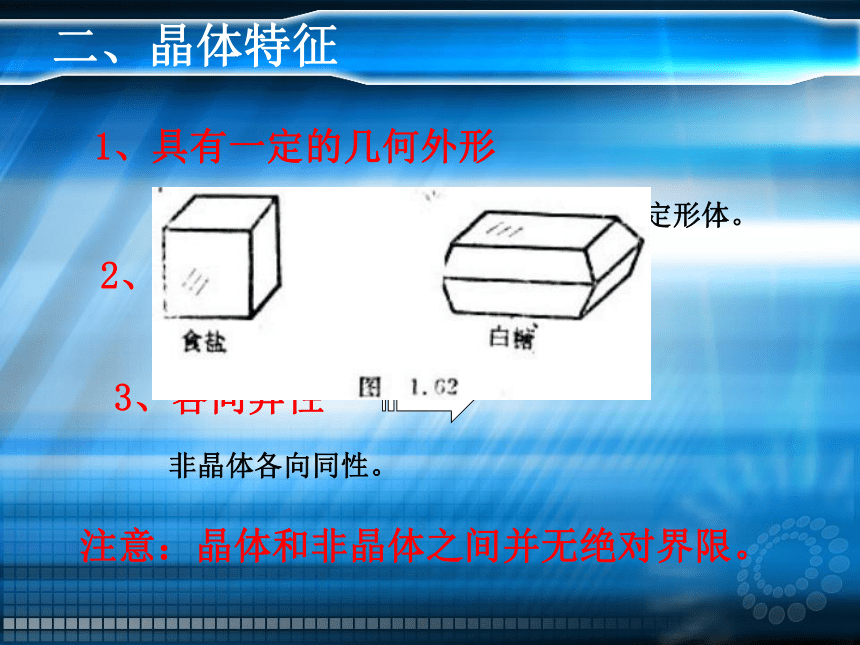
二、晶体特征
1、具有一定的几何外形
2、有固定的熔点
3、各向异性
非晶体没有固定熔点。
非晶体没有一定的几何外形,所以叫无定形体。
非晶体各向同性。
注意:晶体和非晶体之间并无绝对界限。
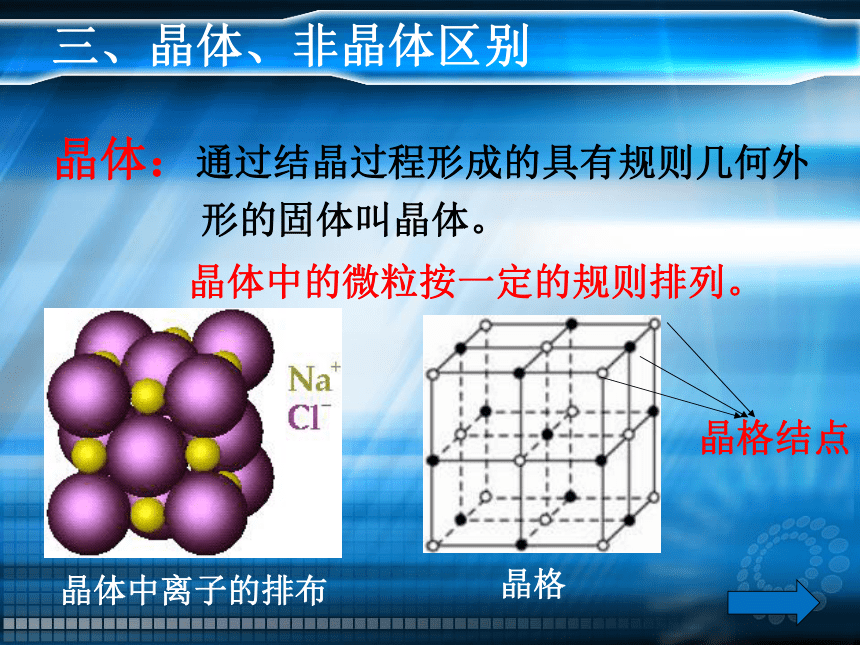
三、晶体、非晶体区别
晶体:通过结晶过程形成的具有规则几何外
形的固体叫晶体。
晶体中的微粒按一定的规则排列。
晶体中离子的排布
晶格
晶格结点
四、晶体的类型
1、离子晶体
2、原子晶体
3、分子晶体
4、金属晶体
离子晶体
1、定义:晶格结点上交替排列着阴阳离子,
两者之间通过离子键结合而成形成
的晶体。
举例
2、特点:
熔沸点较高,硬度较大,难挥发缩。
多数易溶于水,水溶液或者熔融状态下均导电。
原子晶体
1、定义:晶格结点上排列着原子,原子间以
共价键结合而成的晶体。举例
2、特点:
熔沸点很高,硬度很大,延展性较差,不溶于溶剂,一般不导电。
但某些原子晶体:硅,锗,镓,砷可作为优良的半导体材料。
3、常见原子晶体:金刚石(C)、单晶硅(Si)、
金刚砂(SiC)、石英(SiO2)等。
金刚石的晶体结构
金刚石晶体结构模型
分子晶体
1、定义:晶格结点上排列着分子,分子间以
分子间作用力结合而成的晶体。举例
2、特点:
熔沸点很低,硬度很小,挥发性大,不导电,
五、晶体类型的判断
从组成上判断:
从性质上判断:
有无金属离子?(有:则多数为离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
熔沸点和硬度;(高:原子晶体;较高:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:离子晶体)
三种晶体的比较
晶体类型 离子晶体 分子晶体 原子晶体
微粒
作用力
硬度
熔沸点
导电性
典型实例
阴、阳离子
分子
原子
离子键
范德华力
共价键
较大
较小
很大
较高
低
很高
溶于水或熔融态下均导电
熔融态不导电
不导电
NaOH、AgCl、Na2O等
HCl、Cl2、CO2、He、P4、S等
金刚石、碳化硅、刚玉、晶体硅等
【反馈练习】
1.下列物质中,属于离子晶体的是________;含共价键的离子晶体是_______。
KBr、NaOH、HCl、CO2 、NH4Cl、I2
2.下列说法正确的是( )
A.离子晶体中只含离子键
B.不同元素组成的多原子分子里的化学
键一定是极性键
C.共价化合物分子里一定不含离子键
D.非极性键只存在于双原子单质分子里
结束
2、分析下列物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;________________
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电;________________
C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
D、物质A,无色晶体,熔融时或溶于水中都能导电_____________
结束
CO2的晶体结构
石墨的晶体结构
3、化学键与分子结构
3.4晶体的基本类型
一、固体分类
晶体
非晶体
分类
二、晶体特征
1、具有一定的几何外形
2、有固定的熔点
3、各向异性
非晶体没有固定熔点。
非晶体没有一定的几何外形,所以叫无定形体。
非晶体各向同性。
注意:晶体和非晶体之间并无绝对界限。
三、晶体、非晶体区别
晶体:通过结晶过程形成的具有规则几何外
形的固体叫晶体。
晶体中的微粒按一定的规则排列。
晶体中离子的排布
晶格
晶格结点
四、晶体的类型
1、离子晶体
2、原子晶体
3、分子晶体
4、金属晶体
离子晶体
1、定义:晶格结点上交替排列着阴阳离子,
两者之间通过离子键结合而成形成
的晶体。
举例
2、特点:
熔沸点较高,硬度较大,难挥发缩。
多数易溶于水,水溶液或者熔融状态下均导电。
原子晶体
1、定义:晶格结点上排列着原子,原子间以
共价键结合而成的晶体。举例
2、特点:
熔沸点很高,硬度很大,延展性较差,不溶于溶剂,一般不导电。
但某些原子晶体:硅,锗,镓,砷可作为优良的半导体材料。
3、常见原子晶体:金刚石(C)、单晶硅(Si)、
金刚砂(SiC)、石英(SiO2)等。
金刚石的晶体结构
金刚石晶体结构模型
分子晶体
1、定义:晶格结点上排列着分子,分子间以
分子间作用力结合而成的晶体。举例
2、特点:
熔沸点很低,硬度很小,挥发性大,不导电,
五、晶体类型的判断
从组成上判断:
从性质上判断:
有无金属离子?(有:则多数为离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
熔沸点和硬度;(高:原子晶体;较高:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:离子晶体)
三种晶体的比较
晶体类型 离子晶体 分子晶体 原子晶体
微粒
作用力
硬度
熔沸点
导电性
典型实例
阴、阳离子
分子
原子
离子键
范德华力
共价键
较大
较小
很大
较高
低
很高
溶于水或熔融态下均导电
熔融态不导电
不导电
NaOH、AgCl、Na2O等
HCl、Cl2、CO2、He、P4、S等
金刚石、碳化硅、刚玉、晶体硅等
【反馈练习】
1.下列物质中,属于离子晶体的是________;含共价键的离子晶体是_______。
KBr、NaOH、HCl、CO2 、NH4Cl、I2
2.下列说法正确的是( )
A.离子晶体中只含离子键
B.不同元素组成的多原子分子里的化学
键一定是极性键
C.共价化合物分子里一定不含离子键
D.非极性键只存在于双原子单质分子里
结束
2、分析下列物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;________________
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电;________________
C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
D、物质A,无色晶体,熔融时或溶于水中都能导电_____________
结束
CO2的晶体结构
石墨的晶体结构
