湖北省十堰市第二中学2011-2012学年高二上期中考试(化学)
文档属性
| 名称 | 湖北省十堰市第二中学2011-2012学年高二上期中考试(化学) |  | |
| 格式 | zip | ||
| 文件大小 | 222.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-23 09:07:51 | ||
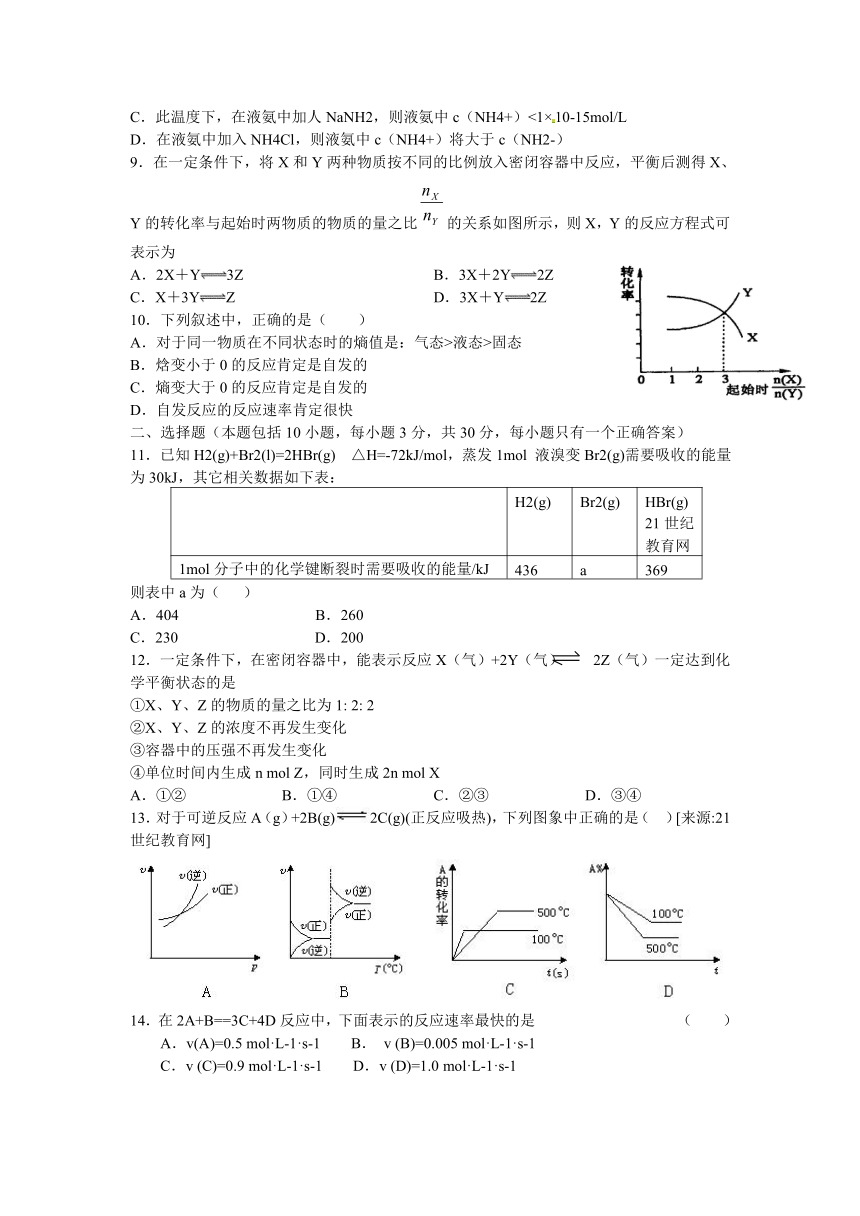
图片预览

文档简介
十堰市第二中学2011——2012学年高二上学期期中考试 化学试题
分值 100 考试时间 90分钟
命题人 汤佐良 全文娟 审核人 张健 2011-11-01
说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。选择题答案写在答题卡上。
第I卷(共计50分)
一、选择题(本题包括10小题,每小题2分,共20分,每小题只有一个正确答案)
1.下列有关说法,正确的是
A.电解质溶于水一定放出热量
B.在一个确定的化学反应中,反应物总能量总是高于生成物总能量
C.可逆反应在加热时正逆反应速率都增大
D.在25℃时,0.01mol/L的氢氧化钠溶液中,水电离的c(H+)与水电离的c(OH-)的积为10-14
2.关于强、弱电解质的叙述不正确的是
A.强电解质在溶液中完全电离,不存在电离平衡
B.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
C.同一弱电解质同浓度的溶液,温度不同时,导电能力不同
D.强电解质在固态或液态时,可能不导电21世纪教育网
3.已知:H2(g)+F2(g)== 2HF(g) △H=-270kJ/mol,下列说法正确的是
A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量21世纪教育网
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ热量
4.关于中和热测定实验的下列说法不正确的是( )
A. 烧杯间填满碎泡沫塑料是减少实验过程中的热量损失
B. 使用环形玻璃棒既可以搅拌又避免损坏温度计
C.向盛装酸的烧杯中加碱时要小心缓慢
D.测了酸后的温度计要用水清洗后再测碱的温度
5.有三支试管,在同温下分别加入下列物质后
甲:10mL 0.01mol·L-1 FeCl3溶液 和10 mL 0.01 mol·L-1 KSCN溶液
乙:5mL水10mL 0.01mol·L-1 FeCl3溶液 5mL 0.01mol·L-1 KSCN溶液
丙:10mL 0.1mol·L-1 FeCl3溶液 和10mL 0.1mol·L-1 KSCN溶液
观察这三支试管的颜色,其中颜色最浅的是
A.甲试管 B.乙试管 C.丙试管 D.无法判断
6.将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液PH的变化是
A.前者减少后者不变 B.前者减小后者增大 C.都不变 D.都减小
7.下列不能减慢锌与稀盐酸的反应速率的措施是
A.降低温度 B.加入氯化钠溶液
C.加入少量CH3COONa固体 D.增大锌的用量
8.液氨与水相似,存在着微弱的电离:2NH3NH4++NH2-。-50℃时,两种离子的平衡浓度均为1×10-15mol/L,下列有关液氨的离子积及其电离平衡的叙述中错误的是
A.此温度下,液氨的离子积等于1×10-30
B.在液氨中放人NaNH2,则液氨的离子积数值将增大
C.此温度下,在液氨中加人NaNH2,则液氨中c(NH4+)<1×10-15mol/L
D.在液氨中加入NH4Cl,则液氨中c(NH4+)将大于c(NH2-)
9.在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,平衡后测得X、Y的转化率与起始时两物质的物质的量之比的关系如图所示,则X,Y的反应方程式可表示为
A.2X+Y3Z B.3X+2Y2Z
C.X+3YZ D.3X+Y2Z
10.下列叙述中,正确的是( )
A.对于同一物质在不同状态时的熵值是:气态>液态>固态
B.焓变小于0的反应肯定是自发的
C.熵变大于0的反应肯定是自发的
D.自发反应的反应速率肯定很快
二、选择题(本题包括10小题,每小题3分,共30分,每小题只有一个正确答案)
11.已知H2(g)+Br2(l)=2HBr(g) △H=-72kJ/mol,蒸发1mol 液溴变Br2(g)需要吸收的能量为30kJ,其它相关数据如下表:
H2(g) Br2(g) HBr(g)21世纪教育网
1mol分子中的化学键断裂时需要吸收的能量/kJ 436 a 369
则表中a为( )
A.404 B.260
C.230 D.200
12.一定条件下,在密闭容器中,能表示反应X(气)+2Y(气) 2Z(气)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1: 2: 2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol X
A.①② B.①④ C.②③ D.③④
13.对于可逆反应A(g)+2B(g)2C(g)(正反应吸热),下列图象中正确的是( )[来源:21世纪教育网]
14.在2A+B==3C+4D反应中,下面表示的反应速率最快的是 ( )
A.v(A)=0.5 mol·L-1·s-1 B. v (B)=0.005 mol·L-1·s-1
C.v (C)=0.9 mol·L-1·s-1 D.v (D)=1.0 mol·L-1·s-1
15.高温下,某反应达到平衡,平衡常数K=。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应是焓变为负值
B.其它条件不变,增大压强,H2浓度一定增大
C.升高温度,正反应速率增大,逆反应速率减小
D.该反应化学方程式为CO+H2O CO2+H2
16.下列液体混合后,常温下溶液一定呈碱性的是
A.pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合
B.pH=6的盐酸溶液1mL与999mL水混合
C.pH=2的盐酸与0.01mol/L的氨水等体积混合
D.1×10-3mol/L的盐酸和6×10-4mol/L的Ba(OH)2溶液各取10mL,混合后再稀释100倍
17.下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热 ΔH =2×
(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH =2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
18.在密闭容器中一定量混合气体发生反应:x A (g) + y B(g) z C(g),平衡时测得A的浓度为 0.5 mol/L,保持温度不变,将容器的容积压缩到原来的1/2,再达平衡时测得A的浓度为 0.8mol/L,下列判断正确的是( )
A.x+y ﹤z B.平衡向正反应方向移动
C.B的物质的量增大 D.C的体积分数保持不变
19.反应2A(g)2Y(g)+E(g)△H>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A.加压 B.减压 C.减小E的浓度 D.降温
20.已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是285.8kJ·mol-1、1411.0kJ·mol-1和1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
A.-44.2kJ·mol-1 B.+44.2kJ·mol-1 C.-330kJ·mol-1 D.+330kJ·mol-1
一、选择题(每题2分,共20分)答题卡
1 2 3 4 5 6 7 8 9 10
21世纪教育网
二、选择题(每题3分,共30分)答题卡
11 12[来源:21世纪教育网] 13 14 15 16 17 1821世纪教育网 19 20
21世纪教育网
第II卷(共5个小题,共计50分)
21、(9分)(1)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 = —702 kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 = —182 kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3= 。
(3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。右图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
22.(15分)t℃时,将2mol A和1mol B通入体积为2L的密闭容器中(容积不变),发生如下反应,A(g)+2B(g) xC(g),2分钟后反应达到平衡状态 ,剩余了0.6molB,并测得C的浓度是0.3mol/L。
请填写下列空白:
(1)从反应开始至平衡状态,A的平均反应速率为 。
(2)x=
(3)若向容器中通入少量氦气,化学平衡(填字母) 。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入2mol A和1mol B,在t℃下达到新的平衡,此时B的物质的量为:n(B)= mol。
(5)在此温度下,该反应的平衡常数K =
23.(15分)(1) 下列溶液中,c(H+)由小到大的排列顺序是 ① 0.1mol/L HCl 溶液 ② 0.1mol/L H2SO4 溶液 ③ 0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(2)25℃,柠檬水的pH是3,其中c(OH-)==
(3)在25 ℃时, 有PH=12的氢氧化钠溶液100ml,要使它的pH降为11。应加蒸馏水的体积为_____ ____ml;若加PH=10的氢氧化钠溶液,应加_____________ ml.
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈 性(选填“酸”、“中”或“碱”)
24.实验题(11分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000 mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入指示剂,进行滴定。滴定至终点,记录数据。
④重复以上过程2次。
试回答下列问题:
(1)应将NaOH溶液注入右图中的 (选填“甲”或“乙”)中。
(2)该小组在步骤①中的错误是 ,
由此造成的测定结果 (偏高、偏低或无影响)。
(3)右图是某次滴定时的滴定管中的液面,右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。
(4)该滴定操作中③应选用的指示剂是 ,滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视? ,如何确定终点? 。
(5)根据下列数据:
滴定次数 待测液体积(mL)[ 21世纪教育网 标准盐酸体积(mL)
滴定前读数(mL) 滴定后读数(mL)
第一次 20.00 1.55 28.65
第二次 20.00 4.07 29.17
第三次 20.00 0.52 25.42
请计算待测烧碱溶液的浓度为 (2分) 。
(6) 如有1mol/L和0.1mol/L的HCl溶液,应用_ _ 的HCl溶液,原因是____
___ __
高二化学参考答案
1-5CBCCB 6-10 ADBDA 11-15DCDCB 16-20 DBBDA
21、(1)CH4(g)+2O2(g)===== CO2(g)+ NO(g) ΔH = —880 kJ/mol
(2)ΔH3 =+260 kJ/mol
(3)NO2(g)+CO(g)===== CO2(g)+NO(g) ΔH = —234 kJ/mol
22.(1)0.05mol/(L·min)
(2)3
(3)C
(4)1.2
(5)1/3
22.(1)③④①②(2)1×10-11 mol/L
(3)900 1000 (4)碱
24.(1)乙
(2)没有用待测NaOH溶液润洗碱式滴定管;偏低
(3)25.40
(4)酚酞(或甲基橙) ;锥形瓶内溶液颜色的变化;
酚酞:浅红色(或粉红色)变为无色,且半分钟不复原
甲基橙:黄色变为橙色,且半分钟不复原
(5)0.1250mol/L
(6)0.1mol/L;如果用1 mol/L盐酸滴定,所耗体积约为2.50mL,则相对误差较大。
环形玻璃搅拌棒
温度计
碎泡沫塑料
催化剂
高温
分值 100 考试时间 90分钟
命题人 汤佐良 全文娟 审核人 张健 2011-11-01
说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。选择题答案写在答题卡上。
第I卷(共计50分)
一、选择题(本题包括10小题,每小题2分,共20分,每小题只有一个正确答案)
1.下列有关说法,正确的是
A.电解质溶于水一定放出热量
B.在一个确定的化学反应中,反应物总能量总是高于生成物总能量
C.可逆反应在加热时正逆反应速率都增大
D.在25℃时,0.01mol/L的氢氧化钠溶液中,水电离的c(H+)与水电离的c(OH-)的积为10-14
2.关于强、弱电解质的叙述不正确的是
A.强电解质在溶液中完全电离,不存在电离平衡
B.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
C.同一弱电解质同浓度的溶液,温度不同时,导电能力不同
D.强电解质在固态或液态时,可能不导电21世纪教育网
3.已知:H2(g)+F2(g)== 2HF(g) △H=-270kJ/mol,下列说法正确的是
A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量21世纪教育网
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ热量
4.关于中和热测定实验的下列说法不正确的是( )
A. 烧杯间填满碎泡沫塑料是减少实验过程中的热量损失
B. 使用环形玻璃棒既可以搅拌又避免损坏温度计
C.向盛装酸的烧杯中加碱时要小心缓慢
D.测了酸后的温度计要用水清洗后再测碱的温度
5.有三支试管,在同温下分别加入下列物质后
甲:10mL 0.01mol·L-1 FeCl3溶液 和10 mL 0.01 mol·L-1 KSCN溶液
乙:5mL水10mL 0.01mol·L-1 FeCl3溶液 5mL 0.01mol·L-1 KSCN溶液
丙:10mL 0.1mol·L-1 FeCl3溶液 和10mL 0.1mol·L-1 KSCN溶液
观察这三支试管的颜色,其中颜色最浅的是
A.甲试管 B.乙试管 C.丙试管 D.无法判断
6.将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液PH的变化是
A.前者减少后者不变 B.前者减小后者增大 C.都不变 D.都减小
7.下列不能减慢锌与稀盐酸的反应速率的措施是
A.降低温度 B.加入氯化钠溶液
C.加入少量CH3COONa固体 D.增大锌的用量
8.液氨与水相似,存在着微弱的电离:2NH3NH4++NH2-。-50℃时,两种离子的平衡浓度均为1×10-15mol/L,下列有关液氨的离子积及其电离平衡的叙述中错误的是
A.此温度下,液氨的离子积等于1×10-30
B.在液氨中放人NaNH2,则液氨的离子积数值将增大
C.此温度下,在液氨中加人NaNH2,则液氨中c(NH4+)<1×10-15mol/L
D.在液氨中加入NH4Cl,则液氨中c(NH4+)将大于c(NH2-)
9.在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,平衡后测得X、Y的转化率与起始时两物质的物质的量之比的关系如图所示,则X,Y的反应方程式可表示为
A.2X+Y3Z B.3X+2Y2Z
C.X+3YZ D.3X+Y2Z
10.下列叙述中,正确的是( )
A.对于同一物质在不同状态时的熵值是:气态>液态>固态
B.焓变小于0的反应肯定是自发的
C.熵变大于0的反应肯定是自发的
D.自发反应的反应速率肯定很快
二、选择题(本题包括10小题,每小题3分,共30分,每小题只有一个正确答案)
11.已知H2(g)+Br2(l)=2HBr(g) △H=-72kJ/mol,蒸发1mol 液溴变Br2(g)需要吸收的能量为30kJ,其它相关数据如下表:
H2(g) Br2(g) HBr(g)21世纪教育网
1mol分子中的化学键断裂时需要吸收的能量/kJ 436 a 369
则表中a为( )
A.404 B.260
C.230 D.200
12.一定条件下,在密闭容器中,能表示反应X(气)+2Y(气) 2Z(气)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1: 2: 2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol X
A.①② B.①④ C.②③ D.③④
13.对于可逆反应A(g)+2B(g)2C(g)(正反应吸热),下列图象中正确的是( )[来源:21世纪教育网]
14.在2A+B==3C+4D反应中,下面表示的反应速率最快的是 ( )
A.v(A)=0.5 mol·L-1·s-1 B. v (B)=0.005 mol·L-1·s-1
C.v (C)=0.9 mol·L-1·s-1 D.v (D)=1.0 mol·L-1·s-1
15.高温下,某反应达到平衡,平衡常数K=。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应是焓变为负值
B.其它条件不变,增大压强,H2浓度一定增大
C.升高温度,正反应速率增大,逆反应速率减小
D.该反应化学方程式为CO+H2O CO2+H2
16.下列液体混合后,常温下溶液一定呈碱性的是
A.pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合
B.pH=6的盐酸溶液1mL与999mL水混合
C.pH=2的盐酸与0.01mol/L的氨水等体积混合
D.1×10-3mol/L的盐酸和6×10-4mol/L的Ba(OH)2溶液各取10mL,混合后再稀释100倍
17.下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热 ΔH =2×
(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH =2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
18.在密闭容器中一定量混合气体发生反应:x A (g) + y B(g) z C(g),平衡时测得A的浓度为 0.5 mol/L,保持温度不变,将容器的容积压缩到原来的1/2,再达平衡时测得A的浓度为 0.8mol/L,下列判断正确的是( )
A.x+y ﹤z B.平衡向正反应方向移动
C.B的物质的量增大 D.C的体积分数保持不变
19.反应2A(g)2Y(g)+E(g)△H>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A.加压 B.减压 C.减小E的浓度 D.降温
20.已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是285.8kJ·mol-1、1411.0kJ·mol-1和1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
A.-44.2kJ·mol-1 B.+44.2kJ·mol-1 C.-330kJ·mol-1 D.+330kJ·mol-1
一、选择题(每题2分,共20分)答题卡
1 2 3 4 5 6 7 8 9 10
21世纪教育网
二、选择题(每题3分,共30分)答题卡
11 12[来源:21世纪教育网] 13 14 15 16 17 1821世纪教育网 19 20
21世纪教育网
第II卷(共5个小题,共计50分)
21、(9分)(1)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 = —702 kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 = —182 kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3= 。
(3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。右图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
22.(15分)t℃时,将2mol A和1mol B通入体积为2L的密闭容器中(容积不变),发生如下反应,A(g)+2B(g) xC(g),2分钟后反应达到平衡状态 ,剩余了0.6molB,并测得C的浓度是0.3mol/L。
请填写下列空白:
(1)从反应开始至平衡状态,A的平均反应速率为 。
(2)x=
(3)若向容器中通入少量氦气,化学平衡(填字母) 。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入2mol A和1mol B,在t℃下达到新的平衡,此时B的物质的量为:n(B)= mol。
(5)在此温度下,该反应的平衡常数K =
23.(15分)(1) 下列溶液中,c(H+)由小到大的排列顺序是 ① 0.1mol/L HCl 溶液 ② 0.1mol/L H2SO4 溶液 ③ 0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(2)25℃,柠檬水的pH是3,其中c(OH-)==
(3)在25 ℃时, 有PH=12的氢氧化钠溶液100ml,要使它的pH降为11。应加蒸馏水的体积为_____ ____ml;若加PH=10的氢氧化钠溶液,应加_____________ ml.
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈 性(选填“酸”、“中”或“碱”)
24.实验题(11分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000 mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入指示剂,进行滴定。滴定至终点,记录数据。
④重复以上过程2次。
试回答下列问题:
(1)应将NaOH溶液注入右图中的 (选填“甲”或“乙”)中。
(2)该小组在步骤①中的错误是 ,
由此造成的测定结果 (偏高、偏低或无影响)。
(3)右图是某次滴定时的滴定管中的液面,右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。
(4)该滴定操作中③应选用的指示剂是 ,滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视? ,如何确定终点? 。
(5)根据下列数据:
滴定次数 待测液体积(mL)[ 21世纪教育网 标准盐酸体积(mL)
滴定前读数(mL) 滴定后读数(mL)
第一次 20.00 1.55 28.65
第二次 20.00 4.07 29.17
第三次 20.00 0.52 25.42
请计算待测烧碱溶液的浓度为 (2分) 。
(6) 如有1mol/L和0.1mol/L的HCl溶液,应用_ _ 的HCl溶液,原因是____
___ __
高二化学参考答案
1-5CBCCB 6-10 ADBDA 11-15DCDCB 16-20 DBBDA
21、(1)CH4(g)+2O2(g)===== CO2(g)+ NO(g) ΔH = —880 kJ/mol
(2)ΔH3 =+260 kJ/mol
(3)NO2(g)+CO(g)===== CO2(g)+NO(g) ΔH = —234 kJ/mol
22.(1)0.05mol/(L·min)
(2)3
(3)C
(4)1.2
(5)1/3
22.(1)③④①②(2)1×10-11 mol/L
(3)900 1000 (4)碱
24.(1)乙
(2)没有用待测NaOH溶液润洗碱式滴定管;偏低
(3)25.40
(4)酚酞(或甲基橙) ;锥形瓶内溶液颜色的变化;
酚酞:浅红色(或粉红色)变为无色,且半分钟不复原
甲基橙:黄色变为橙色,且半分钟不复原
(5)0.1250mol/L
(6)0.1mol/L;如果用1 mol/L盐酸滴定,所耗体积约为2.50mL,则相对误差较大。
环形玻璃搅拌棒
温度计
碎泡沫塑料
催化剂
高温
同课章节目录
