第二单元第三节原子中的电子授课课件第二课时
文档属性
| 名称 | 第二单元第三节原子中的电子授课课件第二课时 |  | |
| 格式 | rar | ||
| 文件大小 | 111.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-23 10:09:27 | ||
图片预览







文档简介
(共25张PPT)
原子中的电子
2011.11
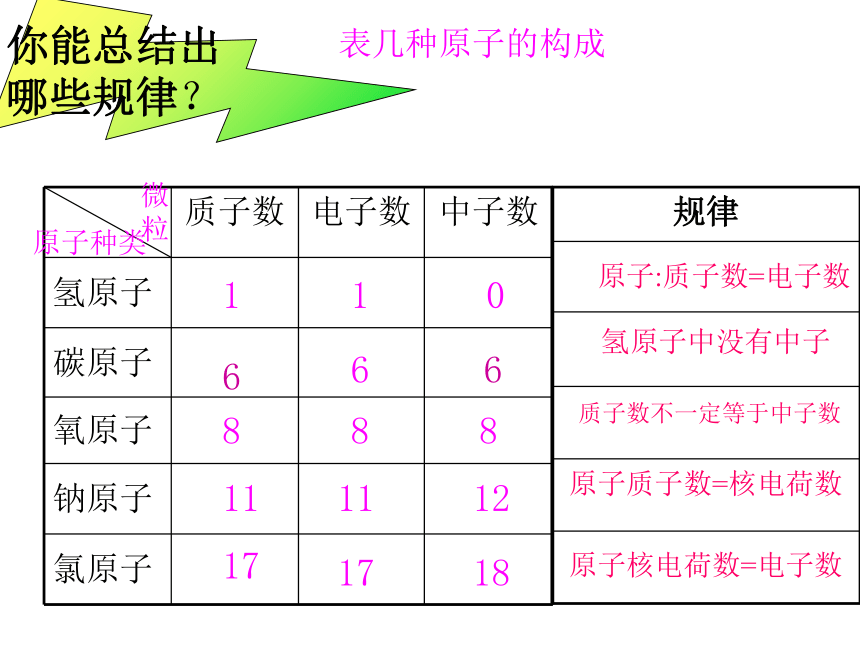
你能总结出
哪些规律?
质子数 电子数 中子数
氢原子
碳原子
氧原子
钠原子
氯原子
原子种类
微粒
规律
表几种原子的构成
1
1
0
6
6
6
8
8
8
11
11
12
17
17
18
氢原子中没有中子
原子:质子数=电子数
质子数不一定等于中子数
原子质子数=核电荷数
原子核电荷数=电子数
重要公式:
在原子中
①核电荷数=质子数
=电子数=原子序数
②相对原子质量≈
质子数+中子数
1、一个铝原子中共有40个粒子,其中14个粒子不带电,则铝的相对原子质量为( )
A.40 B.27
C.26 D.28
B
2、若一个碳12原子的实际质量为mg,则实际质量为ng的原子的相对原子质量为( )
A、12n/m B、12m/n
C、n/12m D、m/12n
3、某原子R,相对原子质量为a,核内中子数为b,则其核外电子数为( )
A、a-b B、a+b
C、b-a D、无法确定
原子中电子运动的部分知识
1、原子核外电子运动特征:电子在原子核外很小的空间内作高速运动,没有确定的轨道。
2、“电子的运动”和“宏观物体的运动”的区别:描述“宏观物体的运动”的方法——计算某时刻的位置,画出运动的轨迹等。描述“电子的运动”的方法——指出它在核外空间某处出现的机会的多少。
原子核外电子的分层排布
原因:电子的能量不同
(1)电子层划分标准:
电子能量的高低及离核的远近。
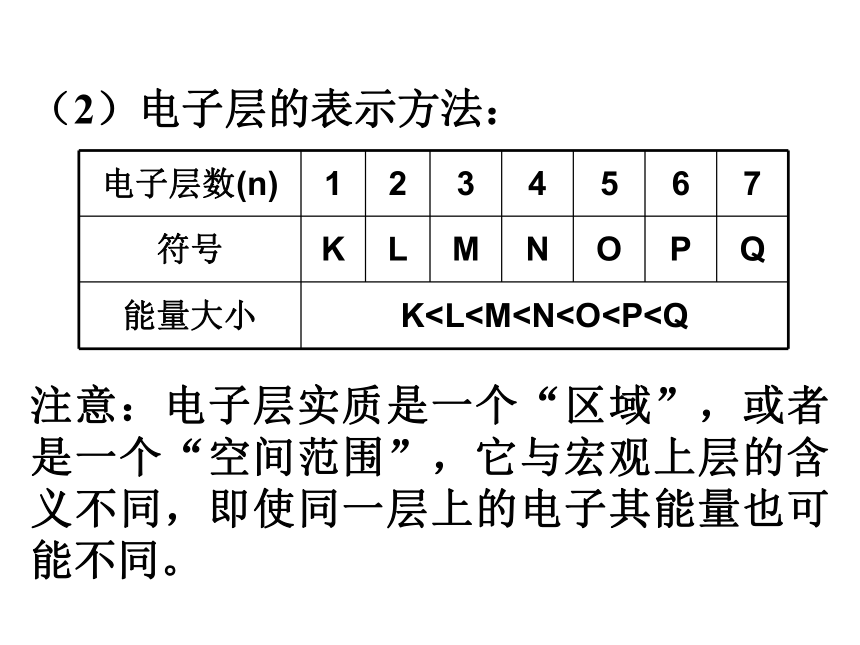
(2)电子层的表示方法:
注意:电子层实质是一个“区域”,或者是一个“空间范围”,它与宏观上层的含义不同,即使同一层上的电子其能量也可能不同。
电子层数(n) 1 2 3 4 5 6 7
符号 K L M N O P Q
能量大小 K(3)原子核外分层排布的一般规律
1)核外电子排布总是尽先排布在能量最低的电子层里,然后依次排布在能量逐渐升高的电子层里
2)原子核外各电子层最多容纳2n2个电子。
3)最外层电子数目不超过8个(第一层为最外层时不超过2个电子)
…………..
知识拓展
电子云:是核外电子运动的一种形象化表示。图中每个小黑点,并不代表一个电子,小黑点的疏密表示电子在核外单位体积内出现机会的多少
电子层
原子核
质子数
原子核带正电
电子层上
的电子数
原子结构示意图中各部分的意义
右图表示的是( )
它的原子核外有( )个电子层,第三层上有( )个电子,在化学反应中( )(填易获得,易失去,不易得失)电子
一个钠原子
Na
电子对原子性质的影响
1 体积
(层多体积大;同层电子,多时体积小)
2 得失电子(最外层电子)
多数金属原子 少于4 易失电子
多数非金属原子 多于4 易得电子
稀有气体的原子 既不易得电子
(氦、氖、氩等) 也不易失电子
例题:在有多个电子的原子里,能量高的电子( )
A 通常在离核较近的区域运动
B 通常在离核较远的区域运动
C 在化学反应中较易失去
D 在化学变化中较难失去
B C
解析:在多电子的原子里,电子运动的区域和其能量的关系为近—低、远—高,原子能量越低越稳定,在离核较远区域运动的电子,其能量较高,易失去,使能量降低处于稳定状态。
原 子 的 愿 望
当原子的最外层电子数达到满电子时,原子就可以稳定存在。第一层为最外层时2个,其余电子层为最外层时8个
若原子不处在稳定结构,将通过得、失电子达到稳定
Na+
Cl
-
阳离子
阴离子
原子失去电子后带 电荷称为 离子
原子得到电子后带 电荷称为 离子
正
阳
负
阴
离子:带电的原子
离子符号:Na 、Cl 等
+
-
原子与离子的转化
原子
阳离子
失电子
得电子
得电子
失电子
阴离子
带正电
不带电
带负电
思考:离子的判断方法
Na+
Cl
-
氯化钠的形成
阳离子
阴离子
NaCl
物 质
分子
原子
离子
构成
构成
构成
构成
课堂练习
1、氧原子和铁原子的区别
在于 不同。
质子数(核电荷数)
电子数行不?
2 右图表示的是( )
它的原子核外有( )个电子,第二层上有( )个电子,在化学反应中( )(填易获得,易失去,不易得失)电子
一个氯离子
Cl
-
3、水是由 构成的;
金刚石是由 构成的;
氯化钠是由 构成的。
水分子
碳原子
钠离子和氯离子
思考:这三种物质的化学性质由什么粒子来保持?
作业布置
1作业本
课本P50在线测试2
组长检查,并签字
2完成同步训练。上交
3记忆P52原子结构示意图
原子中的电子
2011.11
你能总结出
哪些规律?
质子数 电子数 中子数
氢原子
碳原子
氧原子
钠原子
氯原子
原子种类
微粒
规律
表几种原子的构成
1
1
0
6
6
6
8
8
8
11
11
12
17
17
18
氢原子中没有中子
原子:质子数=电子数
质子数不一定等于中子数
原子质子数=核电荷数
原子核电荷数=电子数
重要公式:
在原子中
①核电荷数=质子数
=电子数=原子序数
②相对原子质量≈
质子数+中子数
1、一个铝原子中共有40个粒子,其中14个粒子不带电,则铝的相对原子质量为( )
A.40 B.27
C.26 D.28
B
2、若一个碳12原子的实际质量为mg,则实际质量为ng的原子的相对原子质量为( )
A、12n/m B、12m/n
C、n/12m D、m/12n
3、某原子R,相对原子质量为a,核内中子数为b,则其核外电子数为( )
A、a-b B、a+b
C、b-a D、无法确定
原子中电子运动的部分知识
1、原子核外电子运动特征:电子在原子核外很小的空间内作高速运动,没有确定的轨道。
2、“电子的运动”和“宏观物体的运动”的区别:描述“宏观物体的运动”的方法——计算某时刻的位置,画出运动的轨迹等。描述“电子的运动”的方法——指出它在核外空间某处出现的机会的多少。
原子核外电子的分层排布
原因:电子的能量不同
(1)电子层划分标准:
电子能量的高低及离核的远近。
(2)电子层的表示方法:
注意:电子层实质是一个“区域”,或者是一个“空间范围”,它与宏观上层的含义不同,即使同一层上的电子其能量也可能不同。
电子层数(n) 1 2 3 4 5 6 7
符号 K L M N O P Q
能量大小 K
1)核外电子排布总是尽先排布在能量最低的电子层里,然后依次排布在能量逐渐升高的电子层里
2)原子核外各电子层最多容纳2n2个电子。
3)最外层电子数目不超过8个(第一层为最外层时不超过2个电子)
…………..
知识拓展
电子云:是核外电子运动的一种形象化表示。图中每个小黑点,并不代表一个电子,小黑点的疏密表示电子在核外单位体积内出现机会的多少
电子层
原子核
质子数
原子核带正电
电子层上
的电子数
原子结构示意图中各部分的意义
右图表示的是( )
它的原子核外有( )个电子层,第三层上有( )个电子,在化学反应中( )(填易获得,易失去,不易得失)电子
一个钠原子
Na
电子对原子性质的影响
1 体积
(层多体积大;同层电子,多时体积小)
2 得失电子(最外层电子)
多数金属原子 少于4 易失电子
多数非金属原子 多于4 易得电子
稀有气体的原子 既不易得电子
(氦、氖、氩等) 也不易失电子
例题:在有多个电子的原子里,能量高的电子( )
A 通常在离核较近的区域运动
B 通常在离核较远的区域运动
C 在化学反应中较易失去
D 在化学变化中较难失去
B C
解析:在多电子的原子里,电子运动的区域和其能量的关系为近—低、远—高,原子能量越低越稳定,在离核较远区域运动的电子,其能量较高,易失去,使能量降低处于稳定状态。
原 子 的 愿 望
当原子的最外层电子数达到满电子时,原子就可以稳定存在。第一层为最外层时2个,其余电子层为最外层时8个
若原子不处在稳定结构,将通过得、失电子达到稳定
Na+
Cl
-
阳离子
阴离子
原子失去电子后带 电荷称为 离子
原子得到电子后带 电荷称为 离子
正
阳
负
阴
离子:带电的原子
离子符号:Na 、Cl 等
+
-
原子与离子的转化
原子
阳离子
失电子
得电子
得电子
失电子
阴离子
带正电
不带电
带负电
思考:离子的判断方法
Na+
Cl
-
氯化钠的形成
阳离子
阴离子
NaCl
物 质
分子
原子
离子
构成
构成
构成
构成
课堂练习
1、氧原子和铁原子的区别
在于 不同。
质子数(核电荷数)
电子数行不?
2 右图表示的是( )
它的原子核外有( )个电子,第二层上有( )个电子,在化学反应中( )(填易获得,易失去,不易得失)电子
一个氯离子
Cl
-
3、水是由 构成的;
金刚石是由 构成的;
氯化钠是由 构成的。
水分子
碳原子
钠离子和氯离子
思考:这三种物质的化学性质由什么粒子来保持?
作业布置
1作业本
课本P50在线测试2
组长检查,并签字
2完成同步训练。上交
3记忆P52原子结构示意图
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
