鲁教版 九年级 上册 5.1 化学反应中的质量守恒 练习(带解析答案)
文档属性
| 名称 | 鲁教版 九年级 上册 5.1 化学反应中的质量守恒 练习(带解析答案) |  | |
| 格式 | docx | ||
| 文件大小 | 230.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-04 11:35:38 | ||
图片预览




文档简介
化学反应中的质量守恒练习
一、单选题
某纯净物3g在氧气中完全燃烧,生成8.8g二氧化碳和5.4g水。下列说法不正确的是(????)
A. 该纯净物中含有C、H元素,不含O元素
B. 该反应中O2和CO2的质量比为14:11
C. 该反应中O2和H2O的分子数之比为7:6
D. 该纯净物中C、H原子的个数比为1:4
在密闭容器中有甲、乙、丙、丁四种物质在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如图所示。图中a、b、c、d分别表示相应物质的质量分数。下列数据正确的是(????)
A. a=56% B. b=6% C. c=17% D. d=8%
我国古代典籍中有“银针验毒”的记载,“银针验毒”的反应原理之一是4Ag+2H2S+O2=2X+2H2O,下列有关该反应的说法不正确的是(????)
A. 反应属于氧化反应
B. X的化学式是Ag2S
C. 反应前后元素的种类不变
D. 反应前后所有元素的化合价都发生了变化
如图为电解水的实验装置图,下列说法正确的是(? )
A. 在水中加入少量硫酸钠以增强水的导电性
B. 与负极相连的玻璃管内得到的气体能使带火星的木条复燃
C. 该实验中所得氢气和氧气的质量比约为2:1
D. 该实验说明水是由氢气和氧气组成的
构建化学基本观念是学好化学的基础,下列对化学基本观念的认识错误的是(????)
A. 元素观:一氧化碳、二氧化碳都是由碳元素和氧元素组成的
B. 微粒观:保持氧气化学性质的最小微粒是氧气分子
C. 转化观:氧化镁在一定条件下可直接转化为金属镁
D. 守恒观:18g氢气和18g氧气反应,一定生成36g水
硫代硫酸钠(Na2S2O3)俗称大苏打或海波,是照相常用药品之一,它和H2SO4能发生如下反应:H2SO4+Na2S2O3=Na2SO4+S↓+R+H2O,则R的化学式为(????)
A. SO3 B. H2S C. SO2 D. H2SO3
甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是(????)
A. 丙可能是该反应的催化剂
B. x?的值是?7
C. 丁一定是化合物
D. 参加反应的甲和乙质量比为?2:7
在一个密闭容器内有甲、乙、丙、丁四种物质,经过反应一段时间后,测得反应前后各物质的质量如下表所示,以下说法正确的是(????)
物质
甲
乙
丙
丁
反应前质量/克
30
30
30
30
反应后质量/克
40
30
待测
43
A. 反应中甲和丁的质量比为40:43 B. 该反应是分解反应
C. 乙一定是该反应的是催化剂 D. 待测值为23
在化学反应前后,肯定不会发生变化的是(????)
①原子的数目 ②分子的数目 ③元素的种类 ④物质的总质量 ⑤物质的种类 ⑥分子的种类 ⑦原子的种类.
A. ②④⑤ B. ①③⑦ C. ①③④⑥ D. ①③④⑦
如图是探究反应前后质量变化的实验,玻璃管在酒精灯上烧热后,塞紧橡皮塞同时玻璃管触碰瓶底的白磷后发生燃烧反应。下列说法正确的是(????)
A. 白磷必须过量,否则会影响实验结果
B. 实验中反应的化学方程式为4P+5O2=2P2O5
C. 燃烧后玻璃管顶端的小气球始终胀大
D. 燃烧时有大量白烟生成
过氧化钠(Na2O2)可做呼吸面具中氧气的来源。它与二氧化碳反应后的生成物为(????)
A. Na2CO3 B. Na2O和O2 C. NaOH和O2 D. Na2CO3和O2
在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
下列说法中,不正确的是?
A. 反应后物质甲的质量为13g B. 该化学反应类型是分解反应
C. 反应中乙、丁的质量比为5∶4 D. 物质丙可能是该反应的催化剂
在一个密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识错误的是(???? )
物质
X
Y
Z
Q
反应前质量(g)
20
2
1
37
反应后质量(g)
未测
32
1
12
A. 物质Z可能是该反应的催化剂 B. 物质Y一定是单质
C. 反应中Y、Q的质量比为6﹕5 D. 反应后物质X的质量为15g
某化合物R在纯氧中充分燃烧后,只生成水和二氧化碳,则该化合物的组成中(????)
A. 只含有碳元素
B. 只含有氢元素
C. 一定含有碳元素和氢元素,可能含有氧元素
D. 一定含有碳氢氧三种元素
如图表示三种物质在密闭容器中反应一段时间后质量的变化,其反应的基本类型是(????)
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列说法正确的是(????)
A. 丁一定是氧化物
B. 该反应是置换反应
C. 丙一定是该反应的催化剂
D. 反应前后甲和乙变化的质量比为9:8
二、填空题
“不是花中偏爱菊,此花开尽更无花”秋日菊花开时满园飘香,从微观角度解释其原因______,菊香的重要成分是乙酸龙脑酯(C12H20O2),点燃196g的乙酸龙脑酯与480g?O2恰好完全反应,生成440gCO2和180gH2O和xgCO,x=______g,化学方程式为______。
①黑火药燃烧的化学方程式为:S+2KNO3+3C??点燃??x+N2↑+3CO2↑,则x的化学式为______;
②KI的名称是______。
质量守恒定律的定量研究对化学科学发展具有重大作用。
(1)乙炔燃烧放出大量的热,常用于焊接金属,发生的反应的化学方程式为2X+5O2=4CO2+2H2O,其中X化学式为______。
(2)如图为某化学反应的微观模拟图,“”和“”分别表示不同元素的原子:由“”聚集成的物质______(填“可能”或“不可能”)是氧化物,参加反应的两种反应物分子“”与“”的个数比为______。
(3)已知mg镁条放在空气中完全燃烧,生成ng氧化镁(不考虑其它反应),比较m和n的质量关系,m______n(填“大于”、“小于”或“等于”)。
三、实验题
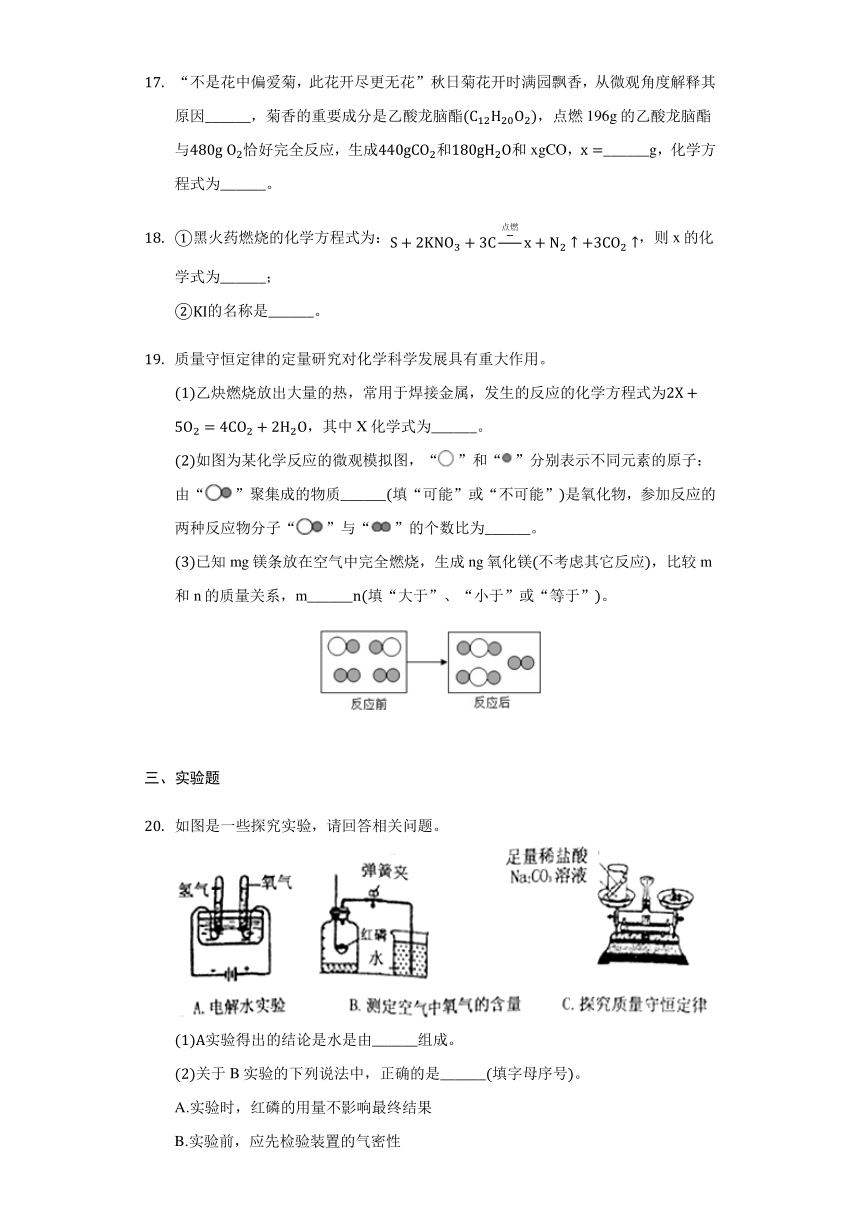
如图是一些探究实验,请回答相关问题。
(1)A实验得出的结论是水是由______组成。
(2)关于B实验的下列说法中,正确的是______(填字母序号)。
A.实验时,红磷的用量不影响最终结果
B.实验前,应先检验装置的气密性
C.点燃红磷前,先用弹簧夹夹紧胶皮管D.红磷熄灭后,应立即打开弹簧夹
(3)C实验能否达到目的并说出理由是______。
小屹同学在学习了实验室制取二氧化碳的原理和装置后,对验证质量守恒定律的实验装置进行了改进:如下图所示,实验前天平平衡。
(制取二氧化碳原理:CaCO3+2HCl=CaCl2+H2O+CO2↑)
?
(1)将注射器中适量的稀盐酸注入锥形瓶中,观察到天平的指针__________________(填“偏左”、“偏右”或“在标尺中央”,下同)。上述实验的反应结束后,松开锥形瓶上的橡皮塞,天平的指针____________________。
(2)结论:为验证质量守恒定律,若有气体参与或生成的实验必须在______________(填“开放”或“密闭”)装置进行探究。
化学的发展趋势是从宏观到微观、由定性到定量。如图是化学反应前后质量测定的实验:
(1)实验结束后,观察到反应后天平不平衡,原因是___________________。
(2)若装置不变,更换烧杯中的反应物也能得出正确的结论。下列几组药品可以选用的是______。
A.铁片和硫酸铜溶液 B.活性炭和水? C.过氧化氢溶液和二氧化锰
答案和解析
1.【答案】D
【解析】【试题剖析】
【试题解析】
解:A、根据质量守恒定律可知,化学反应前后元素的种类保持不变,说明该物质一定含有氢元素和碳元素,可能含有氧元素,二氧化碳中碳元素的质量等于8.8g×1244×100%=2.4g,水中氢元素的质量等于5.4g×218×100%=0.6g,因此氢元素和碳元素的质量之和是2.4g+0.6g=3.0g,说明该物质仅含有碳元素和氢元素,故说法正确;
B、根据质量守恒定律可知,参加反应的氧气的质量为8.8g+5.4g?3g=11.2g,则该反应中O2和CO2的质量比为11.2g:8.8g=14:11,故说法正确;
C、反应中O2和H2O的分子数之比为11.232:5.418=7:6,故说法正确;
D、该纯净物中C、H原子的个数比为2.412:0.61=1:3,故错误。
2.【答案】A
【解答】
由四种物质反应前后各物质的质量分数可知,反应前后甲的质量分数减少了70%?42%=28%,故甲是反应物;反应前乙的质量分数为14%,反应后乙的质量分数为1?42%?40%?10%=8%,乙的质量分数减少了14%?8%=6%,故乙是反应物;反应前丙的质量分数为6%,丙的质量分数增加了40%?6%=34%,丙是生成物;丁的质量分数不变,可能作该反应的催化剂,也可能没有参加反应。
A、参加反应的甲和乙质量比为28%:6%,当乙的质量分数为11%时,减少了14%?11%=3%,则甲的质量分数应减少14%,则a=70%?14%=56%,故选项说法正确;
B、反应后乙的质量分数为1?42%?40%?10%=8%,b=8%,故选项说法错误;
C、生成的丙和参加反应乙质量比为34%:6%,当乙的质量分数为11%时,减少了14%?11%=3%,则丙的质量分数应增加17%,则c=6%+17%=23%,故选项说法错误;
D、丁的质量分数不变,可能作该反应的催化剂,也可能没有参加反应,d=10%,故选项说法错误。
故选A。
3.【答案】D
【解答】
A.反应中有氧气参加,该反应属于氧化反应,故正确;
B.由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式4Ag+2H2S+O2=2X+2H2O,反应前银、氢、硫、氧原子个数分别为4、4、2、2,反应后的生成物中银、氢、硫、氧原子个数分别为0、4、0、2;根据反应前后原子种类、数目不变,则2X分子中含有4个银原子和2个硫原子,则每个X分子由2个银原子和1个硫原子构成,则物质X的化学式为Ag2S,故正确;
C.由质量守恒定律可知,反应前后元素的种类不变,故正确;
D.在反应4Ag+2H2S+O2=2Ag2S+2H2O,中硫元素和氢元素的化合价在反应前后不变,故错误。
故选D。
4.【答案】A
【解答】
A.在水中加入少量硫酸钠以增强导电性,故说法正确;
B.由电解水的装置可知,负极产生的气体较多,是H2,氢气具有可燃性,不能使带火星的木条复燃,故说法错误;
C.电解水时,正极产生的是氧气,负极产生的是氢气,氢气和氧气的体积比约为2:1,故说法错误;
D.电解水生成了氢气和氧气,说明了水是由氢、氧两种元素组成的,故说法错误。
故选A。
5.【答案】D
【解析】解:A、一氧化碳、二氧化碳都是由碳元素和氧元素组成的,故选项说法正确。
B、氧气是由氧分子构成的,保持氧气化学性质的最小微粒是氧气分子,故选项说法正确。
C、氧化镁在一定条件下可直接转化为金属镁,如电解熔融氧化镁时,氧化镁分解生成镁和氧气,该选项说法正确;
D、氢气和氧气反应的化学方程式为:2H2+O2??点燃??2H2O,在此反应中氢气、氧气和水的质量比为4:32:36=1:8:9,18g氢气和18g氧气反应,氢气有剩余,生成水的质量小于36g,故选项说法错误。
故选:D。
6.【答案】C
【解析】解:由反应的化学方程式H2SO4+Na2S2O3=Na2SO4+S↓+R+H2O,可知反应前后各原子的个数分别为
????? 反应前? 反应后
H原子??? 2????? 2
S原子??? 3????? 2
O原子??? 7????? 5
Na原子?? 2????? 2
根据化学变化前后原子的种类、数目不变,生成物R的每个分子由1个S原子和2个O原子构成,则物质R的化学式可表示为SO2;
7.【答案】D
【解析】解:A、丙反应前后质量不变,可能是该反应的催化剂,该选项说法正确;
B、x=14+26+3+5?2?3?36=7,该选项说法正确;
C、反应后甲、乙质量减小,是反应物,丁质量增大,是生成物,丁中的元素和甲、乙物质中的元素质量相同,因此丁一定是化合物,该选项说法正确;
D、参加反应的甲和乙质量比为:(14?2):(26?7)=12:19,该选项说法不正确。
8.【答案】B
【解答】
由表中数据分析可知,反应前后甲的质量增多了40g?30g=10g,故是生成物,生成的质量为10g;乙的质量不变,可能作该反应的催化剂,也可能没有参加反应;同理可以确定丁是生成物,生成的质量为43g?30g=13g;由质量守恒定律,丙应是反应物,且反应的质量为10g+13g=23g,故待测数值为30?23=7。
A.反应中甲和丁的质量比为10:13,故错误。??? ??
B.该反应由丙物质生成了甲和丁,由一种物质生成了两种物质,是分解反应,故正确;
C.乙可能是该反应的是催化剂,故错误;
D.由以上计算可知,待测值为7,故错误。
9.【答案】D
【解析】解:根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。化学反应的过程,就是参加反应的各物质(反应物)的原子,重新组合而生成其他物质的过程。在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。
10.【答案】D
【解析】解:A、由质量守恒定律,参加化学反应的各物质的质量之和等于生成的各物质的质量之和,红磷的用量多少不会影响实验结果,故错误;
B、该化学方程式缺少反应条件,正确的化学方程式应为:4P+5O2??点燃??2P2O5,故错误;
C、白磷燃烧放出大量的热,锥形瓶内的压强增大,气球膨胀;装置冷却后由于消耗氧气,气球又变小,故错误;
D、白磷燃烧产生大量白色烟,故正确;
11.【答案】D
【解析】解:A、过氧化钠(Na2O2)可做呼吸面具中氧气的来源,则与二氧化碳反应后的生成物为碳酸钠和氧气,不只是碳酸钠,故选项错误。
B、过氧化钠(Na2O2)可做呼吸面具中氧气的来源,由质量守恒定律,反应前后元素种类不变,则与二氧化碳反应后的生成物不可能为Na2O和O2,故选项错误。
C、过氧化钠(Na2O2)可做呼吸面具中氧气的来源,由质量守恒定律,反应前后元素种类不变,则与二氧化碳反应后的生成物不可能为氢氧化钠和氧气,故选项错误。
D、过氧化钠(Na2O2)可做呼吸面具中氧气的来源,则与二氧化碳反应后的生成物为碳酸钠和氧气,故选项正确。
12.【答案】B
【解答】
A.根据质量守恒定律,反应前后物质的总质量不变,所以18+1+2+32=X+26+2+12,解得X=13,故A正确;
B.由分析可知,该反应中反应物是甲和丁,生成物是乙,该反应由两种物质生成了一种物质,不属于分解反应,故B错误;
C.反应中乙、丁的质量比为:(26?1)g:(32?12)g=5:4,故C正确;
D.通过分析知,丙质量不变,可能是催化剂,故D正确。
故选B。
13.【答案】B
【解答】
由题意可知,根据质量守恒定律,反应前各物质的质量总和=反应后各物质的质量总和,设未测值为m,则可列式:20+2+1+37=m+32+1+12,解得m=15;
A.物质Z的质量在反应前后不变,可能是该反应的催化剂,故A正确,不符合题意;
B.由分析知,参加反应的X的质量为20g?15g=5g,生成的Y是32g?2g=30g,参加反应的Q质量为37g?12g=25g,所以该反应是X+Q→Y,所以物质Y一定是化合物,故B不正确,符合题意;
C.反应中Y、Q的质量比为30g:25g=6:5,故C正确,不符合题意;
D.由开始计算可得,反应后物质X的质量为15g,故D正确,不符合题意。
故选B。
14.【答案】C
【解析】解:某化合物R在纯氧中充分燃烧后,只生成二氧化碳和水,二氧化碳和水两种物质中含有碳、氧、氢三种元素,根据质量守恒定律,反应前后,元素种类不变,则某化合物中一定含有碳元素和氢元素,可能含有氧元素.
15.【答案】B
【解析】解:由四种物质在密闭容器中反应一段时间后质量的变化图,A物质反应后质量减少,是反应物;B物质反应后质量增加,是生成物;C物质反应后质量增加,是生成物;故该反应的反应物是A,生成物是B和C,该反应符合“一变多”的特征,属于分解反应。
16.【答案】D
【解析】解:由表中数据分析可知,反应前后甲的质量增加了50g?32g=18g,故是生成物,反应生成甲的质量为18g;同理可以确定乙是反应物,反应的乙的质量为40g?14g=16g;丙的质量不变,可能作该反应的催化剂,也可能没有参加反应;丁是反应物,反应的丁的质量为20g?18g=2g。
A、该反应的反应物为乙和丁,生成物是甲,符合“多变一”的形式,属于化合反应,丁可能是化合物,故选项说法错误。
B、该反应的反应物为乙和丁,生成物是甲,符合“多变一”的形式,属于化合反应,故选项说法错误。
C、丙的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
D、反应前后甲和乙变化的质量比为18g:16g=9:8,故选项说法正确。
17.【答案】分子在不断的运动? 56? C12H20O2+15O2??点燃??10H2O+10CO2+2CO
【解析】解:秋日菊花开时满园飘香,说明分子是不断运动的;
x=196g+480g?440g?180g=56g;
反应的乙酸龙脑酯、氧气和生成的水、二氧化碳、一氧化碳分子个数比:196g196:480g32:180g18:440g44:56g28=1:15:10:10:2,因此反应的化学方程式为:
C12H20O2+15O2??点燃??10H2O+10CO2+2CO。
18.【答案】K2S? 碘化钾
【解析】解:①由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前硫、碳、钾、氮、氧、碳原子个数分别为1、2、2、6、3,反应后的生成物中硫、碳、钾、氮、氧、碳原子个数分别为0、0、2、6、3,根据反应前后原子种类、数目不变,则每个x分子由1个钾原子、2个硫原子构成,则物质X的化学式为K2S。
②KI从右向左读,读作碘化钾。
故答案为:
①K2S;
②碘化钾。
19.【答案】C2H2? 可能? 2:1? 小于
【解析】解:(1)根据反应的化学方程式2X+5O2=4CO2+2H2O,反应物中氧原子个数为10,反应后的生成物中碳、氢、氧原子个数分别为4、4、10,根据反应前后原子种类、数目不变,2X含有4个碳原子和4个氢原子,则每个X分子2个碳原子和2个氢原子构成,则物质X的化学式为:C2H2。
(2)”和“”分别表示不同元素的原子:若一种原子是氧原子,由“”聚集成的物质就是氧化物;由微粒的变化可知,有一个未参加反应,所以参加反应的两种反应物分子“”与“”的个数比为2:1。
(3)由于镁在燃烧时与氧气反应生成了氧化镁,由质量守恒定律可知,参加反应镁的质量和氧气的质量之和等于氧化镁的质量,所以m和n的质量关系是:m小于n。
故答案为:(1)C2H2。
(2)可能;2:1。
(3)小于。
20.【答案】氢元素、氧元素 ? BC ? 不能,这是因为反应生成的二氧化碳逸出装置,导致天平失去平衡
【解析】解:(1)A实验中,电解水生成氢气和氧气,得出的结论是水是由氢元素、氧元素组成。
故填:氢元素、氧元素。
(2)A.实验时,红磷的用量影响最终结果,如果红磷不足,会导致实验结果偏小,该选项说法不正确;
B.实验前,应先检验装置的气密性,该选项说法正确;
C.点燃红磷前,先用弹簧夹夹紧胶皮管,防止集气瓶中的气体膨胀逸出,影响实验结果,该选项说法正确;
D.红磷熄灭后,不能立即打开弹簧夹,应该冷却至室温后打开弹簧夹,该选项说法不正确。
21.【答案】(1)在标尺中央,偏右
(2)密闭
【解答】
(1)稀盐酸和碳酸钙反应生成氯化钙,水和二氧化碳,由于是在密闭的装置内反应的,参加化学反应的各物质的质量总和等于生成的各物质的质量总和,故天平指针在标尺中央;实验的反应结束后,松开锥形瓶上的橡皮塞,生成的二氧化碳会飘逸到空气中,导致测得的质量偏小,天平的指针偏右,
故答案是:在标尺中央,偏右;
(2)为验证质量守恒定律,若有气体参与或生成的实验必须在密闭装置进行探究,
故答案是:密闭。
22.【答案】?(1)产生的二氧化碳气体进入到空气中;
(2)A
?
【解答】
(1)由于盐酸与碳酸钠粉末反应,生成氯化钠、水和二氧化碳,产生的二氧化碳气体进入到空气中,因此反应后的天平不平衡;
(2)A.铁片和硫酸铜溶液反应,生成铜和硫酸亚铁,没有气体生成,反应后天平保持平衡,故A正确;
B.活性炭和水不发生化学反应,因此不能验证质量守恒定律,故B错误;
C.过氧化氢溶液和二氧化锰混合之后,生成水和氧气,氧气会进入空气中,天平不会平衡,故C错误;
故选A。
故答案为:(1)产生的二氧化碳气体进入到空气中;(2)A。
一、单选题
某纯净物3g在氧气中完全燃烧,生成8.8g二氧化碳和5.4g水。下列说法不正确的是(????)
A. 该纯净物中含有C、H元素,不含O元素
B. 该反应中O2和CO2的质量比为14:11
C. 该反应中O2和H2O的分子数之比为7:6
D. 该纯净物中C、H原子的个数比为1:4
在密闭容器中有甲、乙、丙、丁四种物质在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如图所示。图中a、b、c、d分别表示相应物质的质量分数。下列数据正确的是(????)
A. a=56% B. b=6% C. c=17% D. d=8%
我国古代典籍中有“银针验毒”的记载,“银针验毒”的反应原理之一是4Ag+2H2S+O2=2X+2H2O,下列有关该反应的说法不正确的是(????)
A. 反应属于氧化反应
B. X的化学式是Ag2S
C. 反应前后元素的种类不变
D. 反应前后所有元素的化合价都发生了变化
如图为电解水的实验装置图,下列说法正确的是(? )
A. 在水中加入少量硫酸钠以增强水的导电性
B. 与负极相连的玻璃管内得到的气体能使带火星的木条复燃
C. 该实验中所得氢气和氧气的质量比约为2:1
D. 该实验说明水是由氢气和氧气组成的
构建化学基本观念是学好化学的基础,下列对化学基本观念的认识错误的是(????)
A. 元素观:一氧化碳、二氧化碳都是由碳元素和氧元素组成的
B. 微粒观:保持氧气化学性质的最小微粒是氧气分子
C. 转化观:氧化镁在一定条件下可直接转化为金属镁
D. 守恒观:18g氢气和18g氧气反应,一定生成36g水
硫代硫酸钠(Na2S2O3)俗称大苏打或海波,是照相常用药品之一,它和H2SO4能发生如下反应:H2SO4+Na2S2O3=Na2SO4+S↓+R+H2O,则R的化学式为(????)
A. SO3 B. H2S C. SO2 D. H2SO3
甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是(????)
A. 丙可能是该反应的催化剂
B. x?的值是?7
C. 丁一定是化合物
D. 参加反应的甲和乙质量比为?2:7
在一个密闭容器内有甲、乙、丙、丁四种物质,经过反应一段时间后,测得反应前后各物质的质量如下表所示,以下说法正确的是(????)
物质
甲
乙
丙
丁
反应前质量/克
30
30
30
30
反应后质量/克
40
30
待测
43
A. 反应中甲和丁的质量比为40:43 B. 该反应是分解反应
C. 乙一定是该反应的是催化剂 D. 待测值为23
在化学反应前后,肯定不会发生变化的是(????)
①原子的数目 ②分子的数目 ③元素的种类 ④物质的总质量 ⑤物质的种类 ⑥分子的种类 ⑦原子的种类.
A. ②④⑤ B. ①③⑦ C. ①③④⑥ D. ①③④⑦
如图是探究反应前后质量变化的实验,玻璃管在酒精灯上烧热后,塞紧橡皮塞同时玻璃管触碰瓶底的白磷后发生燃烧反应。下列说法正确的是(????)
A. 白磷必须过量,否则会影响实验结果
B. 实验中反应的化学方程式为4P+5O2=2P2O5
C. 燃烧后玻璃管顶端的小气球始终胀大
D. 燃烧时有大量白烟生成
过氧化钠(Na2O2)可做呼吸面具中氧气的来源。它与二氧化碳反应后的生成物为(????)
A. Na2CO3 B. Na2O和O2 C. NaOH和O2 D. Na2CO3和O2
在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
下列说法中,不正确的是?
A. 反应后物质甲的质量为13g B. 该化学反应类型是分解反应
C. 反应中乙、丁的质量比为5∶4 D. 物质丙可能是该反应的催化剂
在一个密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识错误的是(???? )
物质
X
Y
Z
Q
反应前质量(g)
20
2
1
37
反应后质量(g)
未测
32
1
12
A. 物质Z可能是该反应的催化剂 B. 物质Y一定是单质
C. 反应中Y、Q的质量比为6﹕5 D. 反应后物质X的质量为15g
某化合物R在纯氧中充分燃烧后,只生成水和二氧化碳,则该化合物的组成中(????)
A. 只含有碳元素
B. 只含有氢元素
C. 一定含有碳元素和氢元素,可能含有氧元素
D. 一定含有碳氢氧三种元素
如图表示三种物质在密闭容器中反应一段时间后质量的变化,其反应的基本类型是(????)
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列说法正确的是(????)
A. 丁一定是氧化物
B. 该反应是置换反应
C. 丙一定是该反应的催化剂
D. 反应前后甲和乙变化的质量比为9:8
二、填空题
“不是花中偏爱菊,此花开尽更无花”秋日菊花开时满园飘香,从微观角度解释其原因______,菊香的重要成分是乙酸龙脑酯(C12H20O2),点燃196g的乙酸龙脑酯与480g?O2恰好完全反应,生成440gCO2和180gH2O和xgCO,x=______g,化学方程式为______。
①黑火药燃烧的化学方程式为:S+2KNO3+3C??点燃??x+N2↑+3CO2↑,则x的化学式为______;
②KI的名称是______。
质量守恒定律的定量研究对化学科学发展具有重大作用。
(1)乙炔燃烧放出大量的热,常用于焊接金属,发生的反应的化学方程式为2X+5O2=4CO2+2H2O,其中X化学式为______。
(2)如图为某化学反应的微观模拟图,“”和“”分别表示不同元素的原子:由“”聚集成的物质______(填“可能”或“不可能”)是氧化物,参加反应的两种反应物分子“”与“”的个数比为______。
(3)已知mg镁条放在空气中完全燃烧,生成ng氧化镁(不考虑其它反应),比较m和n的质量关系,m______n(填“大于”、“小于”或“等于”)。
三、实验题
如图是一些探究实验,请回答相关问题。
(1)A实验得出的结论是水是由______组成。
(2)关于B实验的下列说法中,正确的是______(填字母序号)。
A.实验时,红磷的用量不影响最终结果
B.实验前,应先检验装置的气密性
C.点燃红磷前,先用弹簧夹夹紧胶皮管D.红磷熄灭后,应立即打开弹簧夹
(3)C实验能否达到目的并说出理由是______。
小屹同学在学习了实验室制取二氧化碳的原理和装置后,对验证质量守恒定律的实验装置进行了改进:如下图所示,实验前天平平衡。
(制取二氧化碳原理:CaCO3+2HCl=CaCl2+H2O+CO2↑)
?
(1)将注射器中适量的稀盐酸注入锥形瓶中,观察到天平的指针__________________(填“偏左”、“偏右”或“在标尺中央”,下同)。上述实验的反应结束后,松开锥形瓶上的橡皮塞,天平的指针____________________。
(2)结论:为验证质量守恒定律,若有气体参与或生成的实验必须在______________(填“开放”或“密闭”)装置进行探究。
化学的发展趋势是从宏观到微观、由定性到定量。如图是化学反应前后质量测定的实验:
(1)实验结束后,观察到反应后天平不平衡,原因是___________________。
(2)若装置不变,更换烧杯中的反应物也能得出正确的结论。下列几组药品可以选用的是______。
A.铁片和硫酸铜溶液 B.活性炭和水? C.过氧化氢溶液和二氧化锰
答案和解析
1.【答案】D
【解析】【试题剖析】
【试题解析】
解:A、根据质量守恒定律可知,化学反应前后元素的种类保持不变,说明该物质一定含有氢元素和碳元素,可能含有氧元素,二氧化碳中碳元素的质量等于8.8g×1244×100%=2.4g,水中氢元素的质量等于5.4g×218×100%=0.6g,因此氢元素和碳元素的质量之和是2.4g+0.6g=3.0g,说明该物质仅含有碳元素和氢元素,故说法正确;
B、根据质量守恒定律可知,参加反应的氧气的质量为8.8g+5.4g?3g=11.2g,则该反应中O2和CO2的质量比为11.2g:8.8g=14:11,故说法正确;
C、反应中O2和H2O的分子数之比为11.232:5.418=7:6,故说法正确;
D、该纯净物中C、H原子的个数比为2.412:0.61=1:3,故错误。
2.【答案】A
【解答】
由四种物质反应前后各物质的质量分数可知,反应前后甲的质量分数减少了70%?42%=28%,故甲是反应物;反应前乙的质量分数为14%,反应后乙的质量分数为1?42%?40%?10%=8%,乙的质量分数减少了14%?8%=6%,故乙是反应物;反应前丙的质量分数为6%,丙的质量分数增加了40%?6%=34%,丙是生成物;丁的质量分数不变,可能作该反应的催化剂,也可能没有参加反应。
A、参加反应的甲和乙质量比为28%:6%,当乙的质量分数为11%时,减少了14%?11%=3%,则甲的质量分数应减少14%,则a=70%?14%=56%,故选项说法正确;
B、反应后乙的质量分数为1?42%?40%?10%=8%,b=8%,故选项说法错误;
C、生成的丙和参加反应乙质量比为34%:6%,当乙的质量分数为11%时,减少了14%?11%=3%,则丙的质量分数应增加17%,则c=6%+17%=23%,故选项说法错误;
D、丁的质量分数不变,可能作该反应的催化剂,也可能没有参加反应,d=10%,故选项说法错误。
故选A。
3.【答案】D
【解答】
A.反应中有氧气参加,该反应属于氧化反应,故正确;
B.由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式4Ag+2H2S+O2=2X+2H2O,反应前银、氢、硫、氧原子个数分别为4、4、2、2,反应后的生成物中银、氢、硫、氧原子个数分别为0、4、0、2;根据反应前后原子种类、数目不变,则2X分子中含有4个银原子和2个硫原子,则每个X分子由2个银原子和1个硫原子构成,则物质X的化学式为Ag2S,故正确;
C.由质量守恒定律可知,反应前后元素的种类不变,故正确;
D.在反应4Ag+2H2S+O2=2Ag2S+2H2O,中硫元素和氢元素的化合价在反应前后不变,故错误。
故选D。
4.【答案】A
【解答】
A.在水中加入少量硫酸钠以增强导电性,故说法正确;
B.由电解水的装置可知,负极产生的气体较多,是H2,氢气具有可燃性,不能使带火星的木条复燃,故说法错误;
C.电解水时,正极产生的是氧气,负极产生的是氢气,氢气和氧气的体积比约为2:1,故说法错误;
D.电解水生成了氢气和氧气,说明了水是由氢、氧两种元素组成的,故说法错误。
故选A。
5.【答案】D
【解析】解:A、一氧化碳、二氧化碳都是由碳元素和氧元素组成的,故选项说法正确。
B、氧气是由氧分子构成的,保持氧气化学性质的最小微粒是氧气分子,故选项说法正确。
C、氧化镁在一定条件下可直接转化为金属镁,如电解熔融氧化镁时,氧化镁分解生成镁和氧气,该选项说法正确;
D、氢气和氧气反应的化学方程式为:2H2+O2??点燃??2H2O,在此反应中氢气、氧气和水的质量比为4:32:36=1:8:9,18g氢气和18g氧气反应,氢气有剩余,生成水的质量小于36g,故选项说法错误。
故选:D。
6.【答案】C
【解析】解:由反应的化学方程式H2SO4+Na2S2O3=Na2SO4+S↓+R+H2O,可知反应前后各原子的个数分别为
????? 反应前? 反应后
H原子??? 2????? 2
S原子??? 3????? 2
O原子??? 7????? 5
Na原子?? 2????? 2
根据化学变化前后原子的种类、数目不变,生成物R的每个分子由1个S原子和2个O原子构成,则物质R的化学式可表示为SO2;
7.【答案】D
【解析】解:A、丙反应前后质量不变,可能是该反应的催化剂,该选项说法正确;
B、x=14+26+3+5?2?3?36=7,该选项说法正确;
C、反应后甲、乙质量减小,是反应物,丁质量增大,是生成物,丁中的元素和甲、乙物质中的元素质量相同,因此丁一定是化合物,该选项说法正确;
D、参加反应的甲和乙质量比为:(14?2):(26?7)=12:19,该选项说法不正确。
8.【答案】B
【解答】
由表中数据分析可知,反应前后甲的质量增多了40g?30g=10g,故是生成物,生成的质量为10g;乙的质量不变,可能作该反应的催化剂,也可能没有参加反应;同理可以确定丁是生成物,生成的质量为43g?30g=13g;由质量守恒定律,丙应是反应物,且反应的质量为10g+13g=23g,故待测数值为30?23=7。
A.反应中甲和丁的质量比为10:13,故错误。??? ??
B.该反应由丙物质生成了甲和丁,由一种物质生成了两种物质,是分解反应,故正确;
C.乙可能是该反应的是催化剂,故错误;
D.由以上计算可知,待测值为7,故错误。
9.【答案】D
【解析】解:根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。化学反应的过程,就是参加反应的各物质(反应物)的原子,重新组合而生成其他物质的过程。在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。
10.【答案】D
【解析】解:A、由质量守恒定律,参加化学反应的各物质的质量之和等于生成的各物质的质量之和,红磷的用量多少不会影响实验结果,故错误;
B、该化学方程式缺少反应条件,正确的化学方程式应为:4P+5O2??点燃??2P2O5,故错误;
C、白磷燃烧放出大量的热,锥形瓶内的压强增大,气球膨胀;装置冷却后由于消耗氧气,气球又变小,故错误;
D、白磷燃烧产生大量白色烟,故正确;
11.【答案】D
【解析】解:A、过氧化钠(Na2O2)可做呼吸面具中氧气的来源,则与二氧化碳反应后的生成物为碳酸钠和氧气,不只是碳酸钠,故选项错误。
B、过氧化钠(Na2O2)可做呼吸面具中氧气的来源,由质量守恒定律,反应前后元素种类不变,则与二氧化碳反应后的生成物不可能为Na2O和O2,故选项错误。
C、过氧化钠(Na2O2)可做呼吸面具中氧气的来源,由质量守恒定律,反应前后元素种类不变,则与二氧化碳反应后的生成物不可能为氢氧化钠和氧气,故选项错误。
D、过氧化钠(Na2O2)可做呼吸面具中氧气的来源,则与二氧化碳反应后的生成物为碳酸钠和氧气,故选项正确。
12.【答案】B
【解答】
A.根据质量守恒定律,反应前后物质的总质量不变,所以18+1+2+32=X+26+2+12,解得X=13,故A正确;
B.由分析可知,该反应中反应物是甲和丁,生成物是乙,该反应由两种物质生成了一种物质,不属于分解反应,故B错误;
C.反应中乙、丁的质量比为:(26?1)g:(32?12)g=5:4,故C正确;
D.通过分析知,丙质量不变,可能是催化剂,故D正确。
故选B。
13.【答案】B
【解答】
由题意可知,根据质量守恒定律,反应前各物质的质量总和=反应后各物质的质量总和,设未测值为m,则可列式:20+2+1+37=m+32+1+12,解得m=15;
A.物质Z的质量在反应前后不变,可能是该反应的催化剂,故A正确,不符合题意;
B.由分析知,参加反应的X的质量为20g?15g=5g,生成的Y是32g?2g=30g,参加反应的Q质量为37g?12g=25g,所以该反应是X+Q→Y,所以物质Y一定是化合物,故B不正确,符合题意;
C.反应中Y、Q的质量比为30g:25g=6:5,故C正确,不符合题意;
D.由开始计算可得,反应后物质X的质量为15g,故D正确,不符合题意。
故选B。
14.【答案】C
【解析】解:某化合物R在纯氧中充分燃烧后,只生成二氧化碳和水,二氧化碳和水两种物质中含有碳、氧、氢三种元素,根据质量守恒定律,反应前后,元素种类不变,则某化合物中一定含有碳元素和氢元素,可能含有氧元素.
15.【答案】B
【解析】解:由四种物质在密闭容器中反应一段时间后质量的变化图,A物质反应后质量减少,是反应物;B物质反应后质量增加,是生成物;C物质反应后质量增加,是生成物;故该反应的反应物是A,生成物是B和C,该反应符合“一变多”的特征,属于分解反应。
16.【答案】D
【解析】解:由表中数据分析可知,反应前后甲的质量增加了50g?32g=18g,故是生成物,反应生成甲的质量为18g;同理可以确定乙是反应物,反应的乙的质量为40g?14g=16g;丙的质量不变,可能作该反应的催化剂,也可能没有参加反应;丁是反应物,反应的丁的质量为20g?18g=2g。
A、该反应的反应物为乙和丁,生成物是甲,符合“多变一”的形式,属于化合反应,丁可能是化合物,故选项说法错误。
B、该反应的反应物为乙和丁,生成物是甲,符合“多变一”的形式,属于化合反应,故选项说法错误。
C、丙的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
D、反应前后甲和乙变化的质量比为18g:16g=9:8,故选项说法正确。
17.【答案】分子在不断的运动? 56? C12H20O2+15O2??点燃??10H2O+10CO2+2CO
【解析】解:秋日菊花开时满园飘香,说明分子是不断运动的;
x=196g+480g?440g?180g=56g;
反应的乙酸龙脑酯、氧气和生成的水、二氧化碳、一氧化碳分子个数比:196g196:480g32:180g18:440g44:56g28=1:15:10:10:2,因此反应的化学方程式为:
C12H20O2+15O2??点燃??10H2O+10CO2+2CO。
18.【答案】K2S? 碘化钾
【解析】解:①由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前硫、碳、钾、氮、氧、碳原子个数分别为1、2、2、6、3,反应后的生成物中硫、碳、钾、氮、氧、碳原子个数分别为0、0、2、6、3,根据反应前后原子种类、数目不变,则每个x分子由1个钾原子、2个硫原子构成,则物质X的化学式为K2S。
②KI从右向左读,读作碘化钾。
故答案为:
①K2S;
②碘化钾。
19.【答案】C2H2? 可能? 2:1? 小于
【解析】解:(1)根据反应的化学方程式2X+5O2=4CO2+2H2O,反应物中氧原子个数为10,反应后的生成物中碳、氢、氧原子个数分别为4、4、10,根据反应前后原子种类、数目不变,2X含有4个碳原子和4个氢原子,则每个X分子2个碳原子和2个氢原子构成,则物质X的化学式为:C2H2。
(2)”和“”分别表示不同元素的原子:若一种原子是氧原子,由“”聚集成的物质就是氧化物;由微粒的变化可知,有一个未参加反应,所以参加反应的两种反应物分子“”与“”的个数比为2:1。
(3)由于镁在燃烧时与氧气反应生成了氧化镁,由质量守恒定律可知,参加反应镁的质量和氧气的质量之和等于氧化镁的质量,所以m和n的质量关系是:m小于n。
故答案为:(1)C2H2。
(2)可能;2:1。
(3)小于。
20.【答案】氢元素、氧元素 ? BC ? 不能,这是因为反应生成的二氧化碳逸出装置,导致天平失去平衡
【解析】解:(1)A实验中,电解水生成氢气和氧气,得出的结论是水是由氢元素、氧元素组成。
故填:氢元素、氧元素。
(2)A.实验时,红磷的用量影响最终结果,如果红磷不足,会导致实验结果偏小,该选项说法不正确;
B.实验前,应先检验装置的气密性,该选项说法正确;
C.点燃红磷前,先用弹簧夹夹紧胶皮管,防止集气瓶中的气体膨胀逸出,影响实验结果,该选项说法正确;
D.红磷熄灭后,不能立即打开弹簧夹,应该冷却至室温后打开弹簧夹,该选项说法不正确。
21.【答案】(1)在标尺中央,偏右
(2)密闭
【解答】
(1)稀盐酸和碳酸钙反应生成氯化钙,水和二氧化碳,由于是在密闭的装置内反应的,参加化学反应的各物质的质量总和等于生成的各物质的质量总和,故天平指针在标尺中央;实验的反应结束后,松开锥形瓶上的橡皮塞,生成的二氧化碳会飘逸到空气中,导致测得的质量偏小,天平的指针偏右,
故答案是:在标尺中央,偏右;
(2)为验证质量守恒定律,若有气体参与或生成的实验必须在密闭装置进行探究,
故答案是:密闭。
22.【答案】?(1)产生的二氧化碳气体进入到空气中;
(2)A
?
【解答】
(1)由于盐酸与碳酸钠粉末反应,生成氯化钠、水和二氧化碳,产生的二氧化碳气体进入到空气中,因此反应后的天平不平衡;
(2)A.铁片和硫酸铜溶液反应,生成铜和硫酸亚铁,没有气体生成,反应后天平保持平衡,故A正确;
B.活性炭和水不发生化学反应,因此不能验证质量守恒定律,故B错误;
C.过氧化氢溶液和二氧化锰混合之后,生成水和氧气,氧气会进入空气中,天平不会平衡,故C错误;
故选A。
故答案为:(1)产生的二氧化碳气体进入到空气中;(2)A。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
