溶解度(提高)—浙教版八年级科学上册讲义 (机构专用)(含答案)
文档属性
| 名称 | 溶解度(提高)—浙教版八年级科学上册讲义 (机构专用)(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 232.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-01-04 18:59:38 | ||
图片预览


文档简介
学科教师辅导讲义
学员编号:1 年 级:九年级 课 时 数:
学员姓名: 辅导科目:科学 学科教师:
授课类型
授课日期及时段
教学内容
一.固体溶解度
(1)定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。符号为S。
(2)理解溶解度概念
条件
在一定温度下。物质的溶解度会随温度的变化而变化,不指明温度时,溶解度没有意义。
标准
在100g溶剂里。这是概念中规定的标准,物质溶解量的多少与溶剂量的多少成正比,要比较物质溶解度的大小,必须要等量溶剂。此处100g是指溶剂质量,而不是溶液质量。
状态
“饱和”。规定只有在一定量溶剂中(100g)达到饱和时(溶解质的最大量),所溶解的溶质的质量才是一个确定的值。
单位
“g”。因为溶解度实质上是被溶解的溶质的质量。
溶解度计算:通过溶解度可得到该温度下物质的饱和溶液中,溶质、溶剂和饱和溶液之间的质量关系,即m(溶质):m(溶剂):m(饱和溶液)=S:100g:(100g+S)。
(4)影响因素
①内因:溶质和溶剂本身的性质。
②外因:温度。温度对影响分三种情况:
→大多数固体物质的溶解度随温度的升高而增大,如硝酸钾、蔗糖等。
→少数固体物质的溶解度受温度影响不大,如氯化钠。
→极少数固体物质的溶解度随温度的升高而减小,如氢氧化钙(俗称熟石灰)。
(5)溶解性和溶解度的关系
溶解度/g(20℃)
<0.01
0.01~1
1~10
>10
溶解性分类
难溶
微溶
可溶
易溶
二.影响气体溶解度大小的因素
1.压强 :气体溶解度随压强增大而增大,减小而减小。
2.温度:气体溶解度随温度升高而减小,降低而增大。
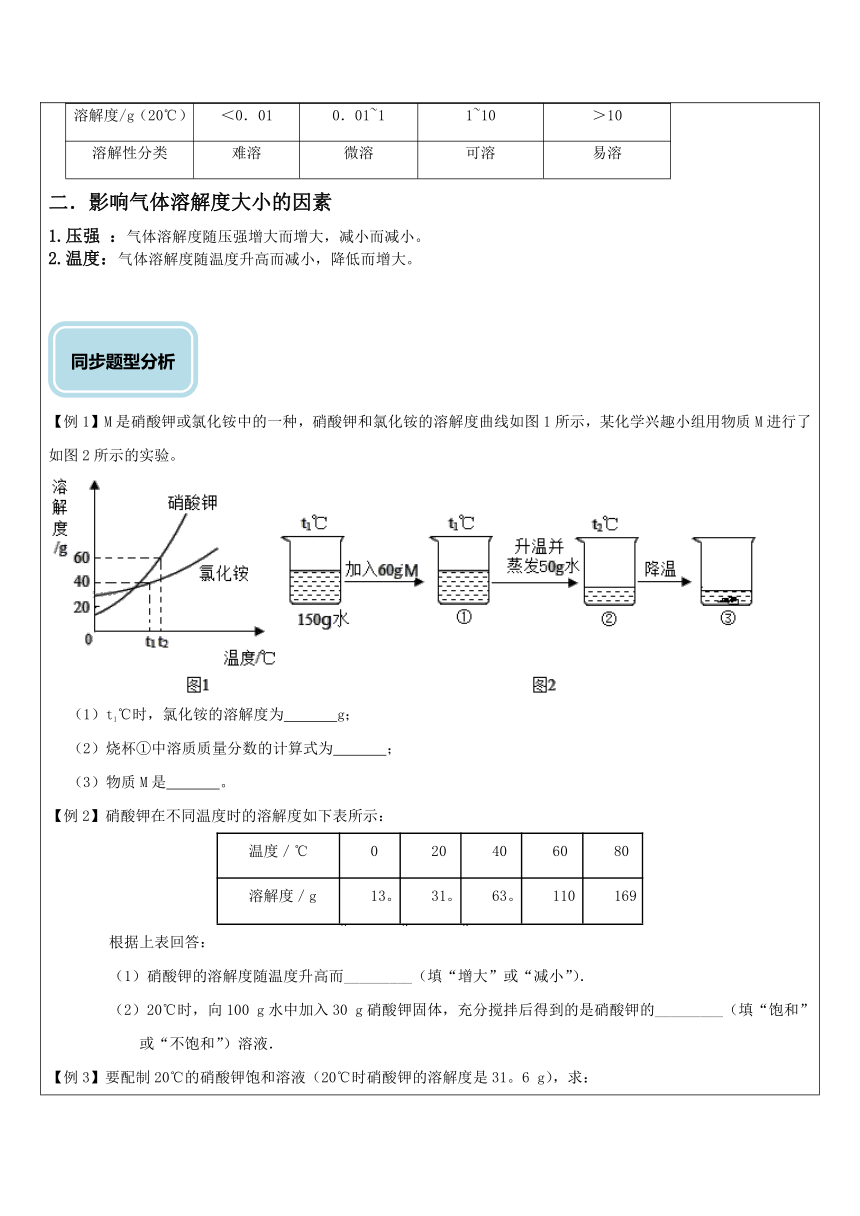
【例1】M是硝酸钾或氯化铵中的一种,硝酸钾和氯化铵的溶解度曲线如图1所示,某化学兴趣小组用物质M进行了如图2所示的实验。
(1)t1℃时,氯化铵的溶解度为 g;
(2)烧杯①中溶质质量分数的计算式为 ;
(3)物质M是 。
【例2】硝酸钾在不同温度时的溶解度如下表所示:
温度/℃
0
20
40
60
80
溶解度/g
13。3
31。6
63。6
110
169
根据上表回答:
(1)硝酸钾的溶解度随温度升高而_________(填“增大”或“减小”).
(2)20℃时,向100 g水中加入30 g硝酸钾固体,充分搅拌后得到的是硝酸钾的_________(填“饱和”或“不饱和”)溶液.
【例3】要配制20℃的硝酸钾饱和溶液(20℃时硝酸钾的溶解度是31。6 g),求:
(1)把20 g硝酸钾溶解到多少克水中就达到饱和状态?
(2)在50 g水中加硝酸钾多少克就达到饱和状态?
1.一定温度下,将100克某硝酸钾不饱和溶液加入5克硝酸钾或恒温蒸发掉10克水,都能成为该温度下的饱和溶液,则该温度下硝酸钾的溶解度为( )
A.50g B.60g C.70g D.80g
2.在一定温度下,向饱和的氯化钠溶液中不断加入氯化钠固体,并搅拌;溶液的质量(b)与加入氯化钠质量(a)的变化关系如下图所示,正确的是( )
B. C. D.
3.地球深处的水处于超临界状态,称为超临界水,如图为某压强下氯化钙(CaCl2)和氯化钠(NaCl)在超临界水中的溶解度曲线,该压强下,下列说法正确的是( )?
A.在超临界水中,氯化钠的溶解度大于氯化钙的溶解度
B.在超临界水中,2种物质的溶解度都随温度升高而增大
C.450℃时,氯化钠在超临界水中的溶解度为0.04 g
D.450℃时,可得到0.04%的氯化钙的超临界水溶液
4.在盛有20毫升水的烧杯中,加入一药匙蔗糖,搅拌后蔗糖很快溶解;再向杯中加入一药匙蔗糖,搅拌后有部分蔗糖不再溶解。由此可以得出的结论是( )
A.物质能够溶解的数量是无限的
B.加入的蔗糖越多,能够溶解的数量也越多
C.在一定条件下,物质能够溶解的数量是有限的
D.在20毫升的水中,不能溶解一药匙蔗糖
5.小明同学往一杯水中加了一勺蔗糖,搅拌后发现蔗糖全部溶解;在相同条件下食盐却不能全部溶解。这说明物质的溶解能力与某个因素有关,该因素是( )
A.温度高低 B.物质本身的性质 C.水的多少 D.时间的长短
6.关于溶液下列说法正确的是(???? )
A.饱和溶液一定是浓溶液
B.t℃时,100克某物质的饱和溶液中含该溶质18克,则该物质在t℃时溶解度是18克
C.饱和溶液指一定温度下一定量溶剂中不能继续溶解某种溶质的溶液???????????
D.不饱和溶液加溶剂可以变为饱和溶液
7.20℃时,取甲、乙、丙、丁四种纯净物各 20g,分别加入到四个各盛有 50g 水的烧杯中,充分溶解,其溶解情况如下表:
物质
甲
乙
丙
丁
未溶解固体的质量/g
4。2
2
0
9。2
下列说法正确的是(??? )
?A.所得四杯溶液都是饱和溶液????????????????????????????????
B.丁溶液的溶质质量分数最大
C.20℃时四种物质溶解度的关系为:丙>乙>甲>丁??????????
D.四杯溶液中溶剂的质量大小为:丙溶液>乙溶液>甲溶液>丁溶液
8.30℃时氯酸钾的溶解度是10克,现用50克水配制30℃的氯酸钾饱和溶液,需氯酸钾的质量是(????)
A.15克??????? ?? B.10克?????? ?
C.5克????? ??D.4。55
9.在相同温度下,同种溶剂A、B、C三种物质的溶解度关系为:A>B>C,则同质量的以上三种饱和溶液中溶剂的量为(????)
A.A>B>C????? ?B.A>C>B???? ??
C.A<B<C????? D.B>C>A
10、将消石灰的不饱和溶液变成饱和溶液,可采取的方法是( )
①蒸发溶剂 ②加入溶质 ③升高温度 ④降低温度
A.① B.①② C.①②③ D.①②④
11.甲、乙的溶解度曲线如图,将t2℃甲、乙的饱和溶液分别降温到t1℃.下列说法一定正确的是( )
甲溶液仍饱和
B.两溶液仍饱和
C.溶质质量分数:甲=乙
D.溶液质量:甲=乙
12.硝酸钾的溶解度随温度的变化如表所示。如图所示,质量为m的小球悬浮在50℃硝酸钾溶液中,烧杯底部还留有一定量的硝酸钾固体,此时小球受到的浮力是F甲,硝酸钾溶液的密度是ρ甲;当温度下降到20℃时,小球受到的浮力是F乙,硝酸钾溶液的密度是ρ乙.此过程中能够溶液体积变化忽略不计,则由以上信息可知( )
温度(℃)
10
20
30
40
50
60
溶解度(克)
20.9
31.6
45.8
63.9
85.8
110
A.F甲<F乙,ρ甲>ρ乙 B.F甲>F乙,ρ甲>ρ乙
C.F甲<F乙,ρ甲<ρ乙 D.F甲>F乙,ρ甲<ρ乙
13.已知硝酸钾在不同温度下的溶解度如下表,下列说法错误的是(??? )
温度/℃
0
10
20
30
40
50
溶解度/g
13。3
20。9
31。6
45。8
63。9
85。5
A.?20℃时,饱和硝酸钾溶液的溶解度为31。6g??????????
B.硝酸钾的溶解度随着温度升高而增大
C.30℃时,145。8g硝酸钾饱和溶液中含有45。8g溶质??????????
D.将40℃的硝酸钾溶液降温至20℃,不一定有晶体析出
14.20℃时50克水中最多可溶解5克A物质,40℃时100克水中最多可溶解10克B物质,则A和B的溶解度相比是(???? )
A>B?????????B.B>A???????? C.A=B???????????? D.无法比较
15.向一接近饱和的硝酸钾溶液中,逐渐加硝酸钾晶体,下列图象中符合溶液中溶质质量变化规律的是( )
A. B. C.D.
【溶液计算】
填空题(每空3分,共27分。)
质量分数为5%的食盐水,其中5%表示100克该食盐溶液里含有 克食盐和 克水。
在20℃时,100克5%的食盐溶液温度升高到60℃(忽略水分的蒸发),则溶质的质量分数为 ;若将该溶液恒温蒸发水分,则溶液中溶质的质量分数会 (填“增大”、“减小”、“不变”);在20℃时,当溶液成为 时,该溶液的质量分数最大,其最大值为 。(20℃时,食盐的溶解度为36克。)
一定温度下将a%的硝酸钾溶液分成两等份,一份恒温蒸发10克水,得到m克无水晶体;另一份恒温蒸发20克水,得到3m 克无水晶体。则该温度下硝酸钾的溶液度为 。
甲、乙两种物质的溶解度曲线如图所示,根据图中信息回答:
在 时,甲、乙两种物质的溶解度相等。
在t2℃时,把60克甲物质与50克水充分溶解,所得溶液质量分数为 。
实验题(每空2分,共20分。)
5、下图是某同学配制100g9.2%的食盐溶液的全过程,
(1)请找出图中的错误(至少两处)
① ②
(2)在配制100g 9.2%的食盐溶液时,该同学将食盐放于天平的右盘,游码移至0.2g处,左盘上放置的砝码质量是9g,则该同学需要称取的质量是 g.若正确操作,实际所称取的氯化钠质量是 g.
(3)配制此食盐溶液时:
①主要步骤是: 、 、 、 .
②下列仪器在配制溶液过程中不可能用到的是 (填序号)
A、胶头滴管 B、漏斗 C、玻璃棒 D、量筒 E、酒精灯 F、托盘天平 G、药匙
(4)如果其他操作正确,在量取溶剂时,仰视了量筒的刻度,所得溶液质量分数将 .
三、计算题(共43分)
6、氯化钠俗名食盐是工业生产和生活的一种重要原料,也是实验室里常见的一种药品.下表是20℃时,氯化钠溶解于水的实验数据,回答下列问题;
实验序号
水的质量(g)
加入氯化钠的质量(g)
溶液的质量(g)
①
10
2
12
②
10
3
13
③
10
4
13.6
④
10
5
m
(1)表中 m= ;(4分)
(2)在这4次实验中,得到的是20℃氯化钠溶液属于饱和溶液的是 (填实验序号,4分)
(3)计算第3次实验得到的氯化钠溶液的溶质质量分数.(写出过程,6分)
(4)20℃时,实验室把100克溶质质量分数为20%的氯化钠溶液释成5%的氯化钠溶液,需加水多少克?(写出过程,6分)
配制100毫升溶质的质量分数为49%的稀硫酸(密度为0.9克/厘米3),需要98%的浓硫酸(密度为1.80克/厘米3)多少毫升?(写出过程,6分)
如图是酒精的试剂瓶标签部分内容。回答问题
(1)未开启前,该瓶液体的质量是多少克?(写出过程,4分)
(2)欲配制200克溶质质量分数为75%的酒精溶液,需要取这种酒精多少毫升?需要水多少毫升?(写出过程,4分+4分)
酒精 500ml
密度:0.81克/厘米3 质量分数:95%
9、现有60克质量分数为10%的氯化钠溶液,欲使其溶质质量分数增大一倍:(写出过程,5分+5分+5分)
若采用蒸发溶剂的方法,则需要蒸发多少克溶剂?
若采用加入溶质的方法,应该加入多少克溶质氯化钠?
若采用加入浓溶液的方法,应该加入40%的浓溶液多少克?
实验探究答案
【溶液计算】
5;95.
5%;不变;饱和溶液;26.47%。
20m 克
t ;47.4%
(1)①瓶塞没有倒放在桌面上②左物右码放反了位置不能用玻璃棒搅拌
(2)9.2;8.8克。
(3)①计算、称量和量取、溶解、装瓶贴标签;②BE
(4)偏小
6、(1)13.6;(2)③④;(3)26.47%;(4)300g。
7、 25毫升
(1)405g; (2)194.93毫升;42.1毫升。
(1)30g;(2)7.5g;(3)30g.
学员编号:1 年 级:九年级 课 时 数:
学员姓名: 辅导科目:科学 学科教师:
授课类型
授课日期及时段
教学内容
一.固体溶解度
(1)定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。符号为S。
(2)理解溶解度概念
条件
在一定温度下。物质的溶解度会随温度的变化而变化,不指明温度时,溶解度没有意义。
标准
在100g溶剂里。这是概念中规定的标准,物质溶解量的多少与溶剂量的多少成正比,要比较物质溶解度的大小,必须要等量溶剂。此处100g是指溶剂质量,而不是溶液质量。
状态
“饱和”。规定只有在一定量溶剂中(100g)达到饱和时(溶解质的最大量),所溶解的溶质的质量才是一个确定的值。
单位
“g”。因为溶解度实质上是被溶解的溶质的质量。
溶解度计算:通过溶解度可得到该温度下物质的饱和溶液中,溶质、溶剂和饱和溶液之间的质量关系,即m(溶质):m(溶剂):m(饱和溶液)=S:100g:(100g+S)。
(4)影响因素
①内因:溶质和溶剂本身的性质。
②外因:温度。温度对影响分三种情况:
→大多数固体物质的溶解度随温度的升高而增大,如硝酸钾、蔗糖等。
→少数固体物质的溶解度受温度影响不大,如氯化钠。
→极少数固体物质的溶解度随温度的升高而减小,如氢氧化钙(俗称熟石灰)。
(5)溶解性和溶解度的关系
溶解度/g(20℃)
<0.01
0.01~1
1~10
>10
溶解性分类
难溶
微溶
可溶
易溶
二.影响气体溶解度大小的因素
1.压强 :气体溶解度随压强增大而增大,减小而减小。
2.温度:气体溶解度随温度升高而减小,降低而增大。
【例1】M是硝酸钾或氯化铵中的一种,硝酸钾和氯化铵的溶解度曲线如图1所示,某化学兴趣小组用物质M进行了如图2所示的实验。
(1)t1℃时,氯化铵的溶解度为 g;
(2)烧杯①中溶质质量分数的计算式为 ;
(3)物质M是 。
【例2】硝酸钾在不同温度时的溶解度如下表所示:
温度/℃
0
20
40
60
80
溶解度/g
13。3
31。6
63。6
110
169
根据上表回答:
(1)硝酸钾的溶解度随温度升高而_________(填“增大”或“减小”).
(2)20℃时,向100 g水中加入30 g硝酸钾固体,充分搅拌后得到的是硝酸钾的_________(填“饱和”或“不饱和”)溶液.
【例3】要配制20℃的硝酸钾饱和溶液(20℃时硝酸钾的溶解度是31。6 g),求:
(1)把20 g硝酸钾溶解到多少克水中就达到饱和状态?
(2)在50 g水中加硝酸钾多少克就达到饱和状态?
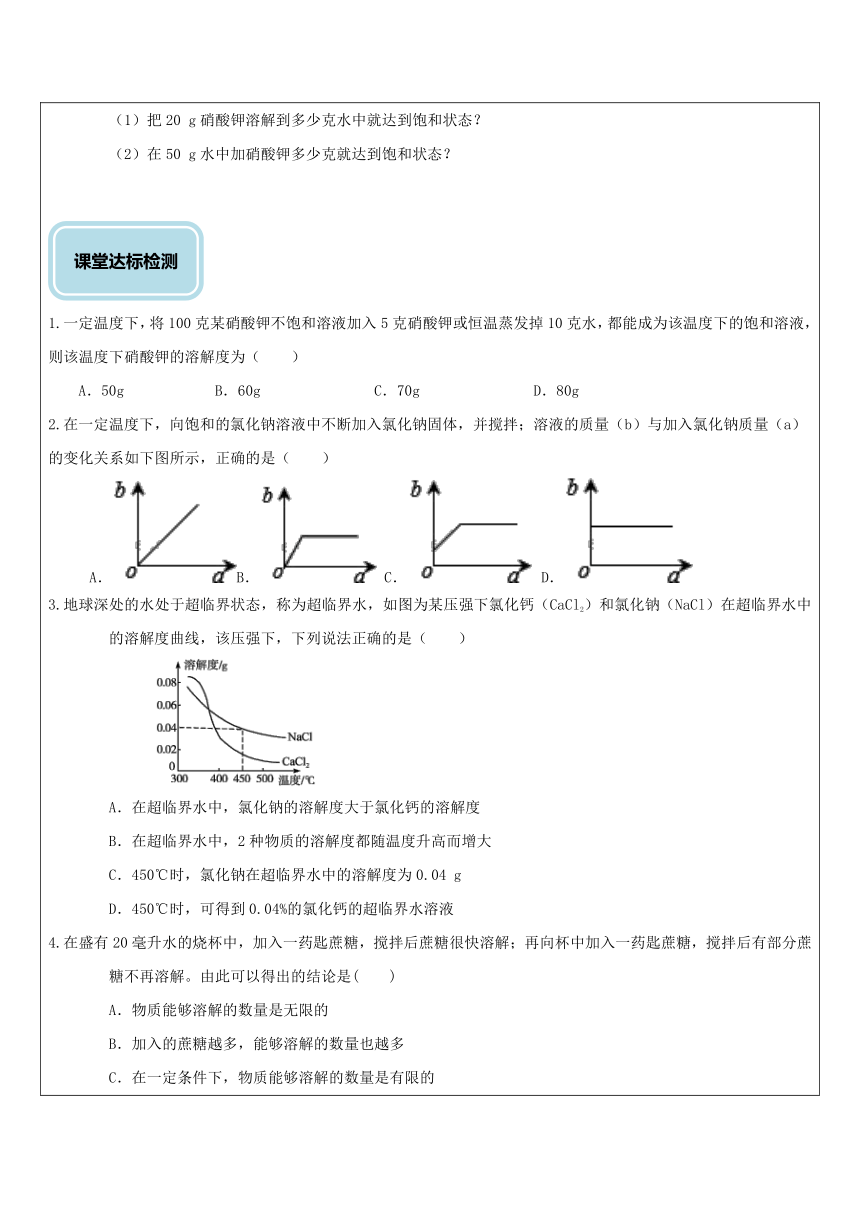
1.一定温度下,将100克某硝酸钾不饱和溶液加入5克硝酸钾或恒温蒸发掉10克水,都能成为该温度下的饱和溶液,则该温度下硝酸钾的溶解度为( )
A.50g B.60g C.70g D.80g
2.在一定温度下,向饱和的氯化钠溶液中不断加入氯化钠固体,并搅拌;溶液的质量(b)与加入氯化钠质量(a)的变化关系如下图所示,正确的是( )
B. C. D.
3.地球深处的水处于超临界状态,称为超临界水,如图为某压强下氯化钙(CaCl2)和氯化钠(NaCl)在超临界水中的溶解度曲线,该压强下,下列说法正确的是( )?
A.在超临界水中,氯化钠的溶解度大于氯化钙的溶解度
B.在超临界水中,2种物质的溶解度都随温度升高而增大
C.450℃时,氯化钠在超临界水中的溶解度为0.04 g
D.450℃时,可得到0.04%的氯化钙的超临界水溶液
4.在盛有20毫升水的烧杯中,加入一药匙蔗糖,搅拌后蔗糖很快溶解;再向杯中加入一药匙蔗糖,搅拌后有部分蔗糖不再溶解。由此可以得出的结论是( )
A.物质能够溶解的数量是无限的
B.加入的蔗糖越多,能够溶解的数量也越多
C.在一定条件下,物质能够溶解的数量是有限的
D.在20毫升的水中,不能溶解一药匙蔗糖
5.小明同学往一杯水中加了一勺蔗糖,搅拌后发现蔗糖全部溶解;在相同条件下食盐却不能全部溶解。这说明物质的溶解能力与某个因素有关,该因素是( )
A.温度高低 B.物质本身的性质 C.水的多少 D.时间的长短
6.关于溶液下列说法正确的是(???? )
A.饱和溶液一定是浓溶液
B.t℃时,100克某物质的饱和溶液中含该溶质18克,则该物质在t℃时溶解度是18克
C.饱和溶液指一定温度下一定量溶剂中不能继续溶解某种溶质的溶液???????????
D.不饱和溶液加溶剂可以变为饱和溶液
7.20℃时,取甲、乙、丙、丁四种纯净物各 20g,分别加入到四个各盛有 50g 水的烧杯中,充分溶解,其溶解情况如下表:
物质
甲
乙
丙
丁
未溶解固体的质量/g
4。2
2
0
9。2
下列说法正确的是(??? )
?A.所得四杯溶液都是饱和溶液????????????????????????????????
B.丁溶液的溶质质量分数最大
C.20℃时四种物质溶解度的关系为:丙>乙>甲>丁??????????
D.四杯溶液中溶剂的质量大小为:丙溶液>乙溶液>甲溶液>丁溶液
8.30℃时氯酸钾的溶解度是10克,现用50克水配制30℃的氯酸钾饱和溶液,需氯酸钾的质量是(????)
A.15克??????? ?? B.10克?????? ?
C.5克????? ??D.4。55
9.在相同温度下,同种溶剂A、B、C三种物质的溶解度关系为:A>B>C,则同质量的以上三种饱和溶液中溶剂的量为(????)
A.A>B>C????? ?B.A>C>B???? ??
C.A<B<C????? D.B>C>A
10、将消石灰的不饱和溶液变成饱和溶液,可采取的方法是( )
①蒸发溶剂 ②加入溶质 ③升高温度 ④降低温度
A.① B.①② C.①②③ D.①②④
11.甲、乙的溶解度曲线如图,将t2℃甲、乙的饱和溶液分别降温到t1℃.下列说法一定正确的是( )
甲溶液仍饱和
B.两溶液仍饱和
C.溶质质量分数:甲=乙
D.溶液质量:甲=乙
12.硝酸钾的溶解度随温度的变化如表所示。如图所示,质量为m的小球悬浮在50℃硝酸钾溶液中,烧杯底部还留有一定量的硝酸钾固体,此时小球受到的浮力是F甲,硝酸钾溶液的密度是ρ甲;当温度下降到20℃时,小球受到的浮力是F乙,硝酸钾溶液的密度是ρ乙.此过程中能够溶液体积变化忽略不计,则由以上信息可知( )
温度(℃)
10
20
30
40
50
60
溶解度(克)
20.9
31.6
45.8
63.9
85.8
110
A.F甲<F乙,ρ甲>ρ乙 B.F甲>F乙,ρ甲>ρ乙
C.F甲<F乙,ρ甲<ρ乙 D.F甲>F乙,ρ甲<ρ乙
13.已知硝酸钾在不同温度下的溶解度如下表,下列说法错误的是(??? )
温度/℃
0
10
20
30
40
50
溶解度/g
13。3
20。9
31。6
45。8
63。9
85。5
A.?20℃时,饱和硝酸钾溶液的溶解度为31。6g??????????
B.硝酸钾的溶解度随着温度升高而增大
C.30℃时,145。8g硝酸钾饱和溶液中含有45。8g溶质??????????
D.将40℃的硝酸钾溶液降温至20℃,不一定有晶体析出
14.20℃时50克水中最多可溶解5克A物质,40℃时100克水中最多可溶解10克B物质,则A和B的溶解度相比是(???? )
A>B?????????B.B>A???????? C.A=B???????????? D.无法比较
15.向一接近饱和的硝酸钾溶液中,逐渐加硝酸钾晶体,下列图象中符合溶液中溶质质量变化规律的是( )
A. B. C.D.
【溶液计算】
填空题(每空3分,共27分。)
质量分数为5%的食盐水,其中5%表示100克该食盐溶液里含有 克食盐和 克水。
在20℃时,100克5%的食盐溶液温度升高到60℃(忽略水分的蒸发),则溶质的质量分数为 ;若将该溶液恒温蒸发水分,则溶液中溶质的质量分数会 (填“增大”、“减小”、“不变”);在20℃时,当溶液成为 时,该溶液的质量分数最大,其最大值为 。(20℃时,食盐的溶解度为36克。)
一定温度下将a%的硝酸钾溶液分成两等份,一份恒温蒸发10克水,得到m克无水晶体;另一份恒温蒸发20克水,得到3m 克无水晶体。则该温度下硝酸钾的溶液度为 。
甲、乙两种物质的溶解度曲线如图所示,根据图中信息回答:
在 时,甲、乙两种物质的溶解度相等。
在t2℃时,把60克甲物质与50克水充分溶解,所得溶液质量分数为 。
实验题(每空2分,共20分。)
5、下图是某同学配制100g9.2%的食盐溶液的全过程,
(1)请找出图中的错误(至少两处)
① ②
(2)在配制100g 9.2%的食盐溶液时,该同学将食盐放于天平的右盘,游码移至0.2g处,左盘上放置的砝码质量是9g,则该同学需要称取的质量是 g.若正确操作,实际所称取的氯化钠质量是 g.
(3)配制此食盐溶液时:
①主要步骤是: 、 、 、 .
②下列仪器在配制溶液过程中不可能用到的是 (填序号)
A、胶头滴管 B、漏斗 C、玻璃棒 D、量筒 E、酒精灯 F、托盘天平 G、药匙
(4)如果其他操作正确,在量取溶剂时,仰视了量筒的刻度,所得溶液质量分数将 .
三、计算题(共43分)
6、氯化钠俗名食盐是工业生产和生活的一种重要原料,也是实验室里常见的一种药品.下表是20℃时,氯化钠溶解于水的实验数据,回答下列问题;
实验序号
水的质量(g)
加入氯化钠的质量(g)
溶液的质量(g)
①
10
2
12
②
10
3
13
③
10
4
13.6
④
10
5
m
(1)表中 m= ;(4分)
(2)在这4次实验中,得到的是20℃氯化钠溶液属于饱和溶液的是 (填实验序号,4分)
(3)计算第3次实验得到的氯化钠溶液的溶质质量分数.(写出过程,6分)
(4)20℃时,实验室把100克溶质质量分数为20%的氯化钠溶液释成5%的氯化钠溶液,需加水多少克?(写出过程,6分)
配制100毫升溶质的质量分数为49%的稀硫酸(密度为0.9克/厘米3),需要98%的浓硫酸(密度为1.80克/厘米3)多少毫升?(写出过程,6分)
如图是酒精的试剂瓶标签部分内容。回答问题
(1)未开启前,该瓶液体的质量是多少克?(写出过程,4分)
(2)欲配制200克溶质质量分数为75%的酒精溶液,需要取这种酒精多少毫升?需要水多少毫升?(写出过程,4分+4分)
酒精 500ml
密度:0.81克/厘米3 质量分数:95%
9、现有60克质量分数为10%的氯化钠溶液,欲使其溶质质量分数增大一倍:(写出过程,5分+5分+5分)
若采用蒸发溶剂的方法,则需要蒸发多少克溶剂?
若采用加入溶质的方法,应该加入多少克溶质氯化钠?
若采用加入浓溶液的方法,应该加入40%的浓溶液多少克?
实验探究答案
【溶液计算】
5;95.
5%;不变;饱和溶液;26.47%。
20m 克
t ;47.4%
(1)①瓶塞没有倒放在桌面上②左物右码放反了位置不能用玻璃棒搅拌
(2)9.2;8.8克。
(3)①计算、称量和量取、溶解、装瓶贴标签;②BE
(4)偏小
6、(1)13.6;(2)③④;(3)26.47%;(4)300g。
7、 25毫升
(1)405g; (2)194.93毫升;42.1毫升。
(1)30g;(2)7.5g;(3)30g.
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
