高中化学鲁科版(2019)必修第一册第二章元素与物质世界第二节电解质的电离 离子反应同步优化含答案
文档属性
| 名称 | 高中化学鲁科版(2019)必修第一册第二章元素与物质世界第二节电解质的电离 离子反应同步优化含答案 |  | |
| 格式 | zip | ||
| 文件大小 | 153.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-04 22:02:32 | ||
图片预览


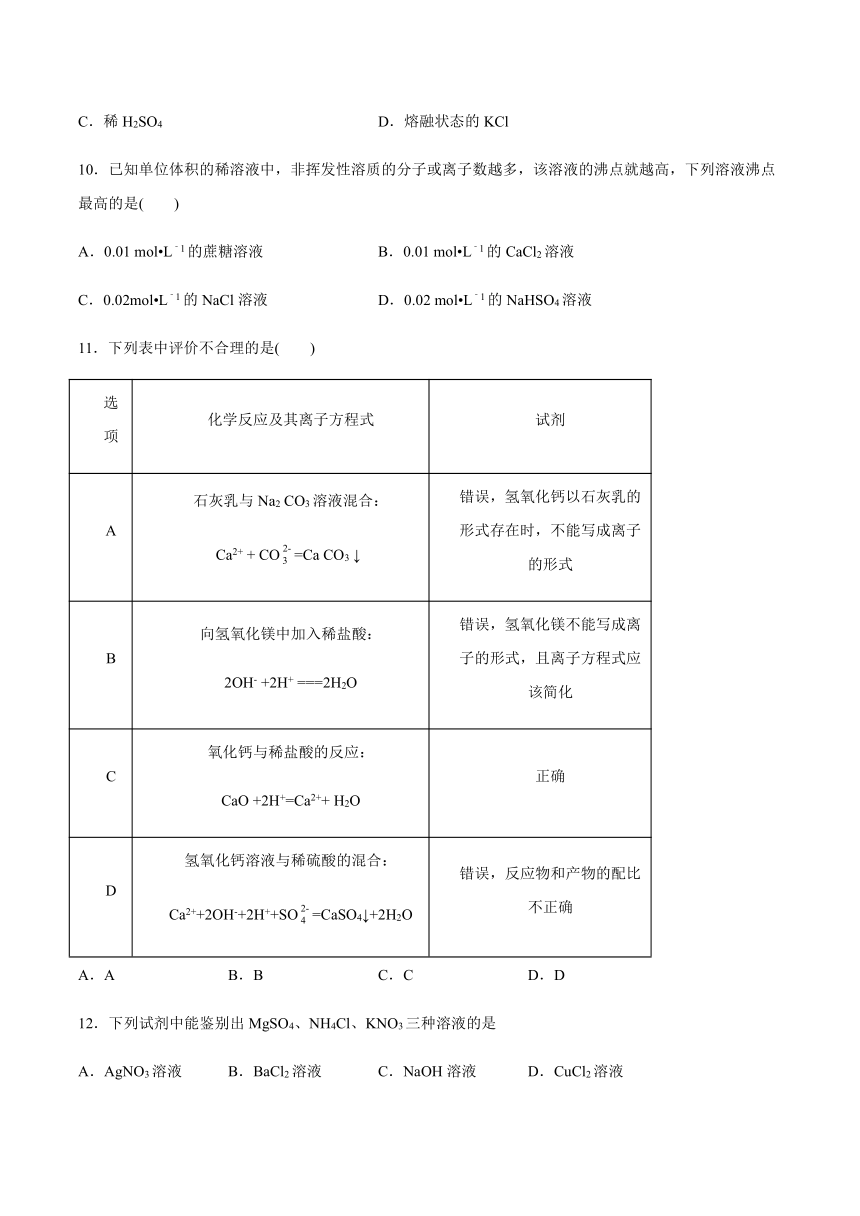
文档简介
高中化学鲁科版(2019)必修第一册第二元素与物质世界第二节电解质的电离
离子反应同步优化
一、单选题
1.下列各组物质,前者为强电解质,后者为弱电解质的是(
)
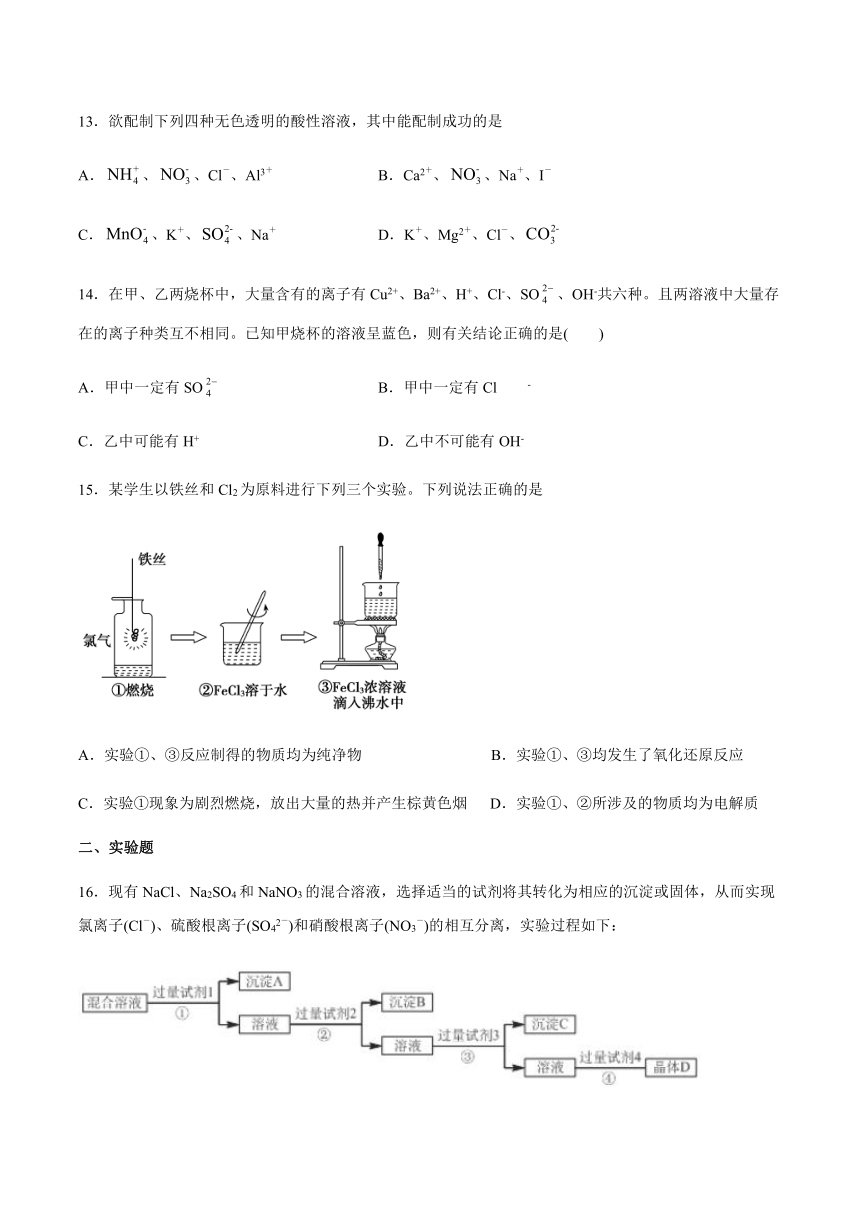
A.硫酸钡、CCl4
B.苛性钠、氨水
C.氯化氢、金刚石
D.氯化钠晶体、硫化氢
2.某溶液中含有K+、HCO、SO等离子,向溶液中加入适量的NaOH固体,溶液中离子的数目显著增加的是(
)
A.HCO
B.K+
C.CO
D.SO
3.下列关于物质分类的说法,正确的个数有(
)
(1)
冰水混合物属于纯净物,高分子化合物属于混合物
(2)
CaCl2、NaOH、HCl、HT四种物质都是化合物
(3)
由同一种元素组成的物质一定是纯净物
(4)
酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系
(5)
NaHSO4、NaHCO3都属于酸式盐,其水溶液都显酸性
(6)
SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物
(7)
NaCl固体不导电,熔融的KCl能导电,所以前者是非电解质,后者是电解质
(8)
强电解质都是离子化合物,弱电解质都是共价化合物
(9)
强电解质溶液的导电性一定比弱电解质溶液的导电性强
(10)胆矾、苛性钠、冰醋酸、氧化钾均是电解质
A.1
B.2
C.3
D.4
4.某溶液中含有0.5mol的硫酸,加入下面某物质后,导电性明显增强,该物质是(
)
A.0.5molBa(OH)2溶液
B.0.5mol的K2SO4固体
C.0.5mol酒精
D.0.5mol水
5.某溶液中含有大量的Cl-、、OH-阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是
①滴加Mg(NO3)2溶液②过滤③滴加Ba(NO3)2溶液④滴加AgNO3溶液
A.①②③②④
B.③②①②④
C.①②④②③
D.④②③②①
6.室温下,下列各组离子在指定溶液中能大量共存的是(
)
A.能使甲基橙变红的溶液:Na+、Ca2+、Br-、
B.=1×10-12的溶液:K+、Na+、、
C.0.1mol/LKFe(SO4)2溶液:Mg2+、Al3+、SCN-、
D.0.1mol/LCa5NH4(NO3)11溶液:H+、Fe2+、Cl-、
7.能用H++OH-=H2O来表示的化学反应是(
)
A.氢氧化铁固体和稀盐酸反应
B.硫酸氢钠滴入氢氧化钡溶液中
C.醋酸滴入烧碱中
D.澄清石灰水和稀硝酸反应
8.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.氢氧化钠与盐酸;氢氧化钠与碳酸
B.BaCl2溶液与H2SO4溶液;
Ba(OH)2溶液与H2SO4溶液
C.BaCl2溶液与AgNO3溶液;HCl溶液与AgNO3溶液
D.Na2CO3溶液与硝酸溶液;CaCO3与硝酸溶液
9.下列物质中导电性最差的是(
)
A.KOH晶体
B.石墨棒
C.稀H2SO4
D.熔融状态的KCl
10.已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高,下列溶液沸点最高的是( )
A.0.01
mol?L﹣1的蔗糖溶液
B.0.01
mol?L﹣1的CaCl2溶液
C.0.02mol?L﹣1的NaCl溶液
D.0.02
mol?L﹣1的NaHSO4溶液
11.下列表中评价不合理的是( )
选项
化学反应及其离子方程式
试剂
A
石灰乳与Na2
CO3溶液混合:
Ca2+
+
CO=Ca
CO3
↓
错误,氢氧化钙以石灰乳的形式存在时,不能写成离子的形式
B
向氢氧化镁中加入稀盐酸:
2OH-
+2H+
===2H2O
错误,氢氧化镁不能写成离子的形式,且离子方程式应该简化
C
氧化钙与稀盐酸的反应:
CaO
+2H+=Ca2++
H2O
正确
D
氢氧化钙溶液与稀硫酸的混合:
Ca2++2OH-+2H++SO=CaSO4↓+2H2O
错误,反应物和产物的配比不正确
A.A
B.B
C.C
D.D
12.下列试剂中能鉴别出MgSO4、NH4Cl、KNO3三种溶液的是
A.AgNO3溶液
B.BaCl2溶液
C.NaOH溶液
D.CuCl2溶液
13.欲配制下列四种无色透明的酸性溶液,其中能配制成功的是
A.、、Cl-、Al3+
B.Ca2+、、Na+、I-
C.、K+、、Na+
D.K+、Mg2+、Cl-、
14.在甲、乙两烧杯中,大量含有的离子有Cu2+、Ba2+、H+、Cl-、SO、OH-共六种。且两溶液中大量存在的离子种类互不相同。已知甲烧杯的溶液呈蓝色,则有关结论正确的是(
)
A.甲中一定有SO
B.甲中一定有Cl-
C.乙中可能有H+
D.乙中不可能有OH-
15.某学生以铁丝和Cl2为原料进行下列三个实验。下列说法正确的是
A.实验①、③反应制得的物质均为纯净物
B.实验①、③均发生了氧化还原反应
C.实验①现象为剧烈燃烧,放出大量的热并产生棕黄色烟
D.实验①、②所涉及的物质均为电解质
二、实验题
16.现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现氯离子(Cl-)、硫酸根离子(SO42-)和硝酸根离子(NO3-)的相互分离,实验过程如下:
试剂3:Na2CO3;试剂4:硝酸
请回答下列问题:
(1)写出试剂②的名称______________。
(2)写出过量Na2CO3的目的是___________________________________________________。
(3)写出混合溶液D与过量硝酸反应的化学方程式:________________________________。
(4)写出操作④的名称______________。
17.(1)13.8g氮的氧化物(NOx)中含N原子数为0.3mol,则NOx的摩尔质量为___,x的数值为___,该质量的NOx在标准状况下的体积为___L。
(2)某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:①
加入过量的稀盐酸,有白色沉淀生成;②
过滤,得无色透明溶液,在滤液中加入过量的稀硫酸,又有白色沉淀生成;③
过滤,取少量滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有___离子;—定不含有__离子;还有____离子不能确定是否存在,要检验这些离子的实验方法是___。
18.过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:
回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有___。
(2)仪器X的主要作用除导气外,还具有的作用是___。
(3)在冰水浴中进行的原因是___。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为___。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是____。
A.无水乙醇
B.浓盐酸
C.Na2SO3溶液
D.CaCl2溶液
(6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
①Fe3+
+H2O2=Fe2++H++HOO·
②H2O2+X=Y
+Z+W(已配平)
③Fe2++·OH=Fe3++OH-
④H+
+OH-=H2O
根据上述机理推导步骤②中的化学方程式为___。
(7)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有____的性质。
A.与水缓慢反应供氧
B.能吸收鱼苗呼出的CO2气体
C.能是水体酸性增强
D.具有强氧化性,可杀菌灭藻
(8)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。
则:所得过氧化钙样品中CaO2的纯度为_____。
19.碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置模拟制备碳酸镧。
(1)盛放稀盐酸的仪器名称为________________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为F→____→____→____→____→______。
(3)W中发生反应的离子方程式为_______Y中发生反应的化学反应方程式为__________
(4)X中盛放的试剂是_________,干燥管的作用为_________________。
(5)Z中通入气体的方式________
A.先通入足量NH3,后通入过量的CO2
B.先通入足量CO2,后通入过量的NH3
C.NH3和CO2同时通入
(6)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为________________,实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,则关于两种物质稳定性实验结论为_____。
A.稳定性La2(CO3)3>La(HCO3)3
B.稳定性La2(CO3)3C.无法判断
参考答案
1.D2.C3.B4.B5.B6.B7.D8.C9.A10.D11.D12.C13.A14.A15.C
16.硝酸银溶液
除去过量的Ba2+和Ag+
Na2CO3+2HNO3=2NaNO3+H2O+CO2
蒸发
17.46g/mol
2
6.72
Ag+
Ba2+
NH4+、Fe3+、K+
焰色反应
18.烧杯、量筒
防止三颈烧瓶中溶液发生倒吸
防止温度过高H2O2分解、有利于晶体析出
Ca2++H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+
A
HOO·+
H2O2=H2O
+
O2
+·OH
ABD
54.00%
19.分液漏斗
A
B
D
E
C
CaCO3+2H+=Ca2++H2O+CO2
NH3·H2O+CaO=Ca(OH)2+NH3↑
饱和NaHCO3溶液
防倒吸
A
La(HCO3)3
C
离子反应同步优化
一、单选题
1.下列各组物质,前者为强电解质,后者为弱电解质的是(
)
A.硫酸钡、CCl4
B.苛性钠、氨水
C.氯化氢、金刚石
D.氯化钠晶体、硫化氢
2.某溶液中含有K+、HCO、SO等离子,向溶液中加入适量的NaOH固体,溶液中离子的数目显著增加的是(
)
A.HCO
B.K+
C.CO
D.SO
3.下列关于物质分类的说法,正确的个数有(
)
(1)
冰水混合物属于纯净物,高分子化合物属于混合物
(2)
CaCl2、NaOH、HCl、HT四种物质都是化合物
(3)
由同一种元素组成的物质一定是纯净物
(4)
酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系
(5)
NaHSO4、NaHCO3都属于酸式盐,其水溶液都显酸性
(6)
SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物
(7)
NaCl固体不导电,熔融的KCl能导电,所以前者是非电解质,后者是电解质
(8)
强电解质都是离子化合物,弱电解质都是共价化合物
(9)
强电解质溶液的导电性一定比弱电解质溶液的导电性强
(10)胆矾、苛性钠、冰醋酸、氧化钾均是电解质
A.1
B.2
C.3
D.4
4.某溶液中含有0.5mol的硫酸,加入下面某物质后,导电性明显增强,该物质是(
)
A.0.5molBa(OH)2溶液
B.0.5mol的K2SO4固体
C.0.5mol酒精
D.0.5mol水
5.某溶液中含有大量的Cl-、、OH-阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是
①滴加Mg(NO3)2溶液②过滤③滴加Ba(NO3)2溶液④滴加AgNO3溶液
A.①②③②④
B.③②①②④
C.①②④②③
D.④②③②①
6.室温下,下列各组离子在指定溶液中能大量共存的是(
)
A.能使甲基橙变红的溶液:Na+、Ca2+、Br-、
B.=1×10-12的溶液:K+、Na+、、
C.0.1mol/LKFe(SO4)2溶液:Mg2+、Al3+、SCN-、
D.0.1mol/LCa5NH4(NO3)11溶液:H+、Fe2+、Cl-、
7.能用H++OH-=H2O来表示的化学反应是(
)
A.氢氧化铁固体和稀盐酸反应
B.硫酸氢钠滴入氢氧化钡溶液中
C.醋酸滴入烧碱中
D.澄清石灰水和稀硝酸反应
8.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.氢氧化钠与盐酸;氢氧化钠与碳酸
B.BaCl2溶液与H2SO4溶液;
Ba(OH)2溶液与H2SO4溶液
C.BaCl2溶液与AgNO3溶液;HCl溶液与AgNO3溶液
D.Na2CO3溶液与硝酸溶液;CaCO3与硝酸溶液
9.下列物质中导电性最差的是(
)
A.KOH晶体
B.石墨棒
C.稀H2SO4
D.熔融状态的KCl
10.已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高,下列溶液沸点最高的是( )
A.0.01
mol?L﹣1的蔗糖溶液
B.0.01
mol?L﹣1的CaCl2溶液
C.0.02mol?L﹣1的NaCl溶液
D.0.02
mol?L﹣1的NaHSO4溶液
11.下列表中评价不合理的是( )
选项
化学反应及其离子方程式
试剂
A
石灰乳与Na2
CO3溶液混合:
Ca2+
+
CO=Ca
CO3
↓
错误,氢氧化钙以石灰乳的形式存在时,不能写成离子的形式
B
向氢氧化镁中加入稀盐酸:
2OH-
+2H+
===2H2O
错误,氢氧化镁不能写成离子的形式,且离子方程式应该简化
C
氧化钙与稀盐酸的反应:
CaO
+2H+=Ca2++
H2O
正确
D
氢氧化钙溶液与稀硫酸的混合:
Ca2++2OH-+2H++SO=CaSO4↓+2H2O
错误,反应物和产物的配比不正确
A.A
B.B
C.C
D.D
12.下列试剂中能鉴别出MgSO4、NH4Cl、KNO3三种溶液的是
A.AgNO3溶液
B.BaCl2溶液
C.NaOH溶液
D.CuCl2溶液
13.欲配制下列四种无色透明的酸性溶液,其中能配制成功的是
A.、、Cl-、Al3+
B.Ca2+、、Na+、I-
C.、K+、、Na+
D.K+、Mg2+、Cl-、
14.在甲、乙两烧杯中,大量含有的离子有Cu2+、Ba2+、H+、Cl-、SO、OH-共六种。且两溶液中大量存在的离子种类互不相同。已知甲烧杯的溶液呈蓝色,则有关结论正确的是(
)
A.甲中一定有SO
B.甲中一定有Cl-
C.乙中可能有H+
D.乙中不可能有OH-
15.某学生以铁丝和Cl2为原料进行下列三个实验。下列说法正确的是
A.实验①、③反应制得的物质均为纯净物
B.实验①、③均发生了氧化还原反应
C.实验①现象为剧烈燃烧,放出大量的热并产生棕黄色烟
D.实验①、②所涉及的物质均为电解质
二、实验题
16.现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现氯离子(Cl-)、硫酸根离子(SO42-)和硝酸根离子(NO3-)的相互分离,实验过程如下:
试剂3:Na2CO3;试剂4:硝酸
请回答下列问题:
(1)写出试剂②的名称______________。
(2)写出过量Na2CO3的目的是___________________________________________________。
(3)写出混合溶液D与过量硝酸反应的化学方程式:________________________________。
(4)写出操作④的名称______________。
17.(1)13.8g氮的氧化物(NOx)中含N原子数为0.3mol,则NOx的摩尔质量为___,x的数值为___,该质量的NOx在标准状况下的体积为___L。
(2)某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:①
加入过量的稀盐酸,有白色沉淀生成;②
过滤,得无色透明溶液,在滤液中加入过量的稀硫酸,又有白色沉淀生成;③
过滤,取少量滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有___离子;—定不含有__离子;还有____离子不能确定是否存在,要检验这些离子的实验方法是___。
18.过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:
回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有___。
(2)仪器X的主要作用除导气外,还具有的作用是___。
(3)在冰水浴中进行的原因是___。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为___。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是____。
A.无水乙醇
B.浓盐酸
C.Na2SO3溶液
D.CaCl2溶液
(6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
①Fe3+
+H2O2=Fe2++H++HOO·
②H2O2+X=Y
+Z+W(已配平)
③Fe2++·OH=Fe3++OH-
④H+
+OH-=H2O
根据上述机理推导步骤②中的化学方程式为___。
(7)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有____的性质。
A.与水缓慢反应供氧
B.能吸收鱼苗呼出的CO2气体
C.能是水体酸性增强
D.具有强氧化性,可杀菌灭藻
(8)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。
则:所得过氧化钙样品中CaO2的纯度为_____。
19.碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置模拟制备碳酸镧。
(1)盛放稀盐酸的仪器名称为________________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为F→____→____→____→____→______。
(3)W中发生反应的离子方程式为_______Y中发生反应的化学反应方程式为__________
(4)X中盛放的试剂是_________,干燥管的作用为_________________。
(5)Z中通入气体的方式________
A.先通入足量NH3,后通入过量的CO2
B.先通入足量CO2,后通入过量的NH3
C.NH3和CO2同时通入
(6)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为________________,实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,则关于两种物质稳定性实验结论为_____。
A.稳定性La2(CO3)3>La(HCO3)3
B.稳定性La2(CO3)3
参考答案
1.D2.C3.B4.B5.B6.B7.D8.C9.A10.D11.D12.C13.A14.A15.C
16.硝酸银溶液
除去过量的Ba2+和Ag+
Na2CO3+2HNO3=2NaNO3+H2O+CO2
蒸发
17.46g/mol
2
6.72
Ag+
Ba2+
NH4+、Fe3+、K+
焰色反应
18.烧杯、量筒
防止三颈烧瓶中溶液发生倒吸
防止温度过高H2O2分解、有利于晶体析出
Ca2++H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+
A
HOO·+
H2O2=H2O
+
O2
+·OH
ABD
54.00%
19.分液漏斗
A
B
D
E
C
CaCO3+2H+=Ca2++H2O+CO2
NH3·H2O+CaO=Ca(OH)2+NH3↑
饱和NaHCO3溶液
防倒吸
A
La(HCO3)3
C
