广东省执信中学11-12学年高二上学期期中试题化学理
文档属性
| 名称 | 广东省执信中学11-12学年高二上学期期中试题化学理 |

|
|
| 格式 | zip | ||
| 文件大小 | 88.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-24 00:00:00 | ||
图片预览



文档简介
2011-2012学年度第一学期
高二级化学科期中考试试卷
本试卷分选择题和非选择题两部分,共8页,满分100分。考试用时90分钟。
注意事项:1、答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名和学号填写在答题卡和答卷密封线内相应的位置上,用2B铅笔将自己的学号填涂在答题卡上。
2、选择题每小题选出答案后,有2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案;不能答在试卷上。
3、非选择题必须用黑色字迹的钢笔或签字笔在答卷纸上作答,答案必须写在答卷纸各题目指定区域内的相应位置上,超出指定区域的答案无效;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
4、考生必须保持答题卡的整洁和平整。
第一部分 选择题
一、单选题(本题包括15小题,每小题只有一个选项符合题意)[来源:21世纪教育网]
1、下列说法中正确的是
A.非自发反应一定不能实现
B.自发反应在任何条件下都能实现
C.同种物质气态时熵值最大,固态时熵值最小
D.放热同时熵减的反应高温下才能自发进行
2、下列有关叙述正确的是
A.SO2的水溶液能导电,所以SO2是电解质
B.BaSO4难溶于水,其水溶液的导电能力极弱,所以BaSO4是弱电解质
C.液溴不导电,所以液溴是非电解质
D.HI熔融状态不能导电,但HI是强电解质
3、下列电离方程式的书写正确的是
A.Al2(SO4)3=2Al3++3SO42- B.HF = H++F-
C.H3PO4 3H++PO43- D.NaHCO3 = Na++H++CO32-
4、下列酸溶液的pH值相同时,酸的物质的量浓度最小的是
A.H2SO3 B.H2SO4 C.CH3COOH D.HNO3
5、在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g) △H1
Cl2(g)+H2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3 与△H1 和△H2间的关系正确的是
A.△H3 = △H1 + 2△H2 B.△H3 = △H1 + △H2
C.△H3 = △H1 - 2△H2 D.△H3 = △H1 - △H2
6、如图1是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与图1不相符合的是
A.反应达平衡时,正反应速率和逆反应速率相等
B.同一种反应物在平衡态I和平衡态II时浓度不相等
C.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
D.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
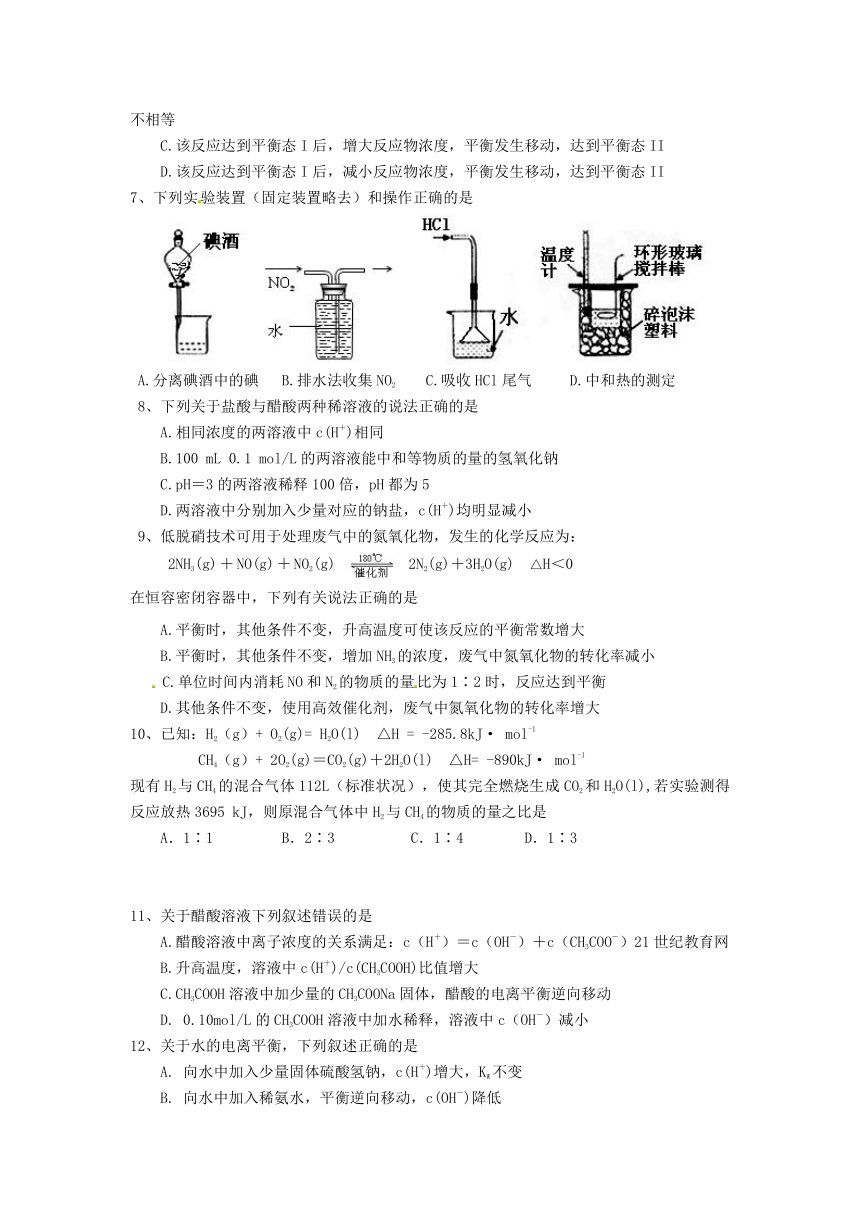
7、下列实验装置(固定装置略去)和操作正确的是
A.分离碘酒中的碘 B.排水法收集NO2 C.吸收HCl尾气 D.中和热的测定
8、下列关于盐酸与醋酸两种稀溶液的说法正确的是
A.相同浓度的两溶液中c(H+)相同
B.100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
9、低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) △H<0
在恒容密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
10、已知:H2(g)+ O2(g)= H2O(l) △H = -285.8kJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) △H= -890kJ· mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695 kJ,则原混合气体中H2与CH4的物质的量之比是
A.1∶1 B.2∶3 C.1∶4 D.1∶3
11、关于醋酸溶液下列叙述错误的是
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)21世纪教育网
B.升高温度,溶液中c(H+)/c(CH3COOH)比值增大
C.CH3COOH溶液中加少量的CH3COONa固体,醋酸的电离平衡逆向移动
D. 0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
12、关于水的电离平衡,下列叙述正确的是
A. 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
B. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
C.向水中加入稀硫酸,c(H+)增大,水的电离程度增大
D. 95 ℃纯水的pH<7,说明加热可导致水呈酸性
13、常温时,取浓度相同的NaOH和HCl溶液,以3∶2体积比混合,所得溶液的pH等于12,则两溶液的原来的浓度为
A.0.01mol·L-1 B.0.017mol·L-1 C.0.05mol·L-1 D.0.50mol·L-1
14、A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000 mL,其pH的变化如图2所示,则下列判断正确的是
A.原酸溶液的浓度c(A)=c(B)
B.若a=5,则A为强酸,B为弱酸
C.原酸溶液的浓度c(A)>c(B)
D.若215、可逆反应aA(g)+bB(g)cC(g)+dD(g)ΔH同时符合图3中各曲线的规律的是
A.a+b>c+d T1<T2 ΔH<0
B.a+b>c+d T1<T2 ΔH>0
C.a+b<c+d T1>T2 ΔH<0
D.a+b>c+d T1>T2 ΔH>0
二、双项选择题(本题包括5小题,每小题有2个选项正确。每小题4分,共20分,少选且正确得2分,错选、未选、多选不得分)
16、下列说法正确的是
A.在水溶液中导电能力弱的电解质一定是弱电解质
B.强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强
C.易溶于水的电解质不一定是强电解质
D.强电解质在水溶液中的电离过程是不可逆的
17、下列热化学方程式或离子方程式中,正确的是:
A.甲烷的燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1
C. 硫酸与氢氧化钡发生中和反应的热化学方程式为:
H+(aq)+SO42 -(aq)+Ba2+(aq)+OH-(aq)=BaSO4(s)+H2O(l) △H=-57.3kJ·mol-1
D. 氯化镁溶液与氨水反应:Mg2+ + 2NH3·H2O = Mg(OH)2↓+ 2NH4+
18、根据热化学方程式:S(g)+O2(g)=SO2(g);△H=-a kJ·mol-1(a>0)。
下列说法正确的是21世纪教育网
A.1 mol SO2的总能量大于1 mol S和1 mol O2能量总和
B.1 mol SO2的总能量小于1 mol S和1 mol O2能量总和
C.S(s)+O2(g)=SO2(g) △H=-b kJ·mol-1,b小于a
D.S(s)+O2(g)=SO2(g) △H=-b kJ·mol-1,b大于a
19、下列各组离子一定能在指定环境中大量共存的是
A.含有大量SO42-的溶液:K+、Cu2+、Cl-、NO3-
B.在pH=1的溶液中:NO3-、SO42-、Na+ 、 NH4+21世纪教育网
C.在由水电离出的c(H+) = 1×10-12mol/L的溶液中:
Fe3+、ClO-、Na +、SO42-
D.滴加石蕊试液显红色的溶液:K+、Al3+、NO3―、CH3COO―
20、在一密闭容器中,有下列的可逆反应:A(g)+B(g)X(g)△H<0,试判断对图4的说法中正确的是(T表示温度,P表示压强)
A.P3>P4,y轴表示B的转化率
B.P3<P4,y轴表示X的体积分数
C.P3<P4,y轴表示混合气体的密度
D.P3>P4,y轴表示混合气体的平均摩尔质量
第二部分 非选择题
三、
21、25℃时,用1.0 mol·L-1 NaOH溶液中和某浓度H2SO4溶液40 mL,其pH和所加NaOH溶液的体积关系如图5所示。求:(写出必要的解题过程)
(1)1.0 mol·L-1 NaOH溶液中由水电离出的c(OH-)。
(2)原H2SO4溶液的物质的量浓度。
22、某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
该反应的离子方程式为:2MnO4-+ 5H2C2O4 + 6H+=2Mn2+ + 10CO2↑+ 8H2O
该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.01 mol·L-1、0.001 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.1 mol·L-1、0.2 mol·L-1;
③催化剂的用量可选择0g、0.5g;
④实验温度可选择298K、323K。
(1)每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成 个实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据:(从混合振荡均匀开始计时)
KMnO4酸性溶液的浓度(mol·L-1)21世纪教育网 溶液褪色所需时间21世纪教育网[来源:21世纪教育网]21世纪教育网(min)21世纪教育网
第1次 第2次 第3次
0.01 14 13 11
0.001 6 7 7
①用0.001 mol·L-1KMnO4酸性溶液进行实验时KMnO4的平均反应速率
(忽略混合前后溶液的体积变化)
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?(填“是”或“否”) 。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案: 。
23、二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚(CH3OCH3)。
请回答下列问题:
(1) 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) CH3OH(g) △H=-90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) + H2(g) △H=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) CH3OCH3(g) + CO2 (g)的 △H=
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是: (填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②:2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 CH3OH CH3OCH3 H2O
浓度(mol·L-1) 0.40 0.6 0.6
① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 温度升高,该反应的平衡常数K (填“增大”、“减小”或“不变”)
24、水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3—、Pb(OH)42—,各形态的浓度分数α随溶液p H变化的关系如图6所示:
[1表示Pb2+、2表示Pb(OH)+、3表示Pb(OH)2、4表示Pb(OH)3—、5表示Pb(OH)42—]
(1)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液存在的阳离子除H+、 Na+ 外 ,还有: 。
(2)pH=9时主要反应的离子方程式是:
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
离子 Pb2+ Ca2+ Fe3+ Mn2+ Cl-
处理前浓度(mg/L) 0.100 29.8 0.120 0.087 51.9
处理后浓度(mg/L) 0.004 22.6 0.040 0.053 49.8
上表中除 Pb2+ 外,该脱铅剂对其他离子的去除效果最好的是:
(4)如该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2EH(s) + Pb2+ E2Pb(s) + 2H+
则脱铅最合适的pH范围为_______(填代码)。
A.4~5 B.6~7 C.9~10 D.11~12
2011-2012学年度第一学期
高二级化学科期中考试答卷
成绩:
注意事项:1、本答卷为第二部分非选择题答题区。考生必须用黑色字迹的钢笔或签字笔在各题目指定区域内的相应位置上答题,超出指定区域的答案无效。
2、如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液,不按以上要求作答的答案无效。
2011-2012学年度第一学期
高二级化学科期中考试答案
二、选择题
题号 1 2 3 4 5 6 7 8 9 10
答案 C D A B A D C B C D
题号 11 12 13 14 15 16 17 18 19 20
答案 D A C B A CD AD BC AB AD
三、非选择题
21、① 1.0×10-14 mol/L ② 0.50 mol/L
22、
(1)4
(2)① 1×10-4 mol·L-1·min-1
② 否; 取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应。
23、
(1) Na2CO3+H2S==NaHCO3+NaHS
(2) -246.4 kJ· mol -1 ; a、 c、e ( http: / / www.21cnjy.com / " \o "欢迎登陆21世纪教育网 )
(3) ① > ② 减少
24、
(1)Pb2+ 、Pb(OH)+
(2)Pb(OH) + +OH- Pb(OH)2
(3)Fe3+
(4)B
图1
图2
图3
图4
图5
图6
班级:_______________姓名:_______________学号:_______________
O 密 O 封 O 线 O
三、
21、
22、
(1)
(2)①
②
23、
(1)
(2)
(3)①
②
24、
(1)
(2)
(3)
(4)
高二级化学科期中考试试卷
本试卷分选择题和非选择题两部分,共8页,满分100分。考试用时90分钟。
注意事项:1、答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名和学号填写在答题卡和答卷密封线内相应的位置上,用2B铅笔将自己的学号填涂在答题卡上。
2、选择题每小题选出答案后,有2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案;不能答在试卷上。
3、非选择题必须用黑色字迹的钢笔或签字笔在答卷纸上作答,答案必须写在答卷纸各题目指定区域内的相应位置上,超出指定区域的答案无效;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
4、考生必须保持答题卡的整洁和平整。
第一部分 选择题
一、单选题(本题包括15小题,每小题只有一个选项符合题意)[来源:21世纪教育网]
1、下列说法中正确的是
A.非自发反应一定不能实现
B.自发反应在任何条件下都能实现
C.同种物质气态时熵值最大,固态时熵值最小
D.放热同时熵减的反应高温下才能自发进行
2、下列有关叙述正确的是
A.SO2的水溶液能导电,所以SO2是电解质
B.BaSO4难溶于水,其水溶液的导电能力极弱,所以BaSO4是弱电解质
C.液溴不导电,所以液溴是非电解质
D.HI熔融状态不能导电,但HI是强电解质
3、下列电离方程式的书写正确的是
A.Al2(SO4)3=2Al3++3SO42- B.HF = H++F-
C.H3PO4 3H++PO43- D.NaHCO3 = Na++H++CO32-
4、下列酸溶液的pH值相同时,酸的物质的量浓度最小的是
A.H2SO3 B.H2SO4 C.CH3COOH D.HNO3
5、在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g) △H1
Cl2(g)+H2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3 与△H1 和△H2间的关系正确的是
A.△H3 = △H1 + 2△H2 B.△H3 = △H1 + △H2
C.△H3 = △H1 - 2△H2 D.△H3 = △H1 - △H2
6、如图1是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与图1不相符合的是
A.反应达平衡时,正反应速率和逆反应速率相等
B.同一种反应物在平衡态I和平衡态II时浓度不相等
C.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
D.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
7、下列实验装置(固定装置略去)和操作正确的是
A.分离碘酒中的碘 B.排水法收集NO2 C.吸收HCl尾气 D.中和热的测定
8、下列关于盐酸与醋酸两种稀溶液的说法正确的是
A.相同浓度的两溶液中c(H+)相同
B.100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
9、低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) △H<0
在恒容密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
10、已知:H2(g)+ O2(g)= H2O(l) △H = -285.8kJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) △H= -890kJ· mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695 kJ,则原混合气体中H2与CH4的物质的量之比是
A.1∶1 B.2∶3 C.1∶4 D.1∶3
11、关于醋酸溶液下列叙述错误的是
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)21世纪教育网
B.升高温度,溶液中c(H+)/c(CH3COOH)比值增大
C.CH3COOH溶液中加少量的CH3COONa固体,醋酸的电离平衡逆向移动
D. 0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
12、关于水的电离平衡,下列叙述正确的是
A. 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
B. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
C.向水中加入稀硫酸,c(H+)增大,水的电离程度增大
D. 95 ℃纯水的pH<7,说明加热可导致水呈酸性
13、常温时,取浓度相同的NaOH和HCl溶液,以3∶2体积比混合,所得溶液的pH等于12,则两溶液的原来的浓度为
A.0.01mol·L-1 B.0.017mol·L-1 C.0.05mol·L-1 D.0.50mol·L-1
14、A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000 mL,其pH的变化如图2所示,则下列判断正确的是
A.原酸溶液的浓度c(A)=c(B)
B.若a=5,则A为强酸,B为弱酸
C.原酸溶液的浓度c(A)>c(B)
D.若2
A.a+b>c+d T1<T2 ΔH<0
B.a+b>c+d T1<T2 ΔH>0
C.a+b<c+d T1>T2 ΔH<0
D.a+b>c+d T1>T2 ΔH>0
二、双项选择题(本题包括5小题,每小题有2个选项正确。每小题4分,共20分,少选且正确得2分,错选、未选、多选不得分)
16、下列说法正确的是
A.在水溶液中导电能力弱的电解质一定是弱电解质
B.强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强
C.易溶于水的电解质不一定是强电解质
D.强电解质在水溶液中的电离过程是不可逆的
17、下列热化学方程式或离子方程式中,正确的是:
A.甲烷的燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1
C. 硫酸与氢氧化钡发生中和反应的热化学方程式为:
H+(aq)+SO42 -(aq)+Ba2+(aq)+OH-(aq)=BaSO4(s)+H2O(l) △H=-57.3kJ·mol-1
D. 氯化镁溶液与氨水反应:Mg2+ + 2NH3·H2O = Mg(OH)2↓+ 2NH4+
18、根据热化学方程式:S(g)+O2(g)=SO2(g);△H=-a kJ·mol-1(a>0)。
下列说法正确的是21世纪教育网
A.1 mol SO2的总能量大于1 mol S和1 mol O2能量总和
B.1 mol SO2的总能量小于1 mol S和1 mol O2能量总和
C.S(s)+O2(g)=SO2(g) △H=-b kJ·mol-1,b小于a
D.S(s)+O2(g)=SO2(g) △H=-b kJ·mol-1,b大于a
19、下列各组离子一定能在指定环境中大量共存的是
A.含有大量SO42-的溶液:K+、Cu2+、Cl-、NO3-
B.在pH=1的溶液中:NO3-、SO42-、Na+ 、 NH4+21世纪教育网
C.在由水电离出的c(H+) = 1×10-12mol/L的溶液中:
Fe3+、ClO-、Na +、SO42-
D.滴加石蕊试液显红色的溶液:K+、Al3+、NO3―、CH3COO―
20、在一密闭容器中,有下列的可逆反应:A(g)+B(g)X(g)△H<0,试判断对图4的说法中正确的是(T表示温度,P表示压强)
A.P3>P4,y轴表示B的转化率
B.P3<P4,y轴表示X的体积分数
C.P3<P4,y轴表示混合气体的密度
D.P3>P4,y轴表示混合气体的平均摩尔质量
第二部分 非选择题
三、
21、25℃时,用1.0 mol·L-1 NaOH溶液中和某浓度H2SO4溶液40 mL,其pH和所加NaOH溶液的体积关系如图5所示。求:(写出必要的解题过程)
(1)1.0 mol·L-1 NaOH溶液中由水电离出的c(OH-)。
(2)原H2SO4溶液的物质的量浓度。
22、某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
该反应的离子方程式为:2MnO4-+ 5H2C2O4 + 6H+=2Mn2+ + 10CO2↑+ 8H2O
该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.01 mol·L-1、0.001 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.1 mol·L-1、0.2 mol·L-1;
③催化剂的用量可选择0g、0.5g;
④实验温度可选择298K、323K。
(1)每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成 个实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据:(从混合振荡均匀开始计时)
KMnO4酸性溶液的浓度(mol·L-1)21世纪教育网 溶液褪色所需时间21世纪教育网[来源:21世纪教育网]21世纪教育网(min)21世纪教育网
第1次 第2次 第3次
0.01 14 13 11
0.001 6 7 7
①用0.001 mol·L-1KMnO4酸性溶液进行实验时KMnO4的平均反应速率
(忽略混合前后溶液的体积变化)
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?(填“是”或“否”) 。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案: 。
23、二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚(CH3OCH3)。
请回答下列问题:
(1) 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) CH3OH(g) △H=-90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) + H2(g) △H=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) CH3OCH3(g) + CO2 (g)的 △H=
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是: (填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②:2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 CH3OH CH3OCH3 H2O
浓度(mol·L-1) 0.40 0.6 0.6
① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 温度升高,该反应的平衡常数K (填“增大”、“减小”或“不变”)
24、水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3—、Pb(OH)42—,各形态的浓度分数α随溶液p H变化的关系如图6所示:
[1表示Pb2+、2表示Pb(OH)+、3表示Pb(OH)2、4表示Pb(OH)3—、5表示Pb(OH)42—]
(1)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液存在的阳离子除H+、 Na+ 外 ,还有: 。
(2)pH=9时主要反应的离子方程式是:
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
离子 Pb2+ Ca2+ Fe3+ Mn2+ Cl-
处理前浓度(mg/L) 0.100 29.8 0.120 0.087 51.9
处理后浓度(mg/L) 0.004 22.6 0.040 0.053 49.8
上表中除 Pb2+ 外,该脱铅剂对其他离子的去除效果最好的是:
(4)如该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2EH(s) + Pb2+ E2Pb(s) + 2H+
则脱铅最合适的pH范围为_______(填代码)。
A.4~5 B.6~7 C.9~10 D.11~12
2011-2012学年度第一学期
高二级化学科期中考试答卷
成绩:
注意事项:1、本答卷为第二部分非选择题答题区。考生必须用黑色字迹的钢笔或签字笔在各题目指定区域内的相应位置上答题,超出指定区域的答案无效。
2、如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液,不按以上要求作答的答案无效。
2011-2012学年度第一学期
高二级化学科期中考试答案
二、选择题
题号 1 2 3 4 5 6 7 8 9 10
答案 C D A B A D C B C D
题号 11 12 13 14 15 16 17 18 19 20
答案 D A C B A CD AD BC AB AD
三、非选择题
21、① 1.0×10-14 mol/L ② 0.50 mol/L
22、
(1)4
(2)① 1×10-4 mol·L-1·min-1
② 否; 取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应。
23、
(1) Na2CO3+H2S==NaHCO3+NaHS
(2) -246.4 kJ· mol -1 ; a、 c、e ( http: / / www.21cnjy.com / " \o "欢迎登陆21世纪教育网 )
(3) ① > ② 减少
24、
(1)Pb2+ 、Pb(OH)+
(2)Pb(OH) + +OH- Pb(OH)2
(3)Fe3+
(4)B
图1
图2
图3
图4
图5
图6
班级:_______________姓名:_______________学号:_______________
O 密 O 封 O 线 O
三、
21、
22、
(1)
(2)①
②
23、
(1)
(2)
(3)①
②
24、
(1)
(2)
(3)
(4)
同课章节目录
