化学:第2章第2节 分子的立体构型 优化课件(人教版选修3)
文档属性
| 名称 | 化学:第2章第2节 分子的立体构型 优化课件(人教版选修3) |

|
|
| 格式 | rar | ||
| 文件大小 | 779.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-24 00:00:00 | ||
图片预览








文档简介
(共70张PPT)
第二节 分子的立体构型
学习目标
1.了解共价键分子结构的多样性和复杂性。
2.认识价层电子对互斥理论、杂化轨道理论和配合物理论。
3.能根据有关理论判断简单分子或离子的立体构型。
4.会判断简单配合物的成键情况,了解简单配合物的命名方法。
5.简单了解分子立体结构的测定办法。
课堂互动讲练
课前自主学案
知能优化训练
第二节 分子的立体构型
课前自主学案
一、形形色色的分子
分子的立体构型:两个以上原子构成的分子中的原子的空间关系问题。
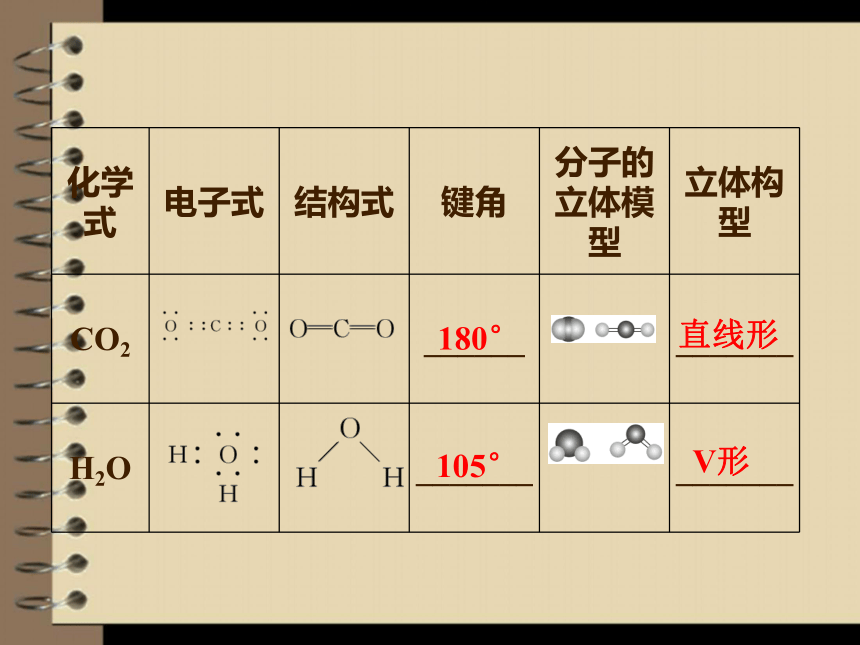
1.三原子分子的立体构型有直线形和V形两种。如:
化学式 电子式 结构式 键角 分子的立体模型 立体构型
CO2
______ _______
H2O
_______ _______
180°
105°
直线形
V形
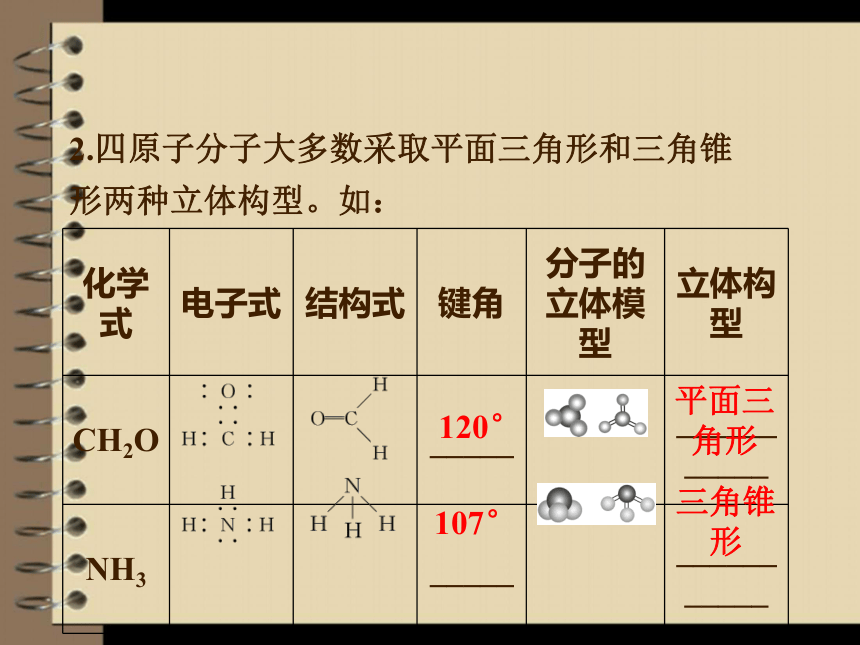
2.四原子分子大多数采取平面三角形和三角锥形两种立体构型。如:
化学式 电子式 结构式 键角 分子的立体模型 立体构型
CH2O _____ ___________
NH3 _____ ___________
120°
107°
平面三
角形
三角锥
形
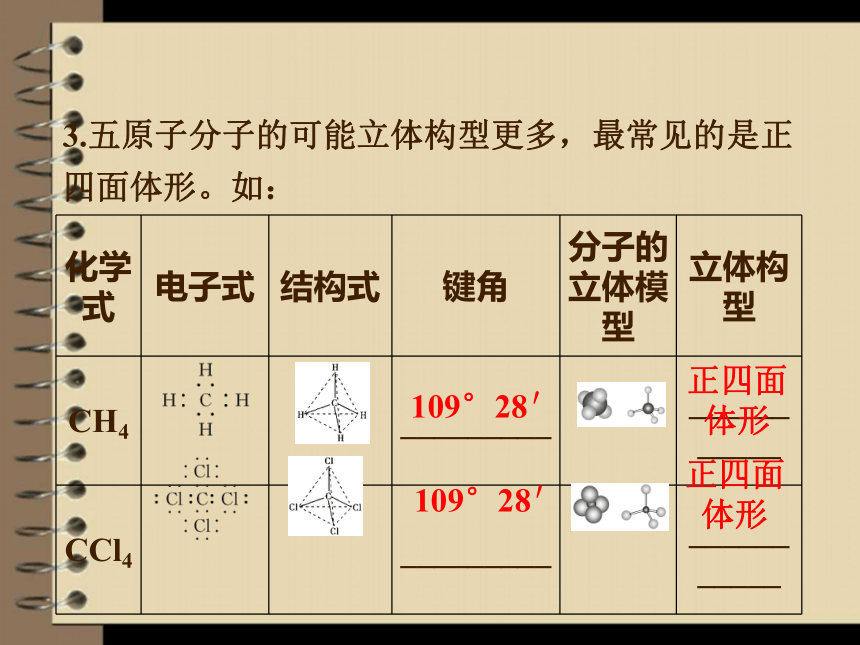
3.五原子分子的可能立体构型更多,最常见的是正四面体形。如:
化学式 电子式 结构式 键角 分子的立体模型 立体构型
CH4 _________ ___________
CCl4 _________ ___________
109°28′
109°28′
正四面
体形
正四面
体形
思考感悟
1.五原子分子都是正四面体结构吗?
【提示】 不是,如CH3Cl、CH2Cl2、CHCl3等,虽为四面体结构,但由于碳原子所连的四个原子不相同,四个原子电子间的排斥力不同,使四个键的键角不再相等,所以并不是正四面体结构。
二、价层电子对互斥理论
1.价层电子对互斥理论(VSEPR)
分子中的价层电子对(包括____________和_________________________)由于___________作用,而趋向尽可能彼此远离以减小_______,分子尽可能采取________的立体构型。电子对之间的夹角越大,排斥力_______。
σ键电子对
中心原子上的孤电子对
相互排斥
斥力
对称
越小
2.价层电子对的确定方法
思考感悟
3.VSEPR模型的用途
预测分子或离子的____________。
(1)中心原子上的价电子都用于形成共价键的分子的立体构型
立体构型
ABn 价层电子对数 电子对排布方式 立体构型 键角 范例
n=2 _____ _________ 180° CO2
2
直线
形
ABn 价层电子对数 电子对排布方式 立体构型 键角 范例
n=3 ____
______________ 120° BF3
n=4 ____
_______________ 109°28′ CH4
平面三角
形
正四面体
形
3
4
(2)中心原子上有孤电子对的分子的立体构型
对于中心原子上有孤电子对(未用于形成共价键的电子对)的分子,中心原子上的孤电子对也要占据中心原子周围的空间,并互相排斥使分子呈现不同的立体构型。见下表。
化学式 结构式 含孤电子对的VSEPR模型 分子或离子的立体构型 分子或离子的立体构型名称
H2O
_______
NH3 ________
V形
三角锥形
化学式 结构式 含孤电子对的VSEPR模型 分子或离子的立体构型 分子或离子的立体构型名称
HCN _______
H3O+ ________
SO2 _______
直线形
三角锥形
V形
三、杂化轨道理论简介
1.杂化与杂化轨道
(1)概念
①轨道的杂化
原子内部____________的原子轨道重新组合生成与原轨道数_________的一组新轨道的过程。
②杂化轨道
杂化后形成的新的_____________的一组原子轨道。
能量相近
相等
能量相同
(2)类型
杂化类型 sp sp2 sp3
参于杂化的原子轨道及数目 1个s轨道和
1个p轨道 1个s轨道和
2个p轨道 1个s轨道和
3个p轨道
杂化轨道的数目 ______ ______ ______
2
3
4
2.杂化轨道类型与分子空间构型的关系
杂化类型 sp sp2 sp3
杂化轨道间的夹角 ______ ______ _________
空间构型 _________ ___________ __________
实例 CO2、C2H2 BF3 CH4、CCl4
180°
120°
109°28′
直线形
平面三角形
正四面体形
思考感悟
3.用杂化轨道理论分析NH3呈三角锥形的原因。
【提示】 NH3分子中的N原子价电子排布图为 ,1个2s轨道与3个2p轨道杂化后,形成4个sp3杂化轨道,其中3个杂化轨道中是单电子,分别与3个H原子形成σ键,一个杂化轨道中是成对电子,不形成共价键。sp3杂化轨道应为正四面体构型,但由于孤电子对不形成化学键,故NH3分子为三角锥形。
四、配合物理论简介
1.配位键
(1)概念:_____________由一个原子_________提供而另一个原子提供空轨道而形成的共价键,即“电子对给予 接受键”,是一类特殊的____________。
(2)表示
配位键可以用A→B来表示,其中A是________孤电子对的原子,叫做给予体;B是_________电子对的原子,叫做接受体。
孤电子对
单方面
共价键
提供
接受
2.配位化合物
(1)概念:___________________与某些分子或离子(称为________)以___________结合形成的化合物,简称配合物。
金属离子(或原子)
配体
配位键
(2)配合物的形成举例
实验操作 实验现象 有关离子方程式
滴加氨水后,试管中首先出现____________,氨水过量后沉淀逐渐_________,滴加乙醇后析出____________ Cu2++2NH3·H2O=== Cu(OH)2↓+ Cu(OH)2+4NH3===
[Cu(NH3)4]2++2OH-
蓝色沉淀
溶解
深蓝色晶体
实验操作 实验现象 有关离子方程式
溶液颜色_____ Fe3++3SCN-??Fe(SCN)3
变红
思考感悟
4.配制银氨溶液时,向AgNO3溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,为什么?
课堂互动讲练
用价层电子对互斥理论确定分子或离子立体构型的方法
2.确定价层电子对的立体构型
由于价层电子对之间的相互排斥作用,它们趋向于尽可能的相互远离。于是价层电子对的立体构型与价层电子对数目的关系如下表:
价层电子对数 2 3 4
价层电子对构型 直线形 三角形 四面体形
这样已知价层电子对的数目,就可以确定它们的立体构型。
3.分子立体构型的确定
价层电子对有成键电子对和孤电子对之分,价层电子对的总数减去成键电子对数,得孤电子对数。根据成键电子对数和孤电子对数,可以确定相应的较稳定的分子立体构型,如下表所示:
价层电子对数 VSEPR模型名称 成键电子对数 孤电子对数 电子对的排列方式 分子的立体构型名称 实例
2 直线形 2 0 直线形 BeCl2 CO2
价层电子对数 VSEPR模型名称 成键电子对数 孤电子对数 电子对的排列方式 分子的立体构型名称 实例
3 平面三角形 3 0
平面三角形 BF3 BCl3
2 1
V形 SO2
价层电子对数 VSEPR模型名称 成键电子对数 孤电子对数 电子对的排列方式 分子的立体构型名称 实例
4 四面体 4 0
正四面体形 CH4 CCl4
3 1
三角锥形 NH3 NF3
2 2
V形 H2O
特别提醒:利用上表判断分子立体构型时注意:
(1)如果在价层电子对中出现孤电子对时,价层电子对立体构型还与下列斥力顺序有关:孤电子对—孤电子对>孤电子对—成键电子对>成键电子对—成键电子对。因此价层电子对立体构型为三角形和四面体形时,孤电子对的存在会改变成键电子对的分布空间。所以H2O分子的键角应小于109°28′。
(2)对于分子中有双键、三键等多重键时,使用价层电子对理论判断其分子构型时,双键的两对电子和三键的三对电子只能作为一对电子来处理,或者说在确定中心原子的价层电子对总数时不包括π电子。
例1
【思路点拨】 解答本题需注意以下两点:
(1)确定每个结构中成键电子及孤电子对。
(2)根据VSEPR模型判断分子或离子的立体构型。
【解析】 根据各分子的电子式和结构式,分析中心原子的孤电子对数,依据中心原子连接的原子数和孤电子对数,确定VSEPR模型和分子的立体构型。
分子或离子 结构式 中心原子孤电子对数 分子或离子的价层电子对数 VSEP R模型名称 立体构型
BeCl2 Cl—Be—Cl 0 2 直线形 直线形
分子或离子 结构式 中心原子孤电子对数 分子或离子的价层电子对数 VSEP R模型名称 立体构型
SCl2
2 4 四面体 V形
BF3 0 3 平面三角形 平面三角形
PF3 1 4 四面体 三角锥形
分子或离子 结构式 中心原子孤电子对数 分子或离子的价层电子对数 VSEP R模型名称 立体构型
NH
0 4 四面体 正四面体形
SO
1 4 四面体 三角锥形
【答案】 直线形 V形 平面三角形 三角锥形 正四面体形 三角锥形
【误区警示】 使用价层电子对互斥理论判断分子立体构型时需注意:
价层电子对互斥构型是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。两者是否一致取决于中心原子上有无孤电子对(未用于形成共价键的电子对),当中心原子上无孤电子对时,两者的构型一致;当中心原子上有孤电子对时,两者的构型不一致。
变式训练1 若ABn分子的中心原子A上没有未用于形成共价键的孤电子对,根据价层电子对互斥理论,下列说法正确的是( )
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确
解析:选C。若中心原子A上没有未成键的孤电子对,则根据斥力最小的原则,当n=2时,分子的立体构型为直线形;n=3时,分子的立体构型为平面三角形;当n=4时,分子的立体构型为正四面体形。
分子立体构型和杂化轨道类型的关系
1.杂化类型的判断
因为杂化轨道只能用于形成σ键或者用来容纳孤电子对,而两个原子之间只能形成一个σ键,故有下列关系:
杂化轨道数=中心原子孤电子对数+中心原子结合的原子数,再由杂化轨道数判断杂化类型。例如:
代表物 杂化轨道数 杂化轨道类型
CO2 0+2=2 sp
CH2O 0+3=3 sp2
CH4 0+4=4 sp3
SO2 1+2=3 sp2
NH3 1+3=4 sp3
H2O 2+2=4 sp3
2.共价键全部为σ键的分子构型与杂化类型
3.含σ键和π键的分子构型和杂化类型
特别提醒:(1)杂化轨道间的夹角与分子内的键角不一定相同,中心原子杂化类型相同时孤电子对越多,键角越小。例如,NH3中的氮原子与CH4中的碳原子均为sp3杂化,但键角分别为107°和109°28′。
(2)杂化轨道与参与杂化的原子轨道数目相同,但能量不同。
(3)杂化轨道也符合价层电子对互斥模型,应尽量占据整个空间,使它们之间的排斥力最小。
例2
元素X和Y属于同一主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%。
(1)确定X、Y两种元素在周期表中的位置。
(2)在元素X和元素Y两种元素形成的化合物中,写出X质量分数为50%的化合物的化学式________;该分子的中心原子以________杂化,分子构型为______________。
(3)写出X的质量分数为60%的化合物的化学式__________________________________;
该分子的中心原子以________杂化,分子构型为______________。
(4)由元素氢、X、Y三种元素形成的化合物常见的有两种,其水溶液均呈酸性,试分别写出其分子式________、____________,并比较酸性强弱:__________________。
两种酸的阴离子分别为________和________,立体构型分别为________和________。
(5)由氢元素与X元素形成的化合物中,含有非极性键的是________(写分子式),分子构型为V形的是______(写分子式)。
SO2 SO3 SO SO H2O
价层电子对数 3 3 4 4 4
价层电子对构型 三角形 三角形 四面体 四面体 四面体
②依据成键电子对和孤电子对数目判断分子构型
SO2 SO3 SO SO H2O
价层电子对数 3 3 4 4 4
成键电子对数 2 3 3 4 2
孤电子对数 1 0 1 0 2
【答案】 (1)X:第二周期,ⅥA族;Y:第三周期,ⅥA族。
(2)SO2 sp2 V形
(3)SO3 sp2 平面三角形
(4)H2SO3 H2SO4 H2SO4>H2SO3 SO SO 三角锥形 正四面体形
(5)H2O2 H2O
【规律方法】 判断分子的中心原子杂化轨道类型的方法
(1)根据杂化轨道的空间分布构型判断
①若杂化轨道在空间的分布为正四面体或三角锥形,则分子的中心原子发生sp3杂化。
②若杂化轨道在空间的分布呈平面三角形,则分子的中心原子发生sp2杂化。
③若杂化轨道在空间的分布呈直线形,则分子的中心原子发生sp杂化。
(2)根据杂化轨道之间的夹角判断
若杂化轨道之间的夹角为109°28′,则分子的中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则分子的中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则分子的中心原子发生sp杂化。
变式训练2 (2011年秦皇岛高二检测)氨气分子的立体构型是三角锥形,而甲烷是正四面体形,这是因为( )
A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D.氨气分子是4原子化合物,甲烷为5原子化合物
解析:选C。NH3和CH4都是sp3杂化,故A、B错误
,跟分子中原子个数无关,故D错误。
配位键与配位化合物
1.配位键与非极性键、极性键的区别与联系
类型
比较 共价键
非极性键 极性键 配位键
本质 相邻原子间的共用电子对(电子云重叠)与原子核间的静电作用
成键条件(元素种类) 成键原子得、失电子能力相同(同种非金属) 成键原子得、失电子能力差别较小(不同非金属) 成键原子一方有孤电子对(配体),另一方有空轨道(中心离子或原子)
特征 有方向性、饱和性
特别提醒:(1)不是所有的配合物都具有颜色。如[Ag(NH3)2]OH 溶液无色,而Fe(SCN)3溶液呈红色。(2)过渡金属原子或离子都有接受孤电子对的空轨道,对多种配体具有较强的结合力,因而过渡金属配合物远比主族金属配合物多。
2.配合物的组成
一般中心原子(或离子)的配位数为2、4、6。
3.形成配合物的条件
(1)配体有孤电子对;(2)中心原子有空轨道。
4.配合物的稳定性
配合物具有一定的稳定性。配合物中的配位键越强,配合物越稳定。当作为中心原子的金属离子相同时,配合物的稳定性与配体的性质有关。
5.配合物形成时的性质改变
(1)颜色的改变,如Fe(SCN)3的形成;
(2)溶解度的改变,如AgCl→[Ag(NH3)2]+。
例3
气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键关系如图所示。请将图中你认为是配位键的斜线加上箭头。
【解析】 解答本题要善于挖掘、提炼题目所给的有用信息,弄清配位键的概念及形成条件。
Cl原子最外层有7个电子,Al原子最外层有3个电子,上图中每个键代表1对共用电子对,据此可判断氯化铝(Al2Cl6)中与两个铝形成共价键的氯原子中,有一个键是配位键,氯原子提供电子对,铝原子提供空轨道。配位键的箭头指向提供空轨道的一方。
【答案】
【规律方法】 要想准确解答此类题目,需要掌握好配位键的形成条件: 一种原子有空轨道,另一种原子有孤电子对。因此正确分析原子的最外层电子排布和成键情况是解答该类题目的关键。
变式训练3 下列现象与形成配合物无关的是
( )
A.向FeCl3中滴入KSCN溶液,溶液呈红色
B.向Cu与Cl2反应后的集气瓶中加少量H2O,溶液呈绿色,再加水,溶液呈蓝色
C.Cu与浓HNO3反应后,溶液呈绿色;Cu与稀HNO3反应后,溶液呈蓝色
D.向FeCl3中滴加氨水产生红褐色沉淀
解析:选D。Fe3+与SCN-形成配合物Fe(SCN)3,显红色;Cu2+在水溶液中形成配离子[Cu(H2O)2]2+显绿色,[Cu(H2O)4]2+显蓝色,故A、B、C项均与形成配合物有关。D项中,FeCl3与氨水反应生成Fe(OH)3红褐色沉淀,与形成配合物无关。
第二节 分子的立体构型
学习目标
1.了解共价键分子结构的多样性和复杂性。
2.认识价层电子对互斥理论、杂化轨道理论和配合物理论。
3.能根据有关理论判断简单分子或离子的立体构型。
4.会判断简单配合物的成键情况,了解简单配合物的命名方法。
5.简单了解分子立体结构的测定办法。
课堂互动讲练
课前自主学案
知能优化训练
第二节 分子的立体构型
课前自主学案
一、形形色色的分子
分子的立体构型:两个以上原子构成的分子中的原子的空间关系问题。
1.三原子分子的立体构型有直线形和V形两种。如:
化学式 电子式 结构式 键角 分子的立体模型 立体构型
CO2
______ _______
H2O
_______ _______
180°
105°
直线形
V形
2.四原子分子大多数采取平面三角形和三角锥形两种立体构型。如:
化学式 电子式 结构式 键角 分子的立体模型 立体构型
CH2O _____ ___________
NH3 _____ ___________
120°
107°
平面三
角形
三角锥
形
3.五原子分子的可能立体构型更多,最常见的是正四面体形。如:
化学式 电子式 结构式 键角 分子的立体模型 立体构型
CH4 _________ ___________
CCl4 _________ ___________
109°28′
109°28′
正四面
体形
正四面
体形
思考感悟
1.五原子分子都是正四面体结构吗?
【提示】 不是,如CH3Cl、CH2Cl2、CHCl3等,虽为四面体结构,但由于碳原子所连的四个原子不相同,四个原子电子间的排斥力不同,使四个键的键角不再相等,所以并不是正四面体结构。
二、价层电子对互斥理论
1.价层电子对互斥理论(VSEPR)
分子中的价层电子对(包括____________和_________________________)由于___________作用,而趋向尽可能彼此远离以减小_______,分子尽可能采取________的立体构型。电子对之间的夹角越大,排斥力_______。
σ键电子对
中心原子上的孤电子对
相互排斥
斥力
对称
越小
2.价层电子对的确定方法
思考感悟
3.VSEPR模型的用途
预测分子或离子的____________。
(1)中心原子上的价电子都用于形成共价键的分子的立体构型
立体构型
ABn 价层电子对数 电子对排布方式 立体构型 键角 范例
n=2 _____ _________ 180° CO2
2
直线
形
ABn 价层电子对数 电子对排布方式 立体构型 键角 范例
n=3 ____
______________ 120° BF3
n=4 ____
_______________ 109°28′ CH4
平面三角
形
正四面体
形
3
4
(2)中心原子上有孤电子对的分子的立体构型
对于中心原子上有孤电子对(未用于形成共价键的电子对)的分子,中心原子上的孤电子对也要占据中心原子周围的空间,并互相排斥使分子呈现不同的立体构型。见下表。
化学式 结构式 含孤电子对的VSEPR模型 分子或离子的立体构型 分子或离子的立体构型名称
H2O
_______
NH3 ________
V形
三角锥形
化学式 结构式 含孤电子对的VSEPR模型 分子或离子的立体构型 分子或离子的立体构型名称
HCN _______
H3O+ ________
SO2 _______
直线形
三角锥形
V形
三、杂化轨道理论简介
1.杂化与杂化轨道
(1)概念
①轨道的杂化
原子内部____________的原子轨道重新组合生成与原轨道数_________的一组新轨道的过程。
②杂化轨道
杂化后形成的新的_____________的一组原子轨道。
能量相近
相等
能量相同
(2)类型
杂化类型 sp sp2 sp3
参于杂化的原子轨道及数目 1个s轨道和
1个p轨道 1个s轨道和
2个p轨道 1个s轨道和
3个p轨道
杂化轨道的数目 ______ ______ ______
2
3
4
2.杂化轨道类型与分子空间构型的关系
杂化类型 sp sp2 sp3
杂化轨道间的夹角 ______ ______ _________
空间构型 _________ ___________ __________
实例 CO2、C2H2 BF3 CH4、CCl4
180°
120°
109°28′
直线形
平面三角形
正四面体形
思考感悟
3.用杂化轨道理论分析NH3呈三角锥形的原因。
【提示】 NH3分子中的N原子价电子排布图为 ,1个2s轨道与3个2p轨道杂化后,形成4个sp3杂化轨道,其中3个杂化轨道中是单电子,分别与3个H原子形成σ键,一个杂化轨道中是成对电子,不形成共价键。sp3杂化轨道应为正四面体构型,但由于孤电子对不形成化学键,故NH3分子为三角锥形。
四、配合物理论简介
1.配位键
(1)概念:_____________由一个原子_________提供而另一个原子提供空轨道而形成的共价键,即“电子对给予 接受键”,是一类特殊的____________。
(2)表示
配位键可以用A→B来表示,其中A是________孤电子对的原子,叫做给予体;B是_________电子对的原子,叫做接受体。
孤电子对
单方面
共价键
提供
接受
2.配位化合物
(1)概念:___________________与某些分子或离子(称为________)以___________结合形成的化合物,简称配合物。
金属离子(或原子)
配体
配位键
(2)配合物的形成举例
实验操作 实验现象 有关离子方程式
滴加氨水后,试管中首先出现____________,氨水过量后沉淀逐渐_________,滴加乙醇后析出____________ Cu2++2NH3·H2O=== Cu(OH)2↓+ Cu(OH)2+4NH3===
[Cu(NH3)4]2++2OH-
蓝色沉淀
溶解
深蓝色晶体
实验操作 实验现象 有关离子方程式
溶液颜色_____ Fe3++3SCN-??Fe(SCN)3
变红
思考感悟
4.配制银氨溶液时,向AgNO3溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,为什么?
课堂互动讲练
用价层电子对互斥理论确定分子或离子立体构型的方法
2.确定价层电子对的立体构型
由于价层电子对之间的相互排斥作用,它们趋向于尽可能的相互远离。于是价层电子对的立体构型与价层电子对数目的关系如下表:
价层电子对数 2 3 4
价层电子对构型 直线形 三角形 四面体形
这样已知价层电子对的数目,就可以确定它们的立体构型。
3.分子立体构型的确定
价层电子对有成键电子对和孤电子对之分,价层电子对的总数减去成键电子对数,得孤电子对数。根据成键电子对数和孤电子对数,可以确定相应的较稳定的分子立体构型,如下表所示:
价层电子对数 VSEPR模型名称 成键电子对数 孤电子对数 电子对的排列方式 分子的立体构型名称 实例
2 直线形 2 0 直线形 BeCl2 CO2
价层电子对数 VSEPR模型名称 成键电子对数 孤电子对数 电子对的排列方式 分子的立体构型名称 实例
3 平面三角形 3 0
平面三角形 BF3 BCl3
2 1
V形 SO2
价层电子对数 VSEPR模型名称 成键电子对数 孤电子对数 电子对的排列方式 分子的立体构型名称 实例
4 四面体 4 0
正四面体形 CH4 CCl4
3 1
三角锥形 NH3 NF3
2 2
V形 H2O
特别提醒:利用上表判断分子立体构型时注意:
(1)如果在价层电子对中出现孤电子对时,价层电子对立体构型还与下列斥力顺序有关:孤电子对—孤电子对>孤电子对—成键电子对>成键电子对—成键电子对。因此价层电子对立体构型为三角形和四面体形时,孤电子对的存在会改变成键电子对的分布空间。所以H2O分子的键角应小于109°28′。
(2)对于分子中有双键、三键等多重键时,使用价层电子对理论判断其分子构型时,双键的两对电子和三键的三对电子只能作为一对电子来处理,或者说在确定中心原子的价层电子对总数时不包括π电子。
例1
【思路点拨】 解答本题需注意以下两点:
(1)确定每个结构中成键电子及孤电子对。
(2)根据VSEPR模型判断分子或离子的立体构型。
【解析】 根据各分子的电子式和结构式,分析中心原子的孤电子对数,依据中心原子连接的原子数和孤电子对数,确定VSEPR模型和分子的立体构型。
分子或离子 结构式 中心原子孤电子对数 分子或离子的价层电子对数 VSEP R模型名称 立体构型
BeCl2 Cl—Be—Cl 0 2 直线形 直线形
分子或离子 结构式 中心原子孤电子对数 分子或离子的价层电子对数 VSEP R模型名称 立体构型
SCl2
2 4 四面体 V形
BF3 0 3 平面三角形 平面三角形
PF3 1 4 四面体 三角锥形
分子或离子 结构式 中心原子孤电子对数 分子或离子的价层电子对数 VSEP R模型名称 立体构型
NH
0 4 四面体 正四面体形
SO
1 4 四面体 三角锥形
【答案】 直线形 V形 平面三角形 三角锥形 正四面体形 三角锥形
【误区警示】 使用价层电子对互斥理论判断分子立体构型时需注意:
价层电子对互斥构型是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。两者是否一致取决于中心原子上有无孤电子对(未用于形成共价键的电子对),当中心原子上无孤电子对时,两者的构型一致;当中心原子上有孤电子对时,两者的构型不一致。
变式训练1 若ABn分子的中心原子A上没有未用于形成共价键的孤电子对,根据价层电子对互斥理论,下列说法正确的是( )
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确
解析:选C。若中心原子A上没有未成键的孤电子对,则根据斥力最小的原则,当n=2时,分子的立体构型为直线形;n=3时,分子的立体构型为平面三角形;当n=4时,分子的立体构型为正四面体形。
分子立体构型和杂化轨道类型的关系
1.杂化类型的判断
因为杂化轨道只能用于形成σ键或者用来容纳孤电子对,而两个原子之间只能形成一个σ键,故有下列关系:
杂化轨道数=中心原子孤电子对数+中心原子结合的原子数,再由杂化轨道数判断杂化类型。例如:
代表物 杂化轨道数 杂化轨道类型
CO2 0+2=2 sp
CH2O 0+3=3 sp2
CH4 0+4=4 sp3
SO2 1+2=3 sp2
NH3 1+3=4 sp3
H2O 2+2=4 sp3
2.共价键全部为σ键的分子构型与杂化类型
3.含σ键和π键的分子构型和杂化类型
特别提醒:(1)杂化轨道间的夹角与分子内的键角不一定相同,中心原子杂化类型相同时孤电子对越多,键角越小。例如,NH3中的氮原子与CH4中的碳原子均为sp3杂化,但键角分别为107°和109°28′。
(2)杂化轨道与参与杂化的原子轨道数目相同,但能量不同。
(3)杂化轨道也符合价层电子对互斥模型,应尽量占据整个空间,使它们之间的排斥力最小。
例2
元素X和Y属于同一主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%。
(1)确定X、Y两种元素在周期表中的位置。
(2)在元素X和元素Y两种元素形成的化合物中,写出X质量分数为50%的化合物的化学式________;该分子的中心原子以________杂化,分子构型为______________。
(3)写出X的质量分数为60%的化合物的化学式__________________________________;
该分子的中心原子以________杂化,分子构型为______________。
(4)由元素氢、X、Y三种元素形成的化合物常见的有两种,其水溶液均呈酸性,试分别写出其分子式________、____________,并比较酸性强弱:__________________。
两种酸的阴离子分别为________和________,立体构型分别为________和________。
(5)由氢元素与X元素形成的化合物中,含有非极性键的是________(写分子式),分子构型为V形的是______(写分子式)。
SO2 SO3 SO SO H2O
价层电子对数 3 3 4 4 4
价层电子对构型 三角形 三角形 四面体 四面体 四面体
②依据成键电子对和孤电子对数目判断分子构型
SO2 SO3 SO SO H2O
价层电子对数 3 3 4 4 4
成键电子对数 2 3 3 4 2
孤电子对数 1 0 1 0 2
【答案】 (1)X:第二周期,ⅥA族;Y:第三周期,ⅥA族。
(2)SO2 sp2 V形
(3)SO3 sp2 平面三角形
(4)H2SO3 H2SO4 H2SO4>H2SO3 SO SO 三角锥形 正四面体形
(5)H2O2 H2O
【规律方法】 判断分子的中心原子杂化轨道类型的方法
(1)根据杂化轨道的空间分布构型判断
①若杂化轨道在空间的分布为正四面体或三角锥形,则分子的中心原子发生sp3杂化。
②若杂化轨道在空间的分布呈平面三角形,则分子的中心原子发生sp2杂化。
③若杂化轨道在空间的分布呈直线形,则分子的中心原子发生sp杂化。
(2)根据杂化轨道之间的夹角判断
若杂化轨道之间的夹角为109°28′,则分子的中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则分子的中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则分子的中心原子发生sp杂化。
变式训练2 (2011年秦皇岛高二检测)氨气分子的立体构型是三角锥形,而甲烷是正四面体形,这是因为( )
A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D.氨气分子是4原子化合物,甲烷为5原子化合物
解析:选C。NH3和CH4都是sp3杂化,故A、B错误
,跟分子中原子个数无关,故D错误。
配位键与配位化合物
1.配位键与非极性键、极性键的区别与联系
类型
比较 共价键
非极性键 极性键 配位键
本质 相邻原子间的共用电子对(电子云重叠)与原子核间的静电作用
成键条件(元素种类) 成键原子得、失电子能力相同(同种非金属) 成键原子得、失电子能力差别较小(不同非金属) 成键原子一方有孤电子对(配体),另一方有空轨道(中心离子或原子)
特征 有方向性、饱和性
特别提醒:(1)不是所有的配合物都具有颜色。如[Ag(NH3)2]OH 溶液无色,而Fe(SCN)3溶液呈红色。(2)过渡金属原子或离子都有接受孤电子对的空轨道,对多种配体具有较强的结合力,因而过渡金属配合物远比主族金属配合物多。
2.配合物的组成
一般中心原子(或离子)的配位数为2、4、6。
3.形成配合物的条件
(1)配体有孤电子对;(2)中心原子有空轨道。
4.配合物的稳定性
配合物具有一定的稳定性。配合物中的配位键越强,配合物越稳定。当作为中心原子的金属离子相同时,配合物的稳定性与配体的性质有关。
5.配合物形成时的性质改变
(1)颜色的改变,如Fe(SCN)3的形成;
(2)溶解度的改变,如AgCl→[Ag(NH3)2]+。
例3
气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键关系如图所示。请将图中你认为是配位键的斜线加上箭头。
【解析】 解答本题要善于挖掘、提炼题目所给的有用信息,弄清配位键的概念及形成条件。
Cl原子最外层有7个电子,Al原子最外层有3个电子,上图中每个键代表1对共用电子对,据此可判断氯化铝(Al2Cl6)中与两个铝形成共价键的氯原子中,有一个键是配位键,氯原子提供电子对,铝原子提供空轨道。配位键的箭头指向提供空轨道的一方。
【答案】
【规律方法】 要想准确解答此类题目,需要掌握好配位键的形成条件: 一种原子有空轨道,另一种原子有孤电子对。因此正确分析原子的最外层电子排布和成键情况是解答该类题目的关键。
变式训练3 下列现象与形成配合物无关的是
( )
A.向FeCl3中滴入KSCN溶液,溶液呈红色
B.向Cu与Cl2反应后的集气瓶中加少量H2O,溶液呈绿色,再加水,溶液呈蓝色
C.Cu与浓HNO3反应后,溶液呈绿色;Cu与稀HNO3反应后,溶液呈蓝色
D.向FeCl3中滴加氨水产生红褐色沉淀
解析:选D。Fe3+与SCN-形成配合物Fe(SCN)3,显红色;Cu2+在水溶液中形成配离子[Cu(H2O)2]2+显绿色,[Cu(H2O)4]2+显蓝色,故A、B、C项均与形成配合物有关。D项中,FeCl3与氨水反应生成Fe(OH)3红褐色沉淀,与形成配合物无关。
