化学:第2章第3节 分子的性质 优化课件(人教版选修3)
文档属性
| 名称 | 化学:第2章第3节 分子的性质 优化课件(人教版选修3) |

|
|
| 格式 | rar | ||
| 文件大小 | 337.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-24 00:00:00 | ||
图片预览











文档简介
(共53张PPT)
第三节 分子的性质
学习目标
1.了解共价键的极性和分子的极性及产生极性的原因。
2.知道范德华力、氢键对物质性质的影响。
3.了解影响物质溶解性的因素及相似相溶规律。
4.了解“手性分子”在生命科学等方面的应用。
5.了解无机含氧酸分子酸性强弱的原因。
课堂互动讲练
课前自主学案
知能优化训练
第三节 分子的性质
课前自主学案
一、键的极性和分子的极性
1.键的极性
共价键
分类 极性共价键 非极性共价键
成键原子 ________元素的原子 ______元素的原子
电子对 ______________ ____________
成键原子的电性 一个原子呈正电性(δ+),一个原子呈负电性(δ-) 电中性
不同
发生偏移
同种
不发生偏移
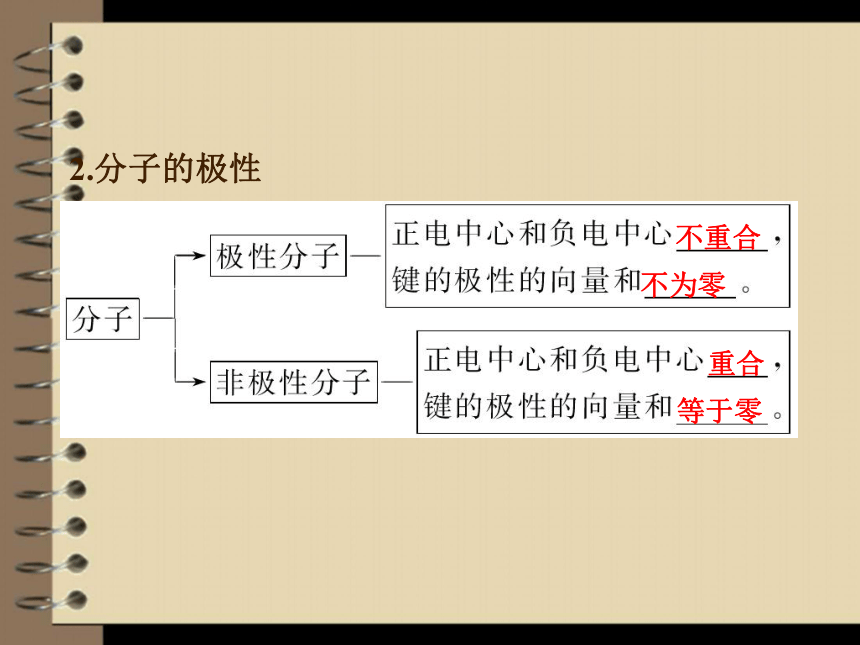
2.分子的极性
不重合
不为零
重合
等于零
3.键的极性与分子极性的关系
(1)只含有非极性键的分子一定是_____________分子。
(2)含极性键的分子,如果分子结构是空间对称的
,则为__________分子,否则是________分子。
非极性
非极性
极性
思考感悟
1.CH4分子中共价键的类型和分子类型分别是什么?
【提示】 CH4分子的结构式为: 分子中有4个C—H键,C—H键为极性键。但由于其立体构型为正四面体形,高度对称,故为非极性分子。
二、范德华力及其对物质性质的影响
分子
相
互作用力
弱
越大
相似
越大
物理
化学
越高
2.Cl2、Br2、I2三者的组成和化学性质均相似,但状态却为气、液、固的原因是什么?
【提示】 Cl2、Br2、I2的组成和结构相似,由于相对分子质量逐渐增大,所以范德华力逐渐增大,故熔、沸点升高,状态由气体变为液体、固体。
三、氢键及其对物质性质的影响
1.概念
氢键是由已经与_________很强的原子(如N、F、O)形成共价键的_________与另一个分子中或同一分子中__________很强的原子之间的作用力。
2.表示方法
氢键通常用A—H…B—表示,其中A、B为____、_____、____中的一种,“—”表示_________,“…”表示形成的________。
电负性
氢原子
电负性
N
O
F
共价键
氢键
强
方向
饱和
分子间
分子内
3.特征
(1)氢键不属于化学键,是一种分子间作用力,比化学键的键能小1~2个数量级,但比范德华力_______。
(2)具有一定的_________性和________性。
4.类型
(1)___________氢键,如水中:O—H…O—;
(2)___________氢键,如 。
5.氢键对物质性质的影响
(1)当形成分子间氢键时,物质的熔、沸点将_________。
(2)当形成分子内氢键时,物质的熔、沸点将_________。
(3)氢键也影响物质的电离、_______等过程。
升高
下降
溶解
6.氢键与水分子的性质
(1)水结冰时,体积膨胀,密度________。
(2)接近沸点时形成“缔合分子”,水蒸气的相对分子质量比用化学式H2O计算出来的相对分子质量_________。
减小
大
思考感悟
3.(1)H2S与H2O组成和结构相似,且H2S的相对分子质量大于H2O,但是H2S为气体,水却为液体,为什么?
(2)冰浮在水面上的原因是什么?
【提示】 (1)水分子间形成氢键,增大了水分子间的作用力,使水的熔、沸点比H2S的熔、沸点高。
(2)由于水结成冰时,水分子大范围地以氢键互相联结,形成疏松的晶体,造成体积膨胀,密度减小。
四、溶解性
1.“相似相溶”规律
非极性溶质一般能溶于_________溶剂,极性溶质一般能溶于_______溶剂。
非极性
极性
2.影响物质溶解性的因素
温度
压强
相似相溶
氢键
增大
氢键
思考感悟
4.CH3OH能与水以任意比互溶而戊醇在水中的溶解度却较小,原因是什么?
【提示】 CH3OH中的—OH与H2O中的—OH相近,甲醇能与H2O互溶,而CH3CH2CH2CH2CH2OH中烃基较大,其中的—OH跟水分子中的—OH相似的因素小得多,因而戊醇在水中的溶解度明显减小。
五、手性
1.手性异构体
具有完全相同的_______和____________的一对分子,如同左手与右手一样互为_______,却在三维空间里不能________,互称手性异构体。
组成
原子排列
镜像
重叠
手性异构体
2.手性分子
有_____________的分子叫做手性分子。如乳酸
( )分子。
六、无机含氧酸分子的酸性
1.对于同一种元素的含氧酸来说,该元素的化合价_______,其含氧酸的酸性_________。
2.含氧酸的通式可写成(HO)mROn,若成酸元素R相同,则n值越大,酸性_______。
越高
越强
越强
课堂互动讲练
分子极性的判断
1.化合价法
ABm型分子中,中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等于其价电子数,则分子的空间结构不对称,其分子为极性分子,具体实例如下:
分子 BF3 CO2 PCl5 SO3(g) H2O NH3 SO2
中心原子化合价绝对值 3 4 5 6 2 3 4
中心原子价电子数 3 4 5 6 6 5 6
分子极性 非极性 非极性 非极性 非极性 极性 极性 极性
2.根据所含键的类型及分子的立体构型判断
分子类型 分子立体构型 键角 键的极性 分子极性 常见物质
A2 直线形(对称) - 非极性键 非极性分子 H2、O2、N2等
AB 直线形(非对称) - 极性键 极性分子 HX、CO、NO等
分子类型 分子立体构型 键角 键的极性 分子极性 常见物质
AB2 直线形(对称) 180° 极性键 非极性分子 CO2、CS2等
A2B V形(不对称) - 极性键 极性分子 H2O、H2S等
AB3 正三角形(对称) 120° 极性键 非极性分子 BF3、SO3等
AB3 三角锥形(不对称) - 极性键 极性分子 NH3、PCl3等
AB4 正四面体形(对称) 109°28′ 极性键 非极性分子 CH4、CCl4等
3.根据中心原子最外层电子是否全部成键判断
中心原子即其他原子围绕它成键的原子。分子中的中心原子最外层电子若全部成键,此分子一般为非极性分子;分子中的中心原子最外层电子若未全部成键,此分子一般为极性分子。
CH4、BF3、CO2等分子中的中心原子的最外层电子均全部成键,它们都是非极性分子。
H2O、NH3、NF3等分子中的中心原子的最外层电子均未全部成键,它们都是极性分子。
特别提醒:(1)极性分子中一定有极性键,非极性分子中不一定只有非极性键。例如CH4是非极性分子,只有极性键。
(2)含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
例1
请指出表中分子的立体构型,判断其中哪些属于极性分子,哪些属于非极性分子。
分子 立体构型 极性(非极性)分子 分子 立体构型 极性(非极性)分子
O2 HF
CO2 H2O
BF3 NH3
CCl4 PCl3
【思路点拨】 解答本题要注意以下两点:
(1)根据中心原子的杂化类型,判断分子的立体构型。
(2)结合分子立体构型判断分子的极性。
【解析】 由于O2、CO2、BF3、CCl4均为对称结构,所以它们均为非极性分子。HF、H2O、NH3、PCl3空间结构不对称,均为极性分子。
【答案】
分子 立体构型 极性(非极性)分子 分子 立体构型 极性(非极性)分子
O2 直线形 非极性分子 HF 直线形 极性分子
CO2 直线形 非极性分子 H2O V形 极性分子
BF3 平面三角形 非极性分子 NH3 三角锥形 极性分子
CCl4 正四面体形 非极性分子 PCl 三角锥形 极性分子
变式训练1 下列叙述中正确的是( )
A.以非极性键结合的双原子分子一定是非极性分子
B.以极性键结合的分子一定是极性分子
C.非极性分子只能是双原子单质分子
D.非极性分子中,一定含有非极性共价键
解析:选A。A是正确的,如O2、H2、N2等;B错误,以极性键结合的分子不一定是极性分子,若分子构型对称,正负电荷中心重合,就是非极性分子,如CH4、CO2、CCl4、CS2等;C错误,非极性分子也可能是某些结构对称的含极性键的化合物,如CH4、CO2等;D错误,非极性分子中不一定含有非极性键,如CH4、CO2等。
范德华力、氢键及共价键的比较
范德华力 氢键 共价键
概念 物质分子之间普遍存在的一种相互作用力 由已经与电负性很强的原子形成共价键的氢原子与另一个分子中电负性很强的原子之间的作用力 原子间通过共用电子对所形成的相互作用
分类 分子内氢键、分子间氢键 极性共价键、非极性共价键
特征 无方向性、无饱和性 有方向性、有饱和性 有方向性、有饱和性
范德华力 氢键 共价键
强度比较 共价键>氢键>范德华力
影响强度的因素 ①随着分子极性的增大而增大
②组成和结构相似的物质,相对分子质量越大,范德华力越大 对于A—H…B—,A、B的电负性越大,B原子的半径越小,键能越大 成键原子半径越小,键长越短,键能越大,共价键越稳定
范德华力 氢键 共价键
对物质性质的影响 ①影响物质的熔、沸点,溶解度等物理性质
②组成和结构相似的物质,随相对分子质量的增大,物质的熔、沸点升高。如F2H2S,HF>HCl,NH3>PH3 ①影响分子的稳定性②共价键键能越大,分子稳定性越强
特别提醒:(1)有氢键的分子间也有范德华力,但有范德华力的分子间不一定有氢键。
(2)氢键与范德华力主要影响物质的物理性质,如熔点、沸点等。化学键主要影响物质的化学性质。
例2
【解析】 分子间作用力是分子间相互作用力的总称,A正确;范德华力是分子与分子间的相互作用力,而氢键是分子间比范德华力稍强的作用力,它们可以同时存在于分子之间,C正确;分子间氢键的形成除使物质的熔、沸点升高外,对物质的溶解度等也有影响,B正确;氢键不是化学键,化学键是原子与原子间强烈的相互作用,D错误。
【答案】 D
【误区警示】 (1)分子间作用力不等价于范德华力,对某些分子来说分子间作用力包括范德华力和氢键。
(2)氢键不是化学键。
变式训练2 二甘醇可用于溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。二甘醇的结构简式是
HO—CH2CH2—O—CH2CH2—OH。下列有关二甘醇的叙述正确的是( )
A.符合通式CnH2nO3
B.分子间能形成氢键
C.分子间不存在范德华力
D.能溶于水,不溶于乙醇
解析:选B。二甘醇的分子式为C4H10O3,它符合通式CnH2n+2O3。二甘醇分子之间能形成O—H…O—氢键,也存在范德华力。由“相似相溶”规律可知,二甘醇能溶于水和乙醇。故正确答案为B。
分子间作用力对物质性质的影响
1.范德华力对物质性质的影响
(1)对物质熔、沸点的影响
一般说来,组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点通常越高。如熔、沸点:I2>Br2>Cl2>F2,Rn>Xe>Kr>Ar>Ne>He。
(2)对物质溶解性的影响
如:在273 K、101 kPa时,氧气在水中的溶解度(0.049 cm3·L-1)比氮气在水中的溶解度(0.024 cm3·L-1)大,就是因为O2与水分子之间的作用力比N2与水分子之间的作用力大所导致的。
(3)相似相溶规律
极性分子一般能溶于极性溶剂中(如HCl易溶于水中),非极性分子一般能溶于非极性溶剂中(如I2易溶于CCl4中,白磷溶于CS2中)。
2.氢键对物质性质的影响
(1)对物质熔、沸点的影响
①某些氢化物分子存在氢键,如H2O、NH3、HF等
,会使同族氢化物沸点反常,如H2O>H2Te>H2Se>H2S。
②当氢键存在于分子内时,它对物质性质的影响与分子间氢键对物质性质产生的影响是不同的。邻羟基苯甲醛的氢键存在于分子内部,对羟基苯甲醛存在分子间氢键,因此对羟基苯甲醛的熔点、沸点分别比邻羟基苯甲醛的熔点、沸点高。
(2)对物质密度的影响
氢键的存在,会使物质的密度出现反常,如液态水变为冰,密度会变小。
(3)对物质溶解度的影响
溶剂和溶质之间存在氢键,溶解性好,溶质分子不能与水分子形成氢键,在水中溶解度就比较小。如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为它们与水形成了分子间氢键的原因。
(4)氢键对物质结构的影响
氢键的存在使一些物质具有一些特殊结构,如冰晶体的孔穴结构等。
特别提醒:判断物质的性质受何种作用力影响,首先要弄清该性质是物理性质还是化学性质,然后找出其影响因素。同时也要能根据作用力的强弱分析物质性质的变化规律。如键能越大,键长越短,键能越强,化学性质越稳定;相对分子质量越大,分子间作用力越强,熔、沸点越高。
例3
下图中A、B、C、D四条曲线表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素气态氢化物沸点的是曲线________,表示ⅣA族元素气态氢化物沸点的是曲线________;同一族中第三、四、五周期元素的气态氢化物沸点依次升高,其原因是________________________________________________________________________。
曲线中第二周期元素的气态氢化物的沸点显著高于第三周期元素气态氢化物的沸点,其原因是________________________________________________________________________。
【解析】 H2O与H2O分子之间有四个氢键,故沸点最高,故A为ⅥA族氢化物沸点曲线,ⅣA族的氢化物都为非极性分子,沸点较低,第二周期元素的氢化物间也不存在氢键,故选D。由于同一主族中第三、四、五周期元素的气态氢化物间不存在氢键,且结构相似,所以它们沸点与范德华力有关,而范德华力与相对分子质量有关,故随着相对分子质量的增大,沸点随之升高。曲线中第
二周期元素的气态氢化物沸点显著高于第三周期元素气态氢化物,原因是第二周期元素氢化物分子间存在氢键。
【答案】 A D 结构相似,相对分子质量增大,范德华力增大,沸点升高 分子间存在氢键
变式训练3 下列现象与化学键有关的是( )
A.F2、Cl2、Br2、I2单质的熔点依次升高
B.H2O的沸点远高于H2S的沸点
C.H2O在高温下也难分解
D.干冰汽化
解析:选C。在A项中,卤素单质分子间存在着分子间作用力,且相对分子质量越大,分子间作用力越强,单质的熔点也就越高。D项,在干冰中,CO2分子间通过范德华力结合在一起,在汽化时需要克服范德华力,而CO2分子内的化学键并没有断裂。B项中由于H2O分子间存在氢键,使分子间作用力增强,所以H2O的沸点要比H2S的高。只有C项中由于H—O键键能很大,在较高温度时也难打开,所以H2O分子很稳定,与共价键有关。故正确答案为C。
第三节 分子的性质
学习目标
1.了解共价键的极性和分子的极性及产生极性的原因。
2.知道范德华力、氢键对物质性质的影响。
3.了解影响物质溶解性的因素及相似相溶规律。
4.了解“手性分子”在生命科学等方面的应用。
5.了解无机含氧酸分子酸性强弱的原因。
课堂互动讲练
课前自主学案
知能优化训练
第三节 分子的性质
课前自主学案
一、键的极性和分子的极性
1.键的极性
共价键
分类 极性共价键 非极性共价键
成键原子 ________元素的原子 ______元素的原子
电子对 ______________ ____________
成键原子的电性 一个原子呈正电性(δ+),一个原子呈负电性(δ-) 电中性
不同
发生偏移
同种
不发生偏移
2.分子的极性
不重合
不为零
重合
等于零
3.键的极性与分子极性的关系
(1)只含有非极性键的分子一定是_____________分子。
(2)含极性键的分子,如果分子结构是空间对称的
,则为__________分子,否则是________分子。
非极性
非极性
极性
思考感悟
1.CH4分子中共价键的类型和分子类型分别是什么?
【提示】 CH4分子的结构式为: 分子中有4个C—H键,C—H键为极性键。但由于其立体构型为正四面体形,高度对称,故为非极性分子。
二、范德华力及其对物质性质的影响
分子
相
互作用力
弱
越大
相似
越大
物理
化学
越高
2.Cl2、Br2、I2三者的组成和化学性质均相似,但状态却为气、液、固的原因是什么?
【提示】 Cl2、Br2、I2的组成和结构相似,由于相对分子质量逐渐增大,所以范德华力逐渐增大,故熔、沸点升高,状态由气体变为液体、固体。
三、氢键及其对物质性质的影响
1.概念
氢键是由已经与_________很强的原子(如N、F、O)形成共价键的_________与另一个分子中或同一分子中__________很强的原子之间的作用力。
2.表示方法
氢键通常用A—H…B—表示,其中A、B为____、_____、____中的一种,“—”表示_________,“…”表示形成的________。
电负性
氢原子
电负性
N
O
F
共价键
氢键
强
方向
饱和
分子间
分子内
3.特征
(1)氢键不属于化学键,是一种分子间作用力,比化学键的键能小1~2个数量级,但比范德华力_______。
(2)具有一定的_________性和________性。
4.类型
(1)___________氢键,如水中:O—H…O—;
(2)___________氢键,如 。
5.氢键对物质性质的影响
(1)当形成分子间氢键时,物质的熔、沸点将_________。
(2)当形成分子内氢键时,物质的熔、沸点将_________。
(3)氢键也影响物质的电离、_______等过程。
升高
下降
溶解
6.氢键与水分子的性质
(1)水结冰时,体积膨胀,密度________。
(2)接近沸点时形成“缔合分子”,水蒸气的相对分子质量比用化学式H2O计算出来的相对分子质量_________。
减小
大
思考感悟
3.(1)H2S与H2O组成和结构相似,且H2S的相对分子质量大于H2O,但是H2S为气体,水却为液体,为什么?
(2)冰浮在水面上的原因是什么?
【提示】 (1)水分子间形成氢键,增大了水分子间的作用力,使水的熔、沸点比H2S的熔、沸点高。
(2)由于水结成冰时,水分子大范围地以氢键互相联结,形成疏松的晶体,造成体积膨胀,密度减小。
四、溶解性
1.“相似相溶”规律
非极性溶质一般能溶于_________溶剂,极性溶质一般能溶于_______溶剂。
非极性
极性
2.影响物质溶解性的因素
温度
压强
相似相溶
氢键
增大
氢键
思考感悟
4.CH3OH能与水以任意比互溶而戊醇在水中的溶解度却较小,原因是什么?
【提示】 CH3OH中的—OH与H2O中的—OH相近,甲醇能与H2O互溶,而CH3CH2CH2CH2CH2OH中烃基较大,其中的—OH跟水分子中的—OH相似的因素小得多,因而戊醇在水中的溶解度明显减小。
五、手性
1.手性异构体
具有完全相同的_______和____________的一对分子,如同左手与右手一样互为_______,却在三维空间里不能________,互称手性异构体。
组成
原子排列
镜像
重叠
手性异构体
2.手性分子
有_____________的分子叫做手性分子。如乳酸
( )分子。
六、无机含氧酸分子的酸性
1.对于同一种元素的含氧酸来说,该元素的化合价_______,其含氧酸的酸性_________。
2.含氧酸的通式可写成(HO)mROn,若成酸元素R相同,则n值越大,酸性_______。
越高
越强
越强
课堂互动讲练
分子极性的判断
1.化合价法
ABm型分子中,中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等于其价电子数,则分子的空间结构不对称,其分子为极性分子,具体实例如下:
分子 BF3 CO2 PCl5 SO3(g) H2O NH3 SO2
中心原子化合价绝对值 3 4 5 6 2 3 4
中心原子价电子数 3 4 5 6 6 5 6
分子极性 非极性 非极性 非极性 非极性 极性 极性 极性
2.根据所含键的类型及分子的立体构型判断
分子类型 分子立体构型 键角 键的极性 分子极性 常见物质
A2 直线形(对称) - 非极性键 非极性分子 H2、O2、N2等
AB 直线形(非对称) - 极性键 极性分子 HX、CO、NO等
分子类型 分子立体构型 键角 键的极性 分子极性 常见物质
AB2 直线形(对称) 180° 极性键 非极性分子 CO2、CS2等
A2B V形(不对称) - 极性键 极性分子 H2O、H2S等
AB3 正三角形(对称) 120° 极性键 非极性分子 BF3、SO3等
AB3 三角锥形(不对称) - 极性键 极性分子 NH3、PCl3等
AB4 正四面体形(对称) 109°28′ 极性键 非极性分子 CH4、CCl4等
3.根据中心原子最外层电子是否全部成键判断
中心原子即其他原子围绕它成键的原子。分子中的中心原子最外层电子若全部成键,此分子一般为非极性分子;分子中的中心原子最外层电子若未全部成键,此分子一般为极性分子。
CH4、BF3、CO2等分子中的中心原子的最外层电子均全部成键,它们都是非极性分子。
H2O、NH3、NF3等分子中的中心原子的最外层电子均未全部成键,它们都是极性分子。
特别提醒:(1)极性分子中一定有极性键,非极性分子中不一定只有非极性键。例如CH4是非极性分子,只有极性键。
(2)含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
例1
请指出表中分子的立体构型,判断其中哪些属于极性分子,哪些属于非极性分子。
分子 立体构型 极性(非极性)分子 分子 立体构型 极性(非极性)分子
O2 HF
CO2 H2O
BF3 NH3
CCl4 PCl3
【思路点拨】 解答本题要注意以下两点:
(1)根据中心原子的杂化类型,判断分子的立体构型。
(2)结合分子立体构型判断分子的极性。
【解析】 由于O2、CO2、BF3、CCl4均为对称结构,所以它们均为非极性分子。HF、H2O、NH3、PCl3空间结构不对称,均为极性分子。
【答案】
分子 立体构型 极性(非极性)分子 分子 立体构型 极性(非极性)分子
O2 直线形 非极性分子 HF 直线形 极性分子
CO2 直线形 非极性分子 H2O V形 极性分子
BF3 平面三角形 非极性分子 NH3 三角锥形 极性分子
CCl4 正四面体形 非极性分子 PCl 三角锥形 极性分子
变式训练1 下列叙述中正确的是( )
A.以非极性键结合的双原子分子一定是非极性分子
B.以极性键结合的分子一定是极性分子
C.非极性分子只能是双原子单质分子
D.非极性分子中,一定含有非极性共价键
解析:选A。A是正确的,如O2、H2、N2等;B错误,以极性键结合的分子不一定是极性分子,若分子构型对称,正负电荷中心重合,就是非极性分子,如CH4、CO2、CCl4、CS2等;C错误,非极性分子也可能是某些结构对称的含极性键的化合物,如CH4、CO2等;D错误,非极性分子中不一定含有非极性键,如CH4、CO2等。
范德华力、氢键及共价键的比较
范德华力 氢键 共价键
概念 物质分子之间普遍存在的一种相互作用力 由已经与电负性很强的原子形成共价键的氢原子与另一个分子中电负性很强的原子之间的作用力 原子间通过共用电子对所形成的相互作用
分类 分子内氢键、分子间氢键 极性共价键、非极性共价键
特征 无方向性、无饱和性 有方向性、有饱和性 有方向性、有饱和性
范德华力 氢键 共价键
强度比较 共价键>氢键>范德华力
影响强度的因素 ①随着分子极性的增大而增大
②组成和结构相似的物质,相对分子质量越大,范德华力越大 对于A—H…B—,A、B的电负性越大,B原子的半径越小,键能越大 成键原子半径越小,键长越短,键能越大,共价键越稳定
范德华力 氢键 共价键
对物质性质的影响 ①影响物质的熔、沸点,溶解度等物理性质
②组成和结构相似的物质,随相对分子质量的增大,物质的熔、沸点升高。如F2
特别提醒:(1)有氢键的分子间也有范德华力,但有范德华力的分子间不一定有氢键。
(2)氢键与范德华力主要影响物质的物理性质,如熔点、沸点等。化学键主要影响物质的化学性质。
例2
【解析】 分子间作用力是分子间相互作用力的总称,A正确;范德华力是分子与分子间的相互作用力,而氢键是分子间比范德华力稍强的作用力,它们可以同时存在于分子之间,C正确;分子间氢键的形成除使物质的熔、沸点升高外,对物质的溶解度等也有影响,B正确;氢键不是化学键,化学键是原子与原子间强烈的相互作用,D错误。
【答案】 D
【误区警示】 (1)分子间作用力不等价于范德华力,对某些分子来说分子间作用力包括范德华力和氢键。
(2)氢键不是化学键。
变式训练2 二甘醇可用于溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。二甘醇的结构简式是
HO—CH2CH2—O—CH2CH2—OH。下列有关二甘醇的叙述正确的是( )
A.符合通式CnH2nO3
B.分子间能形成氢键
C.分子间不存在范德华力
D.能溶于水,不溶于乙醇
解析:选B。二甘醇的分子式为C4H10O3,它符合通式CnH2n+2O3。二甘醇分子之间能形成O—H…O—氢键,也存在范德华力。由“相似相溶”规律可知,二甘醇能溶于水和乙醇。故正确答案为B。
分子间作用力对物质性质的影响
1.范德华力对物质性质的影响
(1)对物质熔、沸点的影响
一般说来,组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点通常越高。如熔、沸点:I2>Br2>Cl2>F2,Rn>Xe>Kr>Ar>Ne>He。
(2)对物质溶解性的影响
如:在273 K、101 kPa时,氧气在水中的溶解度(0.049 cm3·L-1)比氮气在水中的溶解度(0.024 cm3·L-1)大,就是因为O2与水分子之间的作用力比N2与水分子之间的作用力大所导致的。
(3)相似相溶规律
极性分子一般能溶于极性溶剂中(如HCl易溶于水中),非极性分子一般能溶于非极性溶剂中(如I2易溶于CCl4中,白磷溶于CS2中)。
2.氢键对物质性质的影响
(1)对物质熔、沸点的影响
①某些氢化物分子存在氢键,如H2O、NH3、HF等
,会使同族氢化物沸点反常,如H2O>H2Te>H2Se>H2S。
②当氢键存在于分子内时,它对物质性质的影响与分子间氢键对物质性质产生的影响是不同的。邻羟基苯甲醛的氢键存在于分子内部,对羟基苯甲醛存在分子间氢键,因此对羟基苯甲醛的熔点、沸点分别比邻羟基苯甲醛的熔点、沸点高。
(2)对物质密度的影响
氢键的存在,会使物质的密度出现反常,如液态水变为冰,密度会变小。
(3)对物质溶解度的影响
溶剂和溶质之间存在氢键,溶解性好,溶质分子不能与水分子形成氢键,在水中溶解度就比较小。如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为它们与水形成了分子间氢键的原因。
(4)氢键对物质结构的影响
氢键的存在使一些物质具有一些特殊结构,如冰晶体的孔穴结构等。
特别提醒:判断物质的性质受何种作用力影响,首先要弄清该性质是物理性质还是化学性质,然后找出其影响因素。同时也要能根据作用力的强弱分析物质性质的变化规律。如键能越大,键长越短,键能越强,化学性质越稳定;相对分子质量越大,分子间作用力越强,熔、沸点越高。
例3
下图中A、B、C、D四条曲线表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素气态氢化物沸点的是曲线________,表示ⅣA族元素气态氢化物沸点的是曲线________;同一族中第三、四、五周期元素的气态氢化物沸点依次升高,其原因是________________________________________________________________________。
曲线中第二周期元素的气态氢化物的沸点显著高于第三周期元素气态氢化物的沸点,其原因是________________________________________________________________________。
【解析】 H2O与H2O分子之间有四个氢键,故沸点最高,故A为ⅥA族氢化物沸点曲线,ⅣA族的氢化物都为非极性分子,沸点较低,第二周期元素的氢化物间也不存在氢键,故选D。由于同一主族中第三、四、五周期元素的气态氢化物间不存在氢键,且结构相似,所以它们沸点与范德华力有关,而范德华力与相对分子质量有关,故随着相对分子质量的增大,沸点随之升高。曲线中第
二周期元素的气态氢化物沸点显著高于第三周期元素气态氢化物,原因是第二周期元素氢化物分子间存在氢键。
【答案】 A D 结构相似,相对分子质量增大,范德华力增大,沸点升高 分子间存在氢键
变式训练3 下列现象与化学键有关的是( )
A.F2、Cl2、Br2、I2单质的熔点依次升高
B.H2O的沸点远高于H2S的沸点
C.H2O在高温下也难分解
D.干冰汽化
解析:选C。在A项中,卤素单质分子间存在着分子间作用力,且相对分子质量越大,分子间作用力越强,单质的熔点也就越高。D项,在干冰中,CO2分子间通过范德华力结合在一起,在汽化时需要克服范德华力,而CO2分子内的化学键并没有断裂。B项中由于H2O分子间存在氢键,使分子间作用力增强,所以H2O的沸点要比H2S的高。只有C项中由于H—O键键能很大,在较高温度时也难打开,所以H2O分子很稳定,与共价键有关。故正确答案为C。
