2.3重要的碱—华东师大版九年级科学上册同步测验(含解析)
文档属性
| 名称 | 2.3重要的碱—华东师大版九年级科学上册同步测验(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 174.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-01-09 20:26:50 | ||
图片预览



文档简介
重要的碱同步测验
一、单选题
1.下列有关氢氧化钠的说法,错误的是(??? )
A.?氢氧化钠俗称烧碱???????????????????????????????????????B.?氢氧化钠有强烈的腐蚀性
C.?氢氧化钠水溶液能使紫色石蕊试液变红???????D.?氢氧化钠能去油污,厨房碱性清洁剂中含有氢氧化钠
2.下列物质不能与氢氧化钙溶液发生化学反应的是(??? )
A.?稀硫酸??????????????????????????B.?氧化铁??????????????????????????C.?紫色石蕊试液??????????????????????????D.?碳酸钠溶液
3.下列有关氢氧化钠的叙述,不正确的是(??? )
A.?氢氧化钠易吸收空气中的水蒸气,可作某些气体的干燥剂
B.?氢氧化钠的潮解属于化学变化
C.?氢氧化钠暴露在空气中质量增大且变质
D.?氢氧化钠可用于造纸、纺织、制肥皂等工业中
4.氢氧化钠是常见的化工原料,往氢氧化钠溶液中加入以下物质:①BaCl2②CuCl2③HCl④K2CO3 , 一定能发生化学反应的是(??? )
A.?①②?????????????????????????????????????B.?①④?????????????????????????????????????C.?②③?????????????????????????????????????D.?③④
5.氢氧化钠、氢氧化钙的溶液都具有相似化学性质,其原因是(? )
A.?都能解离出金属离子???????????????????????????????????????????B.?都能与酸反应生成盐和水
C.?都能使无色酚酞试液变成红色?????????????????????????????D.?溶液中都含有OH﹣
6.下列关于氢氧化钠的描述中错误的是(?? )
A.?对皮肤有强烈的腐蚀作用???????????????????????????????????B.?水溶液能使石蕊溶液变红
C.?易溶于水,溶于水时放出大量的热?????????????????????D.?能去除油污,可作炉具清洁剂
7.氢氧化钙俗称(?? )
A.?烧碱??????????????????????????????????B.?纯碱??????????????????????????????????C.?熟石灰??????????????????????????????????D.?石灰石
8.向某饱和氢氧化钙溶液中加入下列物质,pH的基本不变的是(?? )
A.?通入二氧化碳??????????B.?加入少量生石灰,保持温度不变??????????C.?加入盐酸??????????D.?加入硫酸铜溶液
9.氢氧化钠、氢氧化钙都是常见的碱,我们之所以认为它们是碱,是因为它们(??? )
A.?都能与酸反应?????????????????????????????????????????????????????B.?电离时生成的阴离子只有OH-
C.?遇紫色石蕊试液变蓝色???????????????????????????????????????D.?溶液的PH大于7
10.硝酸钾和氢氧化钙在工农业上有广泛应用,其溶解度如表所示,下列说法正确的是( ???)
温度(℃)
0
20
40
60
80
硝酸钾溶解度(克)
13.3
31.6
63.9
110
169
氢氧化钙溶解度(克)
0.173
0.165
0.121
0.116
0.094
A.?两种物质的溶解度都随温度升高而增大
B.?20℃时的氢氧化钙饱和溶液降温至10℃,溶质质量分数增大
C.?60℃时100g、110g、120g硝酸钾分别放入100克水中,溶质质量分数依次增大
D.?80℃时100g饱和硝酸钾溶液中,溶质和溶剂的质量比为169:100
11.下列选项没有体现酸的通性或者碱的通性的是(??? )
A.?实验室制取二氧化碳和氢气????????????????????????????????B.?利用稀硫酸除去硫酸钠中混有的少量碳酸钠
C.?可溶性铜盐或铁盐遇氢氧化钠产生有色沉淀????????D.?实验室利用硝酸钡鉴别稀硫酸和稀盐酸
12.下列四个实验中,不能体现碱的通性的是( ???)
A.?????????????????????????????????????????B.?
C.????????????????????????????????????????D.?
13.下列条件中的氢氧化钙溶液,质量分数最大的是(?? )
A.?30℃的不饱和溶液??????????B.?30℃的饱和溶液??????????C.?90℃的不饱和溶液??????????D.?90℃的饱和溶液
14.氢氧化钠、氢氧化钙都具有碱的通性,是因为(?? )
A.?组成中都含有氢、氧两种元素?????????????????????????????B.?电离时生成的阳离子全部是金属离子
C.?水溶液都具有腐蚀性???????????????????????????????????????????D.?电离时生成的阴离子全部是氢氧根离子
15.下列关于酸、碱的说法错误的是( ???)
A.?苛性钠、烧碱、火碱都是氢氧化钠??????????????????????B.?氢氧化钙可以用来改良酸性土壤
C.?稀盐酸能够使酚酞溶液变红????????????????????????????????D.?生活中许多常见的物质(如柠檬、柑橘)中含有酸
16.下列关于酸和碱反应的说法中,错误的是(?? )
A.?酸碱的反应要放出热量
B.?酸碱的反应一定有盐生成
C.?酸碱的反应一定有水生成
D.?酸碱恰好完全反应后溶液的pH=0
17.酸与碱作用生成盐和水的反应,叫做中和反应。它在工农业生产和日常生活中有广泛的用途。下列应用一定与中和反应原理无关的是(? )
A.?施用熟石灰改良酸性土壤????????????????????????????????????B.?服用含Al(OH)3的药物治疗胃酸过多
C.?用熟石灰和硫酸铜配制波尔多液?????????????????????????D.?用NaOH溶液洗涤石油产品中的残余硫酸
18.小科在研究碱的化学性质时,设计了如图所示的五组实验,下列叙述正确的是(?? )
A.?丙组和戊组实验能观察到相同现象
B.?甲组实验能观察到无色变成红色,可推出氢氧化铜也能使指示剂变色
C.?乙组实验无明显现象,说明两者不能发生反应
D.?丁组实验产生蓝色絮状沉淀,说明碱都能和含铜离子的溶液发生反应
19.下列物质的名称、俗名、化学式及其类别中,完全对应的是(??? )
物质的名称
俗名
化学式
类别
A.
碳酸钠
烧碱
Na2CO3
盐
B.
碳酸氢钠
小苏打
NaHCO3
酸
C.
氢氧化钙
熟石灰
CaO
金属氧化物
D.
氢氧化钠
苛性碱
NaOH
碱
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
20.某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是( ?)
A.?反应至A点时,所加NaOH溶液的质量为40g
B.?反应至A点时,溶液中的溶质有CuCl2和NaCl
C.?反应至B点时,锥形瓶内溶液的质量为280.4g
D.?反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g
二、填空题
21.氢氧化钠是重要的化工原料,在生活、生产中应用广泛。
(1)氢氧化钠具有强烈的________性,实验时最好戴防护眼镜。
(2)氢氧化钠若没有密封保存易变质,要检验氢氧化钠溶液是否变质,下列试剂无法达到目的的是 ????????。(填选项)
A.稀HCl
B.酚酞试液
C.CaCl2溶液
D.Ca(OH)2溶液
22.有属于酸、碱、盐的5种常见物质A、B、C、D、E,它们之间可以发生如下反应:
⑴A+B→C+H2O??? ⑵C+H2SO4→D↓+A???? ⑶E+AgNO3→AgCl↓+C
根据上述反应,①推断下列物质的化学式: E________;
②写出 (1)化学方程式 ________。
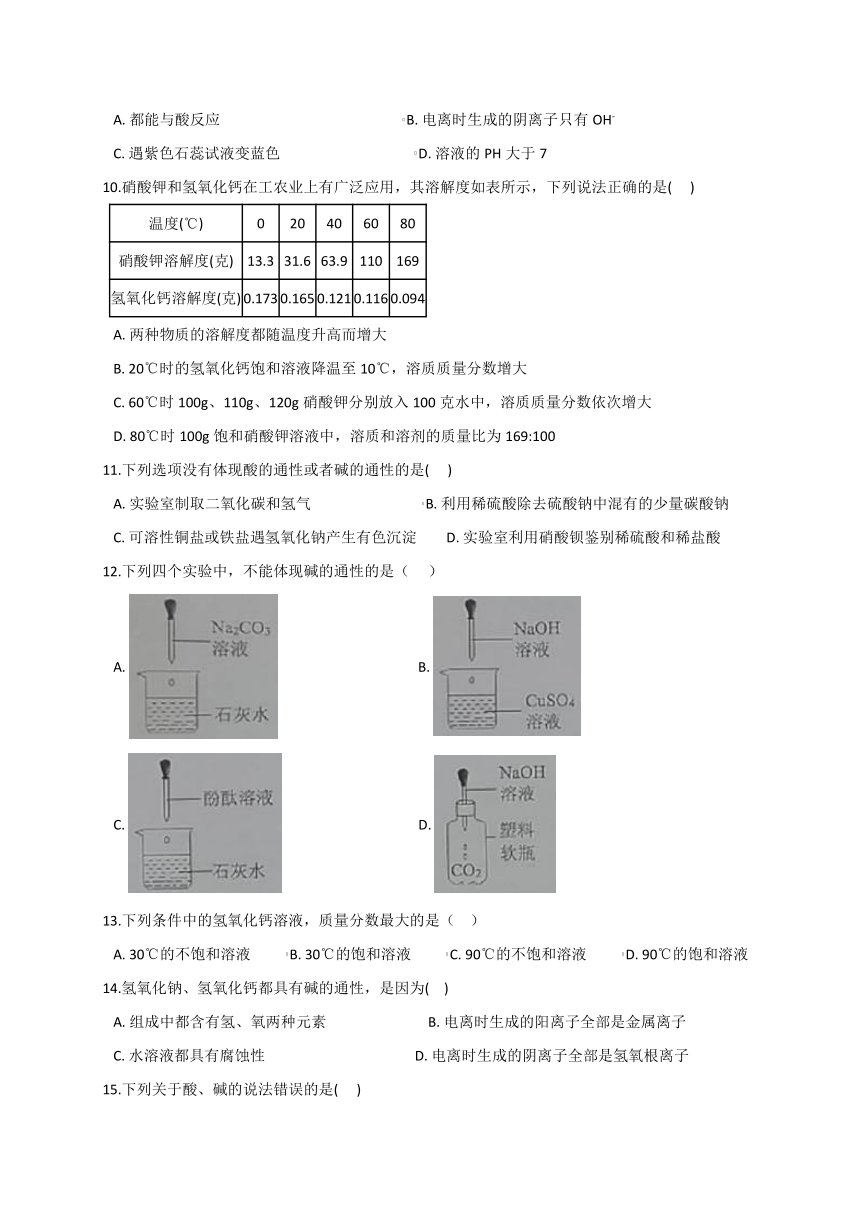
23.某化学活动小组以“酸碱盐的性质”为主题进行探究性学习,用图1总结了NaOH的四条化学性质。
(1)为了验证反应③能够发生,你选择的物质是(??? )
A.Na2CO3
B.HCl
C.FeCl3
D.Ba(NO3)2
(2)依据反应④,NaOH溶液可以吸收工业尾气中的SO2气体,其化学方程式为: ________。
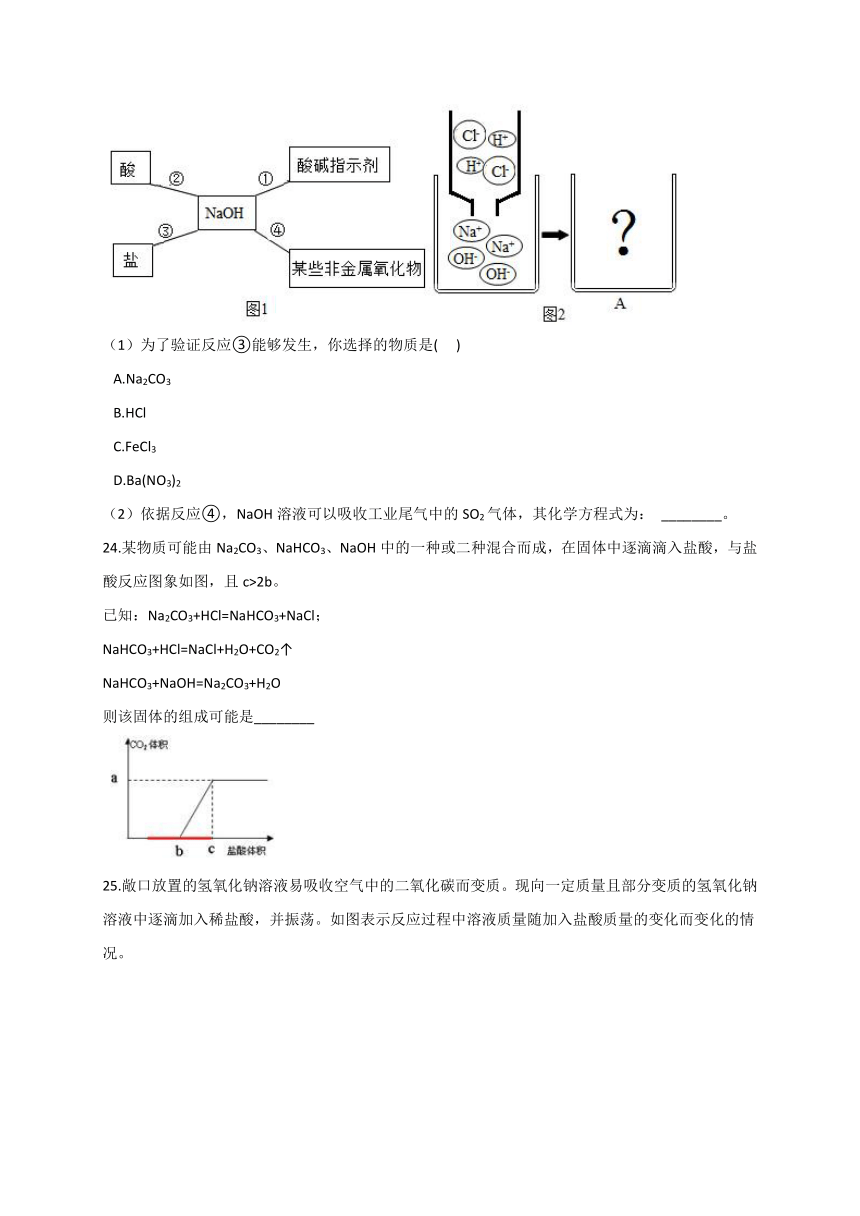
24.某物质可能由Na2CO3、NaHCO3、NaOH中的一种或二种混合而成,在固体中逐滴滴入盐酸,与盐酸反应图象如图,且c>2b。
已知:Na2CO3+HCl=NaHCO3+NaCl;
NaHCO3+HCl=NaCl+H2O+CO2↑
NaHCO3+NaOH=Na2CO3+H2O
则该固体的组成可能是________
25.敞口放置的氢氧化钠溶液易吸收空气中的二氧化碳而变质。现向一定质量且部分变质的氢氧化钠溶液中逐滴加入稀盐酸,并振荡。如图表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况。
(1)写出氢氧化钠溶液变质的化学方程式________.
(2)图中线段BC对应的实验现象是________.
(3)图中B点时溶液中的溶质是________.
26.室温时,向滴加了无色酚酞的Ba(OH)2溶液的烧杯中逐滴加入稀硫酸,烧杯内溶液中溶质质量变化如图所示:
(1)c点溶液中的溶质为________。
(2)ob段实验的现象是________。
27.如图装置可以制造非常有趣的“化学喷泉”,将胶头滴管中的NaOH溶液挤入烧瓶内,在导管的尖嘴处就会形成美丽的“喷泉”。
(1)该现象的出现,原因是瓶内发生化学反应而使瓶内气压减小,请写出反应的化学方程式:________?。
(2)若将烧瓶中的CO2换成下面的四种气体,仍可产生“喷泉”现象的瓶是??????? 。
A.SO2???
B.H2
C.O2
D.HCl
28.化学活动小组的同学用右图所示装置进行实验(装置的气密性良好):先关闭止水夹,将足量氢氧化钠溶液滴入锥形瓶中,充分反应后,再打开止水夹.
(1)锥形瓶中能观察到的现象是________?;
(2)根据上述现象,能否得出“二氧化碳与氢氧化钠能反应”的结论?为什么?答:________
三、解答题
29.为了测定一瓶未密封保存的NaOH固体中NaOH的质量分数,小金采用沉淀法进行如下操作:
①取15克样品于烧杯中,加足量水配成溶液;②在样品溶液中加入足量的BaCl2溶液;③待反应完全后,过滤。有关数据记录如表:
反应前
反应后
烧杯和样品溶液总质量/g
加入的氯化钡溶液质量/g
过滤后烧杯和溶液总质量/g(滤液的损失忽略不计)
95
65
140.3
请回答下列问题:
(1)反应共生成沉淀多少克?
(2)原样品中NaOH的质量分数是多少?
30.向34.2g的Ba(OH)2溶液中先后滴加质量分数为8%的CuSO4和质量分数为9.8%的H2SO4溶液,滴加过程中加入溶液的质量与产生沉淀的质量关系如图所示。
(1)a点对应溶液pH________7(选填“>”“=”或“<”)。
(2)通过计算确定加入的CuSO4溶液中的溶质质量为多少?
(3)原Ba(OH)2溶液溶质的质量分数为多少?
答案解析部分
一、单选题
1.【答案】 C
【解析】根据氢氧化钠俗称、性质及用途分析。
A、 氢氧化钠俗称烧碱、火碱、苛性钠,不符合题意;
B、 氢氧化钠有强烈的腐蚀性,不符合题意;
C、 氢氧化钠水溶液呈碱性,能使紫色石蕊试液变蓝 ,符合题意;
D、 氢氧化钠能去油污,厨房碱性清洁剂中含有氢氧化钠 ,不符合题意;
2.【答案】 B
【解析】根据碱的化学性质分析,碱能与酸、指示剂、碳酸盐溶液或一些非金属氧化物反应,但不能与金属氧化物反应。 稀硫酸、紫色石蕊试液和碳酸钠溶液都能与氢氧化钙溶液发生反应,而氧化铁不能与碱发生化学变化;
3.【答案】 B
【解析】根据氢氧化钠的潮解性、与二氧化碳反应的性质及氢氧化钠的用途分析。
A、 氢氧化钠易潮解,能吸收空气中的水蒸气,可作某些气体的干燥剂 ,不符合题意;
B、 氢氧化钠的潮解属于物理变化 ,符合题意;
C、 氢氧化钠暴露在空气中会吸收水分和二氧化碳,质量增大且变质 ,不符合题意;
D、 氢氧化钠可用于造纸、纺织、制肥皂等工业中 ,不符合题意;
4.【答案】 C
【解析】根据碱的化学性质分析,酸碱盐间的反应都属于复分解反应,判断复分解反应要看生成物中是否有气体、沉淀或水。
①BaCl2不能与氢氧化钠反应,②CuCl2能与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,③HCl能与氢氧化钠反应生成氯化钠和水,④K2CO3 不能与氢氧化钠反应;
5.【答案】 D
【解析】碱溶液中都存在大量的OH-离子,因此它们都呈现相似的化学性质。
氢氧化钠、氢氧化钙的溶液都具有相似化学性质,其原因是溶液中都含有OH﹣ , 故D正确,而A、B、C错误。
6.【答案】 B
【解析】根据氢氧化钠的腐蚀性、碱性、溶解放热、能与油污反应等性质进行分析。氢氧化钠溶液呈碱性,石蕊遇碱性溶液呈蓝色,B描述错误;
7.【答案】C
【解析】根据氢氧化钙的俗称进行分析。氢氧化钙俗称消石灰、熟石灰;
8.【答案】 B
【解析】氢氧化钙的饱和溶液显碱性,pH大于7;加入物质后溶液的pH基本不变,则混合反应后仍有碱性物质存在,据此结合碱的化学性质进行分析判断.
A、二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,溶液的碱性减弱,pH变小,故选项错误.
B、加入生石灰,则氧化钙与水反应生成氢氧化钙,溶液仍为饱和溶液,pH基本不变,故选项正确.
C、盐酸与氢氧化钙反应生成氯化钙和水,溶液的碱性减弱,pH变小,故选项错误.
D、硫酸铜溶液与氢氧化钙反应生成氢氧化铜沉淀和硫酸钙,碱性减弱,pH变小,故选项错误.
9.【答案】 B
【解析】氢氧化钙是一种白色粉末状固体,化学式Ca(OH)2 , 俗称熟石灰、消石灰,水溶液称作澄清石灰水。氢氧化钙具有碱的通性,是一种强碱。 因为物质电离时生成的阴离子全部是OH-的化合物叫做碱,氢氧化钠和氢氧化钙就是如此。
10.【答案】 D
【解析】
A、氢氧化钙的溶解度随温度升高而减小,不符合题意;
B、 20℃时的氢氧化钙饱和溶液降温至10℃,变成不饱和溶液,溶质质量分数不变,不符合题意;
C、 60℃时硝酸钾的溶解度为110克,将100g、110g、120g硝酸钾分别放入100克水中,后两者都形成饱和溶液,溶质质量分数相等,不符合题意;
D、 80℃时硝酸钾溶解度为169克,则该温度下100g饱和硝酸钾溶液中, 溶质和溶剂的质量比为169:100 ,符合题意;
11.【答案】 D
【解析】根据酸和碱的通性分析判断。
A.实验室制取二氧化碳,通常使用碳酸钙和稀盐酸反应,体现酸的通性:盐+酸=盐+酸;制取氢气,通常使用活泼金属和酸反应,体现酸的通性:活泼金属+酸=盐+氢气,故A不合题意;
B.利用稀硫酸除去硫酸钠中混有的少量碳酸钠,体现酸的通性:酸+盐=酸+盐,故B不合题意;?
C.可溶性铜盐或铁盐遇氢氧化钠产生有色沉淀,体现碱的通性:可溶性盐+碱=盐+碱,故C不合题意;?
D.实验室利用硝酸钡鉴别稀硫酸和稀盐酸,稀硫酸能够和硝酸钡反应,而稀盐酸不能和硝酸钡反应,不能体现盐的通性,故D符合题意。
12.【答案】 A
【解析】碱的通性包括:
①碱使指示剂变色;?
②碱 + 酸 = 盐 + 水 ?
③碱 + 某些非金属氧化物= 盐 + 水?
④碱 + 某些盐 = 新碱 + 新盐?
A.氢氧化钙和碳酸钠反应生成白色沉淀碳酸钙,就钙离子和碳酸根离子的结合,碱的共性是氢氧根离子显示的性质,故A错误,符合题意;
B.2NaOH+CuSO4=Na2SO4+Cu(OH)2↓,体现碱的通性:碱 + 某些盐 = 新碱 + 新盐 ,故B不合题意;
C.石灰水(Ca(OH)2)能使无色的酚酞试液变红色,体现碱的通性:碱使指示剂变色,故C不合题意;
D.NaOH+CO2=Na2CO3+H2O,体现碱的通性:碱 + 某些非金属氧化物= 盐 + 水,故D不合题意。
13.【答案】 B
【解析】根据同一温度下饱和溶液溶质质量分数比不饱和溶液溶质质量分数大,低温下氢氧化钙的饱和溶液比高温的饱和溶液溶质质量分数大分析。同一温度下,氢氧化钙饱和溶液比不饱和溶液溶质质量分数大,氢氧化钙的溶解度随温度升高而减小,所以低温下饱和溶液比高温的饱和溶液溶质质量分数大,所以质量分数最大的为 30℃的饱和溶液;
14.【答案】 D
【解析】根据碱的溶液中都含有相同的氢氧根离子分析。
A、 氢氧化钠、氢氧化钙都含有氢氧根离子,所以有碱的通性,不符合题意;
B、氢氧化钠、氢氧化钙都含有氢氧根离子,所以有碱的通性,不符合题意;
C、氢氧化钠、氢氧化钙都含有氢氧根离子,所以有碱的通性,不符合题意;
D、氢氧化钠、氢氧化钙都含有氢氧根离子,所以有碱的通性,符合题意;
15.【答案】 C
【解析】
A.苛性钠、烧碱、火碱都是氢氧化钠 ,故A正确不合题意;
B.氢氧化钙可以用来改良酸性土壤,故B正确不合题意;?
C.稀盐酸不能使酚酞溶液变色,故C错误符合题意;
D.生活中许多常见的物质(如柠檬、柑橘)中含有酸,故D正确不合题意。
16.【答案】D
【解析】根据酸和碱恰好完全反应后溶液呈中性溶液p H=7分析。
酸碱恰好完全反应后溶液呈中性,pH=7;
17.【答案】 C
【解析】酸碱中和反应的关键是:反应物必须是酸和碱,生成物是盐和水,据此判断即可。
A.熟石灰是氢氧化钙,此为碱,酸性土壤有酸性物质,与中和反应有关,故A不合题意;
B. Al(OH)3 为碱,而胃酸为HCl,与中和反应有关,故B不合题意;
C.熟石灰为碱,而硫酸铜为盐,不符合中和反应的条件,故C符合题意;
D. NaOH 为碱,而残余硫酸为酸,与中和反应有关,故D不合题意。
18.【答案】 A
【解析】根据碱的化学性质进行分析判断即可。
A.丙组二氧化碳和氢氧化钙反应能生成碳酸钙沉淀和水,能够观察到产生白色沉淀,戊组碳酸钠和氢氧化钙反应能生成碳酸钙沉淀和氢氧化钠,也能够观察到产生白色沉淀,故A正确;
B.氢氧化钙溶液显碱性,能使无色酚酞变成红色;但是氢氧化铜不溶于水,不能使指示剂变色,故B错误;
C.稀盐酸与氢氧化钠反应能生氯化钠和水,无明显现象,故C错误;
D.丁组实验产生蓝色絮状沉淀,但是碱溶液才能和含铜离子的溶液发生反应,而不是碱,故D错误。
19.【答案】 D
【解析】本题探究物质的名称基础常识。
碳酸钠(Na2CO3)又叫纯碱,但分类属于盐,不属于碱,A不符合题意。
??B、碳酸氢钠,俗称小苏打,化学式NaHCO3 , 碳酸氢钠是强碱与弱酸中和后生成的酸式盐,溶于水时呈现弱碱性,B不符合题意。
??C、氢氧化钙, 化学式Ca(OH)?,俗称熟石灰、消石灰,水溶液称作澄清石灰水。氢氧化钙具有碱的通性,是一种强碱,C不符合题意。
? D、氢氧化钠,俗名苛性碱,化学式NaOH,碱,D符合题意。
20.【答案】 D
【解析】根据向盐酸和氯化铜溶液中加氢氧化钠溶液,氢氧化钠先与盐酸反应,然后再与氯化铜反应及参加反应的氢氧化钠溶液质量代入方程式计算生成氢氧化铜质量、生成氯化钠中钠元素质量与氢氧化钠中钠元素质量相等分析。
A、向盐酸和氯化铜溶液中加氢氧化钠溶液,氢氧化钠先与盐酸反应,然后再与氯化铜反应,由图像可知,A点为氢氧化钠溶液与盐酸的反应,反应后溶液质量为140克,则所加氢氧化钠溶液质量为40克,不符合题意;
B、反应至A点时,溶液中盐酸完全反应,溶质为氯化铜和氯化钠,不符合题意;
C、反应至B点时,氯化铜完全反应,所加氢氧化钠溶液质量为200g-40g=160g,则氢氧化钠质量为160g ×10% =16g,设产生氢氧化铜质量为x
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
80???????????????????????????????????????????? 98
16g??????????????????????????????????????????? x
80:98=16g:x
x=19.6g,则锥形瓶中溶液质量为100g+200g-19.6g=280.4g,不符合题意;
D、 反应至B点时,锥形瓶内溶液中NaCl的质量为200g 反应至B点时,根据生成氯化钠中钠元素质量与氢氧化钠中钠元素质量相等,可知锥形瓶内溶液中NaCl的质量为200g ×10%×2340÷2358.5=29.25g ,符合题意;
二、填空题
21.【答案】 (1)腐蚀性
(2)B
【解析】(1)氢氧化钠具有强烈的腐蚀性;
(2)氢氧化钠变质是吸收二氧化碳生成碳酸钠和水,加稀盐酸、氯化钙溶液、氢氧化钙溶液都能与碳酸钠反应有明显现象,而碳酸钠和氢氧化钠溶液都呈碱性,都能使酚酞变红,所以酚酞溶液无法鉴别氢氧化钠变质;
22.【答案】 BaCl2;2 HNO3+ Ba(OH)2= Ba(NO3)2+2H2O
【解析】根据推断可得A为硝酸,B为氢氧化钡,C为硝酸钡,D为硫酸钡,E为氯化钡.
(1)根据 A+B→C+H2O?可知,A和B为酸和碱,而C是一种盐;
(2)根据③E+AgNO3→AgCl+C可知,可判断物质E为氯化物、物质C为硝酸盐;
(3)由反应②C+H2SO4→D↓+A可知,D肯定为硫酸钡,那么C就是钡盐;因为C还是硝酸盐,所以C为硝酸钡;那么A为硝酸;
(4)A为硝酸,C为硝酸钡,再次根据A+B→C+H2O?可知,那么B氢氧化钡;
(5)C是硝酸钡,那么E为氯化物,再次根据 E+AgNO3→AgCl↓+C 可知,E肯定是氯化钡。
①物质E的化学式为:BaCl2;
②反应(1)为硝酸与氢氧化钡反应生成硝酸钡和水,反应的化学方程式为: 2 HNO3+ Ba(OH)2= Ba(NO3)2+2H2O 。
23.【答案】 (1)C
(2)SO2+2NaOH=Na2SO3+H2O
【解析】
(1) 反应③ 为氢氧化钠与盐的反应,碳酸钠不与氢氧化钠反应,A错误;盐酸为酸,B错误;氯化铁与氢氧化钠反应可生成氢氧化铁沉淀的氯化钠,C正确;硝酸钡不与氢氧化钠反应,D错误;
(2)二氧化硫与氢氧化钠反应生成亚硫酸钠和水,反应方程式为SO2+2NaOH=Na2SO3+H2O;
24.【答案】 Na2CO3、NaHCO3或NaHCO3、NaOH
【解析】(1)因为氢氧化钠溶液碱性大于碳酸钠大于碳酸氢钠,所以盐酸会先与氢氧化钠反应,在与碳酸钠反应,最后与碳酸氢钠反应。
(2)稀盐酸与碳酸钠的反应一定要分步考虑,先生成碳酸氢钠,在生成碳酸钠,否则无法与题目意图向一致。
由题目信息可得,而若反应物中只有Na2CO3 , 则c=2b,不符合要求;若反应物中只有 NaHCO3 , 则会一开始就产生气体,不符合要求;若反应物中只有 NaOH , 则始终不会有气体产生,不符合要求。
?若是Na2CO3、NaHCO3的混合物,则盐酸先与碳酸钠反应,生成碳酸氢钠,不会产生气体,盐酸与碳酸氢钠是1:1反应,此时消耗1份的碳酸钠;因为生成1份的碳酸氢钠,所以生成及原有的碳酸氢钠的量是超过1份的,而盐酸与碳酸氢钠是1:1反应,故这个过程中消耗的盐酸是大于一份的,故最终消耗的盐酸总量一定会大于2倍与碳酸钠反应的盐酸的质量,即 c>2b,符合要求。
若是NaHCO3、NaOH的混合物,则盐酸先与氢氧化钠反应,生成碳氯化钠,不会产生气体,盐酸与氢氧化钠是1:1反应,此时消耗1份的碳酸钠;接着盐酸与所碳酸氢钠反应,盐酸与碳酸氢钠是1:1反应,只要碳酸氢钠的量超过氢氧化钠的量,则消耗的最后消耗的盐酸总量一定会大于2倍与氢氧化钠反应的盐酸的质量,即 c>2b,符合要求。
若是Na2CO3、NaOH的混合物,则盐酸先与氢氧化钠反应,生成碳氯化钠,不会产生气体,盐酸与氢氧化钠是1:1反应,此时消耗1份的碳酸钠,接着盐酸与碳酸钠反应,先生成碳酸氢钠,不会产生气体,此时也消耗1份的碳酸钠,所以此时至b点消耗的盐酸是与氢氧化钠和碳酸钠第一步反应的总和;而之后盐酸与生成的的碳酸氢钠反应,而盐酸与碳酸氢钠是1:1反应,所以增加的稀盐酸的量肯定是小于没有产生气体所加的量的,即 c<2b,不符合要求。
25.【答案】 (1)CO2+2NaOH=Na2CO3+H2O
(2)有气泡产生
(3)碳酸钠和氯化钠
【解析】
(1) 氢氧化钠溶液变质是与二氧化碳反应生成碳酸钠,方程式为CO2+2NaOH=Na2CO3+H2O;
(2) 图中线段BC 为碳酸钠与盐酸的反应,现象为有气泡产生;
(3)B点为氢氧化钠刚好与盐酸完全反应,溶液中溶质为碳酸钠和氯化钠;
26.【答案】 (1)稀硫酸
(2)白色沉淀生成,溶液变为无色
【解析】根据图像可知,开始时一段时间内,氢氧化钡和稀硫酸反应,生成硫酸钡白色沉淀和水,因此溶质的质量会不断减小,即ob段。当氢氧化钡恰好完全反应时,溶液中的溶质质量为零,即b点。再加入稀盐酸,溶液中的溶质H2SO4的质量会不断增大,如bc段,据此分析解答。
(1)b点时氢氧化钡恰好完全反应,此时没有溶质。c点时加入的稀硫酸过量,那么溶质只能是H2SO4;
(2)ob段为氢氧化钡和稀硫酸的反应,现象为:白色沉淀生成,溶液变为无色。
27.【答案】 (1)CO2+2NaOH=Na2CO3+H2O
(2)A,D
【解析】(1)瓶内发生的反应为二氧化碳与氢氧化钠的反应,方程式为 CO2+2NaOH=Na2CO3+H2O ;
(2) 产生“喷泉” 是瓶内气体与氢氧化钠反应压强减少,二氧化硫和氯化氢也能氢氧化钠反应,也会产生相同的现象;
28.【答案】 (1)溶液变浑浊(或出现白色沉淀)
(2)不能,因为二氧化碳与水反应生成碳酸,也会出现上述现象
【解析】
(1)锥形瓶中能观察到的现象是溶液变浑浊(或出现白色沉淀) ;
(2)根据上述现象,不能得出“二氧化碳与氢氧化钠能反应”的结论,因为二氧化碳与水反应生成碳酸,也会出现上述现象。
三、解答题
29.【答案】 (1)生成沉淀:m(BaCO3)=95g+65g-140.3g=19.7g
(2)设参加反应的Na2CO3质量为x,
Na2CO3+BaCl2=
BaCO3↓+2 NaCl
106
197
x
19.7g
106x=19719.7g
解得:x=10.6g
NaOH%=15g-10.6g15g×100%=29.3%
【解析】1、未密封保存的NaOH固体会与空气中二氧化碳反应生成碳酸钠。碳酸钠与氯化钡反应能生成氯化钠和碳酸钡沉淀。经过滤后可将沉淀与滤液分离,根据表中数据可计算出沉淀的质量;
2、可根据生成的沉淀(碳酸钡)计算得到碳酸钠的质量。样品总质量减去碳酸钠的质量即是氢氧化钠的质量,由此可计算出原样品中NaOH的质量分数。
30.【答案】 (1)>
(2)氢氧化铜的质量为:5.64g-4.66g=0.98g;
设加入的CuSO4溶液中的溶质质量为x。
Ba(OH)?2+CuSO4=BaSO4↓+Cu(OH)2↓
???????????????????????160??????????????????????? 98
?????????????????????????x?????????????????????? 0.98g
16098=x0.98g;
解得:x=1.6g;
(3)设原Ba(OH)?2溶液溶质的质量分数为y。
根据钡元素守恒可得:
Ba(OH)?2∽∽∽∽BaSO4↓
?171??????????????? ??????? 233
25gy????????????? ?????? ?4.66g
171233=34.2gy4.66g;
解得:y=10%。
【解析】(1)根据图像的变化趋势,判断a点时氢氧化钡是否已经完全反应即可;
(2)根据图像可知,b段沉淀的质量不断减小,其实是前面生成的氢氧化铜与稀硫酸发生了反应生成了硫酸铜和水。根据前后的沉淀质量差计算出氢氧化铜的质量,然后根据氢氧化钡和硫酸铜反应的方程式计算出参加反应的硫酸铜溶质的质量;
(3)沉淀硫酸钡中的钡离子只来源于氢氧化钡,根据元素质量守恒,列出比例式计算出氢氧化钡溶液溶质的质量分数即可,
a点后加硫酸继续生成沉淀,说明此时依然是氢氧化钡仍在和硫酸反应,即氢氧化钡是过量的,因此所以对应溶液pH>7。
一、单选题
1.下列有关氢氧化钠的说法,错误的是(??? )
A.?氢氧化钠俗称烧碱???????????????????????????????????????B.?氢氧化钠有强烈的腐蚀性
C.?氢氧化钠水溶液能使紫色石蕊试液变红???????D.?氢氧化钠能去油污,厨房碱性清洁剂中含有氢氧化钠
2.下列物质不能与氢氧化钙溶液发生化学反应的是(??? )
A.?稀硫酸??????????????????????????B.?氧化铁??????????????????????????C.?紫色石蕊试液??????????????????????????D.?碳酸钠溶液
3.下列有关氢氧化钠的叙述,不正确的是(??? )
A.?氢氧化钠易吸收空气中的水蒸气,可作某些气体的干燥剂
B.?氢氧化钠的潮解属于化学变化
C.?氢氧化钠暴露在空气中质量增大且变质
D.?氢氧化钠可用于造纸、纺织、制肥皂等工业中
4.氢氧化钠是常见的化工原料,往氢氧化钠溶液中加入以下物质:①BaCl2②CuCl2③HCl④K2CO3 , 一定能发生化学反应的是(??? )
A.?①②?????????????????????????????????????B.?①④?????????????????????????????????????C.?②③?????????????????????????????????????D.?③④
5.氢氧化钠、氢氧化钙的溶液都具有相似化学性质,其原因是(? )
A.?都能解离出金属离子???????????????????????????????????????????B.?都能与酸反应生成盐和水
C.?都能使无色酚酞试液变成红色?????????????????????????????D.?溶液中都含有OH﹣
6.下列关于氢氧化钠的描述中错误的是(?? )
A.?对皮肤有强烈的腐蚀作用???????????????????????????????????B.?水溶液能使石蕊溶液变红
C.?易溶于水,溶于水时放出大量的热?????????????????????D.?能去除油污,可作炉具清洁剂
7.氢氧化钙俗称(?? )
A.?烧碱??????????????????????????????????B.?纯碱??????????????????????????????????C.?熟石灰??????????????????????????????????D.?石灰石
8.向某饱和氢氧化钙溶液中加入下列物质,pH的基本不变的是(?? )
A.?通入二氧化碳??????????B.?加入少量生石灰,保持温度不变??????????C.?加入盐酸??????????D.?加入硫酸铜溶液
9.氢氧化钠、氢氧化钙都是常见的碱,我们之所以认为它们是碱,是因为它们(??? )
A.?都能与酸反应?????????????????????????????????????????????????????B.?电离时生成的阴离子只有OH-
C.?遇紫色石蕊试液变蓝色???????????????????????????????????????D.?溶液的PH大于7
10.硝酸钾和氢氧化钙在工农业上有广泛应用,其溶解度如表所示,下列说法正确的是( ???)
温度(℃)
0
20
40
60
80
硝酸钾溶解度(克)
13.3
31.6
63.9
110
169
氢氧化钙溶解度(克)
0.173
0.165
0.121
0.116
0.094
A.?两种物质的溶解度都随温度升高而增大
B.?20℃时的氢氧化钙饱和溶液降温至10℃,溶质质量分数增大
C.?60℃时100g、110g、120g硝酸钾分别放入100克水中,溶质质量分数依次增大
D.?80℃时100g饱和硝酸钾溶液中,溶质和溶剂的质量比为169:100
11.下列选项没有体现酸的通性或者碱的通性的是(??? )
A.?实验室制取二氧化碳和氢气????????????????????????????????B.?利用稀硫酸除去硫酸钠中混有的少量碳酸钠
C.?可溶性铜盐或铁盐遇氢氧化钠产生有色沉淀????????D.?实验室利用硝酸钡鉴别稀硫酸和稀盐酸
12.下列四个实验中,不能体现碱的通性的是( ???)
A.?????????????????????????????????????????B.?
C.????????????????????????????????????????D.?
13.下列条件中的氢氧化钙溶液,质量分数最大的是(?? )
A.?30℃的不饱和溶液??????????B.?30℃的饱和溶液??????????C.?90℃的不饱和溶液??????????D.?90℃的饱和溶液
14.氢氧化钠、氢氧化钙都具有碱的通性,是因为(?? )
A.?组成中都含有氢、氧两种元素?????????????????????????????B.?电离时生成的阳离子全部是金属离子
C.?水溶液都具有腐蚀性???????????????????????????????????????????D.?电离时生成的阴离子全部是氢氧根离子
15.下列关于酸、碱的说法错误的是( ???)
A.?苛性钠、烧碱、火碱都是氢氧化钠??????????????????????B.?氢氧化钙可以用来改良酸性土壤
C.?稀盐酸能够使酚酞溶液变红????????????????????????????????D.?生活中许多常见的物质(如柠檬、柑橘)中含有酸
16.下列关于酸和碱反应的说法中,错误的是(?? )
A.?酸碱的反应要放出热量
B.?酸碱的反应一定有盐生成
C.?酸碱的反应一定有水生成
D.?酸碱恰好完全反应后溶液的pH=0
17.酸与碱作用生成盐和水的反应,叫做中和反应。它在工农业生产和日常生活中有广泛的用途。下列应用一定与中和反应原理无关的是(? )
A.?施用熟石灰改良酸性土壤????????????????????????????????????B.?服用含Al(OH)3的药物治疗胃酸过多
C.?用熟石灰和硫酸铜配制波尔多液?????????????????????????D.?用NaOH溶液洗涤石油产品中的残余硫酸
18.小科在研究碱的化学性质时,设计了如图所示的五组实验,下列叙述正确的是(?? )
A.?丙组和戊组实验能观察到相同现象
B.?甲组实验能观察到无色变成红色,可推出氢氧化铜也能使指示剂变色
C.?乙组实验无明显现象,说明两者不能发生反应
D.?丁组实验产生蓝色絮状沉淀,说明碱都能和含铜离子的溶液发生反应
19.下列物质的名称、俗名、化学式及其类别中,完全对应的是(??? )
物质的名称
俗名
化学式
类别
A.
碳酸钠
烧碱
Na2CO3
盐
B.
碳酸氢钠
小苏打
NaHCO3
酸
C.
氢氧化钙
熟石灰
CaO
金属氧化物
D.
氢氧化钠
苛性碱
NaOH
碱
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
20.某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是( ?)
A.?反应至A点时,所加NaOH溶液的质量为40g
B.?反应至A点时,溶液中的溶质有CuCl2和NaCl
C.?反应至B点时,锥形瓶内溶液的质量为280.4g
D.?反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g
二、填空题
21.氢氧化钠是重要的化工原料,在生活、生产中应用广泛。
(1)氢氧化钠具有强烈的________性,实验时最好戴防护眼镜。
(2)氢氧化钠若没有密封保存易变质,要检验氢氧化钠溶液是否变质,下列试剂无法达到目的的是 ????????。(填选项)
A.稀HCl
B.酚酞试液
C.CaCl2溶液
D.Ca(OH)2溶液
22.有属于酸、碱、盐的5种常见物质A、B、C、D、E,它们之间可以发生如下反应:
⑴A+B→C+H2O??? ⑵C+H2SO4→D↓+A???? ⑶E+AgNO3→AgCl↓+C
根据上述反应,①推断下列物质的化学式: E________;
②写出 (1)化学方程式 ________。
23.某化学活动小组以“酸碱盐的性质”为主题进行探究性学习,用图1总结了NaOH的四条化学性质。
(1)为了验证反应③能够发生,你选择的物质是(??? )
A.Na2CO3
B.HCl
C.FeCl3
D.Ba(NO3)2
(2)依据反应④,NaOH溶液可以吸收工业尾气中的SO2气体,其化学方程式为: ________。
24.某物质可能由Na2CO3、NaHCO3、NaOH中的一种或二种混合而成,在固体中逐滴滴入盐酸,与盐酸反应图象如图,且c>2b。
已知:Na2CO3+HCl=NaHCO3+NaCl;
NaHCO3+HCl=NaCl+H2O+CO2↑
NaHCO3+NaOH=Na2CO3+H2O
则该固体的组成可能是________
25.敞口放置的氢氧化钠溶液易吸收空气中的二氧化碳而变质。现向一定质量且部分变质的氢氧化钠溶液中逐滴加入稀盐酸,并振荡。如图表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况。
(1)写出氢氧化钠溶液变质的化学方程式________.
(2)图中线段BC对应的实验现象是________.
(3)图中B点时溶液中的溶质是________.
26.室温时,向滴加了无色酚酞的Ba(OH)2溶液的烧杯中逐滴加入稀硫酸,烧杯内溶液中溶质质量变化如图所示:
(1)c点溶液中的溶质为________。
(2)ob段实验的现象是________。
27.如图装置可以制造非常有趣的“化学喷泉”,将胶头滴管中的NaOH溶液挤入烧瓶内,在导管的尖嘴处就会形成美丽的“喷泉”。
(1)该现象的出现,原因是瓶内发生化学反应而使瓶内气压减小,请写出反应的化学方程式:________?。
(2)若将烧瓶中的CO2换成下面的四种气体,仍可产生“喷泉”现象的瓶是??????? 。
A.SO2???
B.H2
C.O2
D.HCl
28.化学活动小组的同学用右图所示装置进行实验(装置的气密性良好):先关闭止水夹,将足量氢氧化钠溶液滴入锥形瓶中,充分反应后,再打开止水夹.
(1)锥形瓶中能观察到的现象是________?;
(2)根据上述现象,能否得出“二氧化碳与氢氧化钠能反应”的结论?为什么?答:________
三、解答题
29.为了测定一瓶未密封保存的NaOH固体中NaOH的质量分数,小金采用沉淀法进行如下操作:
①取15克样品于烧杯中,加足量水配成溶液;②在样品溶液中加入足量的BaCl2溶液;③待反应完全后,过滤。有关数据记录如表:
反应前
反应后
烧杯和样品溶液总质量/g
加入的氯化钡溶液质量/g
过滤后烧杯和溶液总质量/g(滤液的损失忽略不计)
95
65
140.3
请回答下列问题:
(1)反应共生成沉淀多少克?
(2)原样品中NaOH的质量分数是多少?
30.向34.2g的Ba(OH)2溶液中先后滴加质量分数为8%的CuSO4和质量分数为9.8%的H2SO4溶液,滴加过程中加入溶液的质量与产生沉淀的质量关系如图所示。
(1)a点对应溶液pH________7(选填“>”“=”或“<”)。
(2)通过计算确定加入的CuSO4溶液中的溶质质量为多少?
(3)原Ba(OH)2溶液溶质的质量分数为多少?
答案解析部分
一、单选题
1.【答案】 C
【解析】根据氢氧化钠俗称、性质及用途分析。
A、 氢氧化钠俗称烧碱、火碱、苛性钠,不符合题意;
B、 氢氧化钠有强烈的腐蚀性,不符合题意;
C、 氢氧化钠水溶液呈碱性,能使紫色石蕊试液变蓝 ,符合题意;
D、 氢氧化钠能去油污,厨房碱性清洁剂中含有氢氧化钠 ,不符合题意;
2.【答案】 B
【解析】根据碱的化学性质分析,碱能与酸、指示剂、碳酸盐溶液或一些非金属氧化物反应,但不能与金属氧化物反应。 稀硫酸、紫色石蕊试液和碳酸钠溶液都能与氢氧化钙溶液发生反应,而氧化铁不能与碱发生化学变化;
3.【答案】 B
【解析】根据氢氧化钠的潮解性、与二氧化碳反应的性质及氢氧化钠的用途分析。
A、 氢氧化钠易潮解,能吸收空气中的水蒸气,可作某些气体的干燥剂 ,不符合题意;
B、 氢氧化钠的潮解属于物理变化 ,符合题意;
C、 氢氧化钠暴露在空气中会吸收水分和二氧化碳,质量增大且变质 ,不符合题意;
D、 氢氧化钠可用于造纸、纺织、制肥皂等工业中 ,不符合题意;
4.【答案】 C
【解析】根据碱的化学性质分析,酸碱盐间的反应都属于复分解反应,判断复分解反应要看生成物中是否有气体、沉淀或水。
①BaCl2不能与氢氧化钠反应,②CuCl2能与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,③HCl能与氢氧化钠反应生成氯化钠和水,④K2CO3 不能与氢氧化钠反应;
5.【答案】 D
【解析】碱溶液中都存在大量的OH-离子,因此它们都呈现相似的化学性质。
氢氧化钠、氢氧化钙的溶液都具有相似化学性质,其原因是溶液中都含有OH﹣ , 故D正确,而A、B、C错误。
6.【答案】 B
【解析】根据氢氧化钠的腐蚀性、碱性、溶解放热、能与油污反应等性质进行分析。氢氧化钠溶液呈碱性,石蕊遇碱性溶液呈蓝色,B描述错误;
7.【答案】C
【解析】根据氢氧化钙的俗称进行分析。氢氧化钙俗称消石灰、熟石灰;
8.【答案】 B
【解析】氢氧化钙的饱和溶液显碱性,pH大于7;加入物质后溶液的pH基本不变,则混合反应后仍有碱性物质存在,据此结合碱的化学性质进行分析判断.
A、二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,溶液的碱性减弱,pH变小,故选项错误.
B、加入生石灰,则氧化钙与水反应生成氢氧化钙,溶液仍为饱和溶液,pH基本不变,故选项正确.
C、盐酸与氢氧化钙反应生成氯化钙和水,溶液的碱性减弱,pH变小,故选项错误.
D、硫酸铜溶液与氢氧化钙反应生成氢氧化铜沉淀和硫酸钙,碱性减弱,pH变小,故选项错误.
9.【答案】 B
【解析】氢氧化钙是一种白色粉末状固体,化学式Ca(OH)2 , 俗称熟石灰、消石灰,水溶液称作澄清石灰水。氢氧化钙具有碱的通性,是一种强碱。 因为物质电离时生成的阴离子全部是OH-的化合物叫做碱,氢氧化钠和氢氧化钙就是如此。
10.【答案】 D
【解析】
A、氢氧化钙的溶解度随温度升高而减小,不符合题意;
B、 20℃时的氢氧化钙饱和溶液降温至10℃,变成不饱和溶液,溶质质量分数不变,不符合题意;
C、 60℃时硝酸钾的溶解度为110克,将100g、110g、120g硝酸钾分别放入100克水中,后两者都形成饱和溶液,溶质质量分数相等,不符合题意;
D、 80℃时硝酸钾溶解度为169克,则该温度下100g饱和硝酸钾溶液中, 溶质和溶剂的质量比为169:100 ,符合题意;
11.【答案】 D
【解析】根据酸和碱的通性分析判断。
A.实验室制取二氧化碳,通常使用碳酸钙和稀盐酸反应,体现酸的通性:盐+酸=盐+酸;制取氢气,通常使用活泼金属和酸反应,体现酸的通性:活泼金属+酸=盐+氢气,故A不合题意;
B.利用稀硫酸除去硫酸钠中混有的少量碳酸钠,体现酸的通性:酸+盐=酸+盐,故B不合题意;?
C.可溶性铜盐或铁盐遇氢氧化钠产生有色沉淀,体现碱的通性:可溶性盐+碱=盐+碱,故C不合题意;?
D.实验室利用硝酸钡鉴别稀硫酸和稀盐酸,稀硫酸能够和硝酸钡反应,而稀盐酸不能和硝酸钡反应,不能体现盐的通性,故D符合题意。
12.【答案】 A
【解析】碱的通性包括:
①碱使指示剂变色;?
②碱 + 酸 = 盐 + 水 ?
③碱 + 某些非金属氧化物= 盐 + 水?
④碱 + 某些盐 = 新碱 + 新盐?
A.氢氧化钙和碳酸钠反应生成白色沉淀碳酸钙,就钙离子和碳酸根离子的结合,碱的共性是氢氧根离子显示的性质,故A错误,符合题意;
B.2NaOH+CuSO4=Na2SO4+Cu(OH)2↓,体现碱的通性:碱 + 某些盐 = 新碱 + 新盐 ,故B不合题意;
C.石灰水(Ca(OH)2)能使无色的酚酞试液变红色,体现碱的通性:碱使指示剂变色,故C不合题意;
D.NaOH+CO2=Na2CO3+H2O,体现碱的通性:碱 + 某些非金属氧化物= 盐 + 水,故D不合题意。
13.【答案】 B
【解析】根据同一温度下饱和溶液溶质质量分数比不饱和溶液溶质质量分数大,低温下氢氧化钙的饱和溶液比高温的饱和溶液溶质质量分数大分析。同一温度下,氢氧化钙饱和溶液比不饱和溶液溶质质量分数大,氢氧化钙的溶解度随温度升高而减小,所以低温下饱和溶液比高温的饱和溶液溶质质量分数大,所以质量分数最大的为 30℃的饱和溶液;
14.【答案】 D
【解析】根据碱的溶液中都含有相同的氢氧根离子分析。
A、 氢氧化钠、氢氧化钙都含有氢氧根离子,所以有碱的通性,不符合题意;
B、氢氧化钠、氢氧化钙都含有氢氧根离子,所以有碱的通性,不符合题意;
C、氢氧化钠、氢氧化钙都含有氢氧根离子,所以有碱的通性,不符合题意;
D、氢氧化钠、氢氧化钙都含有氢氧根离子,所以有碱的通性,符合题意;
15.【答案】 C
【解析】
A.苛性钠、烧碱、火碱都是氢氧化钠 ,故A正确不合题意;
B.氢氧化钙可以用来改良酸性土壤,故B正确不合题意;?
C.稀盐酸不能使酚酞溶液变色,故C错误符合题意;
D.生活中许多常见的物质(如柠檬、柑橘)中含有酸,故D正确不合题意。
16.【答案】D
【解析】根据酸和碱恰好完全反应后溶液呈中性溶液p H=7分析。
酸碱恰好完全反应后溶液呈中性,pH=7;
17.【答案】 C
【解析】酸碱中和反应的关键是:反应物必须是酸和碱,生成物是盐和水,据此判断即可。
A.熟石灰是氢氧化钙,此为碱,酸性土壤有酸性物质,与中和反应有关,故A不合题意;
B. Al(OH)3 为碱,而胃酸为HCl,与中和反应有关,故B不合题意;
C.熟石灰为碱,而硫酸铜为盐,不符合中和反应的条件,故C符合题意;
D. NaOH 为碱,而残余硫酸为酸,与中和反应有关,故D不合题意。
18.【答案】 A
【解析】根据碱的化学性质进行分析判断即可。
A.丙组二氧化碳和氢氧化钙反应能生成碳酸钙沉淀和水,能够观察到产生白色沉淀,戊组碳酸钠和氢氧化钙反应能生成碳酸钙沉淀和氢氧化钠,也能够观察到产生白色沉淀,故A正确;
B.氢氧化钙溶液显碱性,能使无色酚酞变成红色;但是氢氧化铜不溶于水,不能使指示剂变色,故B错误;
C.稀盐酸与氢氧化钠反应能生氯化钠和水,无明显现象,故C错误;
D.丁组实验产生蓝色絮状沉淀,但是碱溶液才能和含铜离子的溶液发生反应,而不是碱,故D错误。
19.【答案】 D
【解析】本题探究物质的名称基础常识。
碳酸钠(Na2CO3)又叫纯碱,但分类属于盐,不属于碱,A不符合题意。
??B、碳酸氢钠,俗称小苏打,化学式NaHCO3 , 碳酸氢钠是强碱与弱酸中和后生成的酸式盐,溶于水时呈现弱碱性,B不符合题意。
??C、氢氧化钙, 化学式Ca(OH)?,俗称熟石灰、消石灰,水溶液称作澄清石灰水。氢氧化钙具有碱的通性,是一种强碱,C不符合题意。
? D、氢氧化钠,俗名苛性碱,化学式NaOH,碱,D符合题意。
20.【答案】 D
【解析】根据向盐酸和氯化铜溶液中加氢氧化钠溶液,氢氧化钠先与盐酸反应,然后再与氯化铜反应及参加反应的氢氧化钠溶液质量代入方程式计算生成氢氧化铜质量、生成氯化钠中钠元素质量与氢氧化钠中钠元素质量相等分析。
A、向盐酸和氯化铜溶液中加氢氧化钠溶液,氢氧化钠先与盐酸反应,然后再与氯化铜反应,由图像可知,A点为氢氧化钠溶液与盐酸的反应,反应后溶液质量为140克,则所加氢氧化钠溶液质量为40克,不符合题意;
B、反应至A点时,溶液中盐酸完全反应,溶质为氯化铜和氯化钠,不符合题意;
C、反应至B点时,氯化铜完全反应,所加氢氧化钠溶液质量为200g-40g=160g,则氢氧化钠质量为160g ×10% =16g,设产生氢氧化铜质量为x
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
80???????????????????????????????????????????? 98
16g??????????????????????????????????????????? x
80:98=16g:x
x=19.6g,则锥形瓶中溶液质量为100g+200g-19.6g=280.4g,不符合题意;
D、 反应至B点时,锥形瓶内溶液中NaCl的质量为200g 反应至B点时,根据生成氯化钠中钠元素质量与氢氧化钠中钠元素质量相等,可知锥形瓶内溶液中NaCl的质量为200g ×10%×2340÷2358.5=29.25g ,符合题意;
二、填空题
21.【答案】 (1)腐蚀性
(2)B
【解析】(1)氢氧化钠具有强烈的腐蚀性;
(2)氢氧化钠变质是吸收二氧化碳生成碳酸钠和水,加稀盐酸、氯化钙溶液、氢氧化钙溶液都能与碳酸钠反应有明显现象,而碳酸钠和氢氧化钠溶液都呈碱性,都能使酚酞变红,所以酚酞溶液无法鉴别氢氧化钠变质;
22.【答案】 BaCl2;2 HNO3+ Ba(OH)2= Ba(NO3)2+2H2O
【解析】根据推断可得A为硝酸,B为氢氧化钡,C为硝酸钡,D为硫酸钡,E为氯化钡.
(1)根据 A+B→C+H2O?可知,A和B为酸和碱,而C是一种盐;
(2)根据③E+AgNO3→AgCl+C可知,可判断物质E为氯化物、物质C为硝酸盐;
(3)由反应②C+H2SO4→D↓+A可知,D肯定为硫酸钡,那么C就是钡盐;因为C还是硝酸盐,所以C为硝酸钡;那么A为硝酸;
(4)A为硝酸,C为硝酸钡,再次根据A+B→C+H2O?可知,那么B氢氧化钡;
(5)C是硝酸钡,那么E为氯化物,再次根据 E+AgNO3→AgCl↓+C 可知,E肯定是氯化钡。
①物质E的化学式为:BaCl2;
②反应(1)为硝酸与氢氧化钡反应生成硝酸钡和水,反应的化学方程式为: 2 HNO3+ Ba(OH)2= Ba(NO3)2+2H2O 。
23.【答案】 (1)C
(2)SO2+2NaOH=Na2SO3+H2O
【解析】
(1) 反应③ 为氢氧化钠与盐的反应,碳酸钠不与氢氧化钠反应,A错误;盐酸为酸,B错误;氯化铁与氢氧化钠反应可生成氢氧化铁沉淀的氯化钠,C正确;硝酸钡不与氢氧化钠反应,D错误;
(2)二氧化硫与氢氧化钠反应生成亚硫酸钠和水,反应方程式为SO2+2NaOH=Na2SO3+H2O;
24.【答案】 Na2CO3、NaHCO3或NaHCO3、NaOH
【解析】(1)因为氢氧化钠溶液碱性大于碳酸钠大于碳酸氢钠,所以盐酸会先与氢氧化钠反应,在与碳酸钠反应,最后与碳酸氢钠反应。
(2)稀盐酸与碳酸钠的反应一定要分步考虑,先生成碳酸氢钠,在生成碳酸钠,否则无法与题目意图向一致。
由题目信息可得,而若反应物中只有Na2CO3 , 则c=2b,不符合要求;若反应物中只有 NaHCO3 , 则会一开始就产生气体,不符合要求;若反应物中只有 NaOH , 则始终不会有气体产生,不符合要求。
?若是Na2CO3、NaHCO3的混合物,则盐酸先与碳酸钠反应,生成碳酸氢钠,不会产生气体,盐酸与碳酸氢钠是1:1反应,此时消耗1份的碳酸钠;因为生成1份的碳酸氢钠,所以生成及原有的碳酸氢钠的量是超过1份的,而盐酸与碳酸氢钠是1:1反应,故这个过程中消耗的盐酸是大于一份的,故最终消耗的盐酸总量一定会大于2倍与碳酸钠反应的盐酸的质量,即 c>2b,符合要求。
若是NaHCO3、NaOH的混合物,则盐酸先与氢氧化钠反应,生成碳氯化钠,不会产生气体,盐酸与氢氧化钠是1:1反应,此时消耗1份的碳酸钠;接着盐酸与所碳酸氢钠反应,盐酸与碳酸氢钠是1:1反应,只要碳酸氢钠的量超过氢氧化钠的量,则消耗的最后消耗的盐酸总量一定会大于2倍与氢氧化钠反应的盐酸的质量,即 c>2b,符合要求。
若是Na2CO3、NaOH的混合物,则盐酸先与氢氧化钠反应,生成碳氯化钠,不会产生气体,盐酸与氢氧化钠是1:1反应,此时消耗1份的碳酸钠,接着盐酸与碳酸钠反应,先生成碳酸氢钠,不会产生气体,此时也消耗1份的碳酸钠,所以此时至b点消耗的盐酸是与氢氧化钠和碳酸钠第一步反应的总和;而之后盐酸与生成的的碳酸氢钠反应,而盐酸与碳酸氢钠是1:1反应,所以增加的稀盐酸的量肯定是小于没有产生气体所加的量的,即 c<2b,不符合要求。
25.【答案】 (1)CO2+2NaOH=Na2CO3+H2O
(2)有气泡产生
(3)碳酸钠和氯化钠
【解析】
(1) 氢氧化钠溶液变质是与二氧化碳反应生成碳酸钠,方程式为CO2+2NaOH=Na2CO3+H2O;
(2) 图中线段BC 为碳酸钠与盐酸的反应,现象为有气泡产生;
(3)B点为氢氧化钠刚好与盐酸完全反应,溶液中溶质为碳酸钠和氯化钠;
26.【答案】 (1)稀硫酸
(2)白色沉淀生成,溶液变为无色
【解析】根据图像可知,开始时一段时间内,氢氧化钡和稀硫酸反应,生成硫酸钡白色沉淀和水,因此溶质的质量会不断减小,即ob段。当氢氧化钡恰好完全反应时,溶液中的溶质质量为零,即b点。再加入稀盐酸,溶液中的溶质H2SO4的质量会不断增大,如bc段,据此分析解答。
(1)b点时氢氧化钡恰好完全反应,此时没有溶质。c点时加入的稀硫酸过量,那么溶质只能是H2SO4;
(2)ob段为氢氧化钡和稀硫酸的反应,现象为:白色沉淀生成,溶液变为无色。
27.【答案】 (1)CO2+2NaOH=Na2CO3+H2O
(2)A,D
【解析】(1)瓶内发生的反应为二氧化碳与氢氧化钠的反应,方程式为 CO2+2NaOH=Na2CO3+H2O ;
(2) 产生“喷泉” 是瓶内气体与氢氧化钠反应压强减少,二氧化硫和氯化氢也能氢氧化钠反应,也会产生相同的现象;
28.【答案】 (1)溶液变浑浊(或出现白色沉淀)
(2)不能,因为二氧化碳与水反应生成碳酸,也会出现上述现象
【解析】
(1)锥形瓶中能观察到的现象是溶液变浑浊(或出现白色沉淀) ;
(2)根据上述现象,不能得出“二氧化碳与氢氧化钠能反应”的结论,因为二氧化碳与水反应生成碳酸,也会出现上述现象。
三、解答题
29.【答案】 (1)生成沉淀:m(BaCO3)=95g+65g-140.3g=19.7g
(2)设参加反应的Na2CO3质量为x,
Na2CO3+BaCl2=
BaCO3↓+2 NaCl
106
197
x
19.7g
106x=19719.7g
解得:x=10.6g
NaOH%=15g-10.6g15g×100%=29.3%
【解析】1、未密封保存的NaOH固体会与空气中二氧化碳反应生成碳酸钠。碳酸钠与氯化钡反应能生成氯化钠和碳酸钡沉淀。经过滤后可将沉淀与滤液分离,根据表中数据可计算出沉淀的质量;
2、可根据生成的沉淀(碳酸钡)计算得到碳酸钠的质量。样品总质量减去碳酸钠的质量即是氢氧化钠的质量,由此可计算出原样品中NaOH的质量分数。
30.【答案】 (1)>
(2)氢氧化铜的质量为:5.64g-4.66g=0.98g;
设加入的CuSO4溶液中的溶质质量为x。
Ba(OH)?2+CuSO4=BaSO4↓+Cu(OH)2↓
???????????????????????160??????????????????????? 98
?????????????????????????x?????????????????????? 0.98g
16098=x0.98g;
解得:x=1.6g;
(3)设原Ba(OH)?2溶液溶质的质量分数为y。
根据钡元素守恒可得:
Ba(OH)?2∽∽∽∽BaSO4↓
?171??????????????? ??????? 233
25gy????????????? ?????? ?4.66g
171233=34.2gy4.66g;
解得:y=10%。
【解析】(1)根据图像的变化趋势,判断a点时氢氧化钡是否已经完全反应即可;
(2)根据图像可知,b段沉淀的质量不断减小,其实是前面生成的氢氧化铜与稀硫酸发生了反应生成了硫酸铜和水。根据前后的沉淀质量差计算出氢氧化铜的质量,然后根据氢氧化钡和硫酸铜反应的方程式计算出参加反应的硫酸铜溶质的质量;
(3)沉淀硫酸钡中的钡离子只来源于氢氧化钡,根据元素质量守恒,列出比例式计算出氢氧化钡溶液溶质的质量分数即可,
a点后加硫酸继续生成沉淀,说明此时依然是氢氧化钡仍在和硫酸反应,即氢氧化钡是过量的,因此所以对应溶液pH>7。
