人教版化学必修一第四章《非金属及其化合物》测试题(含答案)
文档属性
| 名称 | 人教版化学必修一第四章《非金属及其化合物》测试题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 383.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-12 15:54:28 | ||
图片预览



文档简介
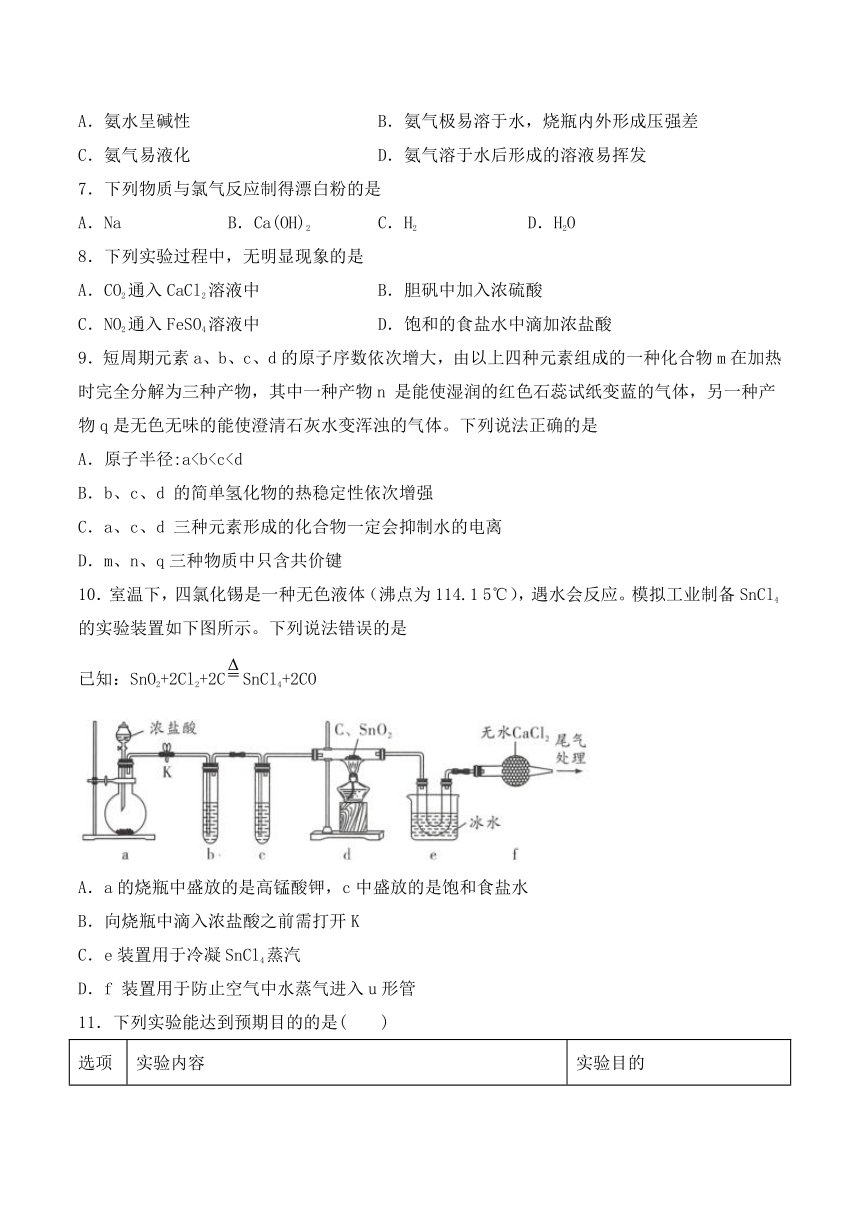
《非金属及其化合物》测试题
一、单选题
1.在一定温度下,某浓度的硝酸与金属锌反应生成NO2和NO,两者的物质的量之比为1∶3,则要使1
mol金属锌完全反应,反应过程中消耗HNO3的物质的量为( )
A.2.4
mol
B.2.6
mol
C.2.8
mol
D.3.2
mol
2.下列有关物质用途的说法中,错误的是(
)
A.用于自来水消毒
B.用作红色油漆和涂料
C.用于漂白纸浆
D.用于呼吸面具作供氧剂
3.下列装置进行相应的实验,能达到实验目的的是
A
B
C
D
吸收少量NO2
分离硝基苯和苯
除去碳酸钠中的碳酸氢钠
制备少量纯净的SO2
A.A
B.B
C.C
D.D
4.下列俗名和化学式配对错误的是
(
)
A.重晶石BaSO4
B.熟石膏CaSO42H2O
C.胆矾CuSO4
5H2O
D.漂粉精的有效成份Ca(ClO)2
5.氯气的水溶液称“氯水”,氯水中含有多种分子和离子,因此氯水有多重性质,下列有关新制氯水的说法中不正确的是
A.新制氯水呈黄绿色,且有刺激性气味,说明氯水中含有Cl2
B.新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,可说明氯水中含有Cl2
C.向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明Cl2的氧化性强于I2
D.新制氯水滴到Na2CO3溶液中,有气体产生,说明氯水中含有H+
6.关于氨的喷泉实验形成的原理解释正确的是
A.氨水呈碱性
B.氨气极易溶于水,烧瓶内外形成压强差
C.氨气易液化
D.氨气溶于水后形成的溶液易挥发
7.下列物质与氯气反应制得漂白粉的是
A.Na
B.Ca(OH)2
C.H2
D.H2O
8.下列实验过程中,无明显现象的是
A.CO2通入CaCl2溶液中
B.胆矾中加入浓硫酸
C.NO2通入FeSO4溶液中
D.饱和的食盐水中滴加浓盐酸
9.短周期元素a、b、c、d的原子序数依次增大,由以上四种元素组成的一种化合物m在加热时完全分解为三种产物,其中一种产物n
是能使湿润的红色石蕊试纸变蓝的气体,另一种产物q是无色无味的能使澄清石灰水变浑浊的气体。下列说法正确的是
A.原子半径:aB.b、c、d
的简单氢化物的热稳定性依次增强
C.a、c、d
三种元素形成的化合物一定会抑制水的电离
D.m、n、q三种物质中只含共价键
10.室温下,四氯化锡是一种无色液体(沸点为114.1
5℃),遇水会反应。模拟工业制备SnCl4的实验装置如下图所示。下列说法错误的是
已知:SnO2+2Cl2+2CSnCl4+2CO
A.a的烧瓶中盛放的是高锰酸钾,c中盛放的是饱和食盐水
B.向烧瓶中滴入浓盐酸之前需打开K
C.e装置用于冷凝SnCl4蒸汽
D.f
装置用于防止空气中水蒸气进入u形管
11.下列实验能达到预期目的的是( )
选项
实验内容
实验目的
A
向1
mL
0.1
mol/L
NaOH溶液中加入2
mL
0.1
mol/L
CuSO4溶液,振荡后滴加0.5
mL葡萄糖溶液,加热观察是否出现红色沉淀
证明葡萄糖中含有醛基
B
向1
mL
0.2
mol/L
NaOH溶液中滴入2滴0.1
mol/L
MgCl2溶液,产生白色沉淀后,再滴加2滴0.1
mol/L
FeCl3溶液,又生成红褐色沉淀
证明在相同温度下,Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
C
测定同温度下相同浓度的碳酸钠和硫酸钠溶液的pH,前者大于后者
证明碳元素非金属性弱于硫
D
向某溶液中滴加少量稀NaOH溶液,将湿润的红色石蕊试纸置于试管口试纸不变蓝
证明溶液中无NH4+
A.A
B.B
C.C
D.D
12.化学与生活密切相关。下列情况会对人体健康造成较大危害的是
A.FeSO4作补血剂时可与维生素C同时服用增强药效
B.用SO2漂白食品
C.用食醋清洗热水瓶胆内壁附着的水垢
D.用小苏打(NaHCO3)发酵面团制作馒头
13.下列说法中,正确的是( )
A.SO2能使FeCl3、酸性KMnO4溶液变色或褪色
B.可以用澄清石灰水来鉴别SO2与CO2
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.少量SO2通入浓的CaCl2溶液中可以生成白色沉淀
二、填空题
14.用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用.例如:计算机芯片的主要成分是________;光导纤维的主要成分是________;
人们使用量最大的传统硅酸盐产品有水泥、玻璃和________
15.(1)据中新社2017年6月29日电,也门遭世界最严重霍乱疫情
1400人死亡疑20余万人感染。霍乱是由霍乱弧菌引起的急性肠道传染病,患者常出现呕吐、腹泻、脱水和高烧等症状,重症和延误治疗可致死亡。据联合国儿童基金会专家表示,正常情况下,霍乱可以预防并且治愈率很高,但由于也门基础设施被完全损坏,将很难控制疾病传播。
请根据此信息和题意回答下列问题(填字母,下同)。
a.蛋白质
b.氨基酸
c.葡萄糖
d.变性
e.盐析
①霍乱弧菌中的主要成分中含有____________;该成分经水解后变为__________;
②为了预防霍乱,该疫情地区普遍采用喷洒消毒水进行消毒,对所接触到的器具均采用高温灭菌处理,这是因为在高温条件下病毒和细菌都发生了__________。
(2)化学与材料密切相关,材料是人类生存和发展的物质基础。
①在快中子反应堆中得以广泛应用的钠钾合金在常温下呈液态,这个事实说明合金的熔点比其成分金属的熔点_______(填“高”或者“低”)。
②有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料而是一种线型高分子化合物,它具有_____________性(选填“热塑”或“热固”)。
③据报道,每年我国因金属腐蚀造成的损失占国民生产总值(GDP)的4%。钢铁在潮湿的空气中发生________腐蚀时,负极的电极反应为
______________。
(3)化学与环境紧密联系。
①空气质量报告的各项指标可以反映出各地空气的质量。下列物质不属于空气污染物的是______(填字母)
a.SO2
b.NO2
c.PM2.5
d.CO2
②
天然水中杂质较多,常需加入明矾,ClO2等物质处理后才能饮用。加入ClO2的作用是__________________;加入明矾后,
Al3+水解的离子方程式是
________________。
③为减少SO2的排放量,可向煤中加入适量
__________(填名称);也可以将煤气化,即在高温条件下与水蒸气反应转化为水煤气,该反应方程式为___________________。
三、实验题
16.氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。回答下列问题:
(1)氨气的制备
①氨气制取的发生装置可以选择上图中的_________(填字母),反应的化学方程式为_____________________________________________。
②选择上图装置组装一套实验装置来收集一瓶干燥的氨气,所选装置的连接顺序为:发生装置→______→______→______→_____→i(按气流方向,用小写英文字母表示)。
③可用如图装置进行氨的喷泉实验,引发喷泉的操作是_______________________________。
(2)如图所示,NH3经一系列反应可以得到HNO3。
①反应①的化学方程式为________________________________________。
②产物NO是大气污染物之一。在400℃左右且有催化剂存在的情况下,可用氨将一氧化氮还原为无色无毒气体。该反应的化学方程式为_______________________。
(3)在某100mL硝酸与硫酸的混合液中,HNO3和H2SO4的物质的量浓度分别为0.6
mol·L-1和0.3mol·L-1。向该混合液中加入3.84g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度为____________。
17.某化学兴趣小组为探究铜和浓硫酸的反应,用下图装置进行有关实验。请回答:实验中甲同学将a
g铜片和12
mL
18mol/L的浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的硫酸和铜片剩余。
(1)请写出铜片和浓硫酸反应的化学方程式__________;
(2)装置E中D内盛品红溶液,当C中气体集满后,D中有可能观察到的现象是__________;
(3)实验装置D中有可能造成环境污染,试用最简单的方法解决(实验用品自选)__________;
(4)装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是__________,B中应放置的液体为:__________(填字母)。
A.饱和
Na2SO3溶液
B.酸性KMnO4溶液
C.浓溴水
D.饱和NaHSO3
(5)问题讨论:为什么有一定量的余酸但未能使铜完全溶解,你认为原因是__________。足量下列药品能够用来证明反应结束后的烧瓶中却有余酸的是__________。
A.Fe粉
B.BaCl2溶液
C.Ag
D.
Na2CO3溶液
18.硫酰氯(SO2Cl2)熔点-54.1℃、沸点69.2℃,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中S的化合价为_______,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为________________。
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(夹持装置未画出)。
①仪器A的名称为___________,装置乙中装入的试剂_____________,装置B的作用是_______________________。
②装置丙分液漏斗中盛装的最佳试剂是________(选填字母)。
A.蒸馏水??
B.10.0
mol/L浓盐酸??
C.浓氢氧化钠溶液??
D.饱和食盐水?
(3)探究硫酰氯在催化剂作用下加热分解的产物,实验装置如图所示(部分夹持装置未画出)。
①加热时A中试管出现黄绿色,装置B的作用是
____________。
②装置C中的现象是___________,反应的离子方程式为___________________。
四、元素或物质推断题
19.现有X、Y、Z三种元素。
①X的单质可以在Z的单质中燃烧,生成XZ,燃烧时火焰为苍白色。
②X的单质可与Y的单质化合,生成X2Y。X2Y在常温下为液体。
③Z的单质溶于X2Y中,所得溶液具有漂白性。
请填写下列空白。
(1)X、Y、Z的元素符号分别为_______、_______、________
(2)将XZ的水溶液滴入Na2CO3溶液中,有气泡产生,反应的离子方程式为_______。
(3)Z的单质溶于X2Y中,反应的化学方程式为________。
20.现有A、B、C、D、E五种物质,它们均含同一种元素,有以下转化关系:已知A、B、C、X在常温下为气体,Z为液体,Y为紫红色金属,A与D的浓溶液相遇会产生白烟E。
请回答下面问题:
(1)写出A、Z的电子式A______Z
_____
(2)写出下列反应的方程式:
①
A与D溶液反应的离子方程式_____________________________________
②
A转化为B的化学方程式:_______________________________
③已知A与C在一定条件下能反应,且生成两种没有污染的物质。请写出该反应的化学方程式__________________________________。
五、计算题
21.一定量氢气在氯气中燃烧,所得混合物用溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500
mol。
(1)所得混合物与NaOH溶液反应的离子方程式______
(2)所得溶液中NaCl的物质的量为________。
(3)所用氯气和参加反应的氢气的物质的量之比________。
22.电解饱和食盐水可产生氯气、氢气和氢氧化钠,氯气与石灰乳反应可制得漂白粉。
(1)请写出上述过程中发生反应的化学方程式。
(2)若电解饱和食盐水时消耗NaCl
117g,
试计算理论上最多可得到氯气的体积(标准状况)。
(3)若将2
mol氯气通入足量石灰乳中,理论上可得到次氯酸钙多少克?
参考答案
1.C
2.B
3.A
4.B
5.B
6.B
7.B
8.A
9.C
10.A
11.C
12.B
13.A
14.硅
二氧化硅
陶瓷
15.a
b
d
低
热塑
电化学(或者吸氧)
Fe-2e-=Fe2+
d
杀菌消毒
Al3++3H2OAl(OH)3
(胶体)+3H+
石灰石
C+H2O(g)
CO+H2
16.A或B
Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O或NH3?H2ONH3↑+H2O
d
c
f
e
挤压胶头滴管的水进入圆底烧瓶,再打开止水夹
4NH3+5O24NO+6H2O
4NH3+6NO5N2+6H2O
0.45mol/L
17.Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑
品红溶液褪色
用氢氧化钠润湿的棉花团塞在试管口
试剂瓶中液面下降,长颈漏斗中液面上升
D
随着硫酸的消耗,浓硫酸的浓度不断减小,稀硫酸与铜不反应
AD
18.+6
SO2Cl2+2H2O=2HCl↑+H2SO4
(球形)冷凝管
浓硫酸
防止空气中水蒸汽进入三颈烧瓶,使SO2Cl2发生水解变质;吸收尾气SO2和Cl2,防止污染环境。
D
吸收Cl2
C中KMnO4溶液褪色
2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
19.H
O
Cl
CO+2H+=CO2↑+H2O
Cl2+H2OHCl+HClO
20.
NH3+H+=NH4+
4NH3+5O24NO+6H2O
8NH3+6NO2=7N2+12H2O
21.、
0.250
22.(1)2NaCl+2H2O2NaOH
+H2↑+Cl2↑
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
(2)22.4L
(3)143g
一、单选题
1.在一定温度下,某浓度的硝酸与金属锌反应生成NO2和NO,两者的物质的量之比为1∶3,则要使1
mol金属锌完全反应,反应过程中消耗HNO3的物质的量为( )
A.2.4
mol
B.2.6
mol
C.2.8
mol
D.3.2
mol
2.下列有关物质用途的说法中,错误的是(
)
A.用于自来水消毒
B.用作红色油漆和涂料
C.用于漂白纸浆
D.用于呼吸面具作供氧剂
3.下列装置进行相应的实验,能达到实验目的的是
A
B
C
D
吸收少量NO2
分离硝基苯和苯
除去碳酸钠中的碳酸氢钠
制备少量纯净的SO2
A.A
B.B
C.C
D.D
4.下列俗名和化学式配对错误的是
(
)
A.重晶石BaSO4
B.熟石膏CaSO42H2O
C.胆矾CuSO4
5H2O
D.漂粉精的有效成份Ca(ClO)2
5.氯气的水溶液称“氯水”,氯水中含有多种分子和离子,因此氯水有多重性质,下列有关新制氯水的说法中不正确的是
A.新制氯水呈黄绿色,且有刺激性气味,说明氯水中含有Cl2
B.新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,可说明氯水中含有Cl2
C.向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明Cl2的氧化性强于I2
D.新制氯水滴到Na2CO3溶液中,有气体产生,说明氯水中含有H+
6.关于氨的喷泉实验形成的原理解释正确的是
A.氨水呈碱性
B.氨气极易溶于水,烧瓶内外形成压强差
C.氨气易液化
D.氨气溶于水后形成的溶液易挥发
7.下列物质与氯气反应制得漂白粉的是
A.Na
B.Ca(OH)2
C.H2
D.H2O
8.下列实验过程中,无明显现象的是
A.CO2通入CaCl2溶液中
B.胆矾中加入浓硫酸
C.NO2通入FeSO4溶液中
D.饱和的食盐水中滴加浓盐酸
9.短周期元素a、b、c、d的原子序数依次增大,由以上四种元素组成的一种化合物m在加热时完全分解为三种产物,其中一种产物n
是能使湿润的红色石蕊试纸变蓝的气体,另一种产物q是无色无味的能使澄清石灰水变浑浊的气体。下列说法正确的是
A.原子半径:a
的简单氢化物的热稳定性依次增强
C.a、c、d
三种元素形成的化合物一定会抑制水的电离
D.m、n、q三种物质中只含共价键
10.室温下,四氯化锡是一种无色液体(沸点为114.1
5℃),遇水会反应。模拟工业制备SnCl4的实验装置如下图所示。下列说法错误的是
已知:SnO2+2Cl2+2CSnCl4+2CO
A.a的烧瓶中盛放的是高锰酸钾,c中盛放的是饱和食盐水
B.向烧瓶中滴入浓盐酸之前需打开K
C.e装置用于冷凝SnCl4蒸汽
D.f
装置用于防止空气中水蒸气进入u形管
11.下列实验能达到预期目的的是( )
选项
实验内容
实验目的
A
向1
mL
0.1
mol/L
NaOH溶液中加入2
mL
0.1
mol/L
CuSO4溶液,振荡后滴加0.5
mL葡萄糖溶液,加热观察是否出现红色沉淀
证明葡萄糖中含有醛基
B
向1
mL
0.2
mol/L
NaOH溶液中滴入2滴0.1
mol/L
MgCl2溶液,产生白色沉淀后,再滴加2滴0.1
mol/L
FeCl3溶液,又生成红褐色沉淀
证明在相同温度下,Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
C
测定同温度下相同浓度的碳酸钠和硫酸钠溶液的pH,前者大于后者
证明碳元素非金属性弱于硫
D
向某溶液中滴加少量稀NaOH溶液,将湿润的红色石蕊试纸置于试管口试纸不变蓝
证明溶液中无NH4+
A.A
B.B
C.C
D.D
12.化学与生活密切相关。下列情况会对人体健康造成较大危害的是
A.FeSO4作补血剂时可与维生素C同时服用增强药效
B.用SO2漂白食品
C.用食醋清洗热水瓶胆内壁附着的水垢
D.用小苏打(NaHCO3)发酵面团制作馒头
13.下列说法中,正确的是( )
A.SO2能使FeCl3、酸性KMnO4溶液变色或褪色
B.可以用澄清石灰水来鉴别SO2与CO2
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.少量SO2通入浓的CaCl2溶液中可以生成白色沉淀
二、填空题
14.用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用.例如:计算机芯片的主要成分是________;光导纤维的主要成分是________;
人们使用量最大的传统硅酸盐产品有水泥、玻璃和________
15.(1)据中新社2017年6月29日电,也门遭世界最严重霍乱疫情
1400人死亡疑20余万人感染。霍乱是由霍乱弧菌引起的急性肠道传染病,患者常出现呕吐、腹泻、脱水和高烧等症状,重症和延误治疗可致死亡。据联合国儿童基金会专家表示,正常情况下,霍乱可以预防并且治愈率很高,但由于也门基础设施被完全损坏,将很难控制疾病传播。
请根据此信息和题意回答下列问题(填字母,下同)。
a.蛋白质
b.氨基酸
c.葡萄糖
d.变性
e.盐析
①霍乱弧菌中的主要成分中含有____________;该成分经水解后变为__________;
②为了预防霍乱,该疫情地区普遍采用喷洒消毒水进行消毒,对所接触到的器具均采用高温灭菌处理,这是因为在高温条件下病毒和细菌都发生了__________。
(2)化学与材料密切相关,材料是人类生存和发展的物质基础。
①在快中子反应堆中得以广泛应用的钠钾合金在常温下呈液态,这个事实说明合金的熔点比其成分金属的熔点_______(填“高”或者“低”)。
②有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料而是一种线型高分子化合物,它具有_____________性(选填“热塑”或“热固”)。
③据报道,每年我国因金属腐蚀造成的损失占国民生产总值(GDP)的4%。钢铁在潮湿的空气中发生________腐蚀时,负极的电极反应为
______________。
(3)化学与环境紧密联系。
①空气质量报告的各项指标可以反映出各地空气的质量。下列物质不属于空气污染物的是______(填字母)
a.SO2
b.NO2
c.PM2.5
d.CO2
②
天然水中杂质较多,常需加入明矾,ClO2等物质处理后才能饮用。加入ClO2的作用是__________________;加入明矾后,
Al3+水解的离子方程式是
________________。
③为减少SO2的排放量,可向煤中加入适量
__________(填名称);也可以将煤气化,即在高温条件下与水蒸气反应转化为水煤气,该反应方程式为___________________。
三、实验题
16.氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。回答下列问题:
(1)氨气的制备
①氨气制取的发生装置可以选择上图中的_________(填字母),反应的化学方程式为_____________________________________________。
②选择上图装置组装一套实验装置来收集一瓶干燥的氨气,所选装置的连接顺序为:发生装置→______→______→______→_____→i(按气流方向,用小写英文字母表示)。
③可用如图装置进行氨的喷泉实验,引发喷泉的操作是_______________________________。
(2)如图所示,NH3经一系列反应可以得到HNO3。
①反应①的化学方程式为________________________________________。
②产物NO是大气污染物之一。在400℃左右且有催化剂存在的情况下,可用氨将一氧化氮还原为无色无毒气体。该反应的化学方程式为_______________________。
(3)在某100mL硝酸与硫酸的混合液中,HNO3和H2SO4的物质的量浓度分别为0.6
mol·L-1和0.3mol·L-1。向该混合液中加入3.84g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度为____________。
17.某化学兴趣小组为探究铜和浓硫酸的反应,用下图装置进行有关实验。请回答:实验中甲同学将a
g铜片和12
mL
18mol/L的浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的硫酸和铜片剩余。
(1)请写出铜片和浓硫酸反应的化学方程式__________;
(2)装置E中D内盛品红溶液,当C中气体集满后,D中有可能观察到的现象是__________;
(3)实验装置D中有可能造成环境污染,试用最简单的方法解决(实验用品自选)__________;
(4)装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是__________,B中应放置的液体为:__________(填字母)。
A.饱和
Na2SO3溶液
B.酸性KMnO4溶液
C.浓溴水
D.饱和NaHSO3
(5)问题讨论:为什么有一定量的余酸但未能使铜完全溶解,你认为原因是__________。足量下列药品能够用来证明反应结束后的烧瓶中却有余酸的是__________。
A.Fe粉
B.BaCl2溶液
C.Ag
D.
Na2CO3溶液
18.硫酰氯(SO2Cl2)熔点-54.1℃、沸点69.2℃,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中S的化合价为_______,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为________________。
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(夹持装置未画出)。
①仪器A的名称为___________,装置乙中装入的试剂_____________,装置B的作用是_______________________。
②装置丙分液漏斗中盛装的最佳试剂是________(选填字母)。
A.蒸馏水??
B.10.0
mol/L浓盐酸??
C.浓氢氧化钠溶液??
D.饱和食盐水?
(3)探究硫酰氯在催化剂作用下加热分解的产物,实验装置如图所示(部分夹持装置未画出)。
①加热时A中试管出现黄绿色,装置B的作用是
____________。
②装置C中的现象是___________,反应的离子方程式为___________________。
四、元素或物质推断题
19.现有X、Y、Z三种元素。
①X的单质可以在Z的单质中燃烧,生成XZ,燃烧时火焰为苍白色。
②X的单质可与Y的单质化合,生成X2Y。X2Y在常温下为液体。
③Z的单质溶于X2Y中,所得溶液具有漂白性。
请填写下列空白。
(1)X、Y、Z的元素符号分别为_______、_______、________
(2)将XZ的水溶液滴入Na2CO3溶液中,有气泡产生,反应的离子方程式为_______。
(3)Z的单质溶于X2Y中,反应的化学方程式为________。
20.现有A、B、C、D、E五种物质,它们均含同一种元素,有以下转化关系:已知A、B、C、X在常温下为气体,Z为液体,Y为紫红色金属,A与D的浓溶液相遇会产生白烟E。
请回答下面问题:
(1)写出A、Z的电子式A______Z
_____
(2)写出下列反应的方程式:
①
A与D溶液反应的离子方程式_____________________________________
②
A转化为B的化学方程式:_______________________________
③已知A与C在一定条件下能反应,且生成两种没有污染的物质。请写出该反应的化学方程式__________________________________。
五、计算题
21.一定量氢气在氯气中燃烧,所得混合物用溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500
mol。
(1)所得混合物与NaOH溶液反应的离子方程式______
(2)所得溶液中NaCl的物质的量为________。
(3)所用氯气和参加反应的氢气的物质的量之比________。
22.电解饱和食盐水可产生氯气、氢气和氢氧化钠,氯气与石灰乳反应可制得漂白粉。
(1)请写出上述过程中发生反应的化学方程式。
(2)若电解饱和食盐水时消耗NaCl
117g,
试计算理论上最多可得到氯气的体积(标准状况)。
(3)若将2
mol氯气通入足量石灰乳中,理论上可得到次氯酸钙多少克?
参考答案
1.C
2.B
3.A
4.B
5.B
6.B
7.B
8.A
9.C
10.A
11.C
12.B
13.A
14.硅
二氧化硅
陶瓷
15.a
b
d
低
热塑
电化学(或者吸氧)
Fe-2e-=Fe2+
d
杀菌消毒
Al3++3H2OAl(OH)3
(胶体)+3H+
石灰石
C+H2O(g)
CO+H2
16.A或B
Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O或NH3?H2ONH3↑+H2O
d
c
f
e
挤压胶头滴管的水进入圆底烧瓶,再打开止水夹
4NH3+5O24NO+6H2O
4NH3+6NO5N2+6H2O
0.45mol/L
17.Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑
品红溶液褪色
用氢氧化钠润湿的棉花团塞在试管口
试剂瓶中液面下降,长颈漏斗中液面上升
D
随着硫酸的消耗,浓硫酸的浓度不断减小,稀硫酸与铜不反应
AD
18.+6
SO2Cl2+2H2O=2HCl↑+H2SO4
(球形)冷凝管
浓硫酸
防止空气中水蒸汽进入三颈烧瓶,使SO2Cl2发生水解变质;吸收尾气SO2和Cl2,防止污染环境。
D
吸收Cl2
C中KMnO4溶液褪色
2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
19.H
O
Cl
CO+2H+=CO2↑+H2O
Cl2+H2OHCl+HClO
20.
NH3+H+=NH4+
4NH3+5O24NO+6H2O
8NH3+6NO2=7N2+12H2O
21.、
0.250
22.(1)2NaCl+2H2O2NaOH
+H2↑+Cl2↑
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
(2)22.4L
(3)143g
