第二节芳香烃
图片预览


文档简介
第二节 芳香烃
【复习指导】
学习目标:
1、掌握苯和苯的同系物的结构及化学性质;
2、了解芳香烃的来源及其应用
学习重点:
苯和苯的同系物的结构特点和化学性质。
学习难点:
苯的同系物的结构和化学性质。
【学法指导】
学习时可以通过比较苯和甲苯的结构与化学性质的不同,认识基团间的相互影响。围绕“苯及其同系物使人中毒”的话题,进行查阅资料或实地调查的实践活动,做成简单的课件或宣传文稿。对于溴苯、硝基苯的实验设计,根据反应条件和反应物的状态及生成物的性质讨论实验方案。
【知识精讲】
复习脂肪烃,回忆必修2中有关苯的知识,完成表格
[思考与交流]
1.在乙烯、乙炔、苯分子中,含碳的质量分数较甲烷等烷烃高,乙炔、苯分子中含碳的质量分数又比乙烯高。乙烯、乙炔、苯在空气中燃烧不完全,易产生黑烟,乙炔、苯的黑烟更浓。
2.略
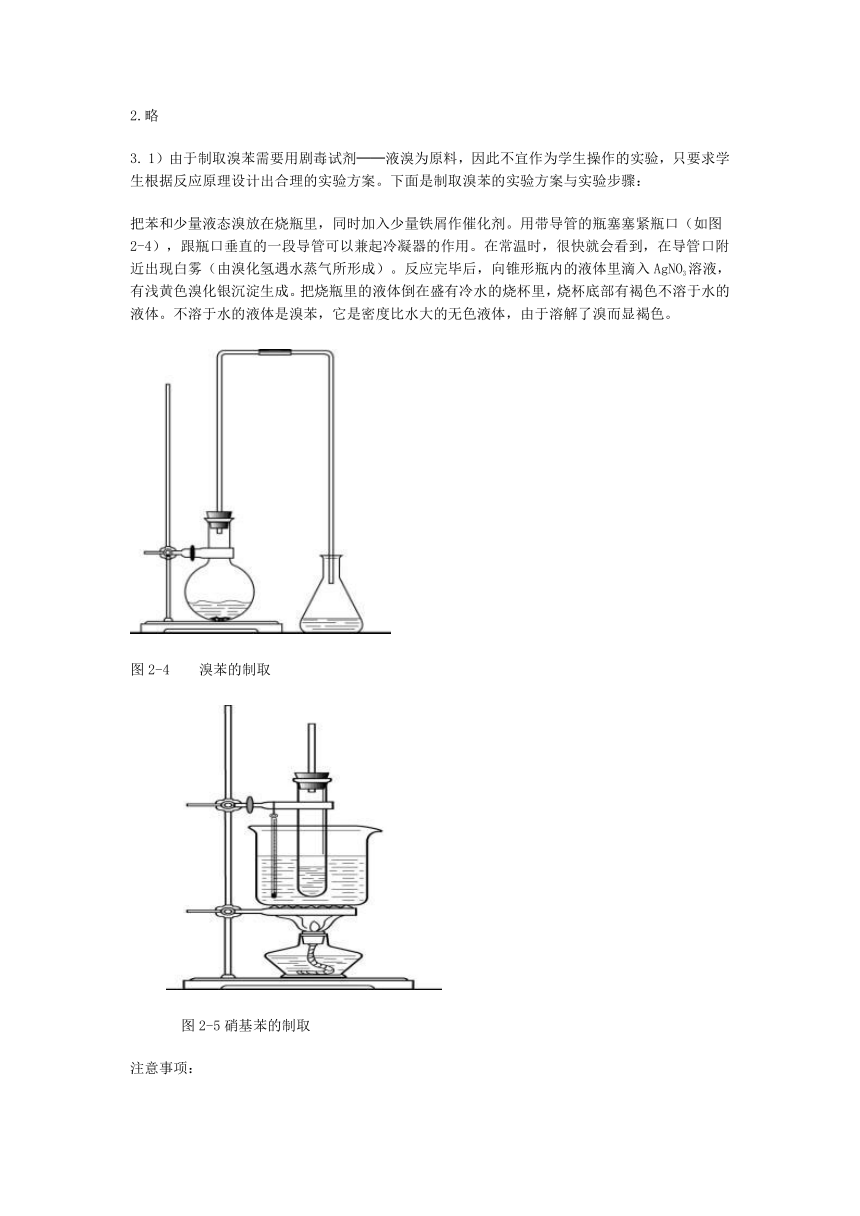
3. 1)由于制取溴苯需要用剧毒试剂──液溴为原料,因此不宜作为学生操作的实验,只要求学生根据反应原理设计出合理的实验方案。下面是制取溴苯的实验方案与实验步骤:
把苯和少量液态溴放在烧瓶里,同时加入少量铁屑作催化剂。用带导管的瓶塞塞紧瓶口(如图2-4),跟瓶口垂直的一段导管可以兼起冷凝器的作用。在常温时,很快就会看到,在导管口附近出现白雾(由溴化氢遇水蒸气所形成)。反应完毕后,向锥形瓶内的液体里滴入AgNO3溶液,有浅黄色溴化银沉淀生成。把烧瓶里的液体倒在盛有冷水的烧杯里,烧杯底部有褐色不溶于水的液体。不溶于水的液体是溴苯,它是密度比水大的无色液体,由于溶解了溴而显褐色。
图2-4 溴苯的制取
图2-5硝基苯的制取
注意事项:
(1)装置特点:长导管;长管管口接近水面,但不接触
(2)长导管的作用:导气;冷凝 [冷苯与溴]
(3)苯,溴,铁顺序加药品(强调:是液溴,不是溴水,苯与溴水只萃取,不反应)
(4)铁粉的作用:催化(真正的催化剂是FeBr3)
(5)提示观察三个现象:导管口的白雾;烧瓶中的现象;滴入硝酸银后水中生成的沉淀
白雾是如何形成的 (长管口与水面位置关系为什么是这样)
(6)将反应的混合物倒入水中的现象是什么 [有红褐色的油状液体沉于水底]
(7)溴苯的物理性质如何 [比水重,不溶于水,油状]
(8)如何除去溴苯中的溴 [水洗,再用10%烧碱溶液洗,再干燥,蒸馏]
(9)反应方程式
2)制取硝基苯的实验方案与实验步骤:
① 配制混和酸:先将1.5 mL浓硝酸注入大试管中,再慢慢注入2 mL浓硫酸,并及时摇匀和冷却。
② 向冷却后的混酸中逐滴加入1 mL苯,充分振荡,混和均匀。
③ 将大试管放在50~60 ℃的水浴中加热约10 min,实验装置如图2-5所示。
④ 将反应后的液体倒入一个盛有冷水的烧杯中,可以观察到烧杯底部有黄色油状物生成,用分液漏斗分离出粗硝基苯。
⑤ 粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。若将用无水CaCl2干燥后的粗硝基苯进行蒸馏,可得纯硝基苯。蒸馏应在通风柜或通风良好处进行。
纯硝基苯为无色、具有苦杏仁气味的油状液体,其密度大于水。
注意事项:
(1)装置特点:水浴;温度计位置;水浴的水面高度(反应装置中的温度计,应插入水浴液面以下,以测量水浴温度。)
(2)药品加入的顺序:先浓硝酸再浓硫酸à冷却到50-60C再加入苯(讲清为什么)
(3)水浴温度:50-60C(温度高苯挥发,硝酸分解,温度低),水浴加热
(4)HNO3àHO-NO2去HO-后,生成-NO2称为硝基
(5)浓硫酸的作用:催化剂,吸水剂
(6)硝基苯的物质性质如何 有杂质与纯净时的颜色有什么不同 要想得到纯净的硝基苯,如何除去其中的杂质 硝基苯的毒性如何
(7)化学方程式
总结苯的物理性质和化学性质:
一、苯的物理性质:
苯是无色有特殊气味的液体,密度比水小,不溶于水,苯的沸点80.1C,熔点5.5C
二、苯的化学性质
在通常情况下比较稳定,在一定条件下能发生氧化、加成、取代等反应。
1)苯的氧化反应:在空气中燃烧,有黑烟。
*但不能使酸性高锰酸钾溶液褪色
2)苯的取代反应(卤代、硝化、磺化)
3)苯的加成反应 (与H2、Cl2)
总结:能燃烧, 难加成, 易取代
三、苯的同系物
苯的同系物的通式是 CnH2n-6苯的同系物都有与苯相似的化学性质
[练习]写出下列化学方程式
(1)甲苯与氢气
(2)苯乙烯与溴水,加聚,过量的氢气
1、[实验2-2]P38甲苯,二甲苯与酸性高锰酸钾溶液的反应
现象:P38
[分析]:苯环的存在使-CH3变得活泼了,乙烷中有-CH3,但不能使高锰酸钾溶液褪色,但甲苯能使酸性高锰酸钾溶液褪色,-CH3被氧化了
2、乙苯与浓硫酸共热
[分析]-CH3的存在,使苯环更易发生取代反应.甲苯与浓硫酸浓硝酸共热时苯环上的三个H原子都被取代
[学与问]P39
[讲解]苯环和烃基相互影响。
小结:比较苯和甲苯
[练习]用化学方法来鉴别下列各组物质
(1)苯和乙苯
(2)已烷和已烯
(3)苯、二甲苯、乙烯
四、芳香烃的来源及其应用
P39
[实践活动]P39
(2)苯的毒性
苯有毒,对中枢神经和血液有较强的作用。严重的急性苯中毒可以引起抽搐,甚至失去知觉。慢性苯中毒能损害造血功能。长期吸入苯及其同系物的蒸气,会引起肝的损伤,损坏造血器官及神经系统,并能导致白血病。空气中苯蒸气的容许量各国都有不同的规定,从每立方米几毫克到几百毫克不等。
【课后习题参考答案】
1. 4, 2. B
3?己烷既不能使溴的四氯化碳溶液褪色,也不能使高锰酸钾酸性溶液褪色;1?己烯既能使溴的四氯化碳溶液褪色,也能使高锰酸钾酸性溶液褪色;邻二甲苯不能使溴的四氯化碳溶液褪色,但能使高锰酸钾酸性溶液褪色;因此用溴的四氯化碳溶液和高锰酸钾酸性溶液可鉴别己烷、1?己烯和邻二甲苯。
【复习指导】
学习目标:
1、掌握苯和苯的同系物的结构及化学性质;
2、了解芳香烃的来源及其应用
学习重点:
苯和苯的同系物的结构特点和化学性质。
学习难点:
苯的同系物的结构和化学性质。
【学法指导】
学习时可以通过比较苯和甲苯的结构与化学性质的不同,认识基团间的相互影响。围绕“苯及其同系物使人中毒”的话题,进行查阅资料或实地调查的实践活动,做成简单的课件或宣传文稿。对于溴苯、硝基苯的实验设计,根据反应条件和反应物的状态及生成物的性质讨论实验方案。
【知识精讲】
复习脂肪烃,回忆必修2中有关苯的知识,完成表格
[思考与交流]
1.在乙烯、乙炔、苯分子中,含碳的质量分数较甲烷等烷烃高,乙炔、苯分子中含碳的质量分数又比乙烯高。乙烯、乙炔、苯在空气中燃烧不完全,易产生黑烟,乙炔、苯的黑烟更浓。
2.略
3. 1)由于制取溴苯需要用剧毒试剂──液溴为原料,因此不宜作为学生操作的实验,只要求学生根据反应原理设计出合理的实验方案。下面是制取溴苯的实验方案与实验步骤:
把苯和少量液态溴放在烧瓶里,同时加入少量铁屑作催化剂。用带导管的瓶塞塞紧瓶口(如图2-4),跟瓶口垂直的一段导管可以兼起冷凝器的作用。在常温时,很快就会看到,在导管口附近出现白雾(由溴化氢遇水蒸气所形成)。反应完毕后,向锥形瓶内的液体里滴入AgNO3溶液,有浅黄色溴化银沉淀生成。把烧瓶里的液体倒在盛有冷水的烧杯里,烧杯底部有褐色不溶于水的液体。不溶于水的液体是溴苯,它是密度比水大的无色液体,由于溶解了溴而显褐色。
图2-4 溴苯的制取
图2-5硝基苯的制取
注意事项:
(1)装置特点:长导管;长管管口接近水面,但不接触
(2)长导管的作用:导气;冷凝 [冷苯与溴]
(3)苯,溴,铁顺序加药品(强调:是液溴,不是溴水,苯与溴水只萃取,不反应)
(4)铁粉的作用:催化(真正的催化剂是FeBr3)
(5)提示观察三个现象:导管口的白雾;烧瓶中的现象;滴入硝酸银后水中生成的沉淀
白雾是如何形成的 (长管口与水面位置关系为什么是这样)
(6)将反应的混合物倒入水中的现象是什么 [有红褐色的油状液体沉于水底]
(7)溴苯的物理性质如何 [比水重,不溶于水,油状]
(8)如何除去溴苯中的溴 [水洗,再用10%烧碱溶液洗,再干燥,蒸馏]
(9)反应方程式
2)制取硝基苯的实验方案与实验步骤:
① 配制混和酸:先将1.5 mL浓硝酸注入大试管中,再慢慢注入2 mL浓硫酸,并及时摇匀和冷却。
② 向冷却后的混酸中逐滴加入1 mL苯,充分振荡,混和均匀。
③ 将大试管放在50~60 ℃的水浴中加热约10 min,实验装置如图2-5所示。
④ 将反应后的液体倒入一个盛有冷水的烧杯中,可以观察到烧杯底部有黄色油状物生成,用分液漏斗分离出粗硝基苯。
⑤ 粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。若将用无水CaCl2干燥后的粗硝基苯进行蒸馏,可得纯硝基苯。蒸馏应在通风柜或通风良好处进行。
纯硝基苯为无色、具有苦杏仁气味的油状液体,其密度大于水。
注意事项:
(1)装置特点:水浴;温度计位置;水浴的水面高度(反应装置中的温度计,应插入水浴液面以下,以测量水浴温度。)
(2)药品加入的顺序:先浓硝酸再浓硫酸à冷却到50-60C再加入苯(讲清为什么)
(3)水浴温度:50-60C(温度高苯挥发,硝酸分解,温度低),水浴加热
(4)HNO3àHO-NO2去HO-后,生成-NO2称为硝基
(5)浓硫酸的作用:催化剂,吸水剂
(6)硝基苯的物质性质如何 有杂质与纯净时的颜色有什么不同 要想得到纯净的硝基苯,如何除去其中的杂质 硝基苯的毒性如何
(7)化学方程式
总结苯的物理性质和化学性质:
一、苯的物理性质:
苯是无色有特殊气味的液体,密度比水小,不溶于水,苯的沸点80.1C,熔点5.5C
二、苯的化学性质
在通常情况下比较稳定,在一定条件下能发生氧化、加成、取代等反应。
1)苯的氧化反应:在空气中燃烧,有黑烟。
*但不能使酸性高锰酸钾溶液褪色
2)苯的取代反应(卤代、硝化、磺化)
3)苯的加成反应 (与H2、Cl2)
总结:能燃烧, 难加成, 易取代
三、苯的同系物
苯的同系物的通式是 CnH2n-6苯的同系物都有与苯相似的化学性质
[练习]写出下列化学方程式
(1)甲苯与氢气
(2)苯乙烯与溴水,加聚,过量的氢气
1、[实验2-2]P38甲苯,二甲苯与酸性高锰酸钾溶液的反应
现象:P38
[分析]:苯环的存在使-CH3变得活泼了,乙烷中有-CH3,但不能使高锰酸钾溶液褪色,但甲苯能使酸性高锰酸钾溶液褪色,-CH3被氧化了
2、乙苯与浓硫酸共热
[分析]-CH3的存在,使苯环更易发生取代反应.甲苯与浓硫酸浓硝酸共热时苯环上的三个H原子都被取代
[学与问]P39
[讲解]苯环和烃基相互影响。
小结:比较苯和甲苯
[练习]用化学方法来鉴别下列各组物质
(1)苯和乙苯
(2)已烷和已烯
(3)苯、二甲苯、乙烯
四、芳香烃的来源及其应用
P39
[实践活动]P39
(2)苯的毒性
苯有毒,对中枢神经和血液有较强的作用。严重的急性苯中毒可以引起抽搐,甚至失去知觉。慢性苯中毒能损害造血功能。长期吸入苯及其同系物的蒸气,会引起肝的损伤,损坏造血器官及神经系统,并能导致白血病。空气中苯蒸气的容许量各国都有不同的规定,从每立方米几毫克到几百毫克不等。
【课后习题参考答案】
1. 4, 2. B
3?己烷既不能使溴的四氯化碳溶液褪色,也不能使高锰酸钾酸性溶液褪色;1?己烯既能使溴的四氯化碳溶液褪色,也能使高锰酸钾酸性溶液褪色;邻二甲苯不能使溴的四氯化碳溶液褪色,但能使高锰酸钾酸性溶液褪色;因此用溴的四氯化碳溶液和高锰酸钾酸性溶液可鉴别己烷、1?己烯和邻二甲苯。
