浙教版科学九年级上册“期末提分”高频考点过关(三十六):金属(1)【含答案】
文档属性
| 名称 | 浙教版科学九年级上册“期末提分”高频考点过关(三十六):金属(1)【含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 244.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-01-13 19:51:20 | ||
图片预览



文档简介
1.向盛有氯化亚铁和氯化铜混合溶液的烧杯中加入一定量的锌粉,充分反应后,得到固体M和溶液N。下列叙述不正确的是(??? )
? A.?锌有剩余时,M中一定有Fe、Cu和Zn
? B.?锌有剩余时,N中一定没有FeCl2和CuCl2
? C.?锌无剩余时,M中一定有Cu、可能有Fe
?D.?锌无剩余时,N中一定有ZnCl2和FeCl2
2.利用下列各组物质之间的反应,不能够验证各选项中三种金属活动性顺序的是(??? )
? A.?硫酸锌溶液、铜丝、硝酸银
? B.?氯化亚铁溶液、铜、硝酸银溶液
? C.?铁、氯化铜溶液、银
D.?氯化亚铁溶液、氯化铜溶液、银
3.下列四个图像的变化趋势,能正确描述对应操作的是(??? )
A.?A图为足量的铁片和铝片分别与等浓度、等质量的稀盐酸反应
? B.?B图为将浓硫酸敞口放置在空气中,硫酸溶液的浓度变化
? C.?C图为向氢氧化钠和氯化钡的混合溶液中,逐滴滴加稀硫酸
? D.?D图为向pH=14的氢氧化钠溶液中不断加入水
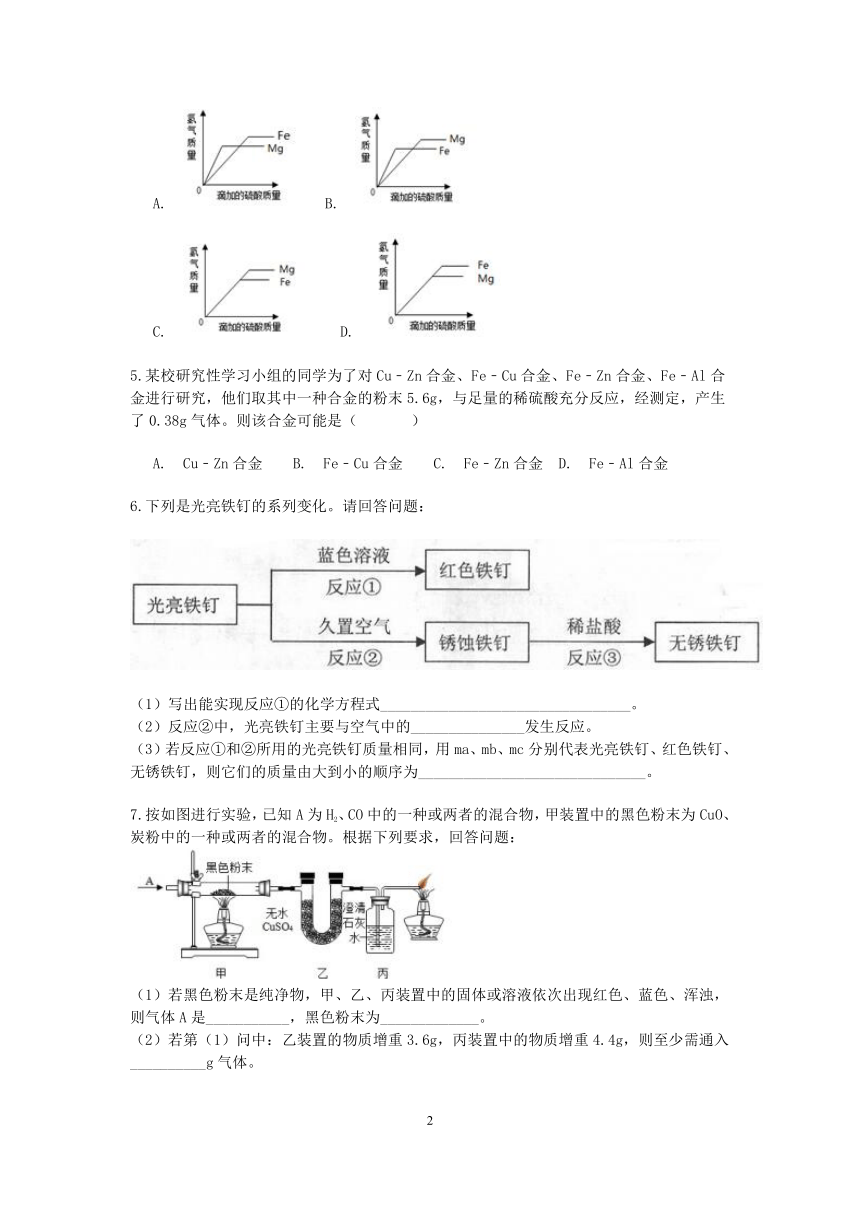
4.等质量的镁和铁分别放置在两只烧杯中,向其中分别逐滴加入质量分数相等的稀硫酸到过量。下图中能正确反映其过程的是( )
? A.? B.?
C.? ? D.?
5.某校研究性学习小组的同学为了对Cu﹣Zn合金、Fe﹣Cu合金、Fe﹣Zn合金、Fe﹣Al合金进行研究,他们取其中一种合金的粉末5.6g,与足量的稀硫酸充分反应,经测定,产生了0.38g气体。则该合金可能是(??? )
? A.?Cu﹣Zn合金 ? B.?Fe﹣Cu合金 ? C.?Fe﹣Zn合金 D.?Fe﹣Al合金
6.下列是光亮铁钉的系列变化。请回答问题:
(1)写出能实现反应①的化学方程式_________________________________。
(2)反应②中,光亮铁钉主要与空气中的_______________发生反应。
(3)若反应①和②所用的光亮铁钉质量相同,用ma、mb、mc分别代表光亮铁钉、红色铁钉、无锈铁钉,则它们的质量由大到小的顺序为______________________________。
7.按如图进行实验,已知A为H2、CO中的一种或两者的混合物,甲装置中的黑色粉末为CuO、炭粉中的一种或两者的混合物。根据下列要求,回答问题:
(1)若黑色粉末是纯净物,甲、乙、丙装置中的固体或溶液依次出现红色、蓝色、浑浊,则气体A是___________,黑色粉末为_____________。
(2)若第(1)问中:乙装置的物质增重3.6g,丙装置中的物质增重4.4g,则至少需通入__________g气体。
(3)若A为纯净物,反应现象与(1)相同,充分反应后,甲装置生成6.4g红色固体,乙装置中物质增重0.9g,则至少需要_________g黑色粉末。
8.小刚通过实验探究得知以下两组物质均能发生反应:
Ⅰ.铁和硫酸铜溶液 ???Ⅱ.铝和硫酸亚铁溶液
①Ⅰ中发生反应的化学方程式是__________。
②小刚继续探究某未知金属X与铁、铜的活动性强弱关系,设计了以下实验方案并对实验结果进行预测。下列实验方案及预测如果与事实相符,就可以判断出X、铁、铜金属活动性强弱顺序的有__________(填序号)。
A.将X放入CuSO4溶液中能反应 ????????B.将X放入CuSO4溶液中不能反应 ?
C.将X放入FeSO4溶液中能反应 ????????D.将X放入FeSO4溶液中不能反应
E.将X放入FeSO4溶液中不能反应,放入CuSO4溶液中能反应
9.细心的小柯同学在观察老师演示的“氧化铜粉末与稀盐酸反应”的实验时,发现所产生的CuCl2溶液为绿色,含铜离子的盐溶液一般呈蓝色,这是怎么回事呢?他对此进行了科学探究:
猜想一:生成物中除铜离子外可能还有亚铁离子
猜想二:可能与铜离子浓度偏大有关
猜想三:可能是由于温度不同所造成的
(1)若要验证猜想一:可向反应后的溶液中加入金属_____________,结果发现在该金属表面只生成红色固体,则证明该猜想是错误的。
(2)若要验证猜想二:在不改变所得溶液构成微粒的前提下,向实验结束后的试管中适量加入某种物质,发现溶液呈现蓝色,猜想二正确。则加入的物质应是__________。
A.酒精?? B.水?? C.硫酸铜溶液?? D.氯化铜粉末
(3)爱动脑筋的小柯对这一实验做了一点改进,将一根铜丝擦光亮后,一端绕成螺旋状放在酒精灯火焰上灼烧至表面出现黑色,然后趁热放进稀盐酸中,一会儿就可以看到螺旋上的_________,溶液也由无色变成蓝色。
10.如图为教材中实验室模拟炼铁的实验改进装置(部分夹持仪器略去)。
实验步骤如下:
Ⅰ.连接好装置,并检查装置的气密性;
Ⅱ.装好药品,先通一会儿CO,再点燃酒精喷灯;
Ⅲ.实验结束,先撤去酒精喷灯,继续通CO直至玻璃管冷却:
回答下列问题:
(1)实验中可看到A处玻璃管里的粉末由红色逐渐变黑,说明Fe2O3转化为_______(填化学式),B瓶中澄清石灰水变浑浊,该反应的化学方程式为____________。
(2)步骤Ⅲ中先撤去酒精喷灯,继续通CO直至玻璃管冷却的目的是___________。
(3)盛满石灰水的B装置在此实验中的作用有下列说法:
①收集多余的CO
②检验并吸收反应生成的CO2
上述说法中正确的_________ ??
A.只有①? B.只有②? C.是①和②
11.小乐发现切过咸菜的铁质菜刀很容易生锈,她猜测可能是咸菜中的盐水加快了铁的锈蚀,于是它设计了如图所示的实验:
(1)在答题卡中画出b试管中还需加入的物质并注明名称;
(2)一段时间后,若在实验中观察到_________(填实验现象),则可证明盐水能加快铁的锈蚀;
(3)日常生活中,人们采取多种方法来防止铁生锈,比如在铁片外面镀覆一层锌,制成镀锌铁皮,小乐为了测定某镀锌铁皮的锌镀层厚度,设计了如下实验:
根据相关信息判断下列说法错误的是________
A.镀锌铁皮属于金属材料中的合金
B.镀锌铁皮不易生锈的原因之一是使铁与空气隔绝
C.在操作Ⅱ中,锌镀层完全反应的标志是盐酸和镀锌铁皮的反应速率突然减小
D.在操作Ⅳ中,剩余样品的质量是镀锌铁皮内铁皮的质量
(4)若要计算得到锌镀层厚度,还需知道的物理量是___________。
12.化学实验室要从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如图流程:
(1)A、B、C三种金属的活动性顺序从大到小为__________。
(2)金属C是__________,操作a的名称是__________。
(3)已知A的硫酸盐中A元素显+2价,请写出步骤①的反应的化学方程式:__________。
13.现有H2SO4和CuSO4的混合溶液,为了测定CuSO4的质量分数,某兴趣小组进行如下实验:取混合溶液于烧杯中,向其中加入铁片至完全反应。反应前后,有关数据如下。
(1)除铁外,加入___也可以看到类似现象(填选项)。
A.K ?????B.Mg ????C.Zn ????D Ag
(2)请根据实验数据计算原混合溶液中CuSO4的质量分数(要求写出计算过程)。
14.Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题: ???
(1)从以上数据可知,最后剩余的11.2g固体的成分是________;表格中,m=________。??
(2)黄铜样品中锌的质量分数为________。 ???
(3)计算所用稀硫酸中硫酸的质量分数是多少? ???
(4)配制100g该浓度的稀硫酸需要质量分数为98%浓硫酸的质量是多少??
15.钢铁工业是一个国家的支柱产业之一,某同学采集了一些生铁样品(含杂质,杂质不溶于水,不与稀硫酸反应)采用如图1所示装置进行分析.分别称得锥形瓶与棉花的质量为44.1g,生铁样品的质量为9.0g.在锥形瓶中加入足量稀硫酸后,立即开始记录电子天平的示数,记录数据如图2.
请认真分析数据,回答下列问题:
(1)小军数据处理的图象中正确的是图3的________。 ??
?
(2)计算样品中铁的质量分数。
参考答案
1.D
2.D
3.A
4.C
5.D
6.(1)Fe+CuSO4=FeSO4+Cu(合理即可)(2)氧气、水蒸气(3)mb>ma>mc
7.(1)H2?CO、CuO (2)3.2 (3)8.3
8.①Fe+CuSO4═FeSO4+Cu ②BCE
9.(1)Mg(Zn)? (2)B? (3)黑色消失,铜丝恢复红色(恢复明亮)
10.(1)Fe;CO2+Ca(OH)2=CaCO3↓+H2O(2)防止生成的铁被空气中的氧气氧化(3)C
11.(1)(2)U型管中红墨水液面左边低,右边高(3)A (4)镀锌铁皮的面积与金属锌的密度
12.(1)A>B>C (2)Ag;蒸发结晶 (3)Mn+H2SO4=MnSO4+H2↑
13.(1)BC?????????
(2)设原混合溶液中CuSO4的质量分数为X
Fe+CuSO4=FeSO4+Cu
160 ?????64
100gX????12.8g ??????
160/100gX =64/12.8g ? X=32%
(1)Cu;17.4(2)44%
设40g稀硫酸中硫酸的质量为x
H2SO4+Zn═ZnSO4+H2↑
98 ?65
x??2.6g
98/x=65/2.6g
解得:x=3.92g
稀硫酸中硫酸的质量分数为:3.92g40g×100%=9.8%
设需要质量分数为98%浓硫酸的质量为Y
则100g×9.8%=Y×98%,解得;Y=10g
(1)B(2)设反应的铁的质量为x
Fe+H2SO4═FeSO4+H2↑
56? ? ?2
x? ? ?0.3g
56/x=2/0.3g??x=8.4g
铁的质量分数为:8.4g/9g?×100%=93.3%
? A.?锌有剩余时,M中一定有Fe、Cu和Zn
? B.?锌有剩余时,N中一定没有FeCl2和CuCl2
? C.?锌无剩余时,M中一定有Cu、可能有Fe
?D.?锌无剩余时,N中一定有ZnCl2和FeCl2
2.利用下列各组物质之间的反应,不能够验证各选项中三种金属活动性顺序的是(??? )
? A.?硫酸锌溶液、铜丝、硝酸银
? B.?氯化亚铁溶液、铜、硝酸银溶液
? C.?铁、氯化铜溶液、银
D.?氯化亚铁溶液、氯化铜溶液、银
3.下列四个图像的变化趋势,能正确描述对应操作的是(??? )
A.?A图为足量的铁片和铝片分别与等浓度、等质量的稀盐酸反应
? B.?B图为将浓硫酸敞口放置在空气中,硫酸溶液的浓度变化
? C.?C图为向氢氧化钠和氯化钡的混合溶液中,逐滴滴加稀硫酸
? D.?D图为向pH=14的氢氧化钠溶液中不断加入水
4.等质量的镁和铁分别放置在两只烧杯中,向其中分别逐滴加入质量分数相等的稀硫酸到过量。下图中能正确反映其过程的是( )
? A.? B.?
C.? ? D.?
5.某校研究性学习小组的同学为了对Cu﹣Zn合金、Fe﹣Cu合金、Fe﹣Zn合金、Fe﹣Al合金进行研究,他们取其中一种合金的粉末5.6g,与足量的稀硫酸充分反应,经测定,产生了0.38g气体。则该合金可能是(??? )
? A.?Cu﹣Zn合金 ? B.?Fe﹣Cu合金 ? C.?Fe﹣Zn合金 D.?Fe﹣Al合金
6.下列是光亮铁钉的系列变化。请回答问题:
(1)写出能实现反应①的化学方程式_________________________________。
(2)反应②中,光亮铁钉主要与空气中的_______________发生反应。
(3)若反应①和②所用的光亮铁钉质量相同,用ma、mb、mc分别代表光亮铁钉、红色铁钉、无锈铁钉,则它们的质量由大到小的顺序为______________________________。
7.按如图进行实验,已知A为H2、CO中的一种或两者的混合物,甲装置中的黑色粉末为CuO、炭粉中的一种或两者的混合物。根据下列要求,回答问题:
(1)若黑色粉末是纯净物,甲、乙、丙装置中的固体或溶液依次出现红色、蓝色、浑浊,则气体A是___________,黑色粉末为_____________。
(2)若第(1)问中:乙装置的物质增重3.6g,丙装置中的物质增重4.4g,则至少需通入__________g气体。
(3)若A为纯净物,反应现象与(1)相同,充分反应后,甲装置生成6.4g红色固体,乙装置中物质增重0.9g,则至少需要_________g黑色粉末。
8.小刚通过实验探究得知以下两组物质均能发生反应:
Ⅰ.铁和硫酸铜溶液 ???Ⅱ.铝和硫酸亚铁溶液
①Ⅰ中发生反应的化学方程式是__________。
②小刚继续探究某未知金属X与铁、铜的活动性强弱关系,设计了以下实验方案并对实验结果进行预测。下列实验方案及预测如果与事实相符,就可以判断出X、铁、铜金属活动性强弱顺序的有__________(填序号)。
A.将X放入CuSO4溶液中能反应 ????????B.将X放入CuSO4溶液中不能反应 ?
C.将X放入FeSO4溶液中能反应 ????????D.将X放入FeSO4溶液中不能反应
E.将X放入FeSO4溶液中不能反应,放入CuSO4溶液中能反应
9.细心的小柯同学在观察老师演示的“氧化铜粉末与稀盐酸反应”的实验时,发现所产生的CuCl2溶液为绿色,含铜离子的盐溶液一般呈蓝色,这是怎么回事呢?他对此进行了科学探究:
猜想一:生成物中除铜离子外可能还有亚铁离子
猜想二:可能与铜离子浓度偏大有关
猜想三:可能是由于温度不同所造成的
(1)若要验证猜想一:可向反应后的溶液中加入金属_____________,结果发现在该金属表面只生成红色固体,则证明该猜想是错误的。
(2)若要验证猜想二:在不改变所得溶液构成微粒的前提下,向实验结束后的试管中适量加入某种物质,发现溶液呈现蓝色,猜想二正确。则加入的物质应是__________。
A.酒精?? B.水?? C.硫酸铜溶液?? D.氯化铜粉末
(3)爱动脑筋的小柯对这一实验做了一点改进,将一根铜丝擦光亮后,一端绕成螺旋状放在酒精灯火焰上灼烧至表面出现黑色,然后趁热放进稀盐酸中,一会儿就可以看到螺旋上的_________,溶液也由无色变成蓝色。
10.如图为教材中实验室模拟炼铁的实验改进装置(部分夹持仪器略去)。
实验步骤如下:
Ⅰ.连接好装置,并检查装置的气密性;
Ⅱ.装好药品,先通一会儿CO,再点燃酒精喷灯;
Ⅲ.实验结束,先撤去酒精喷灯,继续通CO直至玻璃管冷却:
回答下列问题:
(1)实验中可看到A处玻璃管里的粉末由红色逐渐变黑,说明Fe2O3转化为_______(填化学式),B瓶中澄清石灰水变浑浊,该反应的化学方程式为____________。
(2)步骤Ⅲ中先撤去酒精喷灯,继续通CO直至玻璃管冷却的目的是___________。
(3)盛满石灰水的B装置在此实验中的作用有下列说法:
①收集多余的CO
②检验并吸收反应生成的CO2
上述说法中正确的_________ ??
A.只有①? B.只有②? C.是①和②
11.小乐发现切过咸菜的铁质菜刀很容易生锈,她猜测可能是咸菜中的盐水加快了铁的锈蚀,于是它设计了如图所示的实验:
(1)在答题卡中画出b试管中还需加入的物质并注明名称;
(2)一段时间后,若在实验中观察到_________(填实验现象),则可证明盐水能加快铁的锈蚀;
(3)日常生活中,人们采取多种方法来防止铁生锈,比如在铁片外面镀覆一层锌,制成镀锌铁皮,小乐为了测定某镀锌铁皮的锌镀层厚度,设计了如下实验:
根据相关信息判断下列说法错误的是________
A.镀锌铁皮属于金属材料中的合金
B.镀锌铁皮不易生锈的原因之一是使铁与空气隔绝
C.在操作Ⅱ中,锌镀层完全反应的标志是盐酸和镀锌铁皮的反应速率突然减小
D.在操作Ⅳ中,剩余样品的质量是镀锌铁皮内铁皮的质量
(4)若要计算得到锌镀层厚度,还需知道的物理量是___________。
12.化学实验室要从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如图流程:
(1)A、B、C三种金属的活动性顺序从大到小为__________。
(2)金属C是__________,操作a的名称是__________。
(3)已知A的硫酸盐中A元素显+2价,请写出步骤①的反应的化学方程式:__________。
13.现有H2SO4和CuSO4的混合溶液,为了测定CuSO4的质量分数,某兴趣小组进行如下实验:取混合溶液于烧杯中,向其中加入铁片至完全反应。反应前后,有关数据如下。
(1)除铁外,加入___也可以看到类似现象(填选项)。
A.K ?????B.Mg ????C.Zn ????D Ag
(2)请根据实验数据计算原混合溶液中CuSO4的质量分数(要求写出计算过程)。
14.Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题: ???
(1)从以上数据可知,最后剩余的11.2g固体的成分是________;表格中,m=________。??
(2)黄铜样品中锌的质量分数为________。 ???
(3)计算所用稀硫酸中硫酸的质量分数是多少? ???
(4)配制100g该浓度的稀硫酸需要质量分数为98%浓硫酸的质量是多少??
15.钢铁工业是一个国家的支柱产业之一,某同学采集了一些生铁样品(含杂质,杂质不溶于水,不与稀硫酸反应)采用如图1所示装置进行分析.分别称得锥形瓶与棉花的质量为44.1g,生铁样品的质量为9.0g.在锥形瓶中加入足量稀硫酸后,立即开始记录电子天平的示数,记录数据如图2.
请认真分析数据,回答下列问题:
(1)小军数据处理的图象中正确的是图3的________。 ??
?
(2)计算样品中铁的质量分数。
参考答案
1.D
2.D
3.A
4.C
5.D
6.(1)Fe+CuSO4=FeSO4+Cu(合理即可)(2)氧气、水蒸气(3)mb>ma>mc
7.(1)H2?CO、CuO (2)3.2 (3)8.3
8.①Fe+CuSO4═FeSO4+Cu ②BCE
9.(1)Mg(Zn)? (2)B? (3)黑色消失,铜丝恢复红色(恢复明亮)
10.(1)Fe;CO2+Ca(OH)2=CaCO3↓+H2O(2)防止生成的铁被空气中的氧气氧化(3)C
11.(1)(2)U型管中红墨水液面左边低,右边高(3)A (4)镀锌铁皮的面积与金属锌的密度
12.(1)A>B>C (2)Ag;蒸发结晶 (3)Mn+H2SO4=MnSO4+H2↑
13.(1)BC?????????
(2)设原混合溶液中CuSO4的质量分数为X
Fe+CuSO4=FeSO4+Cu
160 ?????64
100gX????12.8g ??????
160/100gX =64/12.8g ? X=32%
(1)Cu;17.4(2)44%
设40g稀硫酸中硫酸的质量为x
H2SO4+Zn═ZnSO4+H2↑
98 ?65
x??2.6g
98/x=65/2.6g
解得:x=3.92g
稀硫酸中硫酸的质量分数为:3.92g40g×100%=9.8%
设需要质量分数为98%浓硫酸的质量为Y
则100g×9.8%=Y×98%,解得;Y=10g
(1)B(2)设反应的铁的质量为x
Fe+H2SO4═FeSO4+H2↑
56? ? ?2
x? ? ?0.3g
56/x=2/0.3g??x=8.4g
铁的质量分数为:8.4g/9g?×100%=93.3%
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
