人教版高二化学选修三及选修四复习建议 课件(共39张ppt)
文档属性
| 名称 | 人教版高二化学选修三及选修四复习建议 课件(共39张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-13 22:54:42 | ||
图片预览




文档简介
(共39张PPT)
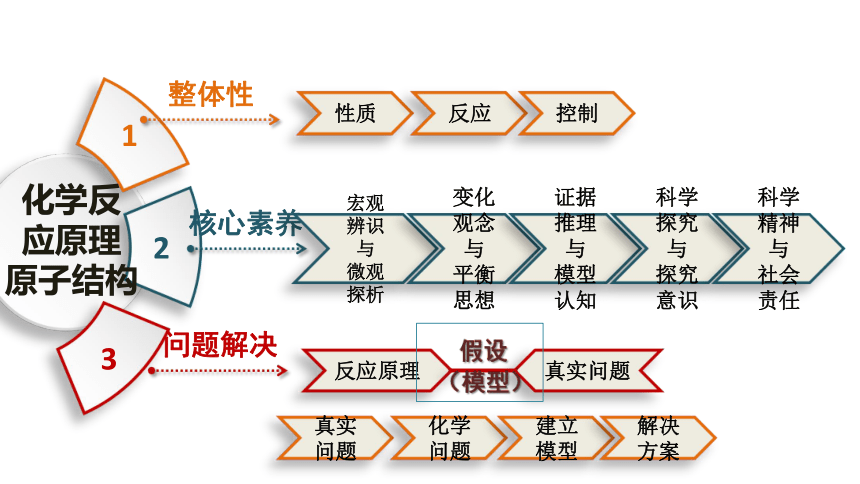
高二化学期末复习建议
性质
1
3
2
整体性
核心素养
问题解决
化学反
应原理
原子结构
反应
控制
宏观辨识
与
微观探析
变化
观念
与
平衡思想
证据推理
与
模型认知
反应原理
真实问题
科学探究与
探究意识
假设
(模型)
真实问题
化学问题
建立模型
解决方案
科学精神与
社会责任
复习建议
整体把握,落实重点知识方法
(整理与提升、书后作业)
形成策略,发展学科核心素养
(方法模型、思维程序)
普通高中化学课程标准(2020年修正版)
主题1:化学反应与能量
主题
内容要求
学业要求
1.3化学反应与能量
1.1
体系与能量
认识化学能可以与热能、电能等其他形式能量之间相互转化,能
量的转化遵循能量守恒定律。知道内能是体系内物质的各种能量的总
和,受温度、压强、物质的聚集状态的影响。
1.2
化学反应与热能
认识化学能与热能的相互转化,恒温恒压条件下化学反应的反应
热可以用焓变表示,了解盖斯定律及其简单应用。
1.3
化学反应与电能
认识化学能与电能相互转化的实际意义及其重要应用。了解原电
池及常见化学电源的工作原理。了解电解池的工作原理,认识电解在
实现物质转化和储存能量中的具体应用。了解金属发生电化学腐蚀的
本质,知道金属腐蚀的危害,了解防止金属腐蚀的措施。。
能辨识化学反应中的能量转化形式,能解释化学反应中能量
变化的本质。
2.
能进行反应焓变的简单计算,能用热化学方程式表示反应中
的能量变化,能运用反应焓变合理选择和利用化学反应。
3.
能分析、解释原电池和电解池的工作原理,能设计简单的原
电池和电解池。
4.
能列举常见的化学电源,并能利用相关信息分析化学电源的
工作原理。能利用电化学原理解释金属腐蚀现象,选择并设计防腐
措施。
5.
能举例说明化学在解决能源危机中的重要作用,能分析能源
的利用对自然环境和社会发展的影响。能综合考虑化学变化中的物质
变化和能量变化来分析、解决实际问题,如煤炭的综合利用、新型电
池的开发等。
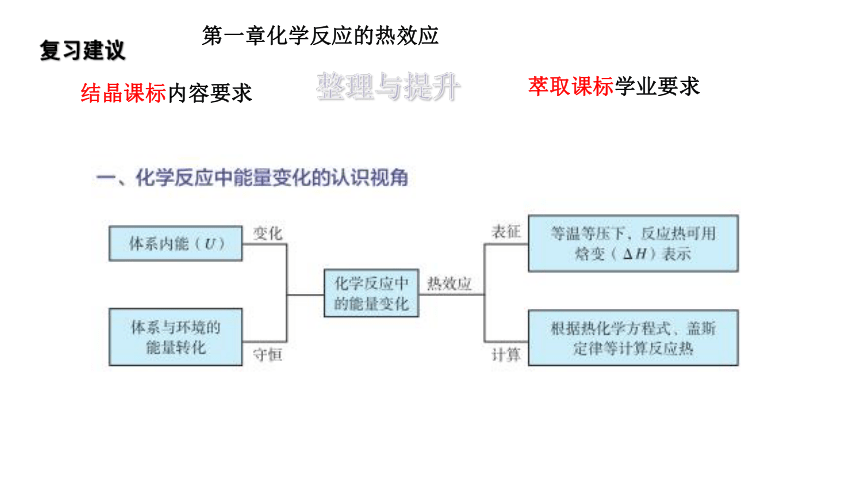
第一章化学反应的热效应
复习建议
整理与提升
结晶课标内容要求
萃取课标学业要求
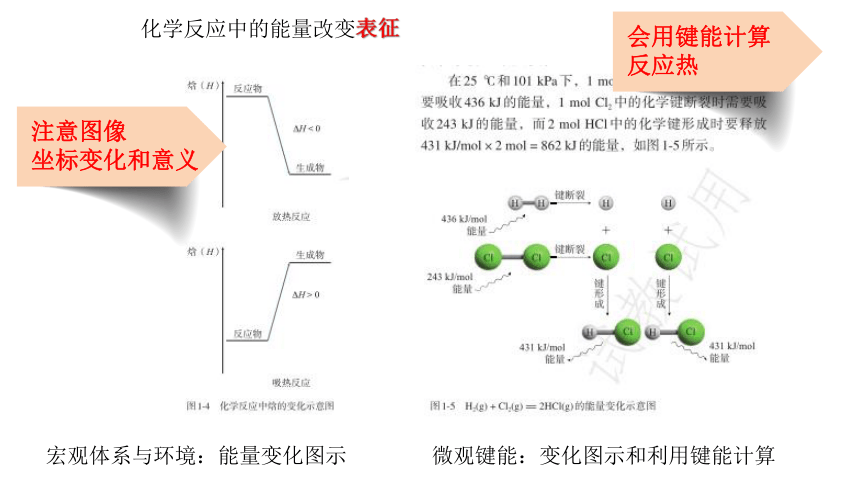
化学反应中的能量改变表征
宏观体系与环境:能量变化图示
微观键能:变化图示和利用键能计算
注意图像
坐标变化和意义
会用键能计算
反应热
根据热化学方程式、盖斯定律计算反应热
会用盖斯定律
计算反应热
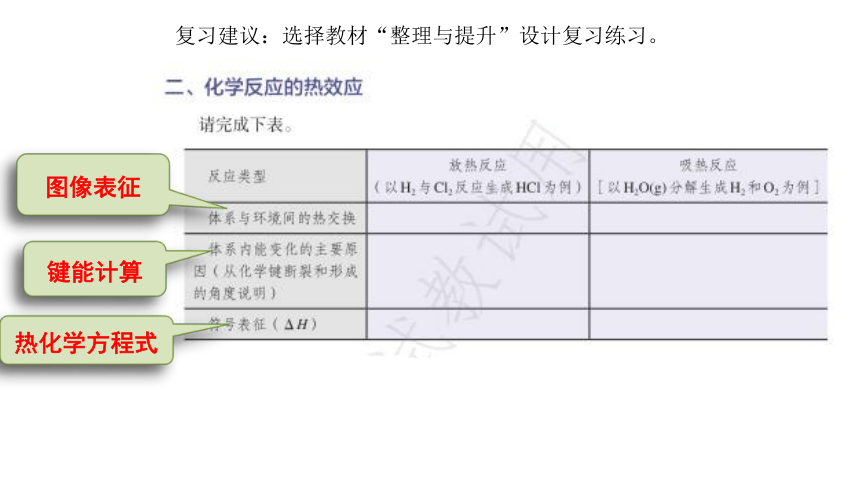
复习建议:选择教材“整理与提升”设计复习练习。
图像表征
键能计算
热化学方程式
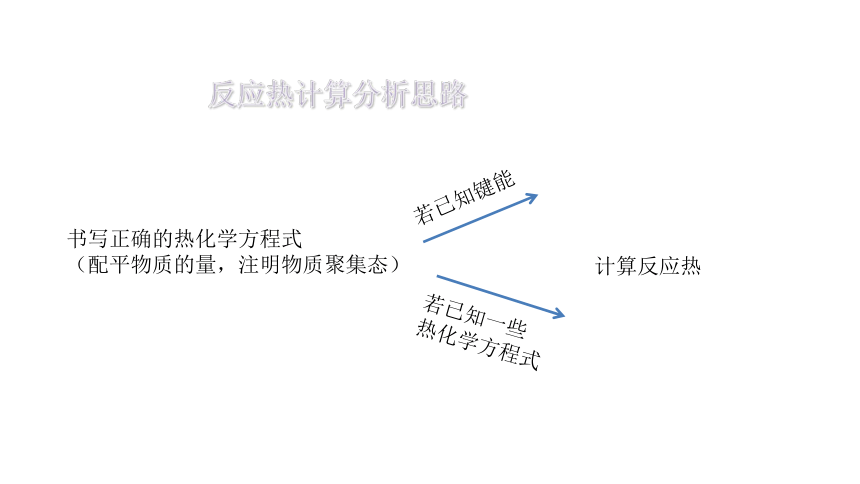
反应热计算分析思路
书写正确的热化学方程式
(配平物质的量,注明物质聚集态)
若已知键能
若已知一些
热化学方程式
计算反应热
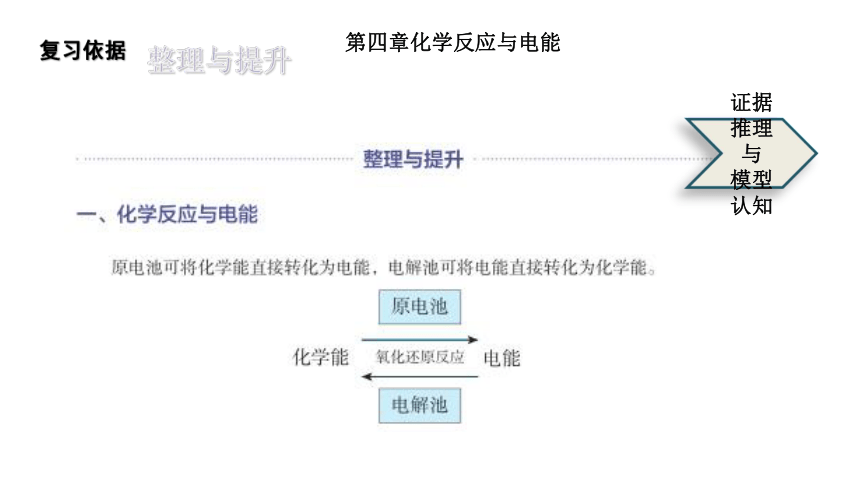
第四章化学反应与电能
复习依据
整理与提升
证据推理
与
模型认知
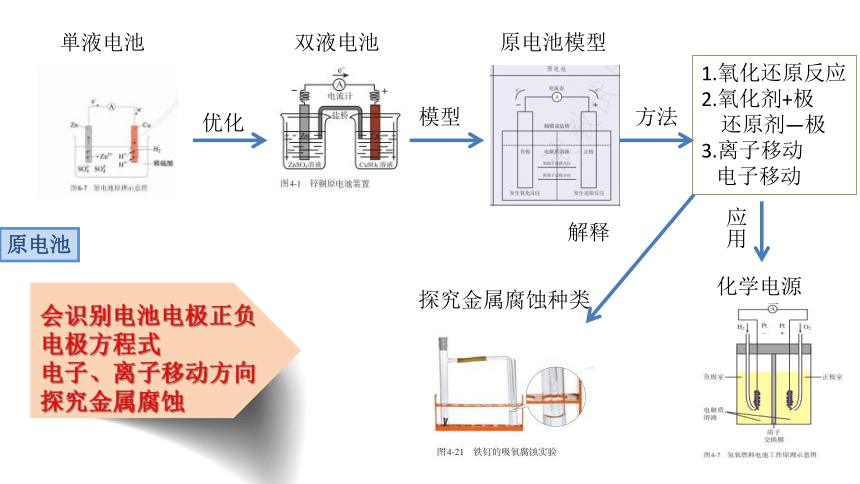
単液电池
双液电池
优化
模型
原电池模型
方法
1.氧化还原反应
2.氧化剂+极
还原剂—极
3.离子移动
电子移动
应用
化学电源
会识别电池电极正负
电极方程式
电子、离子移动方向
探究金属腐蚀
原电池
解释
探究金属腐蚀种类
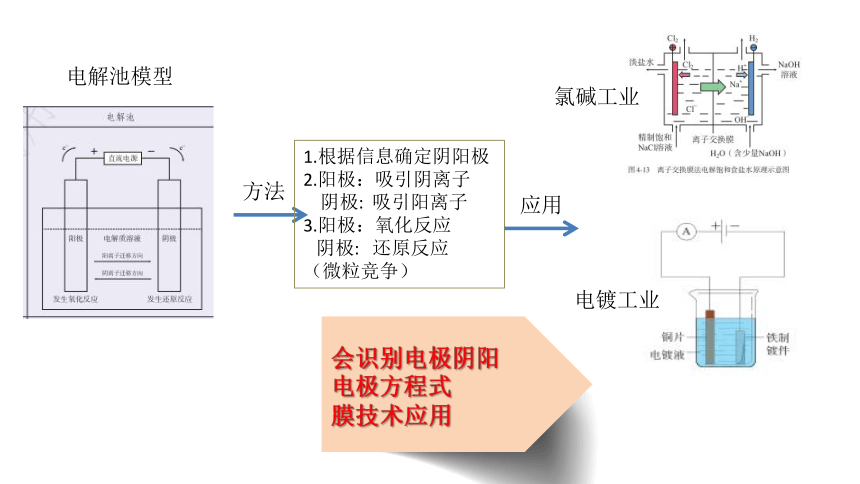
电解池模型
方法
1.根据信息确定阴阳极
2.阳极:吸引阴离子
阴极:
吸引阳离子
3.阳极:氧化反应
阴极:
还原反应
(微粒竞争)
应用
氯碱工业
电镀工业
会识别电极阴阳
电极方程式
膜技术应用
第四章化学反应与电能
复习依据
整理与提升
原电池
电解池
电子
负极
正极
电解质溶液
阴离子
阳离子
阳极
阴极
电解质溶液
阴离子
阳离子
+电源-
电极反应
化学能
电能
氧化反应
还原反应
方法导引
系统
原电池和电解池
电化学过程的系统
电化学分析思路
关注电极
微粒种类
性质
浓度
氧化剂、还原剂
原电池
电解池
分析
环境
明确
反应
关注
竞争
电极反应表征
普通高中化学课程标准(2020年修正版)
主题2
:化学反应的方向、限度和速率
主题
内容要求
学业要求
2.1
化学反应的方向与限度
2.2
化学反应速率
2.3
化学反应的调控
2.1
化学反应的方向与限度
知道化学反应是有方向的,知道化学反应的方向与反应的焓变和
熵变有关。认识化学平衡常数是表征反应限度的物理量,了解浓度商和化学平衡常数的相对大小与反应方向
间的联系。通过实验探究,了解浓度、压强、温度对化学平衡状态的
影响。
2.2
化学反应速率
知道化学反应速率的表示方法,了解测定化学反应速率的简单方
法。通过实验探究,了解温度、浓度、压强和催化剂对化学反应速率
的影响。知道化学反应是有历程的,认识基元反应活化能对化学反应
速率的影响。
2.3
化学反应的调控
认识化学反应速率和化学平衡的综合调控在生产、生活和科学研
究中的重要作用。知道催化剂可以改变反应历程,对调控化学反应速
率具有重要意义。。
能书写平衡常数表达式,能进行平衡常数、转化率的简单计
算,能利用平衡常数和浓度商的关系判断化学反应是否达到平衡及平
衡移动的方向。
2.
能运用浓度、压强、温度对化学平衡的影响规律,推测平衡
移动方向及浓度、转化率等相关物理量的变化,能讨论化学反应条
件的选择和优化。
3.
能进行化学反应速率的简单计算,能通过实验探究分析不同
组分浓度改变对化学反应速率的影响,能用一定的理论模型说明外界
条件改变对化学反应速率的影响。
4.
能运用温度、浓度、压强和催化剂对化学反应速率的影响规
律解释生产、生活、实验室中的实际问题,能讨论化学反应条件的选
择和优化。
5.
针对典型案例,能从限度、速率等角度对化学反应和化工生
产条件进行综合分析。
主题2
:化学反应的方向、限度和速率
化学反应速率计算
外界条件对化学反应速率的影响
平衡状态
平衡常数
平衡移动
平衡计算
能讨论化学反应条件的选
择和优化
能从限度、速率等角度对化学反应和化工生
产条件进行综合分析
平衡图像的认识
(1)转化率
转化率有两种表述,一是即时转化率;(相同时间内不同的几个温度下测试转化率打点描线)二是平衡转化率(单调函数图)
(2)温度对反应的影响
温度对反应速率影响是单一的,温度高速率快
温度对平衡的影响是复杂的,要以反应的焓变为依据
转化率和平衡转化
率的图像辨识
在容积不同的密闭容器内,分别充入
等量的N2和H2,在不同温度下,任其发生
反应
N2(g)+3H2(g)
2NH3(g),
并分别在t秒时测定其中NH3的体积分数,
绘图如右图所示:
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是______________。
(2)此可逆反应的正反应是________反应(填“放热”或“吸热”)。
(3)解释AC段的曲线是增函数,CE段曲线是减函数,原因:__________________。
(1)AB
(2)放热
(3)AC:反应开始v正>v逆,反应向右进行生成NH3;CE:已达平衡,升温使平衡左移,
NH3的体积分数减小
物质和环境
微观粒子
相互作用
先后?
主次?
方向
速率
限度
生产效益
的最大化
转化率
工业和实验探究——
调控反应的思维模型
1
目的
3
角度
2
体系
预测
优化
竞争
压强
浓度
温度
催化剂
4
外因
从微粒看:溶液体系中有Fe3+和SO2
从性质看:发生两个反应体系
从平衡看:有两个平衡体系
溶液体系中存在多反应,多平衡体系
基于实验事实溶液最终变浅绿色,说明反应2进行的更完全,由此颜色变化原因可以认为反应1为研究平衡移动的对象,而反应2就是造成反应1移动的环境条件
可见复杂体系中相互影响的原理分析:
2Fe3+
+
SO2
+
2H2O
=
2Fe2++SO42-
+4H+
反应1达到平衡时,反应2仍未达到平衡,在建立平衡过程中,不断消耗反应1
的反应物,使反应1逆向移动,从而使溶液最终由红色变浅绿色。
1
多微粒
2
多平衡
3
变条件
4
平衡争
真实反应
结论
证据
转化
性质
微粒
组成
多种
类型
化学学科
的研究内容
溶质
相互作用
溶剂
+环境+
现象
结论
理论
解释
SO
酸碱
氧还
沉淀
络合
探究实验中实验方法理解与应用
环境对速率和平衡体系的作用
反应体系对速率和平衡影响
多平衡体系之间的相互作用
体系内的微粒组成决定物质性质
性质是反应的前提,反应是多样的
条件可以改变性质强弱
反应是可以控制的(应用)
普通高中化学课程标准(2020年修改版)
主题3:水溶液中的离子反应与平衡
主题
内容要求
学业要求
3.1电解质在水溶液中的行为
3.2电离平衡
3.3水解平衡
3.4沉淀溶解平衡
3.5离子反应与平衡的应用
从电离、离子反应、化学平衡的角度认识电解质水溶液的组成。
认识弱电解质在水溶液中存在电离平衡,了解电离平衡常数的含义。认识水的电离,了解水的离子积常数,认识溶液的酸碱性及pH,掌握检测溶液pH的方法。
认识盐类水解的原理和影响盐类水解的主要因素。
认识难溶电解质在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解与转化。
了解水溶液中的离子反应与平衡在物质检测、化学反应规律研究、物质转化中的应用。了解溶液pH的调控在工农业生产和科学研究中的应用。
1.能用化学用语正确表示水溶液中的离子反应与平衡,能通过实验证明水溶液中存在的离子平衡,能举例说明离子反应与平衡在生产、生活中的应用。
2.能从电离、离子反应、化学平衡的角度分析溶液的性质,如酸碱性、导电性等。
3.能进行溶液pH的简单计算,能正确测定溶液pH,能调控溶液的酸碱性。能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
4.能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题。
整理与提升
第三章
水溶液中的离子反应和平衡
1
找微粒
2
建平衡
3
变条件
4
平衡动
溶液中微粒分析思路
1
多微粒
2
多平衡
3
变条件
4
平衡争
普通高中化学课程标准(2020年修正版)
主题2
:化学反应的方向、限度和速率
主题
内容要求
学业要求
1.1
原子核外电子的运动状态
1.2
核外电子排布规律
1.3
核外电子排布与元素周期律(表)
了解有关核外电子运动模型的历史发展过程,认识核外电子的运动特点。知道电子运动的能量状态具有量子化的特征(能量不连续),电子可以处于不同的能级,在一定条件下会发生激发与跃迁。
知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
知道原子核外电子的能级高低顺序,了解原子核外电子排布的构造原理,认识基态原子中核外电子的排布遵循能量最低原理、泡利不相容原理和洪特规则等。知道1
~
36号元素基态原子核外电子的排布。
认识元素的原子半径、第一电离能、电负性等元素性质的周期性变化,知道原子核外电子排布呈现周期性变化是导致元素性质周期性
变化的原因。知道元素周期表中分区、周期和族的元素原子核外电子排布特征,了解元素周期律(表)的应用价值。
1.
能说明微观粒子的运动状态与宏观物体运动特点的差异。
2.
能结合能量最低原理、泡利不相容原理、洪特规则书写1
~
36号元素基态原子的核外电子排布式和轨道表示式,并说明含义。
3.
能说出元素电离能、电负性的含义,能描述主族元素第一电离能、电负性变化的一般规律,能从电子排布的角度对这一规律进行解释。能说明电负性大小与原子在化合物中吸引电子能力的关系,能利用电负性判断元素的金属性与非金属性的强弱,推测化学键的极性。
4.
能从原子价电子数目和价电子排布的角度解释元素周期表的分区、周期和族的划分。能列举元素周期律(表)的应用。
5.
能说明建构思维模型在人类认识原子结构过程中的重要作用,能论证证据与模型建立及其发展之间的关系。能简要说明原子核外电子运动规律的理论探究对研究元素性质及其变化规律的意义。
主题1
:原子结构与元素的性质
律
第一章“原子结构与性质”知识的结构化
---教师用书
结构
位置
性质
原子结构
元素的性质
元素在元素
周期表中的位置
原子半径
第一电离能
电负性
化合价
原子
序数
1-36轨道表示式
S,p电子云形状
1-36号元素位置
对角线规则
电子排布式(简)
第一节
原子结构
教学重点和难点
教学重点:
(1)根据构造原理写出1-36号元素的基态原子的
电子排布式和轨道表示式;
(2)核外电子的运动状态,电子云与原子轨道;
(3)能量最低原理、泡利原理和洪特规则。
教学难点:
(1)基态、激发态与原子光谱;
(2)电子云与原子轨道。
原子轨道
球形
哑铃
1
3
相等
难点突破
g能级9个
(1)基态原子或离子的核外电子排布的表示方法
表示方法
举例
电子排布式
S:
1s22s22p63s23p4
简化电子排布式
[Ne]3s23p4(一般:原子实
+
价层电子排布)
轨道表达式
(电子排布图)
价层电子排布式
S:
3s23p4
1s
↑
↑↓
↑↓
↑
↑
2s
2p
N
对比易混淆的内容
核外电子的排布规律
在一个原子轨道里,最多只能容纳2个电子,
它们的自旋相反
泡利原理
洪特规则
洪特规则
特例
能量最低
原理
在构建基态原子时,电子将尽可能占据能量最低的原子轨道,使原子的整体能量最低。
当能量相同的原子轨道在全充满(如p6、d10)、
半充满(如p3、d5)和全空(如p0、d0)状态时,体系的能量较低。
基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
原子实
Na
1s22s22p63s1
Na
[Ne]3s1
学生活动:电子排布式可以简化,如Na的电子排布式可以写成[Ne]3s1。
请分析[Ne]表达的含义,并仿照该式写出14Si和22Ti的简化电子排布式。
分析该表示方法的优点。
原子实外的电子称为价层电子,决定元素的化学性质。
稀有气体的原子序数
非常重要!
+价层电子排布式
核外电子的简化电子排布式
[前一周期稀有气体原子符号]
教学重点:元素的原子结构与元素周期表结构的关系;
元素的原子半径、第一电离能和电负性的周期性变化。
教学难点:元素周期表的分区(删?);
电离能、电负性的含义以及与元素其他性质的关系
。
第二节
原子结构与元素的性质
教师用书
对角线规则
在元素周期表中,某些主族元素与右下方的主族元素的有些性质相似。
化学性质最相似的邻族元素
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,
基态S原子电子占据最高能级的电子云轮廓图为_________形。
哑铃
答案:
(1)
Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能
I1(Zn)________I1(Cu)(填“大于”或“小于”)。原因是____________
___________________________________________________________。
答案: 大于 Zn核外电子排布为全满稳定结构,较难失电子
30号
35
.
(1)基态Ti原子的核外电子排布式为____________。
(3)CaTiO3的组成元素的电负性大小顺序是__________。
答案:(1)1s22s22p63s23p63d24s2
(3)O>Ti>Ca
35
.
(1)H、B、N中,原子半径最大的是______。根据对角线规则,B的一些化学性质与元素______的相似。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ),电负性大小顺序是__________。
答案:(1)B
Si(硅)
(3)N>H>B
22号
4.
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电
子排布式为4f66s2,Sm3+的价层电子排布式为__________。
(3)比较离子半径:F?_____O2?(填“大于”等于”或“小于”)。
答案(2)4s
4f5
(3)小于
5.
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,
该元素基态原子核外
M层电子的自旋状态_________(填“相
同”或“相反”)。
(4)NH4H2PO4中,电负性最高的元素是______;
答案(1)Mg
相反
(4)O
对角线规则
高二化学期末复习建议
性质
1
3
2
整体性
核心素养
问题解决
化学反
应原理
原子结构
反应
控制
宏观辨识
与
微观探析
变化
观念
与
平衡思想
证据推理
与
模型认知
反应原理
真实问题
科学探究与
探究意识
假设
(模型)
真实问题
化学问题
建立模型
解决方案
科学精神与
社会责任
复习建议
整体把握,落实重点知识方法
(整理与提升、书后作业)
形成策略,发展学科核心素养
(方法模型、思维程序)
普通高中化学课程标准(2020年修正版)
主题1:化学反应与能量
主题
内容要求
学业要求
1.3化学反应与能量
1.1
体系与能量
认识化学能可以与热能、电能等其他形式能量之间相互转化,能
量的转化遵循能量守恒定律。知道内能是体系内物质的各种能量的总
和,受温度、压强、物质的聚集状态的影响。
1.2
化学反应与热能
认识化学能与热能的相互转化,恒温恒压条件下化学反应的反应
热可以用焓变表示,了解盖斯定律及其简单应用。
1.3
化学反应与电能
认识化学能与电能相互转化的实际意义及其重要应用。了解原电
池及常见化学电源的工作原理。了解电解池的工作原理,认识电解在
实现物质转化和储存能量中的具体应用。了解金属发生电化学腐蚀的
本质,知道金属腐蚀的危害,了解防止金属腐蚀的措施。。
能辨识化学反应中的能量转化形式,能解释化学反应中能量
变化的本质。
2.
能进行反应焓变的简单计算,能用热化学方程式表示反应中
的能量变化,能运用反应焓变合理选择和利用化学反应。
3.
能分析、解释原电池和电解池的工作原理,能设计简单的原
电池和电解池。
4.
能列举常见的化学电源,并能利用相关信息分析化学电源的
工作原理。能利用电化学原理解释金属腐蚀现象,选择并设计防腐
措施。
5.
能举例说明化学在解决能源危机中的重要作用,能分析能源
的利用对自然环境和社会发展的影响。能综合考虑化学变化中的物质
变化和能量变化来分析、解决实际问题,如煤炭的综合利用、新型电
池的开发等。
第一章化学反应的热效应
复习建议
整理与提升
结晶课标内容要求
萃取课标学业要求
化学反应中的能量改变表征
宏观体系与环境:能量变化图示
微观键能:变化图示和利用键能计算
注意图像
坐标变化和意义
会用键能计算
反应热
根据热化学方程式、盖斯定律计算反应热
会用盖斯定律
计算反应热
复习建议:选择教材“整理与提升”设计复习练习。
图像表征
键能计算
热化学方程式
反应热计算分析思路
书写正确的热化学方程式
(配平物质的量,注明物质聚集态)
若已知键能
若已知一些
热化学方程式
计算反应热
第四章化学反应与电能
复习依据
整理与提升
证据推理
与
模型认知
単液电池
双液电池
优化
模型
原电池模型
方法
1.氧化还原反应
2.氧化剂+极
还原剂—极
3.离子移动
电子移动
应用
化学电源
会识别电池电极正负
电极方程式
电子、离子移动方向
探究金属腐蚀
原电池
解释
探究金属腐蚀种类
电解池模型
方法
1.根据信息确定阴阳极
2.阳极:吸引阴离子
阴极:
吸引阳离子
3.阳极:氧化反应
阴极:
还原反应
(微粒竞争)
应用
氯碱工业
电镀工业
会识别电极阴阳
电极方程式
膜技术应用
第四章化学反应与电能
复习依据
整理与提升
原电池
电解池
电子
负极
正极
电解质溶液
阴离子
阳离子
阳极
阴极
电解质溶液
阴离子
阳离子
+电源-
电极反应
化学能
电能
氧化反应
还原反应
方法导引
系统
原电池和电解池
电化学过程的系统
电化学分析思路
关注电极
微粒种类
性质
浓度
氧化剂、还原剂
原电池
电解池
分析
环境
明确
反应
关注
竞争
电极反应表征
普通高中化学课程标准(2020年修正版)
主题2
:化学反应的方向、限度和速率
主题
内容要求
学业要求
2.1
化学反应的方向与限度
2.2
化学反应速率
2.3
化学反应的调控
2.1
化学反应的方向与限度
知道化学反应是有方向的,知道化学反应的方向与反应的焓变和
熵变有关。认识化学平衡常数是表征反应限度的物理量,了解浓度商和化学平衡常数的相对大小与反应方向
间的联系。通过实验探究,了解浓度、压强、温度对化学平衡状态的
影响。
2.2
化学反应速率
知道化学反应速率的表示方法,了解测定化学反应速率的简单方
法。通过实验探究,了解温度、浓度、压强和催化剂对化学反应速率
的影响。知道化学反应是有历程的,认识基元反应活化能对化学反应
速率的影响。
2.3
化学反应的调控
认识化学反应速率和化学平衡的综合调控在生产、生活和科学研
究中的重要作用。知道催化剂可以改变反应历程,对调控化学反应速
率具有重要意义。。
能书写平衡常数表达式,能进行平衡常数、转化率的简单计
算,能利用平衡常数和浓度商的关系判断化学反应是否达到平衡及平
衡移动的方向。
2.
能运用浓度、压强、温度对化学平衡的影响规律,推测平衡
移动方向及浓度、转化率等相关物理量的变化,能讨论化学反应条
件的选择和优化。
3.
能进行化学反应速率的简单计算,能通过实验探究分析不同
组分浓度改变对化学反应速率的影响,能用一定的理论模型说明外界
条件改变对化学反应速率的影响。
4.
能运用温度、浓度、压强和催化剂对化学反应速率的影响规
律解释生产、生活、实验室中的实际问题,能讨论化学反应条件的选
择和优化。
5.
针对典型案例,能从限度、速率等角度对化学反应和化工生
产条件进行综合分析。
主题2
:化学反应的方向、限度和速率
化学反应速率计算
外界条件对化学反应速率的影响
平衡状态
平衡常数
平衡移动
平衡计算
能讨论化学反应条件的选
择和优化
能从限度、速率等角度对化学反应和化工生
产条件进行综合分析
平衡图像的认识
(1)转化率
转化率有两种表述,一是即时转化率;(相同时间内不同的几个温度下测试转化率打点描线)二是平衡转化率(单调函数图)
(2)温度对反应的影响
温度对反应速率影响是单一的,温度高速率快
温度对平衡的影响是复杂的,要以反应的焓变为依据
转化率和平衡转化
率的图像辨识
在容积不同的密闭容器内,分别充入
等量的N2和H2,在不同温度下,任其发生
反应
N2(g)+3H2(g)
2NH3(g),
并分别在t秒时测定其中NH3的体积分数,
绘图如右图所示:
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是______________。
(2)此可逆反应的正反应是________反应(填“放热”或“吸热”)。
(3)解释AC段的曲线是增函数,CE段曲线是减函数,原因:__________________。
(1)AB
(2)放热
(3)AC:反应开始v正>v逆,反应向右进行生成NH3;CE:已达平衡,升温使平衡左移,
NH3的体积分数减小
物质和环境
微观粒子
相互作用
先后?
主次?
方向
速率
限度
生产效益
的最大化
转化率
工业和实验探究——
调控反应的思维模型
1
目的
3
角度
2
体系
预测
优化
竞争
压强
浓度
温度
催化剂
4
外因
从微粒看:溶液体系中有Fe3+和SO2
从性质看:发生两个反应体系
从平衡看:有两个平衡体系
溶液体系中存在多反应,多平衡体系
基于实验事实溶液最终变浅绿色,说明反应2进行的更完全,由此颜色变化原因可以认为反应1为研究平衡移动的对象,而反应2就是造成反应1移动的环境条件
可见复杂体系中相互影响的原理分析:
2Fe3+
+
SO2
+
2H2O
=
2Fe2++SO42-
+4H+
反应1达到平衡时,反应2仍未达到平衡,在建立平衡过程中,不断消耗反应1
的反应物,使反应1逆向移动,从而使溶液最终由红色变浅绿色。
1
多微粒
2
多平衡
3
变条件
4
平衡争
真实反应
结论
证据
转化
性质
微粒
组成
多种
类型
化学学科
的研究内容
溶质
相互作用
溶剂
+环境+
现象
结论
理论
解释
SO
酸碱
氧还
沉淀
络合
探究实验中实验方法理解与应用
环境对速率和平衡体系的作用
反应体系对速率和平衡影响
多平衡体系之间的相互作用
体系内的微粒组成决定物质性质
性质是反应的前提,反应是多样的
条件可以改变性质强弱
反应是可以控制的(应用)
普通高中化学课程标准(2020年修改版)
主题3:水溶液中的离子反应与平衡
主题
内容要求
学业要求
3.1电解质在水溶液中的行为
3.2电离平衡
3.3水解平衡
3.4沉淀溶解平衡
3.5离子反应与平衡的应用
从电离、离子反应、化学平衡的角度认识电解质水溶液的组成。
认识弱电解质在水溶液中存在电离平衡,了解电离平衡常数的含义。认识水的电离,了解水的离子积常数,认识溶液的酸碱性及pH,掌握检测溶液pH的方法。
认识盐类水解的原理和影响盐类水解的主要因素。
认识难溶电解质在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解与转化。
了解水溶液中的离子反应与平衡在物质检测、化学反应规律研究、物质转化中的应用。了解溶液pH的调控在工农业生产和科学研究中的应用。
1.能用化学用语正确表示水溶液中的离子反应与平衡,能通过实验证明水溶液中存在的离子平衡,能举例说明离子反应与平衡在生产、生活中的应用。
2.能从电离、离子反应、化学平衡的角度分析溶液的性质,如酸碱性、导电性等。
3.能进行溶液pH的简单计算,能正确测定溶液pH,能调控溶液的酸碱性。能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
4.能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题。
整理与提升
第三章
水溶液中的离子反应和平衡
1
找微粒
2
建平衡
3
变条件
4
平衡动
溶液中微粒分析思路
1
多微粒
2
多平衡
3
变条件
4
平衡争
普通高中化学课程标准(2020年修正版)
主题2
:化学反应的方向、限度和速率
主题
内容要求
学业要求
1.1
原子核外电子的运动状态
1.2
核外电子排布规律
1.3
核外电子排布与元素周期律(表)
了解有关核外电子运动模型的历史发展过程,认识核外电子的运动特点。知道电子运动的能量状态具有量子化的特征(能量不连续),电子可以处于不同的能级,在一定条件下会发生激发与跃迁。
知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
知道原子核外电子的能级高低顺序,了解原子核外电子排布的构造原理,认识基态原子中核外电子的排布遵循能量最低原理、泡利不相容原理和洪特规则等。知道1
~
36号元素基态原子核外电子的排布。
认识元素的原子半径、第一电离能、电负性等元素性质的周期性变化,知道原子核外电子排布呈现周期性变化是导致元素性质周期性
变化的原因。知道元素周期表中分区、周期和族的元素原子核外电子排布特征,了解元素周期律(表)的应用价值。
1.
能说明微观粒子的运动状态与宏观物体运动特点的差异。
2.
能结合能量最低原理、泡利不相容原理、洪特规则书写1
~
36号元素基态原子的核外电子排布式和轨道表示式,并说明含义。
3.
能说出元素电离能、电负性的含义,能描述主族元素第一电离能、电负性变化的一般规律,能从电子排布的角度对这一规律进行解释。能说明电负性大小与原子在化合物中吸引电子能力的关系,能利用电负性判断元素的金属性与非金属性的强弱,推测化学键的极性。
4.
能从原子价电子数目和价电子排布的角度解释元素周期表的分区、周期和族的划分。能列举元素周期律(表)的应用。
5.
能说明建构思维模型在人类认识原子结构过程中的重要作用,能论证证据与模型建立及其发展之间的关系。能简要说明原子核外电子运动规律的理论探究对研究元素性质及其变化规律的意义。
主题1
:原子结构与元素的性质
律
第一章“原子结构与性质”知识的结构化
---教师用书
结构
位置
性质
原子结构
元素的性质
元素在元素
周期表中的位置
原子半径
第一电离能
电负性
化合价
原子
序数
1-36轨道表示式
S,p电子云形状
1-36号元素位置
对角线规则
电子排布式(简)
第一节
原子结构
教学重点和难点
教学重点:
(1)根据构造原理写出1-36号元素的基态原子的
电子排布式和轨道表示式;
(2)核外电子的运动状态,电子云与原子轨道;
(3)能量最低原理、泡利原理和洪特规则。
教学难点:
(1)基态、激发态与原子光谱;
(2)电子云与原子轨道。
原子轨道
球形
哑铃
1
3
相等
难点突破
g能级9个
(1)基态原子或离子的核外电子排布的表示方法
表示方法
举例
电子排布式
S:
1s22s22p63s23p4
简化电子排布式
[Ne]3s23p4(一般:原子实
+
价层电子排布)
轨道表达式
(电子排布图)
价层电子排布式
S:
3s23p4
1s
↑
↑↓
↑↓
↑
↑
2s
2p
N
对比易混淆的内容
核外电子的排布规律
在一个原子轨道里,最多只能容纳2个电子,
它们的自旋相反
泡利原理
洪特规则
洪特规则
特例
能量最低
原理
在构建基态原子时,电子将尽可能占据能量最低的原子轨道,使原子的整体能量最低。
当能量相同的原子轨道在全充满(如p6、d10)、
半充满(如p3、d5)和全空(如p0、d0)状态时,体系的能量较低。
基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
原子实
Na
1s22s22p63s1
Na
[Ne]3s1
学生活动:电子排布式可以简化,如Na的电子排布式可以写成[Ne]3s1。
请分析[Ne]表达的含义,并仿照该式写出14Si和22Ti的简化电子排布式。
分析该表示方法的优点。
原子实外的电子称为价层电子,决定元素的化学性质。
稀有气体的原子序数
非常重要!
+价层电子排布式
核外电子的简化电子排布式
[前一周期稀有气体原子符号]
教学重点:元素的原子结构与元素周期表结构的关系;
元素的原子半径、第一电离能和电负性的周期性变化。
教学难点:元素周期表的分区(删?);
电离能、电负性的含义以及与元素其他性质的关系
。
第二节
原子结构与元素的性质
教师用书
对角线规则
在元素周期表中,某些主族元素与右下方的主族元素的有些性质相似。
化学性质最相似的邻族元素
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,
基态S原子电子占据最高能级的电子云轮廓图为_________形。
哑铃
答案:
(1)
Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能
I1(Zn)________I1(Cu)(填“大于”或“小于”)。原因是____________
___________________________________________________________。
答案: 大于 Zn核外电子排布为全满稳定结构,较难失电子
30号
35
.
(1)基态Ti原子的核外电子排布式为____________。
(3)CaTiO3的组成元素的电负性大小顺序是__________。
答案:(1)1s22s22p63s23p63d24s2
(3)O>Ti>Ca
35
.
(1)H、B、N中,原子半径最大的是______。根据对角线规则,B的一些化学性质与元素______的相似。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ),电负性大小顺序是__________。
答案:(1)B
Si(硅)
(3)N>H>B
22号
4.
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电
子排布式为4f66s2,Sm3+的价层电子排布式为__________。
(3)比较离子半径:F?_____O2?(填“大于”等于”或“小于”)。
答案(2)4s
4f5
(3)小于
5.
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,
该元素基态原子核外
M层电子的自旋状态_________(填“相
同”或“相反”)。
(4)NH4H2PO4中,电负性最高的元素是______;
答案(1)Mg
相反
(4)O
对角线规则
同课章节目录
