福建省师大附中11-12学年高二上学期期中考试化学
文档属性
| 名称 | 福建省师大附中11-12学年高二上学期期中考试化学 |

|
|
| 格式 | zip | ||
| 文件大小 | 74.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-28 00:00:00 | ||
图片预览




文档简介
福建师大附中2011-2012学年第一学期期中考试卷
高二 化学
(时间:90分钟 满分:100分)
一、选择题:(1-10每小题2分,11-20每小题3分,共50分)
下列说法不正确的是
A. 氢能、核能均是无污染的高效能源
B. 公共汽车大部分采用天然气作为燃料可减少对大气的污染
C. 把煤转化为液态燃料可提高煤的燃烧效率
D. 使用催化剂,能增大活化分子百分数,所以反应速率增大
2.下列关于化学反应速率的说法中,不正确的是
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示
C.在同一个反应中,各物质的反应速率之比等于化学方程式中的化学计量数之比
D.化学反应速率的常用单位有mol·L-1·S-1和mol/(L·min)
[来源:高[考∴试﹤题∴库]
3.在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
A.0.1 mol·L-1·min-1 B.0.3 mol·L-1·min-1
C.0.2 mol·L-1·min-1 D.0.6 mol·L-1·min-1
4.有甲、乙两个装置,下列说法错误的是
A.甲、乙装置中,Zn的质量均减小
B.甲、乙装置中,Cu上均有气泡产生
C.化学反应速率 乙 > 甲
D.甲中H+移向Zn,乙中SO42-移向Zn
5.下列关于化学反应的自发性叙述中正确的是
A.焓变小于零而熵变大于零的反应肯定是自发的[来源:学优高考网GkStK]
B.焓变和熵变都小于零的反应肯定是自发的
C.焓变和熵变都大于零的反应肯定是自发的
D.熵变小于零而焓变大于零的反应肯定是自发的
6.下列关于热化学反应的描述中正确的是
A.需要加热才能发生的反应一定是吸热反应[来源:学优高考网]
B.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则稀H2SO4和Ba(OH)2反应的中和热为ΔH=2×(-57.3) kJ/mol
C.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) 反应的ΔH=+2×283.0kJ/mol[来源:]
7. 下列事实不能用电化学原理解释的是
A.铝片不需要特殊的保护方法 B.炒过菜的铁锅未清洗易生锈。
C.轮船水线以下的船壳上镶有一定数量的锌 D. 镀锌铁比镀锡铁耐腐蚀。
8. 下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g); △H1 C(s)+1/2O2(g)===CO(g); △H2
②S(s)+O2(g)===SO2(g); △H3 S(g)+O2(g)===SO2(g); △H4
③H2(g)+1/2O2(g)===H2O(l); △H5 2H2(g)+O2(g)===2H2O(l); △H6
④CaCO3(s)===CaO(s)+CO2(g); △H7 CaO(s)+H2O(l)===Ca(OH)2(s); △H8
A.① B.④ C.②③④ D.①②③
9. 已知反应N2(g)+3H2(g) 2NH3(g);ΔH<0,向某体积恒定的密闭容器中按体积比1∶3充入N2和H2,在一定条件下发生反应。右图是某物理量(Y)随时间(t)变化的示意图,Y可以是
A.混合气体的密度
B.N2的转化率
C.H2的体积分数
D.密闭容器的压强
10.可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变[来源:学优高考网]
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
11.某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t3时降低了温度
B.t5时增大了压强
C.t4~t5时间内转化率最低
D.t2时加入了催化剂
12.某原电池总反应的离子方程式: 2Fe3+ + Fe=3Fe2+,不能实现该原理反应的原电池是
A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液
C.正极为Fe, 负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3溶液[来源:高[考∴试﹤题∴库]
13.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2—。下列对该燃料电池说法正确的是 A.在熔融电解质中,O2—由负极移向正极
B.电池的总反应是:2C4H10 + 13O2 8CO2 + 10H2O
C.通入空气的一极是负极,电极反应为:O2 + 4e— 2O2—
D.通入丁烷的一极是正极,电极反应为:C4H10 + 26e— + 13O2— 4CO2 + 5H2O
14.高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如
下:Ni(OH)2+MNiOOH+MH,下列叙述正确的是
A.放电时正极附近溶液的碱性增强
B.放电时负极反应为:M+H2O+e-MH+OH-
C.充电时阳极反应为:NiOOH+H2O+e-Ni(OH)2+OH-
D.放电时每转移1mol电子,正极有1mol NiOOH被氧化
15.已知某可逆反应,x A(g)y B(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器体积扩大到原来的两倍,再达到平衡时,测得A的浓度为0.3 mol/L。下列判断正确的是
A.x < y B.平衡向正反应方向进行
C.B的体积分数降低 D.缩小体积、增大压强,A的体积分数增大
16.电解硫酸铜溶液时,要求满足下列三点要求:①阳极质量逐渐减少;②阴极质量逐 渐增加; ③电解液中铜离子浓度不变。根据这三点要求可以选用的电极是 [来源:高[考∴试﹤题∴库GkStK]
A.石墨作阴极,纯铜作阳极
B.含有锌、银的铜合金作阴极,石墨作阳极
C.纯铁作阳极,纯铜作阴极
D.含有锌、银的铜合金作阳极,纯铜作阴极
17.某温度下在密闭容器中发生如下反应:2M(g)+ N(g) 2E(g),若开始时只充入2 mol E气体,达到平衡时,混合气体的压强比起始增大了20%;若开始时只充入了3 mol M和1 mol N的混合气体,达到平衡时M的转化率为
A.<60% B.=40% C.<40% D.>60%
18.恒温、体积为1L的密闭容器中,充入2molPCl3和1molCl2发生下述反应:
PCl3 (g)+ Cl2(g) PCl5 (g)
达到平衡时,PCl5为0.4mol。如果从体系中移走1molPCl3和0.5molCl2,重新达到平衡时,PCl5的物质的量为[来源:高[考∴试﹤题∴库GkStK]
A.0.15 mol B.0.2 mol C.0.24 mol D.0.48 mol
[来源:]
19.在某密闭容器中,可逆反应:A(g)+B(g) xC(g),符合下列图像(Ⅰ)所示关系。由此推断对图像(Ⅱ)的正确说法是
A.P3﹥P4 , y轴表示A的百分含量
B.P3﹤P4 , y轴表示B的百分含量
C.P3﹤P4 , y轴表示混合气体的密度
D.P3﹥P4 , y轴表示混合气体的平均相对分子质量
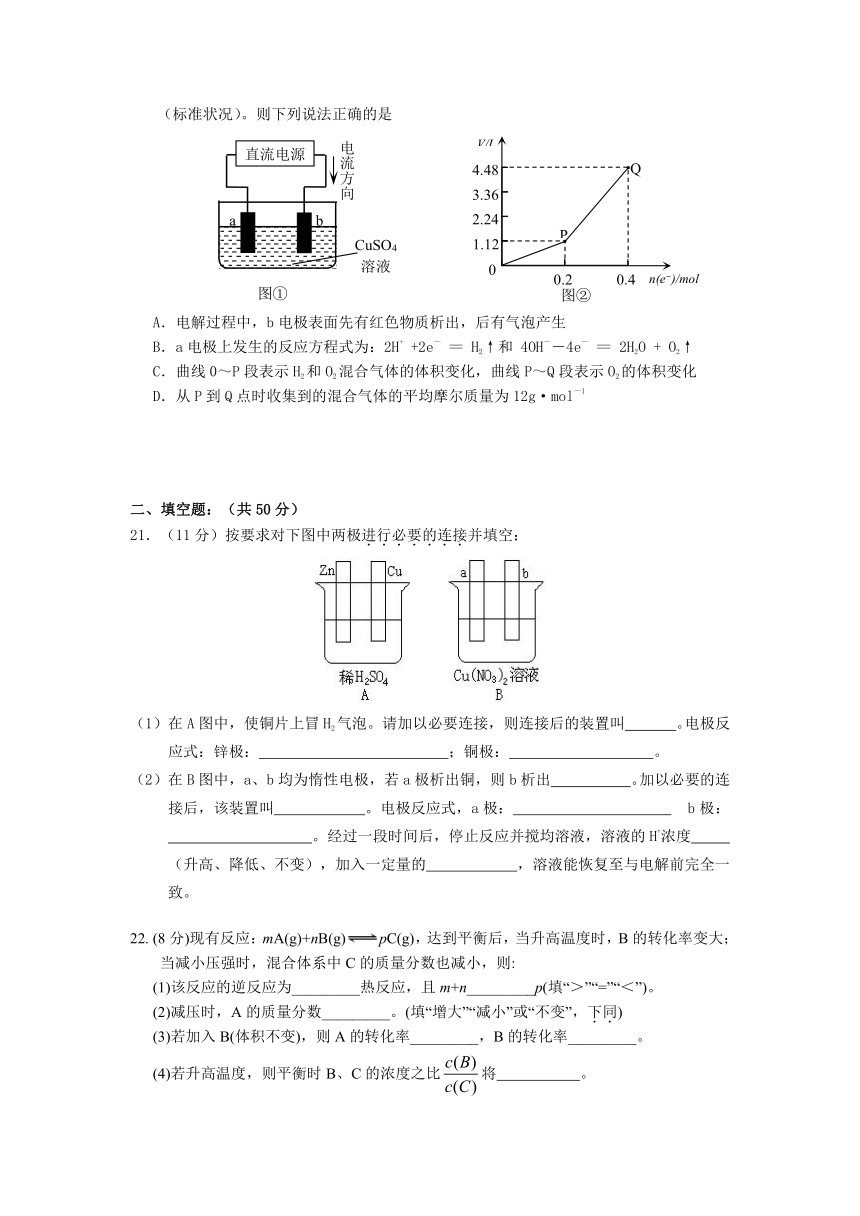
20.用惰性电极电解一定量的硫酸铜溶液,实验装置如图①。电解过程中的实验数据如图②,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法正确的是
A.电解过程中,b电极表面先有红色物质析出,后有气泡产生
B.a电极上发生的反应方程式为:2H+ +2e- = H2↑和 4OH--4e- = 2H2O + O2↑
C.曲线0~P段表示H2和O2混合气体的体积变化,曲线P~Q段表示O2的体积变化
D.从P到Q点时收集到的混合气体的平均摩尔质量为12g·mol-1
二、填空题:(共50分)
21.(11分)按要求对下图中两极进行必要的连接并填空:
(1)在A图中,使铜片上冒H2气泡。请加以必要连接,则连接后的装置叫 。电极反应式:锌极: ;铜极: 。
(2)在B图中,a、b均为惰性电极,若a极析出铜,则b析出 。加以必要的连接后,该装置叫 。电极反应式,a极: b极: 。经过一段时间后,停止反应并搅均溶液,溶液的H+浓度 (升高、降低、不变),加入一定量的 ,溶液能恢复至与电解前完全一致。
22. (8分)现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比将 。
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色 ;而维 持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”)。
23.(7分)某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子 质量为64)。
按照实验步骤依次回答下列问题:
⑴ 导线中电子流向为 (用a、b 表示)。
⑵ 写出装置中锌电极上的电极反应式: ;
⑶ 若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;[来源:学优高考网GkStK]
(不许用“NA”表示)
⑷ 装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向表述正确的是 。
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D. 盐桥中的K+、Cl-几乎都不移动
⑸ 若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B. Zn C. Fe D. H2SO4
24.(6分) 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。
(1)由图中数据分析:该反应的化学方程式为 。
(2)反应开始至2min,用Z表示的平均反应速率为
(3)判断:第5分钟时,反应是否达到平衡?_______(填“是”或“否”)。第5分钟时,Z的生成速率与Z的消耗速率相比_________(填”大”、“小”或“相等”)
25.(4分)(1)已知C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(g) △H1=a kJ·mol-1;
H2O(g)==H2O(1) △H2=b kJ·mol-1;
C2H5OH(g)==C2H5OH(1) △H3=c kJ·mol-1,
写出 C2H5OH(1)完全燃烧生成CO2(g)和H2O(1)的热化学方程式
(2)已知下列热化学方程式:
① H2(g)+1/2O2(g) =H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g) =CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH= kJ/moL
26.(14分)
(1)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)∶CO(g)+2H2(g)CH3OH(g).
根据题意和所给图象完成下列各题:
①反应达到平衡时,平衡常数表达式K= ,
②升高温度,K值 (填“增大”“减小”或“不变”)
(2)一定温度下,将3 mol A气体和1 mol B气体通入一密闭容器中,发生如下反 应:3A(g) + B(g) xC(g) 请填写下列空白:若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
①x=
②若反应经4 min达到平衡,平衡时C的浓度________ 0.8 mol/L(填“大于”、“等 于”或“小于”)。
③平衡混合物中,C的体积分数为22%,则B的转化率是______________。
(3)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
①合成氨反应N2 (g)+3H2(g)2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
②有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式 。
答案
1-20 ABCBA DACBC DCBAC AAADD
21.(11分)
(1)原电池。(1分)Zn→2e- +Zn2+;(1分)2H2+ +2e-→H2↑。(1分)
(2)O2。(1分)电解池(1分)Cu2++2e- →Cu (1分);
4OH—→4e-+O2↑+2H2O,(1分)。升高(1分)CuO(1分),
装置连接各1分
22.(8分)(每空1分)(1)放; > (2)增大 (3)增大; 减小
(4)减小 (5)变深; 变浅
23.(共7分)
⑴ 由a到b(或a→b);
⑵ Zn―2e―=Zn2+
⑶ 1.204×1022
⑷ B (有错不得分) ; [来源:学优高考网GkStK]
⑸ B (有错不得分)。
24.(6分)(1)3X+Y2Z (2分)
(2)0.05mol·L-1·min-1; (2分)
(3) 是 相等(2分)
25.(4分)(1)C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(g) △H1=a-c+3b kJ·mol-1
(2)131.3 (2分)
26.(14分)
(1)①
②减小
(2)①2(2分)
②<(2分)
③36﹪(2分)
(3)①向左; 不改变(2分)
②N2+8H++6e-=2NH4+ (2分)
高α考★试╗题γ库21世纪教育网
命题人:戴 萍
审核人:林 英
Y
0
t
T1
T2
t4
t5
t3
t2
t1
t0
v
v(逆)
v(正)
v(逆)
v(正)
t
v(逆)
v(正)
t6
充电
放电
a
b
直流电源
电流方向
图①
CuSO4
溶液
Q
4.48
3.36
2.24
0
0.2 0.4
n(e-)/mol
V/L
P
图②
1.12
高二 化学
(时间:90分钟 满分:100分)
一、选择题:(1-10每小题2分,11-20每小题3分,共50分)
下列说法不正确的是
A. 氢能、核能均是无污染的高效能源
B. 公共汽车大部分采用天然气作为燃料可减少对大气的污染
C. 把煤转化为液态燃料可提高煤的燃烧效率
D. 使用催化剂,能增大活化分子百分数,所以反应速率增大
2.下列关于化学反应速率的说法中,不正确的是
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示
C.在同一个反应中,各物质的反应速率之比等于化学方程式中的化学计量数之比
D.化学反应速率的常用单位有mol·L-1·S-1和mol/(L·min)
[来源:高[考∴试﹤题∴库]
3.在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
A.0.1 mol·L-1·min-1 B.0.3 mol·L-1·min-1
C.0.2 mol·L-1·min-1 D.0.6 mol·L-1·min-1
4.有甲、乙两个装置,下列说法错误的是
A.甲、乙装置中,Zn的质量均减小
B.甲、乙装置中,Cu上均有气泡产生
C.化学反应速率 乙 > 甲
D.甲中H+移向Zn,乙中SO42-移向Zn
5.下列关于化学反应的自发性叙述中正确的是
A.焓变小于零而熵变大于零的反应肯定是自发的[来源:学优高考网GkStK]
B.焓变和熵变都小于零的反应肯定是自发的
C.焓变和熵变都大于零的反应肯定是自发的
D.熵变小于零而焓变大于零的反应肯定是自发的
6.下列关于热化学反应的描述中正确的是
A.需要加热才能发生的反应一定是吸热反应[来源:学优高考网]
B.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则稀H2SO4和Ba(OH)2反应的中和热为ΔH=2×(-57.3) kJ/mol
C.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) 反应的ΔH=+2×283.0kJ/mol[来源:]
7. 下列事实不能用电化学原理解释的是
A.铝片不需要特殊的保护方法 B.炒过菜的铁锅未清洗易生锈。
C.轮船水线以下的船壳上镶有一定数量的锌 D. 镀锌铁比镀锡铁耐腐蚀。
8. 下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g); △H1 C(s)+1/2O2(g)===CO(g); △H2
②S(s)+O2(g)===SO2(g); △H3 S(g)+O2(g)===SO2(g); △H4
③H2(g)+1/2O2(g)===H2O(l); △H5 2H2(g)+O2(g)===2H2O(l); △H6
④CaCO3(s)===CaO(s)+CO2(g); △H7 CaO(s)+H2O(l)===Ca(OH)2(s); △H8
A.① B.④ C.②③④ D.①②③
9. 已知反应N2(g)+3H2(g) 2NH3(g);ΔH<0,向某体积恒定的密闭容器中按体积比1∶3充入N2和H2,在一定条件下发生反应。右图是某物理量(Y)随时间(t)变化的示意图,Y可以是
A.混合气体的密度
B.N2的转化率
C.H2的体积分数
D.密闭容器的压强
10.可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变[来源:学优高考网]
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
11.某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t3时降低了温度
B.t5时增大了压强
C.t4~t5时间内转化率最低
D.t2时加入了催化剂
12.某原电池总反应的离子方程式: 2Fe3+ + Fe=3Fe2+,不能实现该原理反应的原电池是
A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液
C.正极为Fe, 负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3溶液[来源:高[考∴试﹤题∴库]
13.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2—。下列对该燃料电池说法正确的是 A.在熔融电解质中,O2—由负极移向正极
B.电池的总反应是:2C4H10 + 13O2 8CO2 + 10H2O
C.通入空气的一极是负极,电极反应为:O2 + 4e— 2O2—
D.通入丁烷的一极是正极,电极反应为:C4H10 + 26e— + 13O2— 4CO2 + 5H2O
14.高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如
下:Ni(OH)2+MNiOOH+MH,下列叙述正确的是
A.放电时正极附近溶液的碱性增强
B.放电时负极反应为:M+H2O+e-MH+OH-
C.充电时阳极反应为:NiOOH+H2O+e-Ni(OH)2+OH-
D.放电时每转移1mol电子,正极有1mol NiOOH被氧化
15.已知某可逆反应,x A(g)y B(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器体积扩大到原来的两倍,再达到平衡时,测得A的浓度为0.3 mol/L。下列判断正确的是
A.x < y B.平衡向正反应方向进行
C.B的体积分数降低 D.缩小体积、增大压强,A的体积分数增大
16.电解硫酸铜溶液时,要求满足下列三点要求:①阳极质量逐渐减少;②阴极质量逐 渐增加; ③电解液中铜离子浓度不变。根据这三点要求可以选用的电极是 [来源:高[考∴试﹤题∴库GkStK]
A.石墨作阴极,纯铜作阳极
B.含有锌、银的铜合金作阴极,石墨作阳极
C.纯铁作阳极,纯铜作阴极
D.含有锌、银的铜合金作阳极,纯铜作阴极
17.某温度下在密闭容器中发生如下反应:2M(g)+ N(g) 2E(g),若开始时只充入2 mol E气体,达到平衡时,混合气体的压强比起始增大了20%;若开始时只充入了3 mol M和1 mol N的混合气体,达到平衡时M的转化率为
A.<60% B.=40% C.<40% D.>60%
18.恒温、体积为1L的密闭容器中,充入2molPCl3和1molCl2发生下述反应:
PCl3 (g)+ Cl2(g) PCl5 (g)
达到平衡时,PCl5为0.4mol。如果从体系中移走1molPCl3和0.5molCl2,重新达到平衡时,PCl5的物质的量为[来源:高[考∴试﹤题∴库GkStK]
A.0.15 mol B.0.2 mol C.0.24 mol D.0.48 mol
[来源:]
19.在某密闭容器中,可逆反应:A(g)+B(g) xC(g),符合下列图像(Ⅰ)所示关系。由此推断对图像(Ⅱ)的正确说法是
A.P3﹥P4 , y轴表示A的百分含量
B.P3﹤P4 , y轴表示B的百分含量
C.P3﹤P4 , y轴表示混合气体的密度
D.P3﹥P4 , y轴表示混合气体的平均相对分子质量
20.用惰性电极电解一定量的硫酸铜溶液,实验装置如图①。电解过程中的实验数据如图②,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法正确的是
A.电解过程中,b电极表面先有红色物质析出,后有气泡产生
B.a电极上发生的反应方程式为:2H+ +2e- = H2↑和 4OH--4e- = 2H2O + O2↑
C.曲线0~P段表示H2和O2混合气体的体积变化,曲线P~Q段表示O2的体积变化
D.从P到Q点时收集到的混合气体的平均摩尔质量为12g·mol-1
二、填空题:(共50分)
21.(11分)按要求对下图中两极进行必要的连接并填空:
(1)在A图中,使铜片上冒H2气泡。请加以必要连接,则连接后的装置叫 。电极反应式:锌极: ;铜极: 。
(2)在B图中,a、b均为惰性电极,若a极析出铜,则b析出 。加以必要的连接后,该装置叫 。电极反应式,a极: b极: 。经过一段时间后,停止反应并搅均溶液,溶液的H+浓度 (升高、降低、不变),加入一定量的 ,溶液能恢复至与电解前完全一致。
22. (8分)现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比将 。
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色 ;而维 持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”)。
23.(7分)某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子 质量为64)。
按照实验步骤依次回答下列问题:
⑴ 导线中电子流向为 (用a、b 表示)。
⑵ 写出装置中锌电极上的电极反应式: ;
⑶ 若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;[来源:学优高考网GkStK]
(不许用“NA”表示)
⑷ 装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向表述正确的是 。
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D. 盐桥中的K+、Cl-几乎都不移动
⑸ 若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B. Zn C. Fe D. H2SO4
24.(6分) 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。
(1)由图中数据分析:该反应的化学方程式为 。
(2)反应开始至2min,用Z表示的平均反应速率为
(3)判断:第5分钟时,反应是否达到平衡?_______(填“是”或“否”)。第5分钟时,Z的生成速率与Z的消耗速率相比_________(填”大”、“小”或“相等”)
25.(4分)(1)已知C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(g) △H1=a kJ·mol-1;
H2O(g)==H2O(1) △H2=b kJ·mol-1;
C2H5OH(g)==C2H5OH(1) △H3=c kJ·mol-1,
写出 C2H5OH(1)完全燃烧生成CO2(g)和H2O(1)的热化学方程式
(2)已知下列热化学方程式:
① H2(g)+1/2O2(g) =H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g) =CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH= kJ/moL
26.(14分)
(1)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)∶CO(g)+2H2(g)CH3OH(g).
根据题意和所给图象完成下列各题:
①反应达到平衡时,平衡常数表达式K= ,
②升高温度,K值 (填“增大”“减小”或“不变”)
(2)一定温度下,将3 mol A气体和1 mol B气体通入一密闭容器中,发生如下反 应:3A(g) + B(g) xC(g) 请填写下列空白:若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
①x=
②若反应经4 min达到平衡,平衡时C的浓度________ 0.8 mol/L(填“大于”、“等 于”或“小于”)。
③平衡混合物中,C的体积分数为22%,则B的转化率是______________。
(3)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
①合成氨反应N2 (g)+3H2(g)2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
②有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式 。
答案
1-20 ABCBA DACBC DCBAC AAADD
21.(11分)
(1)原电池。(1分)Zn→2e- +Zn2+;(1分)2H2+ +2e-→H2↑。(1分)
(2)O2。(1分)电解池(1分)Cu2++2e- →Cu (1分);
4OH—→4e-+O2↑+2H2O,(1分)。升高(1分)CuO(1分),
装置连接各1分
22.(8分)(每空1分)(1)放; > (2)增大 (3)增大; 减小
(4)减小 (5)变深; 变浅
23.(共7分)
⑴ 由a到b(或a→b);
⑵ Zn―2e―=Zn2+
⑶ 1.204×1022
⑷ B (有错不得分) ; [来源:学优高考网GkStK]
⑸ B (有错不得分)。
24.(6分)(1)3X+Y2Z (2分)
(2)0.05mol·L-1·min-1; (2分)
(3) 是 相等(2分)
25.(4分)(1)C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(g) △H1=a-c+3b kJ·mol-1
(2)131.3 (2分)
26.(14分)
(1)①
②减小
(2)①2(2分)
②<(2分)
③36﹪(2分)
(3)①向左; 不改变(2分)
②N2+8H++6e-=2NH4+ (2分)
高α考★试╗题γ库21世纪教育网
命题人:戴 萍
审核人:林 英
Y
0
t
T1
T2
t4
t5
t3
t2
t1
t0
v
v(逆)
v(正)
v(逆)
v(正)
t
v(逆)
v(正)
t6
充电
放电
a
b
直流电源
电流方向
图①
CuSO4
溶液
Q
4.48
3.36
2.24
0
0.2 0.4
n(e-)/mol
V/L
P
图②
1.12
同课章节目录
