人教版高中化学选修四1.1 化学反应与能量的变化(第一课时)课件 (22张)
文档属性
| 名称 | 人教版高中化学选修四1.1 化学反应与能量的变化(第一课时)课件 (22张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 255.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-15 00:00:00 | ||
图片预览







文档简介
第一章 化学反应与能量
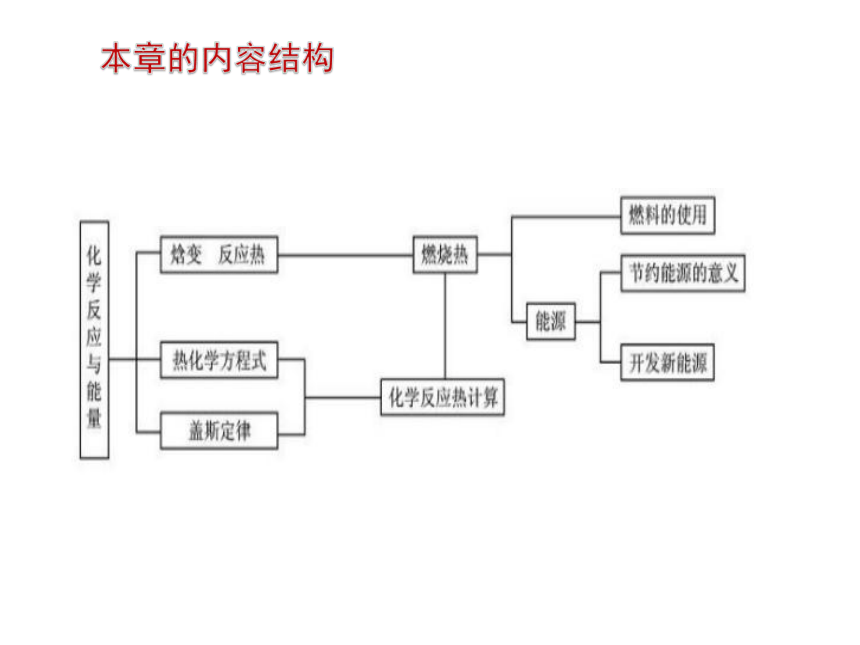
本章的内容结构
第一节 化学反应与能量的变化
学习目标
1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2、放热反应、反应热等概念。
3.了解热化学方程式的含义并能正确书写热化学方程式。
4.认识化学反应过程中同时存在着物质和能量的变化,能量的多少取决于反应物和生成物的量,反应过程中能量守恒。
重点:化学反应中的能量变化,热化学方程式的书写。
难点:焓变,ΔH的“+”与“-”,热化学方程式的书写。
1.化学反应都有新物质产生,同时还伴随着能量变化,请列举学过的有热量变化的相关反应。
2. 在这些反应中,哪些是我们日常生活中利用到的?
化学反应中所释放的能量——当今世界最重要的能源。
常见的放热反应:① 所有的燃烧反应② 所有的中和反应 ③活泼金属与水、酸的反应 ④多数的化合反应
常见的吸热反应: 多数的分解反应
C+CO2 =2CO C+H2O(g)=CO+H2
Ba(OH)2·8H2O+2NH4Cl =BaCl2+2NH3↑+10H2O
思考与交流
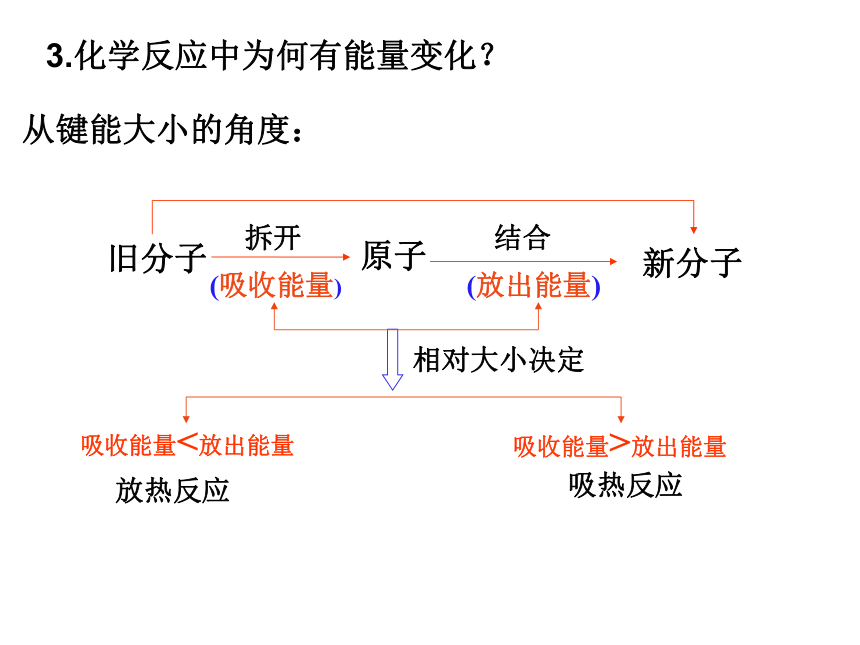
3.化学反应中为何有能量变化?
(吸收能量)
旧分子
拆开
原子
(放出能量)
新分子
结合
吸收能量<放出能量
吸收能量>放出能量
放热反应
吸热反应
相对大小决定
从键能大小的角度:
例如:H2+Cl2==2HCl
E断键=436 kJ/mol+243 kJ/mol=679 kJ/mol
E成键=2×431 kJ/mol=862 kJ/mol
E反应放出=862 kJ/mol-679 kJ/mol=183 kJ/mol
这一反应对外放出了183 KJ/mol热量
H
C
l
H
C
l
H
H
H
H
C
l
C
l
C
l
C
l
+
+
4
3
6
k
J
/
m
o
l
2
4
3
k
J
/
m
o
l
4
3
1
k
J
/
m
o
l
从能量守恒的角度:
E反应物总能量>E生成物总能量
E反应物总能量放热反应
吸热反应
产物的总能量
产物的总能量
一.反应热 焓变
概念:在化学反应过程中放出或吸收的热量,通常叫做反应热,又称焓变。
1.符号:△H
2.单位:kJ/mol 或kJ·mol-1
3.测量条件:一定压强下,敞口容器中发生的反应
5.产生原因:化学键断裂——吸热
化学键形成——放热
思考:如何用焓变来度量反应热的大小呢?
4.研究方法:a:实验法:直接测量反应热的仪器叫量热计 b:计算法
课堂探究
例如:H2+Cl2==2HCl
E反应放出=862 kJ/mol-679 kJ/mol=183 kJ/mol
这一反应对外放出了183 kJ/mol热量
H
C
l
H
C
l
H
H
H
H
C
l
C
l
C
l
C
l
+
+
4
3
6
k
J
/
m
o
l
2
4
3
k
J
/
m
o
l
4
3
1
k
J
/
m
o
l
△H=-183 kJ/mol
即:△H=∑反应物键能-∑产物键能
= E生成物总能量-E反应物总能量
放热反应
吸热反应
键能
变化
生成物总键能 反应物总键能
生成物总键能 反应物总键能
能量
变化
反应物的总能量 .生成物的总能量
反应物的总能量 .生成物的总能量
表现
行式
联系
键能越大,物质能量越低,越稳定;反之键能越小,物质能量越高,越不稳定。
大于
大于
△H﹤0或△H为“—”
小于
小于
△H﹥0或△H为“+”
在200℃、101kPa时,1molH2与碘蒸气作用生成HI的反应中,物质变化与能量变化的关系科学文献上表示为:
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol
200℃
101kPa
CH4 (g) + 2O2(g)=CO2(g) +2H2O(l) ΔH= — 890.31kJ/mol
1
2
CO (g) + O2(g)=CO2(g) ΔH= — 283.0kJ/mol
又如:
这几个式子与我们通常所见的方程式有何不同?
a:物质后面带有(g)、(l),有何涵义?
b:系数为什么可以是分数?
c:ΔH表示什么?mol-1是什么意思?
能量增加
1g液态水
1g气态水
熔化
蒸发
1g 冰
结论:物质所具有的能量与它们的聚集状态有关。即化学反应放出热量的多少与反应物、产物的状态有关。
a:物质后面带有(g)、(l),有何涵义?
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
2H2(g)+O2(g)=2H2O(l) △H=?
-571.6kJ/mol
1
2
CO (g) + O2(g)=CO2(g) ΔH= — 283.0kJ/mol
c:ΔH表示什么?mol-1是什么意思?
2CO(g)+O2(g)=2CO2(g) ΔH =?
ΔH单位中的mol-1是对应整个反应的,即反应热
表示每摩尔反应放出或吸收的热量。
如:2O2(g)+CH4(g)=CO2(g)+H2O(l) ΔH=-890.31kJ/mol
表示每2molO2(g)和1molCH4(g)反应生成1molCO2(g)和2molH2O(l)时放热890.31kJ。
b: 系数为什么可以是分数?
系数表示物质的物质的量而不是物质分子的个数
二、热化学方程式
能表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol
200℃
101kPa
热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。但物质变化是因,能量变化是果。
普通化学方程式只包含物质变化一个部分。
物质变化
能量变化
H2 ( g )+I2 ( g ) ==== 2HI ( g ) ΔH = -14.9 kJ/mol
200 ℃
101 kPa
1)要注明温度和压强(250C ,101kPa时不注明);
2)反应物和生成物要注明聚集状态(s、l、g、aq) ,热化学方程式中不再使用“↑”、“↓”等符号;
3)各物质前的化学计量数表示物质的量, 必要时可使用分数;
4)△H 的“+”与“-”一定要注明, 单位总是kJ/mol, 但△H 的数值与反应式中的系数成比例。且正逆反应的 ΔH绝对值相等,符号相反。
2H2 ( g )+2I2 ( g ) ==== 4HI ( g )
200 ℃
101 kPa
1、正确书写热化学方程式的注意事项
-29.8 kJ/mol
ΔH =
?
+14.9 kJ/mol
ΔH =
?
2HI( g ) ==== I2 ( g ) + H2 ( g )
200 ℃
101 kPa
2、热化学方程式表示的意义
1)、表示某状态的某物质参加反应,结果生成某状态的某物质。
2)、反应物和生成物之间的物质的量比。
3)、反应物完全变成生成物后所放出或吸收的热量。
总结:热化学方程式既表明了化学反应中的物质变化,
也表明了化学反应中的能量变化。
H2(g)+ O2(g)=====H2O(g) △H =-241.8 KJ/mol
[练习1] 1克甲烷在空气中燃烧,恢复常温下测得放出热量55.625KJ,试写出热化学方程式。
[练习2] 同温、同压下,比较Q1与Q2的大小:
S(g)+O2(g)==SO2(g) △H=- Q1 kJ/mol
S(s)+O2(g)==SO2(g) △H=- Q2 kJ/mol
Q1>Q2
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=- 890 kJ/mol
[练习3] 已知:
C(s)+O2(g)==CO2(g) △H=- 393.5 kJ/mol
要获得1000kJ热量,需燃烧多少克碳?
30.5克
[练习4] 已知:
S(s)+O2(g)=SO2(g) △H=- 290.6 kJ/mol
求1.6克硫燃烧成为SO2气体放出多少热量?
14.53kJ
3mol CH4燃烧时,生成液态水和CO2同时 放出2670.9KJ的热。请写出热化学方程式。
2. 常温下14克CO在足量氧气中充分燃烧,放出141.3KJ热量,写出该热化学方程式。
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=- 890.3 kJ/mol
CO(g)+ O2(g)=CO2(g) △H=- 282.6 kJ/mol
当堂检测
3. 已知在25℃,101kpa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,表示上述反应的热化学方程式正确的是 ( )
A.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g)
ΔH=-48.40 kJ·mol-1
B.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=-5518 kJ·mol-1
C.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=+5518 kJ·mol-1
D.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=-48.40 kJ·mol-1
B
4.白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ/mol、P—O bkJ/mol、 P=O ckJ/mol、O=O dkJ/mol,根据图示的分子结构和有关数据估算该反应的△H为 。
-(4c + 12b -6a -5d ) kJ/mol
本章的内容结构
第一节 化学反应与能量的变化
学习目标
1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2、放热反应、反应热等概念。
3.了解热化学方程式的含义并能正确书写热化学方程式。
4.认识化学反应过程中同时存在着物质和能量的变化,能量的多少取决于反应物和生成物的量,反应过程中能量守恒。
重点:化学反应中的能量变化,热化学方程式的书写。
难点:焓变,ΔH的“+”与“-”,热化学方程式的书写。
1.化学反应都有新物质产生,同时还伴随着能量变化,请列举学过的有热量变化的相关反应。
2. 在这些反应中,哪些是我们日常生活中利用到的?
化学反应中所释放的能量——当今世界最重要的能源。
常见的放热反应:① 所有的燃烧反应② 所有的中和反应 ③活泼金属与水、酸的反应 ④多数的化合反应
常见的吸热反应: 多数的分解反应
C+CO2 =2CO C+H2O(g)=CO+H2
Ba(OH)2·8H2O+2NH4Cl =BaCl2+2NH3↑+10H2O
思考与交流
3.化学反应中为何有能量变化?
(吸收能量)
旧分子
拆开
原子
(放出能量)
新分子
结合
吸收能量<放出能量
吸收能量>放出能量
放热反应
吸热反应
相对大小决定
从键能大小的角度:
例如:H2+Cl2==2HCl
E断键=436 kJ/mol+243 kJ/mol=679 kJ/mol
E成键=2×431 kJ/mol=862 kJ/mol
E反应放出=862 kJ/mol-679 kJ/mol=183 kJ/mol
这一反应对外放出了183 KJ/mol热量
H
C
l
H
C
l
H
H
H
H
C
l
C
l
C
l
C
l
+
+
4
3
6
k
J
/
m
o
l
2
4
3
k
J
/
m
o
l
4
3
1
k
J
/
m
o
l
从能量守恒的角度:
E反应物总能量>E生成物总能量
E反应物总能量
吸热反应
产物的总能量
产物的总能量
一.反应热 焓变
概念:在化学反应过程中放出或吸收的热量,通常叫做反应热,又称焓变。
1.符号:△H
2.单位:kJ/mol 或kJ·mol-1
3.测量条件:一定压强下,敞口容器中发生的反应
5.产生原因:化学键断裂——吸热
化学键形成——放热
思考:如何用焓变来度量反应热的大小呢?
4.研究方法:a:实验法:直接测量反应热的仪器叫量热计 b:计算法
课堂探究
例如:H2+Cl2==2HCl
E反应放出=862 kJ/mol-679 kJ/mol=183 kJ/mol
这一反应对外放出了183 kJ/mol热量
H
C
l
H
C
l
H
H
H
H
C
l
C
l
C
l
C
l
+
+
4
3
6
k
J
/
m
o
l
2
4
3
k
J
/
m
o
l
4
3
1
k
J
/
m
o
l
△H=-183 kJ/mol
即:△H=∑反应物键能-∑产物键能
= E生成物总能量-E反应物总能量
放热反应
吸热反应
键能
变化
生成物总键能 反应物总键能
生成物总键能 反应物总键能
能量
变化
反应物的总能量 .生成物的总能量
反应物的总能量 .生成物的总能量
表现
行式
联系
键能越大,物质能量越低,越稳定;反之键能越小,物质能量越高,越不稳定。
大于
大于
△H﹤0或△H为“—”
小于
小于
△H﹥0或△H为“+”
在200℃、101kPa时,1molH2与碘蒸气作用生成HI的反应中,物质变化与能量变化的关系科学文献上表示为:
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol
200℃
101kPa
CH4 (g) + 2O2(g)=CO2(g) +2H2O(l) ΔH= — 890.31kJ/mol
1
2
CO (g) + O2(g)=CO2(g) ΔH= — 283.0kJ/mol
又如:
这几个式子与我们通常所见的方程式有何不同?
a:物质后面带有(g)、(l),有何涵义?
b:系数为什么可以是分数?
c:ΔH表示什么?mol-1是什么意思?
能量增加
1g液态水
1g气态水
熔化
蒸发
1g 冰
结论:物质所具有的能量与它们的聚集状态有关。即化学反应放出热量的多少与反应物、产物的状态有关。
a:物质后面带有(g)、(l),有何涵义?
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
2H2(g)+O2(g)=2H2O(l) △H=?
-571.6kJ/mol
1
2
CO (g) + O2(g)=CO2(g) ΔH= — 283.0kJ/mol
c:ΔH表示什么?mol-1是什么意思?
2CO(g)+O2(g)=2CO2(g) ΔH =?
ΔH单位中的mol-1是对应整个反应的,即反应热
表示每摩尔反应放出或吸收的热量。
如:2O2(g)+CH4(g)=CO2(g)+H2O(l) ΔH=-890.31kJ/mol
表示每2molO2(g)和1molCH4(g)反应生成1molCO2(g)和2molH2O(l)时放热890.31kJ。
b: 系数为什么可以是分数?
系数表示物质的物质的量而不是物质分子的个数
二、热化学方程式
能表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol
200℃
101kPa
热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。但物质变化是因,能量变化是果。
普通化学方程式只包含物质变化一个部分。
物质变化
能量变化
H2 ( g )+I2 ( g ) ==== 2HI ( g ) ΔH = -14.9 kJ/mol
200 ℃
101 kPa
1)要注明温度和压强(250C ,101kPa时不注明);
2)反应物和生成物要注明聚集状态(s、l、g、aq) ,热化学方程式中不再使用“↑”、“↓”等符号;
3)各物质前的化学计量数表示物质的量, 必要时可使用分数;
4)△H 的“+”与“-”一定要注明, 单位总是kJ/mol, 但△H 的数值与反应式中的系数成比例。且正逆反应的 ΔH绝对值相等,符号相反。
2H2 ( g )+2I2 ( g ) ==== 4HI ( g )
200 ℃
101 kPa
1、正确书写热化学方程式的注意事项
-29.8 kJ/mol
ΔH =
?
+14.9 kJ/mol
ΔH =
?
2HI( g ) ==== I2 ( g ) + H2 ( g )
200 ℃
101 kPa
2、热化学方程式表示的意义
1)、表示某状态的某物质参加反应,结果生成某状态的某物质。
2)、反应物和生成物之间的物质的量比。
3)、反应物完全变成生成物后所放出或吸收的热量。
总结:热化学方程式既表明了化学反应中的物质变化,
也表明了化学反应中的能量变化。
H2(g)+ O2(g)=====H2O(g) △H =-241.8 KJ/mol
[练习1] 1克甲烷在空气中燃烧,恢复常温下测得放出热量55.625KJ,试写出热化学方程式。
[练习2] 同温、同压下,比较Q1与Q2的大小:
S(g)+O2(g)==SO2(g) △H=- Q1 kJ/mol
S(s)+O2(g)==SO2(g) △H=- Q2 kJ/mol
Q1>Q2
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=- 890 kJ/mol
[练习3] 已知:
C(s)+O2(g)==CO2(g) △H=- 393.5 kJ/mol
要获得1000kJ热量,需燃烧多少克碳?
30.5克
[练习4] 已知:
S(s)+O2(g)=SO2(g) △H=- 290.6 kJ/mol
求1.6克硫燃烧成为SO2气体放出多少热量?
14.53kJ
3mol CH4燃烧时,生成液态水和CO2同时 放出2670.9KJ的热。请写出热化学方程式。
2. 常温下14克CO在足量氧气中充分燃烧,放出141.3KJ热量,写出该热化学方程式。
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=- 890.3 kJ/mol
CO(g)+ O2(g)=CO2(g) △H=- 282.6 kJ/mol
当堂检测
3. 已知在25℃,101kpa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,表示上述反应的热化学方程式正确的是 ( )
A.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g)
ΔH=-48.40 kJ·mol-1
B.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=-5518 kJ·mol-1
C.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=+5518 kJ·mol-1
D.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=-48.40 kJ·mol-1
B
4.白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ/mol、P—O bkJ/mol、 P=O ckJ/mol、O=O dkJ/mol,根据图示的分子结构和有关数据估算该反应的△H为 。
-(4c + 12b -6a -5d ) kJ/mol
