苏教版(2019)高中化学必修第一册专题1物质的分类及计量专题练习
文档属性
| 名称 | 苏教版(2019)高中化学必修第一册专题1物质的分类及计量专题练习 |

|
|
| 格式 | docx | ||
| 文件大小 | 231.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-16 00:00:00 | ||
图片预览



文档简介
苏教版(2019)高中化学必修第一册专题1物质的分类及计量专题练习
一、单选题
1.设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24 L?H2O中含有的共价键数为0.2NA
B.标准状况下,4.48 L?的Cl2通入稀的NaOH溶液中反应,转移的电子数为0.4NA
C.m gD2O和H2O的混合物中共含有3.2g的氧原子,则混合物的总质子数为2NA
D.100 g?17%的H2O2水溶液中含有氢原子数为NA
2.下列说法正确的是
A.丁达尔效应是区分悬浊液和胶体最简单方法
B.非金属氧化物可能是酸性氧化物,也可能是碱性氧化物
C.纯净物的组成元素可能为多种,混合物的组成元素可能为一?种
D.向煮沸的氢氧化钠溶液中滴入FeCl3溶液可得Fe(OH)3胶体
3.某一化学兴趣小组的同学在家中进行实验,按照图甲连接好线路,发现灯泡不亮;按照图乙连接好线路,发现灯泡亮了。由此得出的以下结论中正确的是
A.NaCl为非电解质
B.NaCl溶液是电解质
C.在NaCl溶液中,水电离出了大量的离子
D.NaCl在水溶液中电离出了可以自由移动的离子
4.下列各组物质全部是弱电解质的是( )
A.H2SO3、Ba(OH)2、BaSO4 B.CH3COOH、C2H5OH、CH3COONa
C.SO2、H2S、CO2 D.H2O、NH3?H2O、HF
5.利托那韦(分子式为C37H48N6O5S2)是一种抗病毒口服用药,按物质的组成和性质分类,该物质属于
A.单质 B.氧化物 C.无机物 D.有机物
6.一定质量的铁铝合金加入到足量的NaOH溶液中,完全反应后产生6.72L(折算成标准标准状况下的体积,下同)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生10.08L气体,则该合金中铁、铝的质量之比为( )
A.3:4 B.4:3 C.7:9 D.14:9
7.下列关于胶体的叙述正确的是( )
A.胶体都是无色的 B.胶体都是混合物
C.胶体的本质特征是丁达尔效应 D.胶体很不稳定,静置后能产生沉淀
8.下列电离方程式错误的是( )
A.BaSO4=Ba2++ B.Al2(SO4)3=Al3++3
C.HCl=H++Cl- D.NaClO=Na++ClO-
9.下列物质溶于水后不能电离出Cl-的是( )
A.氯化镁(MgCl2) B.氯化氢(HCl) C.氯化钠(NaCl) D.氯酸钾(KClO3)
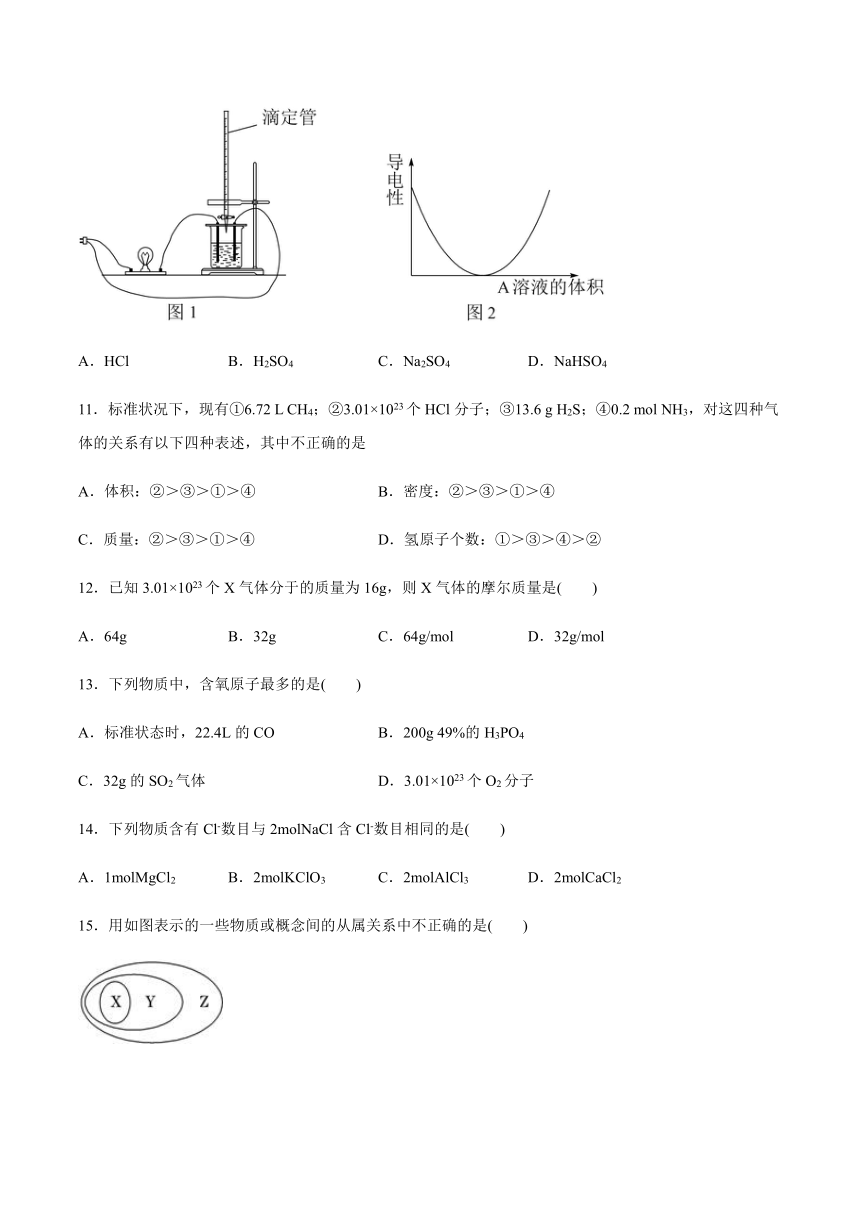
10.在图1所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入A溶液时,溶液导电性的变化趋势如图2所示。滴加溶液A至图2中曲线最低点时,灯泡可能熄灭,溶液A中含有的溶质是( )
A.HCl B.H2SO4 C.Na2SO4 D.NaHSO4
11.标准状况下,现有①6.72 L CH4;②3.01×1023个HCl分子;③13.6 g H2S;④0.2 mol NH3,对这四种气体的关系有以下四种表述,其中不正确的是
A.体积:②>③>①>④ B.密度:②>③>①>④
C.质量:②>③>①>④ D.氢原子个数:①>③>④>②
12.已知3.01×1023个X气体分于的质量为16g,则X气体的摩尔质量是( )
A.64g B.32g C.64g/mol D.32g/mol
13.下列物质中,含氧原子最多的是( )
A.标准状态时,22.4L的CO B.200g 49%的H3PO4
C.32g的SO2气体 D.3.01×1023个O2分子
14.下列物质含有Cl-数目与2molNaCl含Cl-数目相同的是( )
A.1molMgCl2 B.2molKClO3 C.2molAlCl3 D.2molCaCl2
15.用如图表示的一些物质或概念间的从属关系中不正确的是( )
X
Y
Z
A
碱
电解质
化合物
B
含氧酸
酸
化合物
C
置换反应
氧化还原反应
离子反应
D
碱性氧化物
金属氧化物
氧化物
A.A B.B C.C D.D
二、填空题
16.现有下列物质 ①乙醇;②铜;③熔融KCl;④Fe(OH)3胶体;⑤氨气;⑥硫酸氢钠;⑦氢氧化钡;⑧硫酸溶液。
(1)能导电的是:___________。(填序号,下同)
(2)属于强电解质的是:___________;属于非电解质的是:___________。
(3)写出⑥在水溶液中的电离方程式___________。
写出⑦⑧水溶液混合反应的离子方程式___________。
17.下图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3、KOH五种物质,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号。
(1)相连的两种物质都是电解质的是______(填分类标准代号,下同),都是氧化物的是______。
(2)图中相连的两种物质能够相互反应的是_____,所属的基本反应类型是____反应。
(3)上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,则该反应的离子方程式为____。
(4)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,得到的分散系称为____。
(5)在上述五种物质中,有一种物质(假设为甲)的水溶液遇到KSCN溶液变成血红色,甲的化学式是____。
18.关于制备Fe(OH)3胶体,现有甲、乙、丙三名同学分别进行制备Fe(OH)3胶体的实验。
Ⅰ、甲同学直接加热饱和FeCl3溶液;
Ⅱ、乙同学向25 mL沸水中逐滴加入FeCl3饱和溶液;煮沸至液体呈红褐色,停止加热。
Ⅲ、丙同学和乙同学一样,但是溶液出现红褐色后忘记停止,继续加热较长时间。
试回答下列问题:
(1)判断胶体制备是否成功,可利用胶体的_______,其中操作方法及现象是_______。
(2)Fe(OH)3胶体是不是电解质:_______(填“是”或“不是”)。
(3)丁同学检查实验结果发现_______(填甲、乙或丙)的烧杯底部有沉淀。
(4)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①取部分胶体将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶体的胶粒带_______电荷。
②取部分胶体向其中逐滴滴加硫酸溶液,现象:_______,写出化学反应方程式_______。
19.请对下列物质进行归类: CO
(1)属于酸的是_______;
(2)属于碱的是_______;
(3)属于盐的是_______;
(4)属于氧化物的是_______;
(5)属于酸性氧化物的是_______;
(6)属于酸式盐的是_______;
(7)属于碱式盐的是_______;
(8)属于钠盐的是_______。
20.取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的化学方程式为___________,反应后得到的FeCl3溶液呈棕黄色。用此溶液进行以下实验:
(1)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为___________,此反应属于___________反应。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液成___________色,停止加热,制得的分散系为___________。
(3)向(2)中烧杯中的分散系中逐滴滴入过量盐酸,会再出现一系列变化:
①先出现红褐色沉淀,原因是___________。
②随后沉淀逐渐溶解,溶液呈棕黄色,反应的化学方程式为___________。
三、原理综合题
21.现有以下物质:①NaOH溶液;②液氨;③明矾;④熔融KHSO4;⑤Fe(OH)3胶体;⑥铜;⑦CO2;⑧CH3COOH;⑨蔗糖;⑩冰水混合物
(1)以上物质中属于混合物的是__________(填序号),以上物质中属于电解质的是_______(填序号);以上纯净物中能导电的是_________________(填序号)。
(2)写出制备物质⑤的化学方程式___________________,在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈______色,即制得Fe(OH)3胶体。如何用最简单的方法判断是否成功制备出胶体________________?
(3)写出③溶于水的电离方程式________________。
(4)写出④的电离方程式________________。
22.将少量饱和 FeCl3溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和 FeCl3溶液滴加到 NaOH 溶液中;
乙:饱和 FeCl3溶液滴加到冷水中;
丙:饱和 FeCl3溶液滴加到沸水中。
(1)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为_____。
(2)用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论_____。
(3)向经过检验后的丙中逐滴加入稀盐酸,会出现一系列变化:
①先出现和甲中相同的现象,原因为_____。
②随后发生变化得到和乙相同的溶液,此反应的离子反应方程式为_____。
(4)向丙中加入电极通电后,Fe(OH)3胶体粒子移向_____极;(填“阴极”或“阳极”)
(5)可用如图所示的装置除去 Fe(OH)3胶体中的杂质离子来提纯 Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入 AgNO3溶液,若_____(填实验现象),则说明该 Fe(OH)3 胶体中的杂质离子已经完全除去。
23.下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。
配料表
精制海盐、碘酸钾(KIO3)
含碘量
20~40 mg·kg-1
储藏方法
密封、避光、防潮
食用方法
烹调时待食品熟后加入碘盐
回答下列问题:
(1)结合物质分类中的树状分类法的有关知识,根据物质的组成对物质进行分类。在下列五种____(填“混合物”“化合物”“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的是____(填序号)。?
①HIO3 ②NaIO3 ③KOH ④I2O5 ⑤NaCl
(2)推测碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)____(填“能”或“不能”)溶于水;
化学性质:碘酸钾(KIO3)在受热时____(填“易分解”或“不易分解”)。?
(3)碘酸钾是一种电解质,写出其在水溶液中的电离方程式:____________。
参考答案
1.C2.C3.D4.D5.D6.D7.B8.B9.D10.B11.B12.D13.B14.A15.C
16.②③④⑧ ③⑥⑦ ①⑤ NaHSO4=Na++H++ Ba2++2H++2OH-+=BaSO4↓+2H2O
17.C、D B D 复分解 Fe2O3+6H+=2Fe3++3H2O 胶体 FeCl3
18.丁达尔效应 用一束光通过胶体,可以看到一条光亮的通路 不是 丙 正 开始生成红褐色沉淀,继续滴加硫酸溶液,沉淀逐渐溶解 2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O
19. 、、 、、CO、CO2 、 、
20. 复分解 红褐 胶体 HCl中的Cl-所带的电荷与胶体粒子所带的电荷发生了电性中和,破坏了胶体的介稳性,胶体发生聚沉得到沉淀
21.①⑤ ③④⑧⑩ ④⑥ FeCl3+3H2OFe(OH)3 (胶体) +3HCl 红褐 利用丁达尔效应,用一束光照射所得的液体,从侧面观察是否有一条光亮的“通路”出现 KAl(SO4)2·12H2O==K+ +Al3+ +2 +12H2O KHSO4==K++
22.FeCl3+3H2OFe(OH)3( 胶体)+3HCl 用一束光通过制得的液体,若有光亮的“通路”则已经制备成功 由于Fe(OH)3 胶体遇到电解质会发生聚沉,因而形成红褐色沉淀 Fe(OH)3 +3H+ =Fe3++3H2O 阴 不出现白色沉淀
23.化合物 ②⑤ 能 易分解 KIO3=K++
一、单选题
1.设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24 L?H2O中含有的共价键数为0.2NA
B.标准状况下,4.48 L?的Cl2通入稀的NaOH溶液中反应,转移的电子数为0.4NA
C.m gD2O和H2O的混合物中共含有3.2g的氧原子,则混合物的总质子数为2NA
D.100 g?17%的H2O2水溶液中含有氢原子数为NA
2.下列说法正确的是
A.丁达尔效应是区分悬浊液和胶体最简单方法
B.非金属氧化物可能是酸性氧化物,也可能是碱性氧化物
C.纯净物的组成元素可能为多种,混合物的组成元素可能为一?种
D.向煮沸的氢氧化钠溶液中滴入FeCl3溶液可得Fe(OH)3胶体
3.某一化学兴趣小组的同学在家中进行实验,按照图甲连接好线路,发现灯泡不亮;按照图乙连接好线路,发现灯泡亮了。由此得出的以下结论中正确的是
A.NaCl为非电解质
B.NaCl溶液是电解质
C.在NaCl溶液中,水电离出了大量的离子
D.NaCl在水溶液中电离出了可以自由移动的离子
4.下列各组物质全部是弱电解质的是( )
A.H2SO3、Ba(OH)2、BaSO4 B.CH3COOH、C2H5OH、CH3COONa
C.SO2、H2S、CO2 D.H2O、NH3?H2O、HF
5.利托那韦(分子式为C37H48N6O5S2)是一种抗病毒口服用药,按物质的组成和性质分类,该物质属于
A.单质 B.氧化物 C.无机物 D.有机物
6.一定质量的铁铝合金加入到足量的NaOH溶液中,完全反应后产生6.72L(折算成标准标准状况下的体积,下同)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生10.08L气体,则该合金中铁、铝的质量之比为( )
A.3:4 B.4:3 C.7:9 D.14:9
7.下列关于胶体的叙述正确的是( )
A.胶体都是无色的 B.胶体都是混合物
C.胶体的本质特征是丁达尔效应 D.胶体很不稳定,静置后能产生沉淀
8.下列电离方程式错误的是( )
A.BaSO4=Ba2++ B.Al2(SO4)3=Al3++3
C.HCl=H++Cl- D.NaClO=Na++ClO-
9.下列物质溶于水后不能电离出Cl-的是( )
A.氯化镁(MgCl2) B.氯化氢(HCl) C.氯化钠(NaCl) D.氯酸钾(KClO3)
10.在图1所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入A溶液时,溶液导电性的变化趋势如图2所示。滴加溶液A至图2中曲线最低点时,灯泡可能熄灭,溶液A中含有的溶质是( )
A.HCl B.H2SO4 C.Na2SO4 D.NaHSO4
11.标准状况下,现有①6.72 L CH4;②3.01×1023个HCl分子;③13.6 g H2S;④0.2 mol NH3,对这四种气体的关系有以下四种表述,其中不正确的是
A.体积:②>③>①>④ B.密度:②>③>①>④
C.质量:②>③>①>④ D.氢原子个数:①>③>④>②
12.已知3.01×1023个X气体分于的质量为16g,则X气体的摩尔质量是( )
A.64g B.32g C.64g/mol D.32g/mol
13.下列物质中,含氧原子最多的是( )
A.标准状态时,22.4L的CO B.200g 49%的H3PO4
C.32g的SO2气体 D.3.01×1023个O2分子
14.下列物质含有Cl-数目与2molNaCl含Cl-数目相同的是( )
A.1molMgCl2 B.2molKClO3 C.2molAlCl3 D.2molCaCl2
15.用如图表示的一些物质或概念间的从属关系中不正确的是( )
X
Y
Z
A
碱
电解质
化合物
B
含氧酸
酸
化合物
C
置换反应
氧化还原反应
离子反应
D
碱性氧化物
金属氧化物
氧化物
A.A B.B C.C D.D
二、填空题
16.现有下列物质 ①乙醇;②铜;③熔融KCl;④Fe(OH)3胶体;⑤氨气;⑥硫酸氢钠;⑦氢氧化钡;⑧硫酸溶液。
(1)能导电的是:___________。(填序号,下同)
(2)属于强电解质的是:___________;属于非电解质的是:___________。
(3)写出⑥在水溶液中的电离方程式___________。
写出⑦⑧水溶液混合反应的离子方程式___________。
17.下图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3、KOH五种物质,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号。
(1)相连的两种物质都是电解质的是______(填分类标准代号,下同),都是氧化物的是______。
(2)图中相连的两种物质能够相互反应的是_____,所属的基本反应类型是____反应。
(3)上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,则该反应的离子方程式为____。
(4)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,得到的分散系称为____。
(5)在上述五种物质中,有一种物质(假设为甲)的水溶液遇到KSCN溶液变成血红色,甲的化学式是____。
18.关于制备Fe(OH)3胶体,现有甲、乙、丙三名同学分别进行制备Fe(OH)3胶体的实验。
Ⅰ、甲同学直接加热饱和FeCl3溶液;
Ⅱ、乙同学向25 mL沸水中逐滴加入FeCl3饱和溶液;煮沸至液体呈红褐色,停止加热。
Ⅲ、丙同学和乙同学一样,但是溶液出现红褐色后忘记停止,继续加热较长时间。
试回答下列问题:
(1)判断胶体制备是否成功,可利用胶体的_______,其中操作方法及现象是_______。
(2)Fe(OH)3胶体是不是电解质:_______(填“是”或“不是”)。
(3)丁同学检查实验结果发现_______(填甲、乙或丙)的烧杯底部有沉淀。
(4)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①取部分胶体将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶体的胶粒带_______电荷。
②取部分胶体向其中逐滴滴加硫酸溶液,现象:_______,写出化学反应方程式_______。
19.请对下列物质进行归类: CO
(1)属于酸的是_______;
(2)属于碱的是_______;
(3)属于盐的是_______;
(4)属于氧化物的是_______;
(5)属于酸性氧化物的是_______;
(6)属于酸式盐的是_______;
(7)属于碱式盐的是_______;
(8)属于钠盐的是_______。
20.取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的化学方程式为___________,反应后得到的FeCl3溶液呈棕黄色。用此溶液进行以下实验:
(1)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为___________,此反应属于___________反应。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液成___________色,停止加热,制得的分散系为___________。
(3)向(2)中烧杯中的分散系中逐滴滴入过量盐酸,会再出现一系列变化:
①先出现红褐色沉淀,原因是___________。
②随后沉淀逐渐溶解,溶液呈棕黄色,反应的化学方程式为___________。
三、原理综合题
21.现有以下物质:①NaOH溶液;②液氨;③明矾;④熔融KHSO4;⑤Fe(OH)3胶体;⑥铜;⑦CO2;⑧CH3COOH;⑨蔗糖;⑩冰水混合物
(1)以上物质中属于混合物的是__________(填序号),以上物质中属于电解质的是_______(填序号);以上纯净物中能导电的是_________________(填序号)。
(2)写出制备物质⑤的化学方程式___________________,在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈______色,即制得Fe(OH)3胶体。如何用最简单的方法判断是否成功制备出胶体________________?
(3)写出③溶于水的电离方程式________________。
(4)写出④的电离方程式________________。
22.将少量饱和 FeCl3溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和 FeCl3溶液滴加到 NaOH 溶液中;
乙:饱和 FeCl3溶液滴加到冷水中;
丙:饱和 FeCl3溶液滴加到沸水中。
(1)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为_____。
(2)用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论_____。
(3)向经过检验后的丙中逐滴加入稀盐酸,会出现一系列变化:
①先出现和甲中相同的现象,原因为_____。
②随后发生变化得到和乙相同的溶液,此反应的离子反应方程式为_____。
(4)向丙中加入电极通电后,Fe(OH)3胶体粒子移向_____极;(填“阴极”或“阳极”)
(5)可用如图所示的装置除去 Fe(OH)3胶体中的杂质离子来提纯 Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入 AgNO3溶液,若_____(填实验现象),则说明该 Fe(OH)3 胶体中的杂质离子已经完全除去。
23.下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。
配料表
精制海盐、碘酸钾(KIO3)
含碘量
20~40 mg·kg-1
储藏方法
密封、避光、防潮
食用方法
烹调时待食品熟后加入碘盐
回答下列问题:
(1)结合物质分类中的树状分类法的有关知识,根据物质的组成对物质进行分类。在下列五种____(填“混合物”“化合物”“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的是____(填序号)。?
①HIO3 ②NaIO3 ③KOH ④I2O5 ⑤NaCl
(2)推测碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)____(填“能”或“不能”)溶于水;
化学性质:碘酸钾(KIO3)在受热时____(填“易分解”或“不易分解”)。?
(3)碘酸钾是一种电解质,写出其在水溶液中的电离方程式:____________。
参考答案
1.C2.C3.D4.D5.D6.D7.B8.B9.D10.B11.B12.D13.B14.A15.C
16.②③④⑧ ③⑥⑦ ①⑤ NaHSO4=Na++H++ Ba2++2H++2OH-+=BaSO4↓+2H2O
17.C、D B D 复分解 Fe2O3+6H+=2Fe3++3H2O 胶体 FeCl3
18.丁达尔效应 用一束光通过胶体,可以看到一条光亮的通路 不是 丙 正 开始生成红褐色沉淀,继续滴加硫酸溶液,沉淀逐渐溶解 2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O
19. 、、 、、CO、CO2 、 、
20. 复分解 红褐 胶体 HCl中的Cl-所带的电荷与胶体粒子所带的电荷发生了电性中和,破坏了胶体的介稳性,胶体发生聚沉得到沉淀
21.①⑤ ③④⑧⑩ ④⑥ FeCl3+3H2OFe(OH)3 (胶体) +3HCl 红褐 利用丁达尔效应,用一束光照射所得的液体,从侧面观察是否有一条光亮的“通路”出现 KAl(SO4)2·12H2O==K+ +Al3+ +2 +12H2O KHSO4==K++
22.FeCl3+3H2OFe(OH)3( 胶体)+3HCl 用一束光通过制得的液体,若有光亮的“通路”则已经制备成功 由于Fe(OH)3 胶体遇到电解质会发生聚沉,因而形成红褐色沉淀 Fe(OH)3 +3H+ =Fe3++3H2O 阴 不出现白色沉淀
23.化合物 ②⑤ 能 易分解 KIO3=K++
