苏教版(2019)高中化学必修第一册专题2研究物质的基本方法专题练习
文档属性
| 名称 | 苏教版(2019)高中化学必修第一册专题2研究物质的基本方法专题练习 |  | |
| 格式 | docx | ||
| 文件大小 | 344.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-16 14:32:10 | ||
图片预览




文档简介
苏教版(2019)高中化学必修第一册专题2研究物质的基本方法专题练习
一、单选题
1.在相同体积、相同物质的量浓度的酸中,一定相等的是
A.氢离子浓度 B.溶质的质量分数 C.溶质的物质的量 D.溶质的质量
2.下列仪器名称为“坩埚”的是
A. B. C. D.
3.实验室欲配制100?mL?1.00?mol/LNa2CO3溶液。下列有关叙述中,正确的是
A.称取10.6 g?Na2CO3固体
B.将Na2CO3固体放入容量瓶中,加水至刻度线
C.定容时俯视液面,所得溶液浓度偏低
D.加水时不慎超过刻度线,用胶头滴管直接吸出多余液体
4.铀元素的一种核素,它的中子数与电子数相差为
A.50 B.60 C.92 D.142
5.将10 mL淀粉胶体和5 mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中冲洗(如图所示)2 min 后,分别取袋内和烧杯内的液体进行实验。下列说法不正确的是( )。
A.烧杯内液体加入碘水后没有明显变化 B.烧杯内液体加入硝酸银溶液后有白色沉淀产生
C.袋内液体加入碘水后不变蓝 D.袋内液体做焰色反应,可观察到黄光
6.下列溶液中Cl-浓度最大的是
A.10 mL 0.1mol/L AlCl3溶液 B.10 mL0.4 mol/L KClO3溶液
C.50 mL0.2 mol/L NaCl溶液 D.50 mL 0.1 mol/L FeCl2溶液
7.将100 mL10 mol/L的浓硫酸加水稀释到1 L,再取出10 mL,则这10mL溶液中H+的物质的量浓度是
A.2.5 mol/L B.2mo1/L C.1 mol/L D.0.5 mol/L
8.同温同压下,等体积的两容器内分别充满由13C、14N、18O三种原子构成的一氧化氮和一氧化碳,两容器含有的( )
A.分子数和气体质量均不同 B.分子数和电子数均相同
C.质子数和中子数均相同 D.分子数、原子数和中子数均相同
9.把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,怡好使硫酸根离子完全沉淀为硫酸钡,则原混合溶液中钾离子的浓度为
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
10.下列有关0.2mol/LBaCl2溶液的说法不正确的是( )
A.500mL溶液中Cl-离子浓度为0.2mol/L B.500mL溶液中Ba2+离子浓度为0.2mol/L
C.500mL溶液中Cl-总数为0.2NA D.500mL溶液中Ba2+和Cl-总数为0.3NA
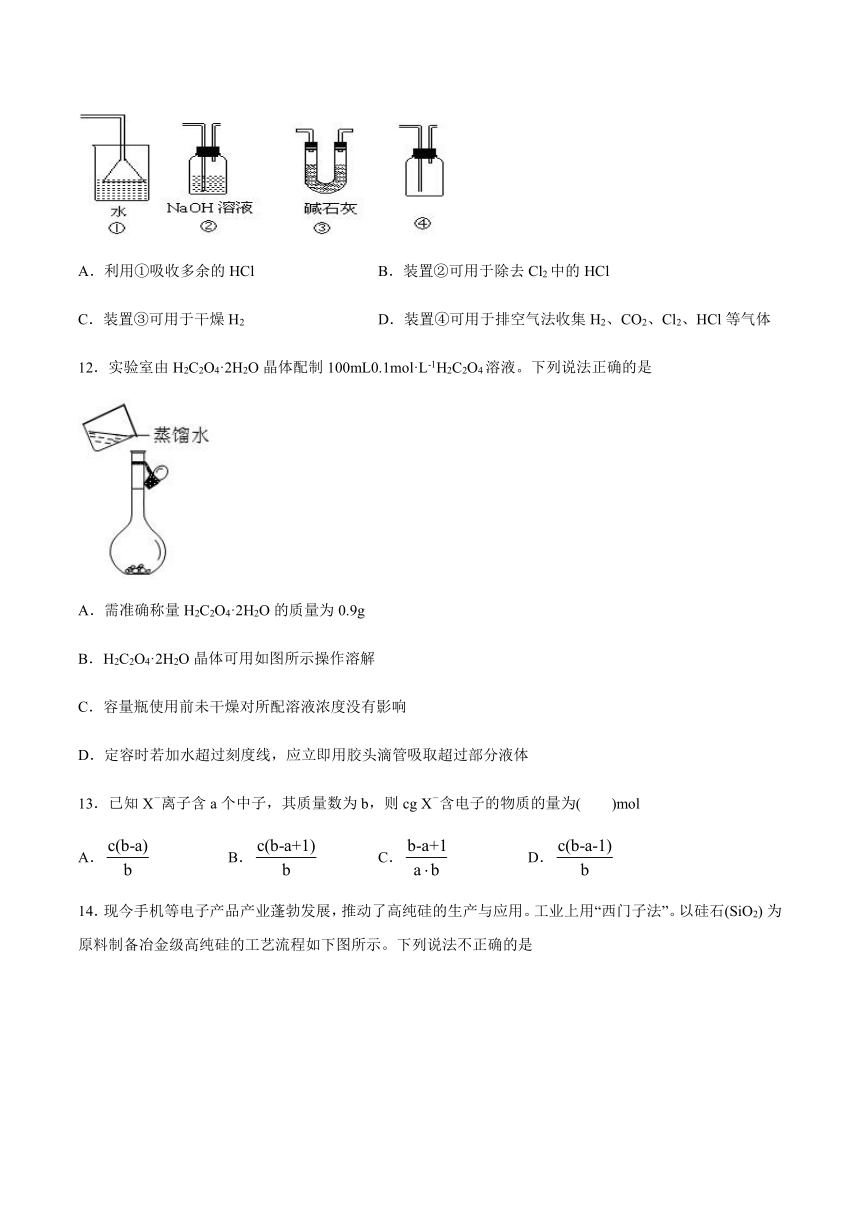
11.下列各装置不能达到实验目的的是:
A.利用①吸收多余的HCl B.装置②可用于除去Cl2中的HCl
C.装置③可用于干燥H2 D.装置④可用于排空气法收集H2、CO2、Cl2、HCl等气体
12.实验室由H2C2O4·2H2O晶体配制100mL0.1mol·L-1H2C2O4溶液。下列说法正确的是
A.需准确称量H2C2O4·2H2O的质量为0.9g
B.H2C2O4·2H2O晶体可用如图所示操作溶解
C.容量瓶使用前未干燥对所配溶液浓度没有影响
D.定容时若加水超过刻度线,应立即用胶头滴管吸取超过部分液体
13.已知X-离子含a个中子,其质量数为b,则cg X-含电子的物质的量为( )mol
A. B. C. D.
14.现今手机等电子产品产业蓬勃发展,推动了高纯硅的生产与应用。工业上用“西门子法”。以硅石(SiO2)?为原料制备冶金级高纯硅的工艺流程如下图所示。下列说法不正确的是
已知:SiHCl3室温下为易挥发、易水解的无色液体。
A.“还原”过程需要在高温条件下,该反应的主要还原产物为Si
B.为最大程度节约成本,上述?生产工艺中能循环使用的物质只有H2
C.为防止SiHCl3水解而损失、氢气爆炸,“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下进行
D.“氧化”过程反应的化学方程式为Si+3HC1SiHCl3+H2
15.下列各组混合物中,能用分液漏斗进行分离的一组混合物是( )
A.酒精和水 B.碘和四氯化碳
C.汽油和植物油 D.水和四氯化碳
二、填空题
16.实验室用质量分数为98%,密度为1.84 g/cm3的浓H2SO4配制450 mL 2 mol/L的硫酸时,具体操作步骤如下,请根据要求回答下列问题:
Ⅰ.准备仪器:实验过程中,下列不必使用的是________(填字母代号)。
A.托盘天平 B.圆底烧瓶 C.烧杯 D.胶头滴管 E.试剂瓶
Ⅱ.配制溶液:
a.计算所需浓H2SO4的体积:________mL(精确到小数点后一位);
b.量取:用量筒量取所需的浓硫酸;
c.溶解:将浓H2SO4沿烧杯内壁缓缓倒入盛水的烧杯中并不断搅拌,并冷却至室温;
d转移:用玻璃棒将烧杯中的溶液引流至________________中;
e洗涤:用蒸馏水洗涤烧杯内壁及玻璃棒2~3次,将洗涤液转移至容量瓶中;
f.振荡并加蒸馏水稀释:轻轻振荡容量瓶,使溶液混合均匀,向容量瓶中加蒸馏水至液面在刻度线以下1~2 cm;
g定容:用____________向容量瓶中加蒸馏水至溶液的凹液面与刻度线相切;
h.摇匀、装瓶。
Ⅲ.误差分析:
(1)上述c步骤中,若溶液温度未冷却至室温,直接转移并定容,所配溶液浓度________(填“偏大”“偏小”或“不变”,下同)。
(2)上述g步骤中,若定容时俯视容量瓶刻度线,则所配溶液浓度________________。
17.Ⅰ.(1)标准状况下,5.6LO2的质量为_____克,共含有_____个原子。
(2)在标准状况下,8gCO2和CO组成的混合气体,其体积为5.6L,则此混合气体中CO2的质量分数为_____
(3)用托盘天平称取5.0gCuSO4·5H2O晶体,溶于水配成100mL溶液,其物质的量浓度为_。
Ⅱ.欲用的浓硫酸(密度为)配制成浓度为的稀硫酸480ml。
(1)选用的主要仪器有:①玻璃棒,②烧杯,③量筒,④胶头滴管,⑤_____。
(2)请将下列各操作相应的序号按要求填在横线上。
A.用量筒量取浓硫酸 B.反复颠倒摇匀 C.用胶头滴管加蒸榴水至刻度线
D.稀释浓硫酸 E.将溶液转入容量瓶
其正确的操作顺序依次为______。
(3)简要回答下列问题:
①所需浓硫酸的体积为________mL。
②定容时必须使溶液凹液面与刻度线相切,若仰视会使浓度________。(填“偏大”、“偏小”、“不变”)
18.如图为某市售盐酸试剂瓶标签上的部分数据。
回答下列问题:
(1)该盐酸的物质的量浓度为___________。
(2)下列实验操作会导致实验结果偏低的是___________(填序号)。
①配制 100 g 10%的 CuSO4 溶液,称取 10 g 硫酸铜晶体溶于 90 g 水中;
②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮;
③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为 0.2 g, 所得溶液的浓度;
④用酸式滴定管量取用 98%,密度为 1.84 g·cm-3 的浓 H2SO4 配制 200 mL 2mol·L-1 的稀 H2SO4 时,先平视后仰视。
(3)已知 CO 和 CO2 的混合气体 14.4 g,在标准状况下所占的体积为 8.96 L。则该混合气体中,CO 的质量为____g,CO2 的物质的量为______mol。
(4)1 mol 氧气在放电条件下,有 30%转化为臭氧(O3),则放电后所得混合气体对氢气的相对密度是___________(填字母)。
A.16 B.17.8 C.18.4 D.35.6
19.根据所学知识填写下列空白。
(1)在标准状况下,6.72 L CO2质量为________g,其中含有氧原子数目为________。
(2)在标准状况下,3.4 g氨气所占的体积约为_______L,它与同条件下________mol H2S含有相同的氢原子数。
(3)V L Fe2(SO4)3溶液中含有a g SO,取此溶液0.5 VL,用水稀释至2 VL,则稀释后溶液中SO的物质的量浓度为______。
(4)下列数量的各物质,所含原子个数由大到小的顺序是________(填序号)。
①0.5 mol SO3 ②标准状况下22.4 L He
③4℃时9 mL水(水的密度为1 g/mL) ④0.2 mol CH3COONH4
(5)现有下列九种物质:①HCl气体 ②Cu ③C2H5OH ④CO2 ⑤CuSO4·5H2O ⑥小苏打 ⑦Ba(OH)2溶液 ⑧熔融Na2SO4 ⑨NH3·H2O
属于电解质的是_________;属于非电解质的是_______;所给状态能导电的电解质是_______(填所给物质的序号)。
20.根据实验要求完成下列问题。
I.实验室需要配制480ml 0.1 mol?L?1的稀硫酸。
(1)若用密度为1.84 g?mL?1,质量分数为98%的浓硫酸来配制,需要用量筒量取浓硫酸_______ml。
(2)该实验除了需要用到量筒、烧杯和玻璃棒之外,还需要用到的玻璃仪器是_______。
(3)配制溶液时,下列操作会导致所配溶液浓度偏高的操作是_______。
A.用蒸馏水洗涤烧杯,洗涤液没有全部注入容量瓶中
B.定容摇匀后,发现液面低于刻度线,又加水到刻度线位置
C.定容时仰视刻度线
D.容量瓶用蒸馏水洗涤后未进行干燥处理,底部有少量水残留。
E.用量筒量取浓硫酸时,仰视刻度线
II.Fe(OH)3胶体可使水中悬浮物凝聚沉淀,是城市饮用水处理新技术。
(1)实验室制取Fe(OH)3胶体相应的化学方程式是_______。
(2)向Fe(OH)3胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是_______。
(3)除去胶体中混有的FeCl3和HCl的方法是_______。
三、工业流程题
21.某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC(聚合氯化铁铝)[AlFe(OH)nCl6-n]m,设计生产流程如下,请回答下列问题:
(1)用10 mol·L-1的浓盐酸配制2 mol·L-1的稀盐酸500 mL,所取浓盐酸的体积___________mL,所用玻璃仪器除量筒和玻璃棒外,还有___________。
A.500mL容量瓶 B.蒸发皿 C.烧瓶 D.胶头滴管
(2)写出Al2O3和Fe3O4粉末与盐酸反应的离子方程式:___________、___________。
(3)取少量酸性溶液滴加几滴KSCN试剂,溶液变为血红色,证明含有Fe3+,写出该反应的离子方程式:___________。
(4)通入氯气的目的是___________。
(5)加入NaOH调节pH时,氢氧化钠不宜过多,生成一种红褐色沉淀,已知Al(OH)3+NaOH=NaAlO2+2H2O。写出溶液中Fe3+和Al3+分别与过量NaOH反应的离子方程式:___________、___________。
22.已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
(1)步骤1的主要操作是_________,需用到的玻璃仪器除烧杯外有______________。
(2)步骤2中发生反应的离子方程式为__________________________________。
(3)步骤3中发生反应的化学方程式为________________________________。
(4)步骤4中涉及的操作是:蒸发浓缩._____________.过滤.洗涤.烘干。
23.工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)流程如下:
(1)浸取时,溶液中的Fe2+易被O2氧化,请完成配平该反应的离子方程式__________。
___________
(2)滤渣Ⅰ的成分是___________(填化学式);还原时,试剂X最好选用___________(填正确选项的字母)。
A.Na2SO4 B.Fe粉 C.KMnO4
(3)调pH的主要目的是除去___________离子(填离子符号)。
(4)一系列操作指的是___________、___________、过滤、洗涤、干燥。
参考答案
1.C2.D3.A4.A5.C6.A7.B8.D9.D10.A11.B12.C13.B14.B15.D
16.AB 54.3 500 mL容量瓶 胶头滴管 偏大 偏大
17.8 0.5NA 34.3% 0.2mol/L 容量瓶 ADECB 13.6mL 偏小
18.11.8 mol·L-1 ①③④ 5.6 0.2 B
19.13.2 3.612×1023个(0.6mol) 4.48 0.3 mol·L-1 ④>①>③>② ①⑤⑥⑧⑨ ③④ ⑧
20.2.7 500ml容量瓶、胶头滴管 E FeCl3+3H2O Fe(OH)3(胶体)+3HCl 硅酸胶粒带负电,使Fe(OH)3胶体聚沉 渗析
21.100.0 AD Al2O3+6H+=2Al3++3H2O Fe3O4+8H+=2Fe3++Fe2++4H2O Fe3++3SCN-=Fe(SCN)3 将Fe2+氧化为Fe3+ Fe3++3OH-=Fe(OH)3↓ Al3++4OH-=AlO+2H2O (或Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO+2H2O,)
22.过滤 玻璃棒和漏斗 Fe2++Cu=Cu2++Fe Fe+H2SO4=FeSO4+H2↑ 冷却结晶
23.4Fe2++O2+4H+=4Fe3++2H2O SiO2 B Al3+ 蒸发浓缩 冷却结晶
一、单选题
1.在相同体积、相同物质的量浓度的酸中,一定相等的是
A.氢离子浓度 B.溶质的质量分数 C.溶质的物质的量 D.溶质的质量
2.下列仪器名称为“坩埚”的是
A. B. C. D.
3.实验室欲配制100?mL?1.00?mol/LNa2CO3溶液。下列有关叙述中,正确的是
A.称取10.6 g?Na2CO3固体
B.将Na2CO3固体放入容量瓶中,加水至刻度线
C.定容时俯视液面,所得溶液浓度偏低
D.加水时不慎超过刻度线,用胶头滴管直接吸出多余液体
4.铀元素的一种核素,它的中子数与电子数相差为
A.50 B.60 C.92 D.142
5.将10 mL淀粉胶体和5 mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中冲洗(如图所示)2 min 后,分别取袋内和烧杯内的液体进行实验。下列说法不正确的是( )。
A.烧杯内液体加入碘水后没有明显变化 B.烧杯内液体加入硝酸银溶液后有白色沉淀产生
C.袋内液体加入碘水后不变蓝 D.袋内液体做焰色反应,可观察到黄光
6.下列溶液中Cl-浓度最大的是
A.10 mL 0.1mol/L AlCl3溶液 B.10 mL0.4 mol/L KClO3溶液
C.50 mL0.2 mol/L NaCl溶液 D.50 mL 0.1 mol/L FeCl2溶液
7.将100 mL10 mol/L的浓硫酸加水稀释到1 L,再取出10 mL,则这10mL溶液中H+的物质的量浓度是
A.2.5 mol/L B.2mo1/L C.1 mol/L D.0.5 mol/L
8.同温同压下,等体积的两容器内分别充满由13C、14N、18O三种原子构成的一氧化氮和一氧化碳,两容器含有的( )
A.分子数和气体质量均不同 B.分子数和电子数均相同
C.质子数和中子数均相同 D.分子数、原子数和中子数均相同
9.把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,怡好使硫酸根离子完全沉淀为硫酸钡,则原混合溶液中钾离子的浓度为
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
10.下列有关0.2mol/LBaCl2溶液的说法不正确的是( )
A.500mL溶液中Cl-离子浓度为0.2mol/L B.500mL溶液中Ba2+离子浓度为0.2mol/L
C.500mL溶液中Cl-总数为0.2NA D.500mL溶液中Ba2+和Cl-总数为0.3NA
11.下列各装置不能达到实验目的的是:
A.利用①吸收多余的HCl B.装置②可用于除去Cl2中的HCl
C.装置③可用于干燥H2 D.装置④可用于排空气法收集H2、CO2、Cl2、HCl等气体
12.实验室由H2C2O4·2H2O晶体配制100mL0.1mol·L-1H2C2O4溶液。下列说法正确的是
A.需准确称量H2C2O4·2H2O的质量为0.9g
B.H2C2O4·2H2O晶体可用如图所示操作溶解
C.容量瓶使用前未干燥对所配溶液浓度没有影响
D.定容时若加水超过刻度线,应立即用胶头滴管吸取超过部分液体
13.已知X-离子含a个中子,其质量数为b,则cg X-含电子的物质的量为( )mol
A. B. C. D.
14.现今手机等电子产品产业蓬勃发展,推动了高纯硅的生产与应用。工业上用“西门子法”。以硅石(SiO2)?为原料制备冶金级高纯硅的工艺流程如下图所示。下列说法不正确的是
已知:SiHCl3室温下为易挥发、易水解的无色液体。
A.“还原”过程需要在高温条件下,该反应的主要还原产物为Si
B.为最大程度节约成本,上述?生产工艺中能循环使用的物质只有H2
C.为防止SiHCl3水解而损失、氢气爆炸,“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下进行
D.“氧化”过程反应的化学方程式为Si+3HC1SiHCl3+H2
15.下列各组混合物中,能用分液漏斗进行分离的一组混合物是( )
A.酒精和水 B.碘和四氯化碳
C.汽油和植物油 D.水和四氯化碳
二、填空题
16.实验室用质量分数为98%,密度为1.84 g/cm3的浓H2SO4配制450 mL 2 mol/L的硫酸时,具体操作步骤如下,请根据要求回答下列问题:
Ⅰ.准备仪器:实验过程中,下列不必使用的是________(填字母代号)。
A.托盘天平 B.圆底烧瓶 C.烧杯 D.胶头滴管 E.试剂瓶
Ⅱ.配制溶液:
a.计算所需浓H2SO4的体积:________mL(精确到小数点后一位);
b.量取:用量筒量取所需的浓硫酸;
c.溶解:将浓H2SO4沿烧杯内壁缓缓倒入盛水的烧杯中并不断搅拌,并冷却至室温;
d转移:用玻璃棒将烧杯中的溶液引流至________________中;
e洗涤:用蒸馏水洗涤烧杯内壁及玻璃棒2~3次,将洗涤液转移至容量瓶中;
f.振荡并加蒸馏水稀释:轻轻振荡容量瓶,使溶液混合均匀,向容量瓶中加蒸馏水至液面在刻度线以下1~2 cm;
g定容:用____________向容量瓶中加蒸馏水至溶液的凹液面与刻度线相切;
h.摇匀、装瓶。
Ⅲ.误差分析:
(1)上述c步骤中,若溶液温度未冷却至室温,直接转移并定容,所配溶液浓度________(填“偏大”“偏小”或“不变”,下同)。
(2)上述g步骤中,若定容时俯视容量瓶刻度线,则所配溶液浓度________________。
17.Ⅰ.(1)标准状况下,5.6LO2的质量为_____克,共含有_____个原子。
(2)在标准状况下,8gCO2和CO组成的混合气体,其体积为5.6L,则此混合气体中CO2的质量分数为_____
(3)用托盘天平称取5.0gCuSO4·5H2O晶体,溶于水配成100mL溶液,其物质的量浓度为_。
Ⅱ.欲用的浓硫酸(密度为)配制成浓度为的稀硫酸480ml。
(1)选用的主要仪器有:①玻璃棒,②烧杯,③量筒,④胶头滴管,⑤_____。
(2)请将下列各操作相应的序号按要求填在横线上。
A.用量筒量取浓硫酸 B.反复颠倒摇匀 C.用胶头滴管加蒸榴水至刻度线
D.稀释浓硫酸 E.将溶液转入容量瓶
其正确的操作顺序依次为______。
(3)简要回答下列问题:
①所需浓硫酸的体积为________mL。
②定容时必须使溶液凹液面与刻度线相切,若仰视会使浓度________。(填“偏大”、“偏小”、“不变”)
18.如图为某市售盐酸试剂瓶标签上的部分数据。
回答下列问题:
(1)该盐酸的物质的量浓度为___________。
(2)下列实验操作会导致实验结果偏低的是___________(填序号)。
①配制 100 g 10%的 CuSO4 溶液,称取 10 g 硫酸铜晶体溶于 90 g 水中;
②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮;
③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为 0.2 g, 所得溶液的浓度;
④用酸式滴定管量取用 98%,密度为 1.84 g·cm-3 的浓 H2SO4 配制 200 mL 2mol·L-1 的稀 H2SO4 时,先平视后仰视。
(3)已知 CO 和 CO2 的混合气体 14.4 g,在标准状况下所占的体积为 8.96 L。则该混合气体中,CO 的质量为____g,CO2 的物质的量为______mol。
(4)1 mol 氧气在放电条件下,有 30%转化为臭氧(O3),则放电后所得混合气体对氢气的相对密度是___________(填字母)。
A.16 B.17.8 C.18.4 D.35.6
19.根据所学知识填写下列空白。
(1)在标准状况下,6.72 L CO2质量为________g,其中含有氧原子数目为________。
(2)在标准状况下,3.4 g氨气所占的体积约为_______L,它与同条件下________mol H2S含有相同的氢原子数。
(3)V L Fe2(SO4)3溶液中含有a g SO,取此溶液0.5 VL,用水稀释至2 VL,则稀释后溶液中SO的物质的量浓度为______。
(4)下列数量的各物质,所含原子个数由大到小的顺序是________(填序号)。
①0.5 mol SO3 ②标准状况下22.4 L He
③4℃时9 mL水(水的密度为1 g/mL) ④0.2 mol CH3COONH4
(5)现有下列九种物质:①HCl气体 ②Cu ③C2H5OH ④CO2 ⑤CuSO4·5H2O ⑥小苏打 ⑦Ba(OH)2溶液 ⑧熔融Na2SO4 ⑨NH3·H2O
属于电解质的是_________;属于非电解质的是_______;所给状态能导电的电解质是_______(填所给物质的序号)。
20.根据实验要求完成下列问题。
I.实验室需要配制480ml 0.1 mol?L?1的稀硫酸。
(1)若用密度为1.84 g?mL?1,质量分数为98%的浓硫酸来配制,需要用量筒量取浓硫酸_______ml。
(2)该实验除了需要用到量筒、烧杯和玻璃棒之外,还需要用到的玻璃仪器是_______。
(3)配制溶液时,下列操作会导致所配溶液浓度偏高的操作是_______。
A.用蒸馏水洗涤烧杯,洗涤液没有全部注入容量瓶中
B.定容摇匀后,发现液面低于刻度线,又加水到刻度线位置
C.定容时仰视刻度线
D.容量瓶用蒸馏水洗涤后未进行干燥处理,底部有少量水残留。
E.用量筒量取浓硫酸时,仰视刻度线
II.Fe(OH)3胶体可使水中悬浮物凝聚沉淀,是城市饮用水处理新技术。
(1)实验室制取Fe(OH)3胶体相应的化学方程式是_______。
(2)向Fe(OH)3胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是_______。
(3)除去胶体中混有的FeCl3和HCl的方法是_______。
三、工业流程题
21.某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC(聚合氯化铁铝)[AlFe(OH)nCl6-n]m,设计生产流程如下,请回答下列问题:
(1)用10 mol·L-1的浓盐酸配制2 mol·L-1的稀盐酸500 mL,所取浓盐酸的体积___________mL,所用玻璃仪器除量筒和玻璃棒外,还有___________。
A.500mL容量瓶 B.蒸发皿 C.烧瓶 D.胶头滴管
(2)写出Al2O3和Fe3O4粉末与盐酸反应的离子方程式:___________、___________。
(3)取少量酸性溶液滴加几滴KSCN试剂,溶液变为血红色,证明含有Fe3+,写出该反应的离子方程式:___________。
(4)通入氯气的目的是___________。
(5)加入NaOH调节pH时,氢氧化钠不宜过多,生成一种红褐色沉淀,已知Al(OH)3+NaOH=NaAlO2+2H2O。写出溶液中Fe3+和Al3+分别与过量NaOH反应的离子方程式:___________、___________。
22.已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
(1)步骤1的主要操作是_________,需用到的玻璃仪器除烧杯外有______________。
(2)步骤2中发生反应的离子方程式为__________________________________。
(3)步骤3中发生反应的化学方程式为________________________________。
(4)步骤4中涉及的操作是:蒸发浓缩._____________.过滤.洗涤.烘干。
23.工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)流程如下:
(1)浸取时,溶液中的Fe2+易被O2氧化,请完成配平该反应的离子方程式__________。
___________
(2)滤渣Ⅰ的成分是___________(填化学式);还原时,试剂X最好选用___________(填正确选项的字母)。
A.Na2SO4 B.Fe粉 C.KMnO4
(3)调pH的主要目的是除去___________离子(填离子符号)。
(4)一系列操作指的是___________、___________、过滤、洗涤、干燥。
参考答案
1.C2.D3.A4.A5.C6.A7.B8.D9.D10.A11.B12.C13.B14.B15.D
16.AB 54.3 500 mL容量瓶 胶头滴管 偏大 偏大
17.8 0.5NA 34.3% 0.2mol/L 容量瓶 ADECB 13.6mL 偏小
18.11.8 mol·L-1 ①③④ 5.6 0.2 B
19.13.2 3.612×1023个(0.6mol) 4.48 0.3 mol·L-1 ④>①>③>② ①⑤⑥⑧⑨ ③④ ⑧
20.2.7 500ml容量瓶、胶头滴管 E FeCl3+3H2O Fe(OH)3(胶体)+3HCl 硅酸胶粒带负电,使Fe(OH)3胶体聚沉 渗析
21.100.0 AD Al2O3+6H+=2Al3++3H2O Fe3O4+8H+=2Fe3++Fe2++4H2O Fe3++3SCN-=Fe(SCN)3 将Fe2+氧化为Fe3+ Fe3++3OH-=Fe(OH)3↓ Al3++4OH-=AlO+2H2O (或Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO+2H2O,)
22.过滤 玻璃棒和漏斗 Fe2++Cu=Cu2++Fe Fe+H2SO4=FeSO4+H2↑ 冷却结晶
23.4Fe2++O2+4H+=4Fe3++2H2O SiO2 B Al3+ 蒸发浓缩 冷却结晶
