人教版高中化学选修四第二章《化学反应速率和化学平衡》单元检测题(含答案)
文档属性
| 名称 | 人教版高中化学选修四第二章《化学反应速率和化学平衡》单元检测题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 152.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-15 22:31:35 | ||
图片预览



文档简介
《化学反应速率和化学平衡》单元检测题
一、单选题
1.已知反应:4HCl(g)+O2(g)===2Cl2(g)+2H2O(g),一定条件下测得反应过程中n(Cl2)与时间的关系如表所示:则2~6min内用O2的物质的量变化表示的反应速率是
t/min
0
2
4
6
8
10
n(Cl2)/mol
0
1.2
2.6
4.4
5.4
6.0
A.7.2mol?min-1
B.0.4mol?min-1
C.0.9mol?min-1
D.0.45mol?min-1
2.某可逆反应L(s)+G(g)
3R(g);
△H>0,下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示
A.平衡混合气中R的质量分数
B.平衡混合气中G的质量分数
C.达到平衡时G的转化率
D.达到平衡时L的转化率
3.氨分解反应在容积为2
L的密闭容器内进行。已知起始时氨气的物质的量为4
mol,5
s末为2.4
mol,则用氨气表示该反应的速率为( )
A.0.32
mol·L-1·s-1
B.0.16
mol·L-1·s-1
C.1.6
mol·L-1·s-1
D.0.8
mol·L-1·s-1
4.已知;(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ·mol﹣1,下列说法中正确的是(
)
A.该反应是吸热反应,因此一定不能自发进行
B.该反应中熵变、焓变皆大于0
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
5.为了研究影响化学反应速率的因素,甲、乙、丙、丁四位学生分别设计了如下四个实验,你认为不正确的是
A.100
mL
2
mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
B.将相同大小、形状的铝条与稀硫酸和浓硫酸反应时,稀硫酸产生氢气快
C.将氢气和氯气的混合气体分别放在冷暗处和强光照射下,会发现光照下有氯化氢生成
D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管再加入少量二氧化锰,产生氧气的快慢不同
6.下列观点正确的是(
)
A.催化剂是影响化学反应速率的主要因素
B.化学反应的反应热与反应途径无关
C.增大压强一定能增大化学反应速率
D.反应物分子间发生碰撞即可发生化学反应
7.在密闭容器中发生下列反应
aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是(
)
A.A的转化率变小
B.平衡向正反应方向移动
C.D的物质的量变多
D.再次平衡时的逆反应速率小于原平衡的正反应速率
8.100mL6mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的(
)
①硫酸钠溶液
②水
③硫酸铜固体
④NaOH溶液
⑤醋酸钠固体
A.②
B.②⑤
C.③④
D.①②⑤
9.少量铁粉与100mL0.01mol/L的稀盐酸反应时,为加快反应速率而不改变生成H2的量,可以采取的方法是(
)
①加H2O
②加NaOH固体③滴入几滴浓盐酸④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol/L盐酸
A.①⑥⑦
B.③⑦⑧
C.③⑤⑧
D.⑤⑦⑧
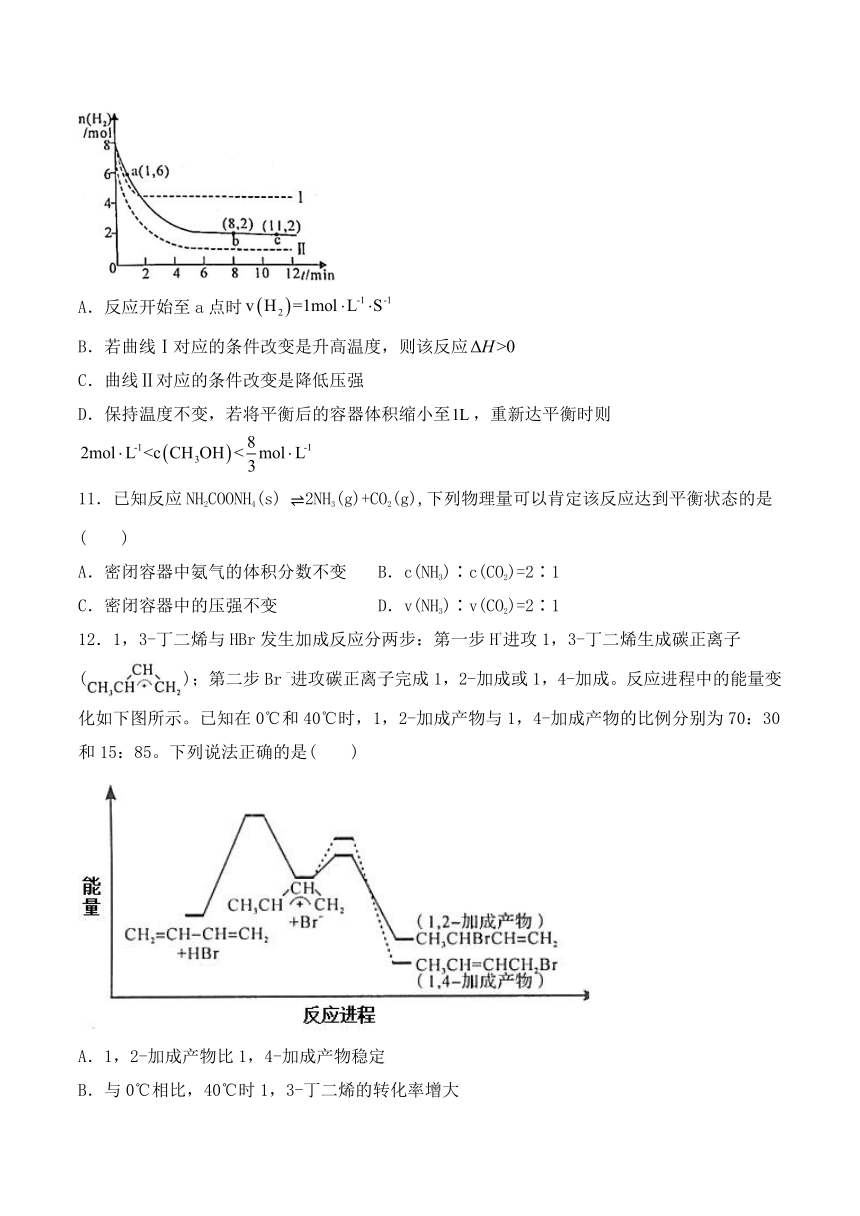
10.工业上可用生产甲醇,反应为:。将和充入的密闭容器中,测得的物质的量随时间变化如图实线所示。图中虚线表示仅改变某一反应条件时,物质的量随时间的变化,下列说法正确的是(
)
A.反应开始至a点时
B.若曲线Ⅰ对应的条件改变是升高温度,则该反应
C.曲线Ⅱ对应的条件改变是降低压强
D.保持温度不变,若将平衡后的容器体积缩小至,重新达平衡时则
11.已知反应NH2COONH4(s)
2NH3(g)+CO2(g),下列物理量可以肯定该反应达到平衡状态的是 ( )
A.密闭容器中氨气的体积分数不变
B.c(NH3)∶c(CO2)=2∶1
C.密闭容器中的压强不变
D.v(NH3)∶v(CO2)=2∶1
12.1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子();第二步Br
-进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如下图所示。已知在0℃和40℃时,1,2-加成产物与1,4-加成产物的比例分别为70:30和15:85。下列说法正确的是(
)
A.1,2-加成产物比1,4-加成产物稳定
B.与0℃相比,40℃时1,3-丁二烯的转化率增大
C.从0℃升至40℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小
D.从0℃升至40℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度
13.在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为6∶5.3
B.若反应开始时容器容积为2L,则v(SO3)=0.35mol·L-1·min-1
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)>1.4mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量小于QkJ
二、填空题
14.如图所示,一定条件下,在体积为3
L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)
+
2H2(g)CH3OH(g)
上述可逆反应正反应为___________反应(填“放热”或“吸热”)。
在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)
=___________________________(用nB、tB表示)。
对处于E点的体系,改变外界条件使平衡向正反应方向移动时,下列有关该体系的说法正确的是______________________(填字母)。
A.H2的转化率一定增大
B.v正一定增大,v逆一定减小
C.CH3OH的质量分数一定增加
D.v逆一定小于v正
15.在化学的学习中,我们会学到很多理论,这些理论对化学中千变万化的现象的规律性总结,指导我们认识化学世界的变化规律和本质。
(1)化学家盖斯根据一系列事实于1840年提出了盖斯定律:不管化学过程是____步完成或分几步完成,其反应热是____
(填“相同”或“不同”)的。换句话说,化学反应的反应热只与反应体系的____和____有关,而与反应的途径无关。
(2)法国化学家勒夏特列总结出一条经验规律:如果改变影响平衡的条件之一(如温度、______、以及参加及应的化学物质的______),平衡将向着能够这种改变的方向移动,这就是著名的勒夏特列原理。
(3)已知NaSO4·10H2ONaSO4·nH2O+(10?n)
H2O,将装有芒硝的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将______能转化为______能,晚上将______能转化为______能。
16.甲烷是一种理想的洁净燃料,利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g)
CO(g)+3H2(g)
△H>0
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
CH4
H2O
CO
H2
3.0
mol·L-1
8.5
mol·L-1
2.0
mol·L-1
2.0
mol·L-1
(1)则此时正、逆反应速率的关系是__________
。(填“>”“<”“=”)
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101
kPa或303
kPa,其余实验条件见下表)。
实验序号
温度/℃
压强/kPa
CH4初始浓度/mol·L-1
H2O初始浓度/
mol·L-1
1
360
P
2.00
6.80
2
t
101
2.00
6.80
3
360
101
2.00
6.80
(2)表中t=_________,P=_________;设计实验2、3的目的是______________;
实验l、2、3中反应的化学平衡常数的大小关系是_________(用K1、K2、K3表示)
(3)—定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,
一段时间后达到平衡。
容器
甲
乙
反应物投入量
1molCH4、
1molH2O
amolCH4、
amolH2O、
b
molCO、
c
molH2
经测定甲容器经过5min达到平衡,平衡后甲中气体的压强为开始的1.2倍,甲容器中该反应在5min内的平均速率v(H2)=__________,若要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为__________________。
三、实验题
17.生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关四环素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应)
相关资料
①氰化物主要以CN-和[Fe(CN)6]3-两种形式存在
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂,Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH值越大,越稳定,越难被氧化。
实验过程
(1)请完成以下实验设计表(表中不要留空格)
实验
序号
实验目的
初始pH
废水样品体积/mL
CuSO4溶液的体积/mL
双氧水溶液的体积/mL
蒸馏水的体积/mL
1
为以下实验操作参考
7
60
10
10
20
2
废水的初始pH对破氰反应速率的影响
12
60
10
10
20
3
___
7
60
___
___
10
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示。
(2)实验①中20~60min时间段反应速率:υ(CN-)=___mol?L-1?min-1。
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是__(填一点即可),在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式___。
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成表2中内容。(已知:废水中的CN-浓度可用离子色谱仪测定)___
实验步骤(不要写出具体操作过程)
预期实验现象和结论
18.为分别验证温度、浓度、催化剂颗粒大小对化学反应速率的影响规律,某同学设计了如下4组实验。
(1)上表中,反应速率最快的是_______;
(2)实验3、4预期可得出的结论是_______;
(3)设计实验2、3的目的是_________;
(4)设计一个实验证明在其它条件相同时,改变温度对过氧化氢分解速率的影响(写出操作步骤)__________。
四、计算题
19.在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)4NO2(g)+
O2(g)。反应5min后,测得N2O5转化了20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
(要求写出计算过程)
20.在2
L密闭容器中充入1
mol
N2和3
mol
H2,一定条件下发生反应,2
min后达到平衡状态。相同温度下,测得平衡时混合气体的压强比反应前混合气体的压强减小了1/10。
请据此填空:
(1)平衡时混合气体中三种气体的物质的量之比为______________。
(2)N2的转化率为________________;
(3)2
min内,NH3的平均反应速率为_________________________________。
21.可逆反应4A(g)+5B(g)4C(g)+6D(g),取4
mol
A和5
mol
B置于容积为5
L的密闭容器中,20
s后,测得容器内A的浓度为0.4
mol·L-1。则此时B、C的浓度是多少?若以物质D来表示这段时间的反应速率应为多少?__________
参考答案
1.B
2.B
3.B
4.B
5.A
6.B
7.A
8.D
9.B
10.D
11.C
12.D
13.D
14.
(1)放热
(2)2nB/3tBmol/(L·min)
(3)D
15.一
相同
始态
终态
压强
浓度
太阳
化学
化学
热
16.>
480
303
探究温度对化学反应速率的影响
K1=K30.06mol·L-1
min-1
0.217.双氧水的浓度对破氰反应速率的影响
10
20
0.0175
初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)
CN-+H2O2+H2O═NH3↑+HCO3-
实验方案(不要求写出具体操作过程)
预期实验现象和结论
分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度
相同时间内,若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用;若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用
18.2
催化剂颗粒越小,化学反应速率越大
探究浓度对化学反应速率的影响
取相同浓度的过氧化氢溶液,控制催化剂相同,分别在不同温度下加热,观察产生气体的快慢
19.(1)υ(NO2)=0.16mol/(L·min)υ(O2)=0.O4mol/(L·min)(2)61.5%
20.2∶6∶1
20%
0.1
mol·L-1·min-1
21.B的浓度是0.5mol/L,C的浓度是0.4mol/L,若以物质D来表示这段时间的反应速率应为0.03mol/(L?s)
一、单选题
1.已知反应:4HCl(g)+O2(g)===2Cl2(g)+2H2O(g),一定条件下测得反应过程中n(Cl2)与时间的关系如表所示:则2~6min内用O2的物质的量变化表示的反应速率是
t/min
0
2
4
6
8
10
n(Cl2)/mol
0
1.2
2.6
4.4
5.4
6.0
A.7.2mol?min-1
B.0.4mol?min-1
C.0.9mol?min-1
D.0.45mol?min-1
2.某可逆反应L(s)+G(g)
3R(g);
△H>0,下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示
A.平衡混合气中R的质量分数
B.平衡混合气中G的质量分数
C.达到平衡时G的转化率
D.达到平衡时L的转化率
3.氨分解反应在容积为2
L的密闭容器内进行。已知起始时氨气的物质的量为4
mol,5
s末为2.4
mol,则用氨气表示该反应的速率为( )
A.0.32
mol·L-1·s-1
B.0.16
mol·L-1·s-1
C.1.6
mol·L-1·s-1
D.0.8
mol·L-1·s-1
4.已知;(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ·mol﹣1,下列说法中正确的是(
)
A.该反应是吸热反应,因此一定不能自发进行
B.该反应中熵变、焓变皆大于0
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
5.为了研究影响化学反应速率的因素,甲、乙、丙、丁四位学生分别设计了如下四个实验,你认为不正确的是
A.100
mL
2
mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
B.将相同大小、形状的铝条与稀硫酸和浓硫酸反应时,稀硫酸产生氢气快
C.将氢气和氯气的混合气体分别放在冷暗处和强光照射下,会发现光照下有氯化氢生成
D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管再加入少量二氧化锰,产生氧气的快慢不同
6.下列观点正确的是(
)
A.催化剂是影响化学反应速率的主要因素
B.化学反应的反应热与反应途径无关
C.增大压强一定能增大化学反应速率
D.反应物分子间发生碰撞即可发生化学反应
7.在密闭容器中发生下列反应
aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是(
)
A.A的转化率变小
B.平衡向正反应方向移动
C.D的物质的量变多
D.再次平衡时的逆反应速率小于原平衡的正反应速率
8.100mL6mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的(
)
①硫酸钠溶液
②水
③硫酸铜固体
④NaOH溶液
⑤醋酸钠固体
A.②
B.②⑤
C.③④
D.①②⑤
9.少量铁粉与100mL0.01mol/L的稀盐酸反应时,为加快反应速率而不改变生成H2的量,可以采取的方法是(
)
①加H2O
②加NaOH固体③滴入几滴浓盐酸④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol/L盐酸
A.①⑥⑦
B.③⑦⑧
C.③⑤⑧
D.⑤⑦⑧
10.工业上可用生产甲醇,反应为:。将和充入的密闭容器中,测得的物质的量随时间变化如图实线所示。图中虚线表示仅改变某一反应条件时,物质的量随时间的变化,下列说法正确的是(
)
A.反应开始至a点时
B.若曲线Ⅰ对应的条件改变是升高温度,则该反应
C.曲线Ⅱ对应的条件改变是降低压强
D.保持温度不变,若将平衡后的容器体积缩小至,重新达平衡时则
11.已知反应NH2COONH4(s)
2NH3(g)+CO2(g),下列物理量可以肯定该反应达到平衡状态的是 ( )
A.密闭容器中氨气的体积分数不变
B.c(NH3)∶c(CO2)=2∶1
C.密闭容器中的压强不变
D.v(NH3)∶v(CO2)=2∶1
12.1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子();第二步Br
-进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如下图所示。已知在0℃和40℃时,1,2-加成产物与1,4-加成产物的比例分别为70:30和15:85。下列说法正确的是(
)
A.1,2-加成产物比1,4-加成产物稳定
B.与0℃相比,40℃时1,3-丁二烯的转化率增大
C.从0℃升至40℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小
D.从0℃升至40℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度
13.在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为6∶5.3
B.若反应开始时容器容积为2L,则v(SO3)=0.35mol·L-1·min-1
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)>1.4mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量小于QkJ
二、填空题
14.如图所示,一定条件下,在体积为3
L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)
+
2H2(g)CH3OH(g)
上述可逆反应正反应为___________反应(填“放热”或“吸热”)。
在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)
=___________________________(用nB、tB表示)。
对处于E点的体系,改变外界条件使平衡向正反应方向移动时,下列有关该体系的说法正确的是______________________(填字母)。
A.H2的转化率一定增大
B.v正一定增大,v逆一定减小
C.CH3OH的质量分数一定增加
D.v逆一定小于v正
15.在化学的学习中,我们会学到很多理论,这些理论对化学中千变万化的现象的规律性总结,指导我们认识化学世界的变化规律和本质。
(1)化学家盖斯根据一系列事实于1840年提出了盖斯定律:不管化学过程是____步完成或分几步完成,其反应热是____
(填“相同”或“不同”)的。换句话说,化学反应的反应热只与反应体系的____和____有关,而与反应的途径无关。
(2)法国化学家勒夏特列总结出一条经验规律:如果改变影响平衡的条件之一(如温度、______、以及参加及应的化学物质的______),平衡将向着能够这种改变的方向移动,这就是著名的勒夏特列原理。
(3)已知NaSO4·10H2ONaSO4·nH2O+(10?n)
H2O,将装有芒硝的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将______能转化为______能,晚上将______能转化为______能。
16.甲烷是一种理想的洁净燃料,利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g)
CO(g)+3H2(g)
△H>0
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
CH4
H2O
CO
H2
3.0
mol·L-1
8.5
mol·L-1
2.0
mol·L-1
2.0
mol·L-1
(1)则此时正、逆反应速率的关系是__________
。(填“>”“<”“=”)
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101
kPa或303
kPa,其余实验条件见下表)。
实验序号
温度/℃
压强/kPa
CH4初始浓度/mol·L-1
H2O初始浓度/
mol·L-1
1
360
P
2.00
6.80
2
t
101
2.00
6.80
3
360
101
2.00
6.80
(2)表中t=_________,P=_________;设计实验2、3的目的是______________;
实验l、2、3中反应的化学平衡常数的大小关系是_________(用K1、K2、K3表示)
(3)—定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,
一段时间后达到平衡。
容器
甲
乙
反应物投入量
1molCH4、
1molH2O
amolCH4、
amolH2O、
b
molCO、
c
molH2
经测定甲容器经过5min达到平衡,平衡后甲中气体的压强为开始的1.2倍,甲容器中该反应在5min内的平均速率v(H2)=__________,若要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为__________________。
三、实验题
17.生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关四环素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应)
相关资料
①氰化物主要以CN-和[Fe(CN)6]3-两种形式存在
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂,Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH值越大,越稳定,越难被氧化。
实验过程
(1)请完成以下实验设计表(表中不要留空格)
实验
序号
实验目的
初始pH
废水样品体积/mL
CuSO4溶液的体积/mL
双氧水溶液的体积/mL
蒸馏水的体积/mL
1
为以下实验操作参考
7
60
10
10
20
2
废水的初始pH对破氰反应速率的影响
12
60
10
10
20
3
___
7
60
___
___
10
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示。
(2)实验①中20~60min时间段反应速率:υ(CN-)=___mol?L-1?min-1。
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是__(填一点即可),在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式___。
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成表2中内容。(已知:废水中的CN-浓度可用离子色谱仪测定)___
实验步骤(不要写出具体操作过程)
预期实验现象和结论
18.为分别验证温度、浓度、催化剂颗粒大小对化学反应速率的影响规律,某同学设计了如下4组实验。
(1)上表中,反应速率最快的是_______;
(2)实验3、4预期可得出的结论是_______;
(3)设计实验2、3的目的是_________;
(4)设计一个实验证明在其它条件相同时,改变温度对过氧化氢分解速率的影响(写出操作步骤)__________。
四、计算题
19.在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)4NO2(g)+
O2(g)。反应5min后,测得N2O5转化了20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
(要求写出计算过程)
20.在2
L密闭容器中充入1
mol
N2和3
mol
H2,一定条件下发生反应,2
min后达到平衡状态。相同温度下,测得平衡时混合气体的压强比反应前混合气体的压强减小了1/10。
请据此填空:
(1)平衡时混合气体中三种气体的物质的量之比为______________。
(2)N2的转化率为________________;
(3)2
min内,NH3的平均反应速率为_________________________________。
21.可逆反应4A(g)+5B(g)4C(g)+6D(g),取4
mol
A和5
mol
B置于容积为5
L的密闭容器中,20
s后,测得容器内A的浓度为0.4
mol·L-1。则此时B、C的浓度是多少?若以物质D来表示这段时间的反应速率应为多少?__________
参考答案
1.B
2.B
3.B
4.B
5.A
6.B
7.A
8.D
9.B
10.D
11.C
12.D
13.D
14.
(1)放热
(2)2nB/3tBmol/(L·min)
(3)D
15.一
相同
始态
终态
压强
浓度
太阳
化学
化学
热
16.>
480
303
探究温度对化学反应速率的影响
K1=K3
min-1
0.2
10
20
0.0175
初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)
CN-+H2O2+H2O═NH3↑+HCO3-
实验方案(不要求写出具体操作过程)
预期实验现象和结论
分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度
相同时间内,若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用;若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用
18.2
催化剂颗粒越小,化学反应速率越大
探究浓度对化学反应速率的影响
取相同浓度的过氧化氢溶液,控制催化剂相同,分别在不同温度下加热,观察产生气体的快慢
19.(1)υ(NO2)=0.16mol/(L·min)υ(O2)=0.O4mol/(L·min)(2)61.5%
20.2∶6∶1
20%
0.1
mol·L-1·min-1
21.B的浓度是0.5mol/L,C的浓度是0.4mol/L,若以物质D来表示这段时间的反应速率应为0.03mol/(L?s)
