仁爱版初中化学九年级上册专题六 物质的溶解检测题(含答案)
文档属性
| 名称 | 仁爱版初中化学九年级上册专题六 物质的溶解检测题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 105.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-16 00:00:00 | ||
图片预览


文档简介
本卷由系统自动生成,请仔细校对后使用,答案仅供参考。
《物质的溶解》检测题
一、单选题
1.下列对一些事实的解释中,合理的是
A.事实:洗涤剂能去油污;解释:洗涤剂能使油污溶于水形成溶液
B.事实:净水器中有活性炭;解释:活性炭有吸附作用
C.事实:电解水时可生成氢气和氧气;解释:水由氢气和氧气组成
D.事实:6000L氧气加压可装入40L的钢瓶中;解释:氧分子体积变小
2.判断下列的说法正确的是(
)
A.20℃时,100g食盐溶液里含有10g食盐,所以20℃时食盐的溶解度为10g
B.20℃时食盐的溶解度为36g,则100克饱和食盐水中含氯化钠36g
C.50℃时氯化铵饱和溶液150g中,含氯化铵50g,则50℃时氯化铵的溶解度为50g
D.100g的水中最多可溶解氯化钠36g,则氯化钠的溶解度为36g
3.如图为a、b、c三种固体物质的溶解度曲线,下列说法正确的是
A.图中M点时a、c两种物质的溶液中溶质质量一定相等
B.将c物质的溶液升温至t2°C,一定有晶体析出
C.t1°C时,将b物质的不饱和溶液变为饱和溶液,可以增加溶质b
D.将t2°C时a、b、c的饱和溶液分别降温至t1°C时,所得溶液溶质质量分数的大小关系是b>a=c
4.下列关于溶液的叙述中,错误的是
A.泥沙水中,泥沙是溶质,水是溶剂
B.搅拌和升温能加快溶质的溶解,是因为加快微粒的运动速率
C.物质的溶解过程通常会伴随着能量的变化
D.溶液不一定是无色透明的液体
5.如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是(
)
A.t1℃时,把甲的不饱和溶液变为饱和溶液,溶剂质量一定不变
B.t2℃时,甲、乙两种物质饱和溶液的溶质质量分数一定相等
C.将t1℃时的甲、乙、丙三种物质的饱和溶液升温到t2℃,三种溶液的溶质质量分数大小关系是:甲=乙>丙
D.若甲中混有少量乙,可采用蒸发结晶的方法提纯甲
6.氯化钾(KCl)和氯酸钾(KClO3)的溶解度随温度变化曲线如图所示,下列说法正确的是
A.30℃时,KCl饱和溶液的溶质质量分数为35%
B.60℃时,a点对应KCl溶液恒温加水可变饱和
C.KCl的溶解度随温度变化的趋势比KClO3大
D.90℃150gKClO3饱和溶液降温到10℃可析出45g晶体
7.保持温度不变,小心蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是(
)
A.B.C.D.
8.有关溶质质量分数叙述正确的是
A.某盐酸中氯化氢含量为36%是指100克水中含氯化氢36克
B.往某溶液中加固体,则溶质质量分数一定变大
C.一定温度下,饱和溶液的溶质质量分数是定值
D.溶质的质量分数越大,溶液中的溶质含量越大
9.除去下列物质或溶液中杂质(括号内为杂质)的方法,合理可行的是(
)
A.氧化钙(碳酸钙)加水、过滤
B.氯化亚铁(氯化铜)加足量铁粉、过滤
C.硫酸(硫酸钠)加入适量氯化钡试剂、过滤
D.氯化钾(氢氧化钾)通入足量二氧化碳气体
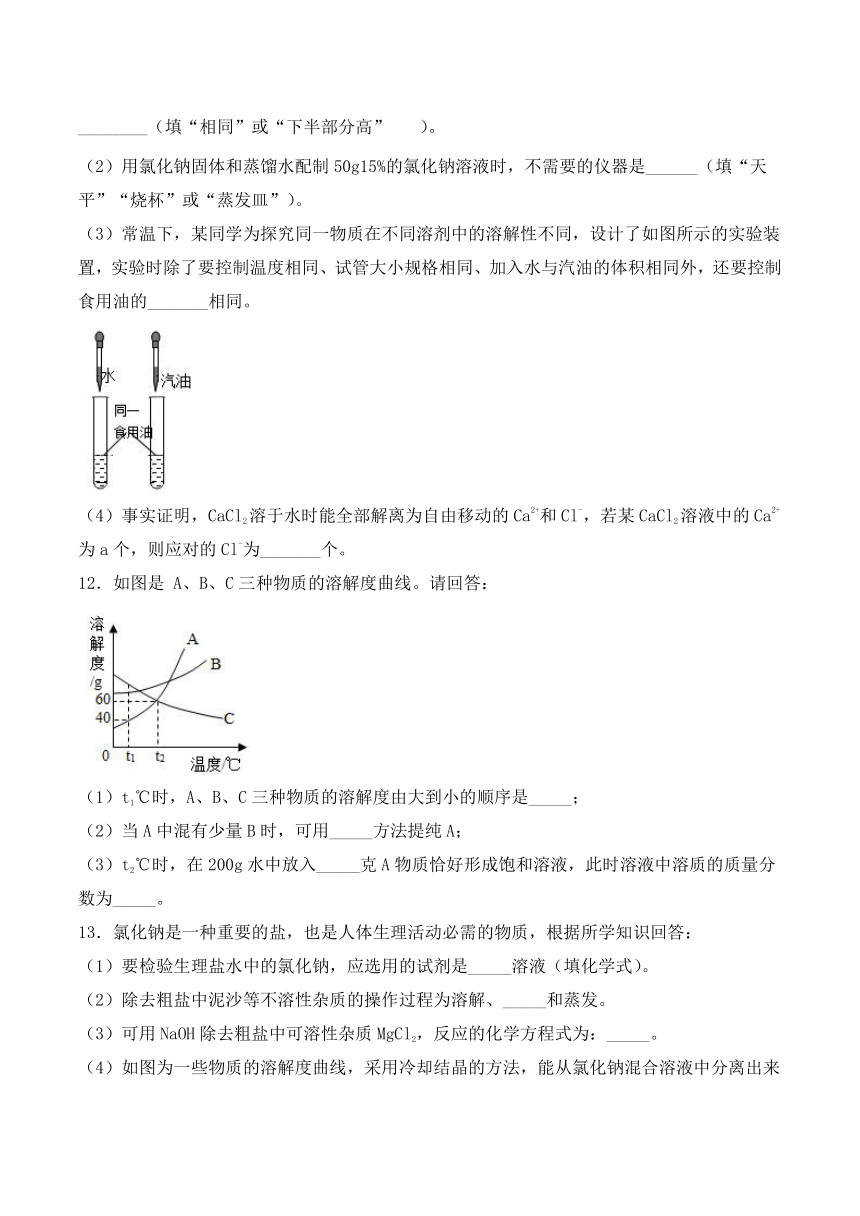
10.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是( )
A.t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙
B.t2℃时,30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为37.5%
C.将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,析出晶体最多的是甲
D.欲将丙物质的不饱和溶液变为饱和溶液,可以采取升高温度的方法
二、填空题
11.生活生产中,一种或几种物质分散到水等物质里的现象广泛存在。
(1)常温下,在密闭容器中的蔗糖溶液里,溶液下半部分的甜度与上半部分的甜度的关系是________(填“相同”或“下半部分高”)。
(2)用氯化钠固体和蒸馏水配制50g15%的氯化钠溶液时,不需要的仪器是______(填“天平”“烧杯”或“蒸发皿”)。
(3)常温下,某同学为探究同一物质在不同溶剂中的溶解性不同,设计了如图所示的实验装置,实验时除了要控制温度相同、试管大小规格相同、加入水与汽油的体积相同外,还要控制食用油的_______相同。
(4)事实证明,CaCl2溶于水时能全部解离为自由移动的Ca2+和Cl-,若某CaCl2溶液中的Ca2+为a个,则应对的Cl-为_______个。
12.如图是
A、B、C三种物质的溶解度曲线。请回答:
(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是_____;
(2)当A中混有少量B时,可用_____方法提纯A;
(3)t2℃时,在200g水中放入_____克A物质恰好形成饱和溶液,此时溶液中溶质的质量分数为_____。
13.氯化钠是一种重要的盐,也是人体生理活动必需的物质,根据所学知识回答:
(1)要检验生理盐水中的氯化钠,应选用的试剂是_____溶液(填化学式)。
(2)除去粗盐中泥沙等不溶性杂质的操作过程为溶解、_____和蒸发。
(3)可用NaOH除去粗盐中可溶性杂质MgCl2,反应的化学方程式为:_____。
(4)如图为一些物质的溶解度曲线,采用冷却结晶的方法,能从氯化钠混合溶液中分离出来的物质有_____(从图的物质中选填)。
三、实验题
14.请根据X、Y的溶解度曲线。
(1)t3℃时50克水中放入30克X充分溶解后溶液所处的状态_____(是否饱和)。
(2)X中混有少量的Y,你用什么方法除去Y。_____
15.精盐中含有较多的可溶性杂质(氯化镁、氯化钙)和不溶性杂质,进行粗盐提纯的实验:
①实验步骤包括:a
计算产率,b
过滤,c
溶解,d
蒸发,e
称量。实验步骤的正确顺序是:e,_______________,a(填写编号)。
②最后得到的精盐属于____________(填“混合物”或“纯净物”。)
③已知:产率=×100%,某实验小组计算出的产率比其他组的产率低,你认为有哪些原因:____________________。
16.根据如图所示实验回答下列问题:
(1)甲是实验室制取二氧化碳的实验,实验过程中长颈漏斗的下端必须浸没在稀盐酸中,形成“液封”,其目的是_____,该装置还可用于制取_____。
(2)乙为铝丝(经充分打磨)与硫酸铜溶液反应的实验,充分反应一段时间后,可观察到的现象是_____。发生反应的化方程式为_____。
(3)如图丙是探究不同溶质在同一溶剂中的溶解性实验,除需要控制汽油的体积相等外,还需要控制_____相等。
四、推断题
17.A、B、C、D是初中化学常见的物质,它们之间的转化关系如图所示:
(1)若该反应为高温下进行的置换反应,且A、C为黑色固体,A具有磁性,D在常温常压下为无色无味的气体,反应的化学方程式为_______________________________.
(2)若该反应为A燃烧不充分的反应,且A由两种元素组成,质量比为3:1,B可供给动物呼吸,常温下C为气体,反应的化学方程式为_____________________________.
(3)若在20℃时,将B溶于乙醇中配成饱和溶液,通入适量A发生反应,且A是参与光合作用的气体,B为碱,C为纯碱,则在乙醇中该反应的化学方程式为_________________________.
20℃时,B、C在水中和乙醇中的溶解度
物质
水中的溶解度
乙醇中的溶解度
B
109g
17.3g
C
21.8g
<0.01g
五、计算题
18.20
℃时,将40
g氯化钠(20
℃时NaCl的溶解度为36.0
g)放入100
g水中,所配置的溶液溶质质量分数是_______
19.已知氯化铵在30℃时的溶解度为45.8克。30℃时将68.7克氯化铵配制成400克的溶液,通过计算:
(1)溶液是否饱和?
(2)若不饱和,为了使其饱和,可用下面的方法:
①蒸发溶剂法:需蒸发多少克水才能成为饱和溶液?
②加溶质法:需再加入多少克氯化铵,溶液才能成为饱和溶液?
20.台风是台州地区夏天常见的自然灾害。台风、洪灾过后,为防止细菌、病毒传染,水淹后的房间应及时消毒。过氧化氢溶液俗称双氧水,是常用消毒剂。
(1)小科要配制质量分数为的过氧化氢溶液,需要如图所示的过氧化氢溶液多少毫升?需要水多少毫升?请写出计算过程。
过氧化氢溶液(550毫升)
溶质质量分数:
密度:
注意:密封保存、不能久置
(2)如果用量筒量水时仰视读数,则所配制的溶液中溶质质量分数会______(填“偏大”“偏小”或“不变”)。
21.实验小组的同学对实验室制取二氧化碳反应后的溶液进行了如下探究:取大理石和盐酸反应且过滤后所得废液20克于烧杯中,逐滴滴入碳酸钠溶液至过量,滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系如图所示.试回答:
(1)分析图中信息可知,20g废液中,所含的溶质是________(写化学式);
(2)在废液中加入碳酸钠溶液,首先与碳酸钠溶液反应的化学方程式为________;
(3)计算废液中氯化钙的质量分数是多少?(写出计算过程
参考答案
1.B
2.C
3.C
4.A
5.B
6.D
7.A
8.C
9.B
10.B
11.相同
蒸发皿
体积
2a
12.C>B>A
降温结晶
120
37.5%
13.AgNO3
过滤
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
硝酸钾
14.饱和
降温结晶
15.cbde
混合物
溶解时没有完全溶解(或蒸发时未用玻璃棒搅拌使得液体飞溅)
16.防止二氧化碳沿长颈漏斗逸出
氧气
铝丝表面有红色物质出现,蓝色溶液慢慢变成无色
2Al+3CuSO4=3Cu+Al2(SO4)3
高锰酸钾和碘的质量
17.Fe3O4+2C3Fe+2CO2↑
2CH4+3O22CO+4H2O
2NaOH+CO2=Na2CO3↓+H2O
18.26.45%
19.(1)不饱和;(2)①181.3g;②83g
20.(1)100毫升;110毫升;(2)偏小
21.(1)CaCl2和HCl;(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑;(3)11.1%
答案第1页,总2页
《物质的溶解》检测题
一、单选题
1.下列对一些事实的解释中,合理的是
A.事实:洗涤剂能去油污;解释:洗涤剂能使油污溶于水形成溶液
B.事实:净水器中有活性炭;解释:活性炭有吸附作用
C.事实:电解水时可生成氢气和氧气;解释:水由氢气和氧气组成
D.事实:6000L氧气加压可装入40L的钢瓶中;解释:氧分子体积变小
2.判断下列的说法正确的是(
)
A.20℃时,100g食盐溶液里含有10g食盐,所以20℃时食盐的溶解度为10g
B.20℃时食盐的溶解度为36g,则100克饱和食盐水中含氯化钠36g
C.50℃时氯化铵饱和溶液150g中,含氯化铵50g,则50℃时氯化铵的溶解度为50g
D.100g的水中最多可溶解氯化钠36g,则氯化钠的溶解度为36g
3.如图为a、b、c三种固体物质的溶解度曲线,下列说法正确的是
A.图中M点时a、c两种物质的溶液中溶质质量一定相等
B.将c物质的溶液升温至t2°C,一定有晶体析出
C.t1°C时,将b物质的不饱和溶液变为饱和溶液,可以增加溶质b
D.将t2°C时a、b、c的饱和溶液分别降温至t1°C时,所得溶液溶质质量分数的大小关系是b>a=c
4.下列关于溶液的叙述中,错误的是
A.泥沙水中,泥沙是溶质,水是溶剂
B.搅拌和升温能加快溶质的溶解,是因为加快微粒的运动速率
C.物质的溶解过程通常会伴随着能量的变化
D.溶液不一定是无色透明的液体
5.如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是(
)
A.t1℃时,把甲的不饱和溶液变为饱和溶液,溶剂质量一定不变
B.t2℃时,甲、乙两种物质饱和溶液的溶质质量分数一定相等
C.将t1℃时的甲、乙、丙三种物质的饱和溶液升温到t2℃,三种溶液的溶质质量分数大小关系是:甲=乙>丙
D.若甲中混有少量乙,可采用蒸发结晶的方法提纯甲
6.氯化钾(KCl)和氯酸钾(KClO3)的溶解度随温度变化曲线如图所示,下列说法正确的是
A.30℃时,KCl饱和溶液的溶质质量分数为35%
B.60℃时,a点对应KCl溶液恒温加水可变饱和
C.KCl的溶解度随温度变化的趋势比KClO3大
D.90℃150gKClO3饱和溶液降温到10℃可析出45g晶体
7.保持温度不变,小心蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是(
)
A.B.C.D.
8.有关溶质质量分数叙述正确的是
A.某盐酸中氯化氢含量为36%是指100克水中含氯化氢36克
B.往某溶液中加固体,则溶质质量分数一定变大
C.一定温度下,饱和溶液的溶质质量分数是定值
D.溶质的质量分数越大,溶液中的溶质含量越大
9.除去下列物质或溶液中杂质(括号内为杂质)的方法,合理可行的是(
)
A.氧化钙(碳酸钙)加水、过滤
B.氯化亚铁(氯化铜)加足量铁粉、过滤
C.硫酸(硫酸钠)加入适量氯化钡试剂、过滤
D.氯化钾(氢氧化钾)通入足量二氧化碳气体
10.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是( )
A.t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙
B.t2℃时,30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为37.5%
C.将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,析出晶体最多的是甲
D.欲将丙物质的不饱和溶液变为饱和溶液,可以采取升高温度的方法
二、填空题
11.生活生产中,一种或几种物质分散到水等物质里的现象广泛存在。
(1)常温下,在密闭容器中的蔗糖溶液里,溶液下半部分的甜度与上半部分的甜度的关系是________(填“相同”或“下半部分高”)。
(2)用氯化钠固体和蒸馏水配制50g15%的氯化钠溶液时,不需要的仪器是______(填“天平”“烧杯”或“蒸发皿”)。
(3)常温下,某同学为探究同一物质在不同溶剂中的溶解性不同,设计了如图所示的实验装置,实验时除了要控制温度相同、试管大小规格相同、加入水与汽油的体积相同外,还要控制食用油的_______相同。
(4)事实证明,CaCl2溶于水时能全部解离为自由移动的Ca2+和Cl-,若某CaCl2溶液中的Ca2+为a个,则应对的Cl-为_______个。
12.如图是
A、B、C三种物质的溶解度曲线。请回答:
(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是_____;
(2)当A中混有少量B时,可用_____方法提纯A;
(3)t2℃时,在200g水中放入_____克A物质恰好形成饱和溶液,此时溶液中溶质的质量分数为_____。
13.氯化钠是一种重要的盐,也是人体生理活动必需的物质,根据所学知识回答:
(1)要检验生理盐水中的氯化钠,应选用的试剂是_____溶液(填化学式)。
(2)除去粗盐中泥沙等不溶性杂质的操作过程为溶解、_____和蒸发。
(3)可用NaOH除去粗盐中可溶性杂质MgCl2,反应的化学方程式为:_____。
(4)如图为一些物质的溶解度曲线,采用冷却结晶的方法,能从氯化钠混合溶液中分离出来的物质有_____(从图的物质中选填)。
三、实验题
14.请根据X、Y的溶解度曲线。
(1)t3℃时50克水中放入30克X充分溶解后溶液所处的状态_____(是否饱和)。
(2)X中混有少量的Y,你用什么方法除去Y。_____
15.精盐中含有较多的可溶性杂质(氯化镁、氯化钙)和不溶性杂质,进行粗盐提纯的实验:
①实验步骤包括:a
计算产率,b
过滤,c
溶解,d
蒸发,e
称量。实验步骤的正确顺序是:e,_______________,a(填写编号)。
②最后得到的精盐属于____________(填“混合物”或“纯净物”。)
③已知:产率=×100%,某实验小组计算出的产率比其他组的产率低,你认为有哪些原因:____________________。
16.根据如图所示实验回答下列问题:
(1)甲是实验室制取二氧化碳的实验,实验过程中长颈漏斗的下端必须浸没在稀盐酸中,形成“液封”,其目的是_____,该装置还可用于制取_____。
(2)乙为铝丝(经充分打磨)与硫酸铜溶液反应的实验,充分反应一段时间后,可观察到的现象是_____。发生反应的化方程式为_____。
(3)如图丙是探究不同溶质在同一溶剂中的溶解性实验,除需要控制汽油的体积相等外,还需要控制_____相等。
四、推断题
17.A、B、C、D是初中化学常见的物质,它们之间的转化关系如图所示:
(1)若该反应为高温下进行的置换反应,且A、C为黑色固体,A具有磁性,D在常温常压下为无色无味的气体,反应的化学方程式为_______________________________.
(2)若该反应为A燃烧不充分的反应,且A由两种元素组成,质量比为3:1,B可供给动物呼吸,常温下C为气体,反应的化学方程式为_____________________________.
(3)若在20℃时,将B溶于乙醇中配成饱和溶液,通入适量A发生反应,且A是参与光合作用的气体,B为碱,C为纯碱,则在乙醇中该反应的化学方程式为_________________________.
20℃时,B、C在水中和乙醇中的溶解度
物质
水中的溶解度
乙醇中的溶解度
B
109g
17.3g
C
21.8g
<0.01g
五、计算题
18.20
℃时,将40
g氯化钠(20
℃时NaCl的溶解度为36.0
g)放入100
g水中,所配置的溶液溶质质量分数是_______
19.已知氯化铵在30℃时的溶解度为45.8克。30℃时将68.7克氯化铵配制成400克的溶液,通过计算:
(1)溶液是否饱和?
(2)若不饱和,为了使其饱和,可用下面的方法:
①蒸发溶剂法:需蒸发多少克水才能成为饱和溶液?
②加溶质法:需再加入多少克氯化铵,溶液才能成为饱和溶液?
20.台风是台州地区夏天常见的自然灾害。台风、洪灾过后,为防止细菌、病毒传染,水淹后的房间应及时消毒。过氧化氢溶液俗称双氧水,是常用消毒剂。
(1)小科要配制质量分数为的过氧化氢溶液,需要如图所示的过氧化氢溶液多少毫升?需要水多少毫升?请写出计算过程。
过氧化氢溶液(550毫升)
溶质质量分数:
密度:
注意:密封保存、不能久置
(2)如果用量筒量水时仰视读数,则所配制的溶液中溶质质量分数会______(填“偏大”“偏小”或“不变”)。
21.实验小组的同学对实验室制取二氧化碳反应后的溶液进行了如下探究:取大理石和盐酸反应且过滤后所得废液20克于烧杯中,逐滴滴入碳酸钠溶液至过量,滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系如图所示.试回答:
(1)分析图中信息可知,20g废液中,所含的溶质是________(写化学式);
(2)在废液中加入碳酸钠溶液,首先与碳酸钠溶液反应的化学方程式为________;
(3)计算废液中氯化钙的质量分数是多少?(写出计算过程
参考答案
1.B
2.C
3.C
4.A
5.B
6.D
7.A
8.C
9.B
10.B
11.相同
蒸发皿
体积
2a
12.C>B>A
降温结晶
120
37.5%
13.AgNO3
过滤
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
硝酸钾
14.饱和
降温结晶
15.cbde
混合物
溶解时没有完全溶解(或蒸发时未用玻璃棒搅拌使得液体飞溅)
16.防止二氧化碳沿长颈漏斗逸出
氧气
铝丝表面有红色物质出现,蓝色溶液慢慢变成无色
2Al+3CuSO4=3Cu+Al2(SO4)3
高锰酸钾和碘的质量
17.Fe3O4+2C3Fe+2CO2↑
2CH4+3O22CO+4H2O
2NaOH+CO2=Na2CO3↓+H2O
18.26.45%
19.(1)不饱和;(2)①181.3g;②83g
20.(1)100毫升;110毫升;(2)偏小
21.(1)CaCl2和HCl;(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑;(3)11.1%
答案第1页,总2页
同课章节目录
- 专题一 走进化学殿堂
- 单元1 化学使生活更美好
- 单元2 如何学习化学
- 专题二 空气和水
- 单元1 多组分的空气
- 单元2 氧气
- 单元3 自然界的水
- 专题三 物质的构成
- 单元1 构成物质的微粒
- 单元2 组成物质的元素
- 单元3 纯净物组成的表示方法
- 专题四 燃料与燃烧
- 单元1 燃烧与灭火
- 单元2 碳及其化合物
- 单元3 化石燃料的利用
- 专题五 化学变化及其表示
- 单元1 化学变化是有条件的
- 单元2 质量守恒定律
- 单元3 化学方程式
- 专题六 物质的溶解
- 单元1 物质的溶解过程
- 单元2 物质的溶解性
- 单元3 物质的溶解性的改变
- 学生实验
- 实验1 实验基本操作
- 实验2 氧气的实验室制取与性质
- 实验3 燃烧的条件
- 实验4 二氧化碳的实验室制取与性质
- 实验5 一定浓度溶液的配置
