上海市奉贤区2020-2021学年九年级上学期期末化学试题(含答案解析)
文档属性
| 名称 | 上海市奉贤区2020-2021学年九年级上学期期末化学试题(含答案解析) |  | |
| 格式 | docx | ||
| 文件大小 | 116.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-17 11:48:19 | ||
图片预览




文档简介
上海市奉贤区2020-2021学年九年级上学期期末化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.5G时代已经来临,高纯度单质硅是制作芯片的重要材料,硅的元素符号为
A.Si B.S C.SI D.AI
2.拉瓦锡通过实验得出:约占空气总体积1/5的气体是
A.N2 B.CO2 C.O2 D.稀有气体
3.属于溶液的是
A.牛奶 B.碘酒 C.蒸馏水 D.石灰乳
4.属于纯净物的是
A.空气 B.食醋 C.液氧 D.大理石
5.与金刚石互为同素异形体的是
A.钻石 B.石墨 C.碳酸 D.活性炭
6.人体内一些体液的近似pH如下,其中酸性最强的是
A.胃液(0.8-1.5) B.唾液(6.5-7.5) C.胆液(6.8-7.4) D.血液(7.35-7.45)
7.下列关于“酒精温度计遇热读数上升”的微观解释正确的是
A.分子质量增大 B.分子体积扩大 C.分子间隔变大 D.分子个数增多
8.物质的俗称和化学式对应正确的是
A.胆矾CuSO4 B.食盐NaCl C.水银Ag D.熟石灰CaCO3
9.下列物质的用途利用其化学性质的是
A.稀有气体作电光源 B.活性炭消除水中异味
C.一氧化碳冶炼金属 D.干冰用于人工降雨
10.物质燃烧的现象描述正确的是
A.碳在氧气中燃烧发出红光 B.磷在空气中燃烧产生大量白雾
C.硫在氧气中燃烧发出淡蓝色火焰 D.镁带在空气中燃烧发出耀眼的白光
11.如图为实验室新购置的盐酸试剂瓶标签上的内容,用掉一部分盐酸后(忽略盐酸的挥发),不能再表示试剂瓶中剩余盐酸信息的是( )
A.37% B.36.5 C.1.19g/cm3 D.500mL
12.下列实验方案不能达到目的的是
选项
实验目的
实验方案
A
除去生石灰中少量碳酸钙
高温烧至质量不再变化
B
排空气法收集气O2验满
将带火星的木条伸入集气瓶中
C
区分水和过氧化氢溶液
取样,分别加入MnO2中,观察
D
区分CO和CH4
点燃,在火焰上方分别罩一个干冷的烧杯,观察
A.A B.B C.C D.D
13.利用太阳光能人工合成燃料,反应的微观示意图如下,说法正确的是
A.参加反应的甲、乙物质的量之比为1:1
B.反应前后各元素的化合价均不发生变化
C.甲、乙、丁都是氧化物
D.氧元素由化合态变成游离态
14.质量相等的O2和O3具有相同的
A.分子数 B.物质的量 C.摩尔质量 D.原子总数
15.下列说法正确的是
A.由同种元素组成的物质一定是单质
B.由不同种元素组成的物质一定是化合物
C.由多种物质组成的一定是混合物
D.含氧元素的化合物一定是氧化物
二、多选题
16.能证明水是由氢元素和氧元素组成的实验是
A.水的电解 B.水的蒸发 C.水的净化 D.氢气在氧气中燃烧
17.高温煅烧ag碳酸钙,一段时间后停止加热,测得剩余固体质量为bg,为判断碳酸钙是否全部分解,下列方法可行的是
A.加水,观察是否有不溶物存在 B.加足量稀盐酸,观察是否有气泡生成
C.加水、加酚酞试液,观察是否变红色 D.计算 是否等于
三、填空题
18.人类的生活离不开化学。
①煤、______、天然气是世界上最重要的化石燃料。煤燃烧生成的CO2、SO2、CO等气体中,引起“酸雨”的主要物质是______,能与血红蛋白结合,造成人体中毒的物质是_____。
②炒菜时油锅着火,用锅盖盖灭,其原理是_________。
③氧化钙是常见的食品干燥剂,其吸水过程属于_______(选填“物理”或“化学”)变化。
④自来水生产过程中通常用氯气杀菌消毒,氯气与水发生反应的化学方程式为:,其中X的化学式是_____,HC1O中C1元素的化合价为______,1molHCIO中约含__________个O原子(用科学计数法表示)。
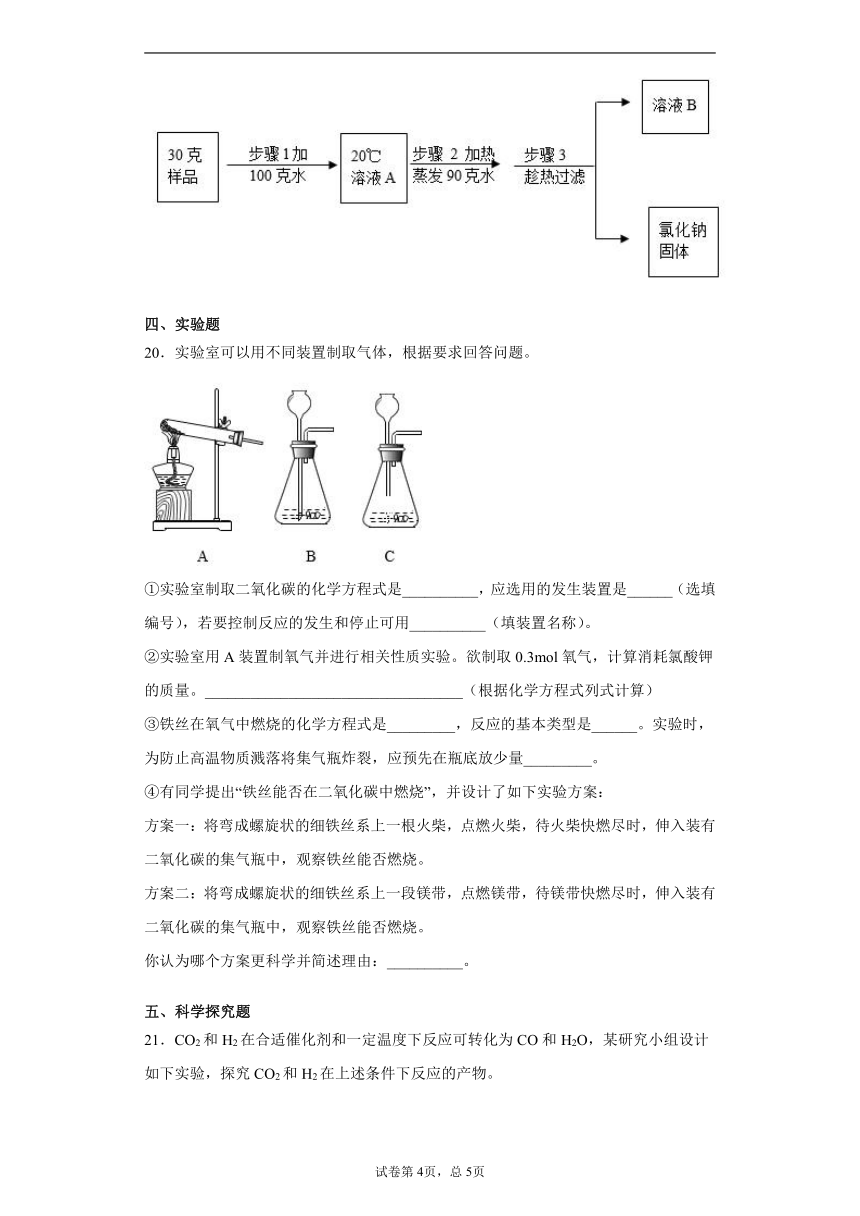
19.过滤和结晶是常见的混合物分离提纯的方法。
①利用泥沙难溶于水而NaC1___________的性质,我们可以通过溶解、_______、蒸发等操作除去粗盐中的泥沙,得到较纯净的NaCl。
②NaCl、KNO3的部分溶解度数据见下表。
温度(℃)
20
40
60
80
100
溶解度(g/100g水)
NaCl
36
36.6
37.1
38
39.2
KNO3
31.6
63.9
110
169
246
Ⅰ由上表可知,溶解度受温度影响变化较小的物质是____;80℃时KNO3的溶解度是______g/100g水,此温度下10克水中最多能溶解KNO3_______克。
Ⅱ某NaCl样品中含有KNO3杂质。现有30克NaC1样品,经测定含4克KNO3,现设计如下实验提纯NaCl;
溶液B是NaC1的________(填“饱和”或“不饱和”)溶液。步骤3趁热过滤的设计意图是____。
四、实验题
20.实验室可以用不同装置制取气体,根据要求回答问题。
①实验室制取二氧化碳的化学方程式是__________,应选用的发生装置是______(选填编号),若要控制反应的发生和停止可用__________(填装置名称)。
②实验室用A装置制氧气并进行相关性质实验。欲制取0.3mol氧气,计算消耗氯酸钾的质量。__________________________________(根据化学方程式列式计算)
③铁丝在氧气中燃烧的化学方程式是_________,反应的基本类型是______。实验时,为防止高温物质溅落将集气瓶炸裂,应预先在瓶底放少量_________。
④有同学提出“铁丝能否在二氧化碳中燃烧”,并设计了如下实验方案:
方案一:将弯成螺旋状的细铁丝系上一根火柴,点燃火柴,待火柴快燃尽时,伸入装有二氧化碳的集气瓶中,观察铁丝能否燃烧。
方案二:将弯成螺旋状的细铁丝系上一段镁带,点燃镁带,待镁带快燃尽时,伸入装有二氧化碳的集气瓶中,观察铁丝能否燃烧。
你认为哪个方案更科学并简述理由:__________。
五、科学探究题
21.CO2和H2在合适催化剂和一定温度下反应可转化为CO和H2O,某研究小组设计如下实验,探究CO2和H2在上述条件下反应的产物。
实验过程中观察到的主要现象有:B装置中白色固体变为蓝色,C装置中黑色固体变为红色,D装置中澄清石灰水变浑浊。
①设计B装置的目的是__________。
②C装置中发生反应的化学方程式是__________。
③从环保角度考虑,该装置存在的问题是__________。
④研究小组反思后认为,根据上述实验现象不能确认CO2和H2反应生成了CO,理由是__________。
参考答案
1.A
【详解】
书写元素符号注意“一大二小”,硅的元素符号是Si。
故选:A。
2.C
【详解】
拉瓦锡通过实验得出了空气由氧气和氮气组成,其中氧气约占空气总体积1/5的结论。故选C。
3.B
【分析】
溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,属于混合物。
【详解】
A、牛奶是不溶性的小液滴等分散到液体中形成的,不均一、不稳定,不属于溶液,故选项错误;
B、碘酒是碘溶于酒精形成的,是均一、稳定的混合物,属于溶液,故选项正确;
C、蒸馏水是纯净物,不属于混合物,故不是溶液,故选项错误;
D、石灰乳是氢氧化钙固体悬浮于水中形成的,是不均一、不稳定的混合物,属于悬浊液,不属于溶液,故选项错误;
故选B。
4.C
【详解】
只由一种物质组成的物质叫纯净物,由两种或两种以上的物质混合而成的物质是混合物。
A、空气中含有氧气、氮气等很多物质,属于混合物,A错误;
B、食醋含有了醋酸和水,属于混合物,B错误;
C、液氧是液态的氧气,属于纯净物,C正确;
D、大理石含有碳酸钙、碳酸镁、氧化钙等多种物质,属于混合物,D错误。
故选C。
5.B
【详解】
判断同素异形体的关键把握两点:①同种元素形成,②不同单质。
A、钻石是将金刚石打磨而成的一种宝石,不属于同素异形体,故选项错误。
B、石墨和金刚石均是碳元素形成的不同单质,互为同素异形体,故选项正确。
C、碳酸属于化合物,与金刚石不属于同素异形体,故选项错误。
D、活性炭的主要成分是碳,属于混合物,与金刚石不属于同素异形体,故选项错误。
故选:B。
6.A
【详解】
pH<7,显酸性,且pH越小,酸性越强。胃液的pH<7,且最小,酸性最强。
故选A。
7.C
【详解】
温度升高,分子间隔变大,体积变大,故选C。
8.B
【详解】
A、胆矾是五水硫酸铜的俗称,化学式为CuSO4﹒5H2O,不符合题意;
B、食盐是氯化钠的俗称,化学式为NaCl,符合题意;
C、水银是汞的俗称,化学式为Hg,不符合题意;
D、熟石灰是氢氧化钙的俗称,化学式为Ca(OH)2,不符合题意。
故选B。
9.C
【详解】
A、稀有气体作电光源,是因为稀有气体通电时,能发出不同颜色的光,不需要通过化学变化就能表现出来,利用的是其物理性质,不符合题意;
B、活性炭消除水中异味,是因为活性炭具有吸附性,不需要通过化学变化就能表现出来,利用的是其物理性质,不符合题意;
C、一氧化碳冶炼金属,是因为一氧化碳具有还原性,还原性需要通过化学变化才能表现出来,利用的是其化学性质,符合题意;
D、干冰用于人工降雨,是因为干冰升华吸热,不需要通过化学变化就能表现出来,利用的是其物理性质,不符合题意。
故选C。
10.D
【详解】
A、碳在氧气中燃烧,发出白光,生成能使澄清石灰水变浑浊的气体,故选项说法错误。
B、磷在空气中燃烧,产生大量的白烟,而不是白色烟雾,故选项说法错误。
C、硫在氧气中燃烧,发出明亮的蓝紫色火焰,产生一种具有刺激性气味的气体,故选项说法错误。
D、镁带在空气中燃烧,发出耀眼的白光,故选项说法正确。
故选:D。
11.D
【详解】
A.由溶液的均一性可知,剩余溶液的溶质质量分数仍为37%,不符合题意;
B.HCl的相对分子质量=1+35.5=36.5,不符合题意;
C.由溶液的均一性可知,剩余溶液的密度仍为1.19g/cm3,不符合题意;
D.原瓶盐酸的体积为500mL,用掉一部分后,盐酸的体积减少了,不能再表示试剂瓶中剩余盐酸信息,符合题意。故选D。
12.B
【详解】
A、碳酸钙在高温下生成氧化钙和二氧化碳,高温烧至质量不再变化可以除去生石灰中少量碳酸钙,正确;
B、氧气的验满应把将带火星的木条放到集气瓶瓶口,错误;
C、向两种溶液加二氧化锰,产生气泡的是过氧化氢溶液,否则是水,正确;
D、分别点燃两种气体,在火焰上方分别罩一个干冷的烧杯,若烧杯内壁有水雾,说明该气体是甲烷,否则是一氧化碳,正确;
故选B。
13.D
【分析】
由图可知,该反应是二氧化碳和水在光和催化剂的作用下反应生成甲烷和氧气,该反应的化学方程式为。
【详解】
A、由化学方程式可知,参加反应的甲、乙物质的量之比为1:2,不符合题意;
B、在该反应中,氧元素由化合态转化为游离态,化合价一定发生了改变,不符合题意;
C、甲是二氧化碳,二氧化碳是由C、O两种元素组成的化合物,属于氧化物;乙是水,水是由H、O两种元素组成的化合物,属于氧化物;丁是氧气,氧气是由氧元素组成的纯净物,属于单质,不符合题意;
D、在该反应中,氧元素由化合态转化为游离态,符合题意。
故选D。
14.D
【详解】
A、根据、可知,质量相等时O2和O3含有分子数一定不相等,故A不正确;
B、O2和O3的摩尔质量不同,根据可知,二者的物质的量一定不相等,故B不正确;
C、氧气的摩尔质量为32g/mol,臭氧的摩尔质量为48g/mol,故C不正确;
D、O2和O3都只含有O原子,所以相同质量的O2和O3含有相同质量的O,二者一定具有相同的氧原子总数,故D正确。故选D。
15.C
【详解】
A、由同种元素组成的纯净物一定是单质,由同种元素组成的物质不一定是单质,有可能是混合物,如氧气和臭氧,A错误;
B、由不同种元素组成的纯净物一定是化合物,由不同种元素组成的物质不一定是化合物,有可能是混合物,如空气中含有氧气、氮气等,B错误;
C、由两种或两种以上的物质混合而成的物质是混合物,C正确;
D、含有不同种元素的纯净物叫做化合物,由两种元素组成的化合物中,其中一种元素是氧元素的叫氧化物,如NaOH中含有氧元素但不是氧化物,D错误。
故选C。
16.AD
【详解】
A、水通电可以分解出氢气和氧气,正极产生氧气、负极产生氢气,二者气体体积之比为1:2;组成氢气的氢元素、氧气的氧元素都来自水,所以水是由氢、氧两种元素组成的,能证明水的组成。
B、水的蒸发是液态的水变为气态水的过程,发生物理变化,无法证明水的组成。
C、水的净化是除去水中杂质的操作,无法证明水的组成;
D、氢气燃烧生成水,氢气是由氢元素组成的,氧气是由氧元素组成的,由化学反应前后元素种类不变,可以得出水是由氢、氧两种元素组成的,能证明水的组成。
故选:AD。
17.BD
【详解】
A、碳酸钙难溶于水,但是高温煅烧生成氧化钙,氧化钙能与水反应生成氢氧化钙,氢氧化钙微溶于水,故加水,有不溶物存在,可能是未溶解的氢氧化钙,不能确定碳酸钙未完全分解,不符合题意;
B、碳酸钙能与稀盐酸反应生成氯化钙、二氧化碳和水,如果加足量稀盐酸,有气泡产生,说明碳酸钙未完全分解,符合题意;
C、碳酸钙高温煅烧生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙显碱性,能使无色酚酞试液变红,不管碳酸钙是否完全分解,都能使无色酚酞试液变红,不符合题意;
D、假设碳酸钙完全分解
,如果,说明碳酸钙完全分解。符合题意。
故选BD。
18.石油 SO2 CO 隔绝氧气 化学 HC1 +1 6.02×1023
【详解】
①煤、石油、天然气是世界上最重要的化石燃料。煤燃烧生成的CO2、SO2、CO等气体中,二氧化硫和水反应生成酸性物质,故引起“酸雨”的主要物质是SO2;一氧化碳有毒能与血红蛋白结合,造成人体中毒的物质是CO;
②炒菜时油锅着火,用锅盖盖灭,其原理是隔绝氧气破坏燃烧的条件;
③氧化钙是常见的食品干燥剂,其吸水过程和水反应生成了氢氧化钙,属于化学变化;
④化学反应前后原子种类数目不变;,反应前氯原子、氢原子、氧原子个数分别为2、2、1,反应前氯原子、氢原子、氧原子个数分别为1、1、1,故X的化学式是HCl;HC1O中中氢元素化合价为正一价、氧元素化合价为负二价,设氯元素化合价为x,化合物中正负化合价代数和为零;则(+1)+ x +(-2)=0,x=+1; 1molHClO中约含个1mol ×6.02×1023/ mol = 6.02×1023个O原子。
19.易溶于水 过滤 NaCl 169 16.9 饱和 KNO3的溶解度随温度的升高而増大,温度降低可能会得到KNO3的饱和溶液,进而析出KNO3,导致得到的NaCl固体不纯
【详解】
①NaCl易溶于水,除去NaCl中的不溶于水的杂质,可以通过溶解、过滤、蒸发等操作除去。
②由表可知,NaCl在温度20℃时溶解度是36g/100g水,100℃时溶解度是39.2g/100g水;KNO3在温度20℃时溶解度是31.6g/100g水,100℃时溶解度是246g/100g水,NaCl的变化比较小,所以溶解度受温度影响变化较小的物质是NaCl。80℃时KNO3的溶解度是169g/100g水;此温度下10克水中最多能溶解KNO316.9克。
溶液B是解热后过滤出固体剩余的滤液,如果NaCl不饱和的化,会继续溶解NaCl固体,而不会析出NaCl固体,故是NaCl饱和溶液,步骤3趁热过滤是因为KNO3的溶解度随温度的升高而増大,温度降低可能会得到KNO3的饱和溶液,进而析出KNO3,导致得到的NaCl固体不纯。
20. B 启普发生器 24.5g;
解:实验室用A装置制氧气,试管口没有棉花,应是加热条件下二氧化锰催化氯酸钾反应生成氯化钾和氧气,欲制取0.3mol氧气,设消耗氯酸钾的质量为x,则
解得x=24.5g
答:需要氯酸钾的质量为24.5g。 化合反应 水或细沙 方案二更科学,因为镁带能在CO2中燃烧而火柴不能,待其快燃尽时伸入集气瓶,而火柴在二氧化碳中无法燃烧产生热量,可能会无法达到铁丝的着火点,导致无法得到铁丝能否在CO2中燃烧的结论
【详解】
①实验室制取二氧化碳,是在常温下,用大理石或石灰石和稀盐酸制取,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,反应的化学方程式是,属于固液混合不需加热型,应选用的发生装置是B,若要控制反应的发生和停止可用启普发生器。
②见答案。
③铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式是,反应的基本类型是化合反应。实验时,为防止高温物质溅落将集气瓶炸裂,应预先在瓶底放少量水或细砂。
④方案二更科学,因为镁带能在CO2中燃烧而火柴不能,待其快燃尽时伸入集气瓶,而火柴无法燃烧产生热量,可能会无法达到铁丝的着火点,导致无法得到铁丝能否在CO2中燃烧的结论。
21.检验(并吸收)CO2与H2反应产生的水 缺少尾气处理装置 通入的氢气和二氧化碳可能在A处未能完全反应,氢气能使C中黑色固体变红色,二氧化碳使D中石灰水变浑浊,不能证明CO2与H2反应生成了CO
【详解】
①无水硫酸铜遇水变蓝,设计B装置的目的是检验(并吸收)CO2与H2反应产生的水。
②C装置中氢气与氧化铜在加热条件下反应生成铜和水,发生反应的化学方程式是。
③实验中有一氧化碳参与,一氧化碳有毒,从环保角度考虑,该装置存在的问题是缺少尾气处理装置。
④研究小组反思后认为,根据上述实验现象不能确认CO2和H2反应生成了CO,理由是通入的氢气和二氧化碳可能在A处未能完全反应,氢气能使C中黑色固体变红色,二氧化碳使D中石灰水变浑浊,不能证明CO2与H2反应生成了CO。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.5G时代已经来临,高纯度单质硅是制作芯片的重要材料,硅的元素符号为
A.Si B.S C.SI D.AI
2.拉瓦锡通过实验得出:约占空气总体积1/5的气体是
A.N2 B.CO2 C.O2 D.稀有气体
3.属于溶液的是
A.牛奶 B.碘酒 C.蒸馏水 D.石灰乳
4.属于纯净物的是
A.空气 B.食醋 C.液氧 D.大理石
5.与金刚石互为同素异形体的是
A.钻石 B.石墨 C.碳酸 D.活性炭
6.人体内一些体液的近似pH如下,其中酸性最强的是
A.胃液(0.8-1.5) B.唾液(6.5-7.5) C.胆液(6.8-7.4) D.血液(7.35-7.45)
7.下列关于“酒精温度计遇热读数上升”的微观解释正确的是
A.分子质量增大 B.分子体积扩大 C.分子间隔变大 D.分子个数增多
8.物质的俗称和化学式对应正确的是
A.胆矾CuSO4 B.食盐NaCl C.水银Ag D.熟石灰CaCO3
9.下列物质的用途利用其化学性质的是
A.稀有气体作电光源 B.活性炭消除水中异味
C.一氧化碳冶炼金属 D.干冰用于人工降雨
10.物质燃烧的现象描述正确的是
A.碳在氧气中燃烧发出红光 B.磷在空气中燃烧产生大量白雾
C.硫在氧气中燃烧发出淡蓝色火焰 D.镁带在空气中燃烧发出耀眼的白光
11.如图为实验室新购置的盐酸试剂瓶标签上的内容,用掉一部分盐酸后(忽略盐酸的挥发),不能再表示试剂瓶中剩余盐酸信息的是( )
A.37% B.36.5 C.1.19g/cm3 D.500mL
12.下列实验方案不能达到目的的是
选项
实验目的
实验方案
A
除去生石灰中少量碳酸钙
高温烧至质量不再变化
B
排空气法收集气O2验满
将带火星的木条伸入集气瓶中
C
区分水和过氧化氢溶液
取样,分别加入MnO2中,观察
D
区分CO和CH4
点燃,在火焰上方分别罩一个干冷的烧杯,观察
A.A B.B C.C D.D
13.利用太阳光能人工合成燃料,反应的微观示意图如下,说法正确的是
A.参加反应的甲、乙物质的量之比为1:1
B.反应前后各元素的化合价均不发生变化
C.甲、乙、丁都是氧化物
D.氧元素由化合态变成游离态
14.质量相等的O2和O3具有相同的
A.分子数 B.物质的量 C.摩尔质量 D.原子总数
15.下列说法正确的是
A.由同种元素组成的物质一定是单质
B.由不同种元素组成的物质一定是化合物
C.由多种物质组成的一定是混合物
D.含氧元素的化合物一定是氧化物
二、多选题
16.能证明水是由氢元素和氧元素组成的实验是
A.水的电解 B.水的蒸发 C.水的净化 D.氢气在氧气中燃烧
17.高温煅烧ag碳酸钙,一段时间后停止加热,测得剩余固体质量为bg,为判断碳酸钙是否全部分解,下列方法可行的是
A.加水,观察是否有不溶物存在 B.加足量稀盐酸,观察是否有气泡生成
C.加水、加酚酞试液,观察是否变红色 D.计算 是否等于
三、填空题
18.人类的生活离不开化学。
①煤、______、天然气是世界上最重要的化石燃料。煤燃烧生成的CO2、SO2、CO等气体中,引起“酸雨”的主要物质是______,能与血红蛋白结合,造成人体中毒的物质是_____。
②炒菜时油锅着火,用锅盖盖灭,其原理是_________。
③氧化钙是常见的食品干燥剂,其吸水过程属于_______(选填“物理”或“化学”)变化。
④自来水生产过程中通常用氯气杀菌消毒,氯气与水发生反应的化学方程式为:,其中X的化学式是_____,HC1O中C1元素的化合价为______,1molHCIO中约含__________个O原子(用科学计数法表示)。
19.过滤和结晶是常见的混合物分离提纯的方法。
①利用泥沙难溶于水而NaC1___________的性质,我们可以通过溶解、_______、蒸发等操作除去粗盐中的泥沙,得到较纯净的NaCl。
②NaCl、KNO3的部分溶解度数据见下表。
温度(℃)
20
40
60
80
100
溶解度(g/100g水)
NaCl
36
36.6
37.1
38
39.2
KNO3
31.6
63.9
110
169
246
Ⅰ由上表可知,溶解度受温度影响变化较小的物质是____;80℃时KNO3的溶解度是______g/100g水,此温度下10克水中最多能溶解KNO3_______克。
Ⅱ某NaCl样品中含有KNO3杂质。现有30克NaC1样品,经测定含4克KNO3,现设计如下实验提纯NaCl;
溶液B是NaC1的________(填“饱和”或“不饱和”)溶液。步骤3趁热过滤的设计意图是____。
四、实验题
20.实验室可以用不同装置制取气体,根据要求回答问题。
①实验室制取二氧化碳的化学方程式是__________,应选用的发生装置是______(选填编号),若要控制反应的发生和停止可用__________(填装置名称)。
②实验室用A装置制氧气并进行相关性质实验。欲制取0.3mol氧气,计算消耗氯酸钾的质量。__________________________________(根据化学方程式列式计算)
③铁丝在氧气中燃烧的化学方程式是_________,反应的基本类型是______。实验时,为防止高温物质溅落将集气瓶炸裂,应预先在瓶底放少量_________。
④有同学提出“铁丝能否在二氧化碳中燃烧”,并设计了如下实验方案:
方案一:将弯成螺旋状的细铁丝系上一根火柴,点燃火柴,待火柴快燃尽时,伸入装有二氧化碳的集气瓶中,观察铁丝能否燃烧。
方案二:将弯成螺旋状的细铁丝系上一段镁带,点燃镁带,待镁带快燃尽时,伸入装有二氧化碳的集气瓶中,观察铁丝能否燃烧。
你认为哪个方案更科学并简述理由:__________。
五、科学探究题
21.CO2和H2在合适催化剂和一定温度下反应可转化为CO和H2O,某研究小组设计如下实验,探究CO2和H2在上述条件下反应的产物。
实验过程中观察到的主要现象有:B装置中白色固体变为蓝色,C装置中黑色固体变为红色,D装置中澄清石灰水变浑浊。
①设计B装置的目的是__________。
②C装置中发生反应的化学方程式是__________。
③从环保角度考虑,该装置存在的问题是__________。
④研究小组反思后认为,根据上述实验现象不能确认CO2和H2反应生成了CO,理由是__________。
参考答案
1.A
【详解】
书写元素符号注意“一大二小”,硅的元素符号是Si。
故选:A。
2.C
【详解】
拉瓦锡通过实验得出了空气由氧气和氮气组成,其中氧气约占空气总体积1/5的结论。故选C。
3.B
【分析】
溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,属于混合物。
【详解】
A、牛奶是不溶性的小液滴等分散到液体中形成的,不均一、不稳定,不属于溶液,故选项错误;
B、碘酒是碘溶于酒精形成的,是均一、稳定的混合物,属于溶液,故选项正确;
C、蒸馏水是纯净物,不属于混合物,故不是溶液,故选项错误;
D、石灰乳是氢氧化钙固体悬浮于水中形成的,是不均一、不稳定的混合物,属于悬浊液,不属于溶液,故选项错误;
故选B。
4.C
【详解】
只由一种物质组成的物质叫纯净物,由两种或两种以上的物质混合而成的物质是混合物。
A、空气中含有氧气、氮气等很多物质,属于混合物,A错误;
B、食醋含有了醋酸和水,属于混合物,B错误;
C、液氧是液态的氧气,属于纯净物,C正确;
D、大理石含有碳酸钙、碳酸镁、氧化钙等多种物质,属于混合物,D错误。
故选C。
5.B
【详解】
判断同素异形体的关键把握两点:①同种元素形成,②不同单质。
A、钻石是将金刚石打磨而成的一种宝石,不属于同素异形体,故选项错误。
B、石墨和金刚石均是碳元素形成的不同单质,互为同素异形体,故选项正确。
C、碳酸属于化合物,与金刚石不属于同素异形体,故选项错误。
D、活性炭的主要成分是碳,属于混合物,与金刚石不属于同素异形体,故选项错误。
故选:B。
6.A
【详解】
pH<7,显酸性,且pH越小,酸性越强。胃液的pH<7,且最小,酸性最强。
故选A。
7.C
【详解】
温度升高,分子间隔变大,体积变大,故选C。
8.B
【详解】
A、胆矾是五水硫酸铜的俗称,化学式为CuSO4﹒5H2O,不符合题意;
B、食盐是氯化钠的俗称,化学式为NaCl,符合题意;
C、水银是汞的俗称,化学式为Hg,不符合题意;
D、熟石灰是氢氧化钙的俗称,化学式为Ca(OH)2,不符合题意。
故选B。
9.C
【详解】
A、稀有气体作电光源,是因为稀有气体通电时,能发出不同颜色的光,不需要通过化学变化就能表现出来,利用的是其物理性质,不符合题意;
B、活性炭消除水中异味,是因为活性炭具有吸附性,不需要通过化学变化就能表现出来,利用的是其物理性质,不符合题意;
C、一氧化碳冶炼金属,是因为一氧化碳具有还原性,还原性需要通过化学变化才能表现出来,利用的是其化学性质,符合题意;
D、干冰用于人工降雨,是因为干冰升华吸热,不需要通过化学变化就能表现出来,利用的是其物理性质,不符合题意。
故选C。
10.D
【详解】
A、碳在氧气中燃烧,发出白光,生成能使澄清石灰水变浑浊的气体,故选项说法错误。
B、磷在空气中燃烧,产生大量的白烟,而不是白色烟雾,故选项说法错误。
C、硫在氧气中燃烧,发出明亮的蓝紫色火焰,产生一种具有刺激性气味的气体,故选项说法错误。
D、镁带在空气中燃烧,发出耀眼的白光,故选项说法正确。
故选:D。
11.D
【详解】
A.由溶液的均一性可知,剩余溶液的溶质质量分数仍为37%,不符合题意;
B.HCl的相对分子质量=1+35.5=36.5,不符合题意;
C.由溶液的均一性可知,剩余溶液的密度仍为1.19g/cm3,不符合题意;
D.原瓶盐酸的体积为500mL,用掉一部分后,盐酸的体积减少了,不能再表示试剂瓶中剩余盐酸信息,符合题意。故选D。
12.B
【详解】
A、碳酸钙在高温下生成氧化钙和二氧化碳,高温烧至质量不再变化可以除去生石灰中少量碳酸钙,正确;
B、氧气的验满应把将带火星的木条放到集气瓶瓶口,错误;
C、向两种溶液加二氧化锰,产生气泡的是过氧化氢溶液,否则是水,正确;
D、分别点燃两种气体,在火焰上方分别罩一个干冷的烧杯,若烧杯内壁有水雾,说明该气体是甲烷,否则是一氧化碳,正确;
故选B。
13.D
【分析】
由图可知,该反应是二氧化碳和水在光和催化剂的作用下反应生成甲烷和氧气,该反应的化学方程式为。
【详解】
A、由化学方程式可知,参加反应的甲、乙物质的量之比为1:2,不符合题意;
B、在该反应中,氧元素由化合态转化为游离态,化合价一定发生了改变,不符合题意;
C、甲是二氧化碳,二氧化碳是由C、O两种元素组成的化合物,属于氧化物;乙是水,水是由H、O两种元素组成的化合物,属于氧化物;丁是氧气,氧气是由氧元素组成的纯净物,属于单质,不符合题意;
D、在该反应中,氧元素由化合态转化为游离态,符合题意。
故选D。
14.D
【详解】
A、根据、可知,质量相等时O2和O3含有分子数一定不相等,故A不正确;
B、O2和O3的摩尔质量不同,根据可知,二者的物质的量一定不相等,故B不正确;
C、氧气的摩尔质量为32g/mol,臭氧的摩尔质量为48g/mol,故C不正确;
D、O2和O3都只含有O原子,所以相同质量的O2和O3含有相同质量的O,二者一定具有相同的氧原子总数,故D正确。故选D。
15.C
【详解】
A、由同种元素组成的纯净物一定是单质,由同种元素组成的物质不一定是单质,有可能是混合物,如氧气和臭氧,A错误;
B、由不同种元素组成的纯净物一定是化合物,由不同种元素组成的物质不一定是化合物,有可能是混合物,如空气中含有氧气、氮气等,B错误;
C、由两种或两种以上的物质混合而成的物质是混合物,C正确;
D、含有不同种元素的纯净物叫做化合物,由两种元素组成的化合物中,其中一种元素是氧元素的叫氧化物,如NaOH中含有氧元素但不是氧化物,D错误。
故选C。
16.AD
【详解】
A、水通电可以分解出氢气和氧气,正极产生氧气、负极产生氢气,二者气体体积之比为1:2;组成氢气的氢元素、氧气的氧元素都来自水,所以水是由氢、氧两种元素组成的,能证明水的组成。
B、水的蒸发是液态的水变为气态水的过程,发生物理变化,无法证明水的组成。
C、水的净化是除去水中杂质的操作,无法证明水的组成;
D、氢气燃烧生成水,氢气是由氢元素组成的,氧气是由氧元素组成的,由化学反应前后元素种类不变,可以得出水是由氢、氧两种元素组成的,能证明水的组成。
故选:AD。
17.BD
【详解】
A、碳酸钙难溶于水,但是高温煅烧生成氧化钙,氧化钙能与水反应生成氢氧化钙,氢氧化钙微溶于水,故加水,有不溶物存在,可能是未溶解的氢氧化钙,不能确定碳酸钙未完全分解,不符合题意;
B、碳酸钙能与稀盐酸反应生成氯化钙、二氧化碳和水,如果加足量稀盐酸,有气泡产生,说明碳酸钙未完全分解,符合题意;
C、碳酸钙高温煅烧生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙显碱性,能使无色酚酞试液变红,不管碳酸钙是否完全分解,都能使无色酚酞试液变红,不符合题意;
D、假设碳酸钙完全分解
,如果,说明碳酸钙完全分解。符合题意。
故选BD。
18.石油 SO2 CO 隔绝氧气 化学 HC1 +1 6.02×1023
【详解】
①煤、石油、天然气是世界上最重要的化石燃料。煤燃烧生成的CO2、SO2、CO等气体中,二氧化硫和水反应生成酸性物质,故引起“酸雨”的主要物质是SO2;一氧化碳有毒能与血红蛋白结合,造成人体中毒的物质是CO;
②炒菜时油锅着火,用锅盖盖灭,其原理是隔绝氧气破坏燃烧的条件;
③氧化钙是常见的食品干燥剂,其吸水过程和水反应生成了氢氧化钙,属于化学变化;
④化学反应前后原子种类数目不变;,反应前氯原子、氢原子、氧原子个数分别为2、2、1,反应前氯原子、氢原子、氧原子个数分别为1、1、1,故X的化学式是HCl;HC1O中中氢元素化合价为正一价、氧元素化合价为负二价,设氯元素化合价为x,化合物中正负化合价代数和为零;则(+1)+ x +(-2)=0,x=+1; 1molHClO中约含个1mol ×6.02×1023/ mol = 6.02×1023个O原子。
19.易溶于水 过滤 NaCl 169 16.9 饱和 KNO3的溶解度随温度的升高而増大,温度降低可能会得到KNO3的饱和溶液,进而析出KNO3,导致得到的NaCl固体不纯
【详解】
①NaCl易溶于水,除去NaCl中的不溶于水的杂质,可以通过溶解、过滤、蒸发等操作除去。
②由表可知,NaCl在温度20℃时溶解度是36g/100g水,100℃时溶解度是39.2g/100g水;KNO3在温度20℃时溶解度是31.6g/100g水,100℃时溶解度是246g/100g水,NaCl的变化比较小,所以溶解度受温度影响变化较小的物质是NaCl。80℃时KNO3的溶解度是169g/100g水;此温度下10克水中最多能溶解KNO316.9克。
溶液B是解热后过滤出固体剩余的滤液,如果NaCl不饱和的化,会继续溶解NaCl固体,而不会析出NaCl固体,故是NaCl饱和溶液,步骤3趁热过滤是因为KNO3的溶解度随温度的升高而増大,温度降低可能会得到KNO3的饱和溶液,进而析出KNO3,导致得到的NaCl固体不纯。
20. B 启普发生器 24.5g;
解:实验室用A装置制氧气,试管口没有棉花,应是加热条件下二氧化锰催化氯酸钾反应生成氯化钾和氧气,欲制取0.3mol氧气,设消耗氯酸钾的质量为x,则
解得x=24.5g
答:需要氯酸钾的质量为24.5g。 化合反应 水或细沙 方案二更科学,因为镁带能在CO2中燃烧而火柴不能,待其快燃尽时伸入集气瓶,而火柴在二氧化碳中无法燃烧产生热量,可能会无法达到铁丝的着火点,导致无法得到铁丝能否在CO2中燃烧的结论
【详解】
①实验室制取二氧化碳,是在常温下,用大理石或石灰石和稀盐酸制取,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,反应的化学方程式是,属于固液混合不需加热型,应选用的发生装置是B,若要控制反应的发生和停止可用启普发生器。
②见答案。
③铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式是,反应的基本类型是化合反应。实验时,为防止高温物质溅落将集气瓶炸裂,应预先在瓶底放少量水或细砂。
④方案二更科学,因为镁带能在CO2中燃烧而火柴不能,待其快燃尽时伸入集气瓶,而火柴无法燃烧产生热量,可能会无法达到铁丝的着火点,导致无法得到铁丝能否在CO2中燃烧的结论。
21.检验(并吸收)CO2与H2反应产生的水 缺少尾气处理装置 通入的氢气和二氧化碳可能在A处未能完全反应,氢气能使C中黑色固体变红色,二氧化碳使D中石灰水变浑浊,不能证明CO2与H2反应生成了CO
【详解】
①无水硫酸铜遇水变蓝,设计B装置的目的是检验(并吸收)CO2与H2反应产生的水。
②C装置中氢气与氧化铜在加热条件下反应生成铜和水,发生反应的化学方程式是。
③实验中有一氧化碳参与,一氧化碳有毒,从环保角度考虑,该装置存在的问题是缺少尾气处理装置。
④研究小组反思后认为,根据上述实验现象不能确认CO2和H2反应生成了CO,理由是通入的氢气和二氧化碳可能在A处未能完全反应,氢气能使C中黑色固体变红色,二氧化碳使D中石灰水变浑浊,不能证明CO2与H2反应生成了CO。
同课章节目录
