上海市嘉定区2020-2021学年九年级上学期期末化学试题(含答案解析)
文档属性
| 名称 | 上海市嘉定区2020-2021学年九年级上学期期末化学试题(含答案解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 273.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-17 00:00:00 | ||
图片预览



文档简介
上海市嘉定区2020-2021学年九年级上学期期末化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.属于物理变化的是
A.食物腐烂 B.铜丝折弯 C.火柴燃烧 D.铁器生锈
2.空气中能供给动植物呼吸的气体是( )
A.N2 B.O2 C.H2O D.CO2
3.废弃的易拉罐和塑料瓶属于
A.厨余垃圾 B.其他垃圾 C.可回收物 D.有害垃圾
4.加入足量的水搅拌能形成溶液的是( )
A.泥沙 B.植物油 C.白砂糖 D.粉笔灰
5.下列物质的主要成分属于氧化物的是( )
A. 钻石(C) B. 水晶(SiO2) C. 食盐(NaCl) D. 钟乳石(CaCO3)
6.化学用语表示错误的是( )
A.钡元素:Ba B.氦气:He2 C.2 个氯原子:2Cl D.氧化铝:Al2O3
7.氨气(NH3)燃烧反应的化学方程式为:4NH3 + 3O2 点燃 6H2O + 2 X,则X的化学式为
A.H2 B.O2 C.N2 D.NO2
8.属于同素异形体的是( )
A.二氧化碳与一氧化碳 B.水与冰 C.汞与水银 D.金刚石与石墨
9.属于分解反应的是( )
A. B.CuSO4+2NaOH=Na2SO4+Cu(OH)2
C. D.H2CO3CO2+H2O
10.二氧化氯是国际上公认的高效消毒剂,其化学式为 ClO2,其中氯元素的化合价为( )
A.+2 B.+4 C.-1 D.-2
11.物质的“性质—用途”对应关系正确的是( )
性质
用途
A
石墨软又滑
作电极
B
稀有气体通电发光
作保护气
C
CO 有还原性
冶炼金属
D
活性炭有吸附性
杀菌消毒
A.A B.B C.C D.D
12.有关分子和原子的说法正确的是( )
A.分子大,原子小 B.保持水的化学性质的微粒是水分子
C.热胀冷缩的过程分子体积变大 D.化学变化中有新的原子产生
13.甲() 和乙()是两种不同的分子,它们在一定条件下能发生化学反应,反应前后的微观变化如下图所示,下列说法正确的是( )
A.参加反应的甲、乙分子个数比为 1:1 B.该反应前后原子种类和原子个数均不变
C.生成物中一定有氧化物 D.反应生成了二种物质
14.以下说法正确的是( )
A.1mol氧气的摩尔质量为32g
B.1mol任何物质都约含有6.02×1023个分子
C.2gH2中含有1mol 氢
D.质量相等的O2和O3,它们的物质的量之比为3:2
15.比较食盐和蔗糖在水中的溶解性,必须控制的条件是( )
A.温度均相同 B.均用玻璃棒搅拌
C.均达到饱和状态 D.食盐和蔗糖颗粒大小均相同
16.工业上常用高温煅烧石灰石来制得生石灰,发生的反应为CaCO3CaO+CO2。现取一定量的石灰石样品进行煅烧(假设杂质不变),某变量 y 随时间的变化趋势如图所示。则纵坐标表示的是( )
A.生成CO2的体积 B.生成CaO的质量
C.固体中杂质的质量分数 D.固体中氧元素的质量分数
二、多选题
17.科学探究中常用到推理的方法。根据下列实验事实推出结论正确的是( )
编号
实验事实
实验结论
A
化学反应前后原子数目不变
化学反应前后分子数目也不变
B
某纯净物中含有一种元素
该物质一定是单质
C
常温下,测定某溶液的pH=3
该溶液一定呈酸性
D
某气体不能使带火星的木条复燃
该气体一定不含氧气
A.A B.B C.C D.D
三、填空题
18.日常生活,离不开化学,通过学习我们知道:
①能引起酸雨的气体是_____。
②常见的化石燃料包括煤、石油和_____。
③生理盐水中的溶质是_____。
④活性炭常用作冰箱除味剂,是因为它具有_______________作用。
⑤可以做干燥剂的金属氧化物是__________________(填化学式)。
19.水是生命的源泉,也是不可缺少的资源。
①如图电解水实验,写出该反应的化学方程式__________________,1处产生的气体是____________________。
②该实验的主要目的是验证水由______________组成。
③我区华亭大米远近闻名,选种时可用一定浓度的食盐水浸泡选种。现要配制浓度为16%的食盐水50kg,需要称量氯化钠______________________kg。
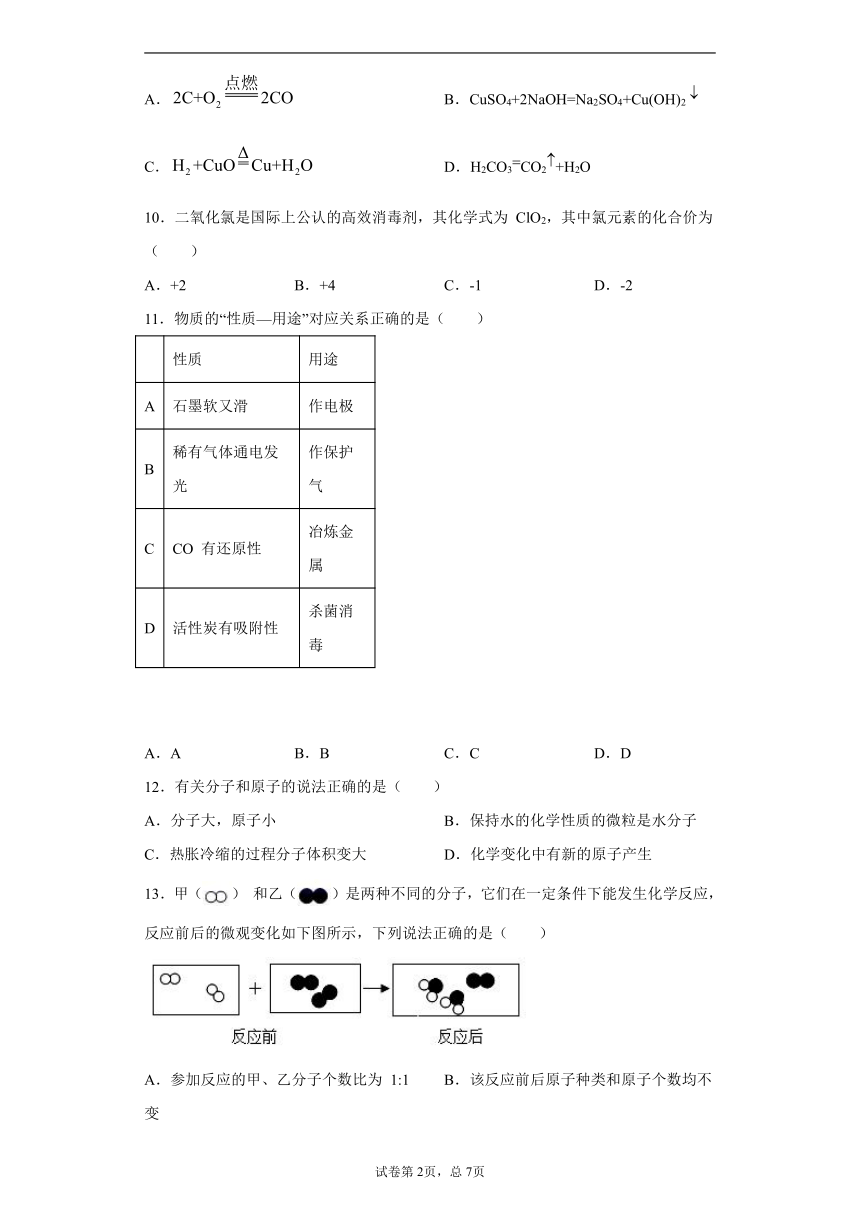
④下表是KNO3、NaCl 在不同温度下的部分溶解度数据(单位:g/100g 水),请回答问题:
温度(℃)
10
20
40
60
80
KNO3
20.9
31.6
63.9
110
169
NaCl
35.8
36
36.6
37.3
38.4
Ⅰ. 60℃时,KNO3溶解度是________________。将70g的硝酸钾加入到50g 水中,所得溶液的质量是________________g。
Ⅱ. 60℃时,KNO3的饱和溶液中含有少量NaCl,通过___________________方法获得较纯净的KNO3晶体。
Ⅲ. 根据表中数据,请在坐标图中描点、绘制符合KNO3 溶解度变化规律的曲线__________________。
Ⅳ. 40℃时,向两个分别盛有相同质量的硝酸钾和氯化钠的烧杯中,各加入100g 水,充分溶解后,恢复至40℃,其结果如图所示。下列有关说法中,错误的是____________________(填字母编号)。
A烧杯①中溶解的是NaCl,烧杯②中溶解的是KNO3
B烧杯②中溶液肯定是不饱和溶液
C使烧杯①中固体全部溶解可以增加溶剂
D若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定减小
四、综合应用题
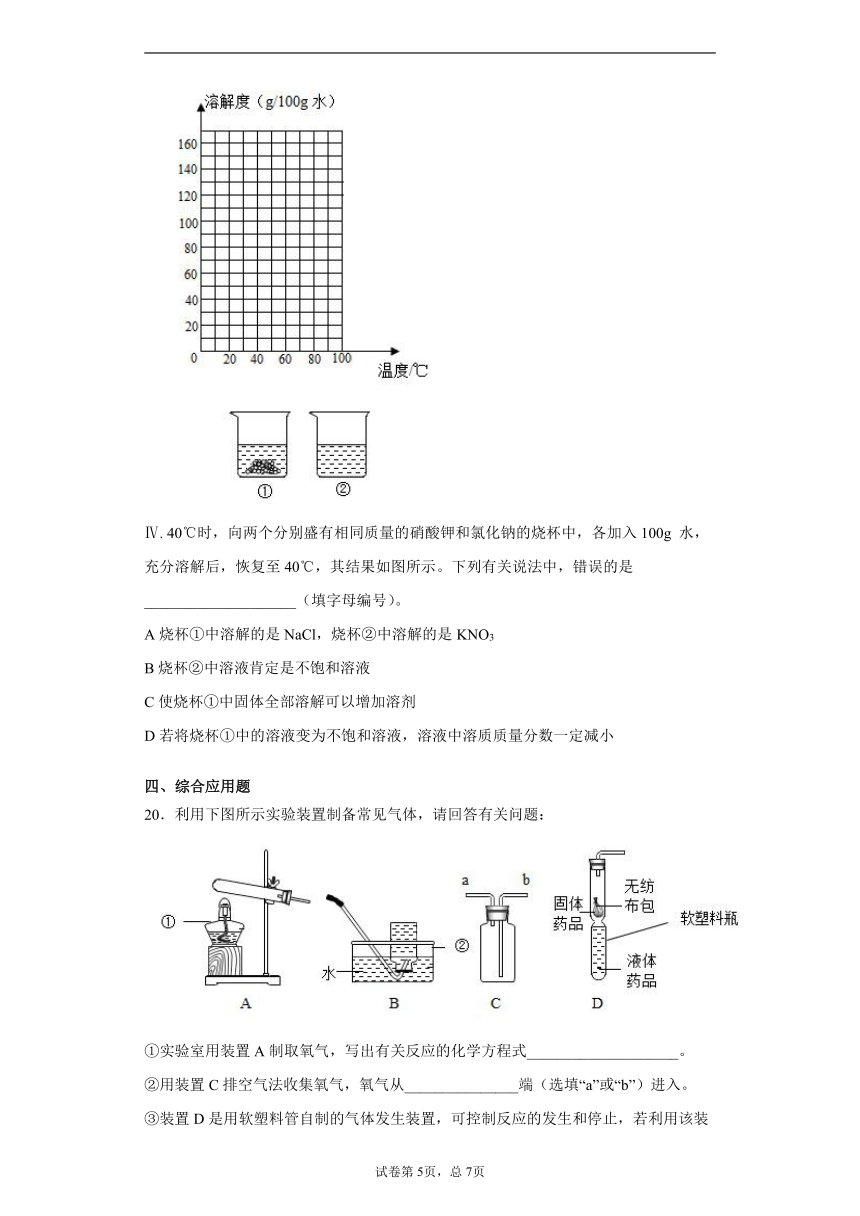
20.利用下图所示实验装置制备常见气体,请回答有关问题:
①实验室用装置A制取氧气,写出有关反应的化学方程式____________________。
②用装置C排空气法收集氧气,氧气从_______________端(选填“a”或“b”)进入。
③装置D是用软塑料管自制的气体发生装置,可控制反应的发生和停止,若利用该装置制取二氧化碳气体,药品加入完毕后(如图D 所示),欲产生二氧化碳接下来的操作是:________________。
④实验中用足量的石灰石和稀盐酸反应,制得二氧化碳为0.2mol。试计算:稀盐酸中参加反应的HCl的物质的量为多少mol?(根据化学方程式列式计算):____________________。
⑤“数字化实验”丰富了实验研究的方法,它可将实验过程中某些因素(酸碱性、气压等)的变化以数据、图像的形式呈现出来,下面是探究二氧化碳与水的反应的两种方案。请回答:
Ⅰ. 图1中可观察到甲试管中的紫色液体变为________________色,写出发生反应的化学方程式_________________,乙试管的作用是_______________。
Ⅱ. 由图2坐标图中的曲线可知,烧杯内溶液的酸性逐渐变_____________(填“强”或“弱”)。
五、科学探究题
21.为了验证某混合气体是由水蒸气、一氧化碳、二氧化碳三种气体组成。某化学小组设计了如图1的实验方案。小组查阅资料:氢氧化钠溶液能与CO2反应,可除去CO2气体。
①验证混合气体中含有二氧化碳和水蒸气,在图1的A、B 处依次放置______________(填图2 中的编号)。证明混合气体中含有水蒸气的现象是_______________。
②装置D中的实验现象为______________。
③在图1中装置E的作用是_____________,反应的化学方程式为_____________。
④小明认为图1中,去掉部分装置,也可以达到实验目的,你认为可以去掉的装置是_____(填图1 中字母序号)。
参考答案
1.B
【解析】
物理变化和化学变化的根本区别在于是否有新物质生成,如果有新物质生成,则属于化学变化; 反之,则是物理变化。铜丝折弯,只改变形状,物质的种类没有改变,所以是物理变化;故选B
2.B
【解析】
试题分析∶空气中能供给动植物呼吸的气体是B.O2.
考点∶考查氧气的性质。
3.C
【解析】
试题分析:废弃的易拉罐,属于金属材料,塑料瓶属于塑料,都是可回收物,故选C
考点:金属材料和塑料
4.C
【详解】
A、泥沙不溶于水,与水混合形成悬浊液;
B、植物油不溶于水,与水混合形成乳浊液;
C、白砂糖易溶于水,形成均一、稳定的混合物,属于溶液;
D、粉笔灰不溶于水,与水混合形成悬浊液。
故选:C。
5.B
【详解】
A、钻石(C)是由一种元素组成的纯净物,属于单质,故A错误;
B、水晶(SiO2)是由两种元素组成的且有一种是氧元素的化合物,属于氧化物,故B正确;
C、食盐(NaCl)是由两种元素组成的化合物,但不含氧元素,不属于氧化物,故C错误;
D、钟乳石(CaCO3)是由钙、碳、氧三种元素组成的化合物,不属于氧化物,故D错误。故选B。
6.B
【详解】
A、钡元素的元素符号为Ba,故选项化学用语书写正确。
B、氦气为稀有气体,由氦原子直接构成,化学式为He,故选项化学用语书写错误。
C、由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故2Cl可表示2个氯原子,故选项化学用语书写正确。
D、氧化铝中铝元素显+3价,氧元素显-2价,其化学式为:Al2O3,故选项化学用语书写正确。
故选:B。
7.C
【解析】
试题分析:根据质量守恒定律化学反应前后原子的种类和数目不变,反应前N:4,H:12,O:6,反应后H:12,O:6,X的前面有化学计量数2,故X的化学式为N2,故选C。
考点:质量守恒定律的应用
8.D
【分析】
由同种元素组成的不同单质互为同素异形体。
【详解】
A、二氧化碳与一氧化碳都属于化合物,它们不属于同素异形体,故A不符合题意;
B、水和冰是由氢氧两种元素组成的同种物质,古B不符合题意;
C、水银是汞的俗称,它们是同一种物质,故C不符合题意;
D、金刚石是由碳元素组成的单质,石墨也是由碳元素组成的单质,所以它们互为同素异形体,故D符合题意。
故选D。
9.D
【详解】
A、,此反应是两种物质生成一种物质,属于化合反应,不符合题意;
B、CuSO4+2NaOH=Na2SO4+Cu(OH)2 ,此反应是两种化合物互相交换成分生成另外两种化合物,属于复分解反应,不符合题意;
C、,此反应是一种单质和一种化合物生成另一种单质和另一种化合物,属于置换反应,不符合题意;
D、H2CO3=CO2+H2O,是一种化合物分解生成两种化合物的反应,属于分解反应,符合题意。
故选D。
10.B
【详解】
氧显-2价,设二氧化氯中氯元素的化合价为x,根据在化合物中正负化合价代数和为零,则:x+(-2)×2=0,得x=+4。故选B。
11.C
【详解】
A、石墨具有优良的导电性,可用做电池电极,故错误;
B、稀有气体通电后能发出不同颜色的光,所以可用制霓虹灯,故错误;
C、一氧化碳具有还原性,所以可用冶炼金属,故正确;
D、活性炭具有吸附性,可以吸附色素和异味,不能杀菌消毒,故错误。
故选C。
12.B
【详解】
A、分子的质量比构成它的原子的质量大,而不同种分子和原子无法比较大小,说法错误;
B、分子是保持物质化学性质的最小粒子,所以保持水的化学性质的微粒是水分子,说法正确;
C、热胀冷缩的过程是因为微粒间间隔随温度变化而变化,说法错误;
D、在化学变化中原子的种类不变,没有新的原子产生,说法错误。
故选:B。
13.B
【详解】
A、由图可知,参加反应的甲、乙分子个数比为2:1,有一个乙分子未参与反应,不符合题意;
B、由图可知,该反应前后,原子种类和数目不变,符合题意;
C、生成物是由两种元素组成的纯净物,可能含氧元素,属于氧化物,也可能不含氧元素,不符合题意;
D、反应生成了一种物质,不符合题意。
故选B。
14.D
【详解】
A.摩尔质量是指1mol物质的质量,单位为g/mol,故摩尔质量之前不应再规定物质的量,所以应为氧气的摩尔质量为32g/mol,故选项A说法错误;
B.1mol任何物质都约含有6.02×1023个微粒,不一定是分子,也有可能是离子或原子,故选项B说法错误;
C.2gH2中含有1mol氢分子,故选项C说法错误;
D.一个氧分子的相对分子质量为32,一个臭氧分子的相对分子质量为48,故3个氧气分子和2个臭氧分子的质量相等,故它们的物质的量之比为3:2,故选项D说法正确。
故选D。
15.A
【详解】
要比较食盐和蔗糖在水中的溶解性,需要控制在相同的温度下,可以比较在相同量的水中溶解食盐和蔗糖的质量的大小,可以比较相同量的食盐和蔗糖全部溶解需要的水的质量,搅拌、饱和状态、颗粒大小不需要控制。
故选:A。
16.C
【详解】
A、开始固体中不含二氧化碳,碳酸钙高温分解生成氧化钙和CO2,CO2的体积应该是从0开始,随时间增加,到一定时间后碳酸钙反应完全,不再产生二氧化碳,体积不再变,A错误;
B、开始固体中不含氧化钙,碳酸钙高温分解生成氧化钙和CO2,CaO的质量应该是从0开始,随时间增加,到一定时间后碳酸钙反应完全,不再产生CaO,质量不再变,B错误;
C、高温煅烧碳酸钙达到分解温度才开始分解,反应开始后,碳酸钙的质量减少,生成二氧化碳,所以固体总质量减少,但杂质不变,所以固体中杂质的质量分数会增大,当碳酸钙完全分解后,质量分数不再变化,C正确;
D、碳酸钙反应生成氧化钙,CaCO3中氧元素的质量分数为:
CaO中氧元素的质量分数为:
所以固体中氧元素的质量分数先减少然后反应完全后保持不变,D错误。
故选C。
17.BC
【详解】
A、在化学反应中,反应前后原子的种类没有改变,数目没有增减,化学反应前后分子数目不一定变,故错误;
B、由同种元素组成的纯净物叫单质,故正确;
C、常温下,测定某溶液的pH=3,该溶液一定呈酸性,故正确;
D、某气体不能使带火星木条复燃,该气体中可能含有氧气,例如空气不能使带火星的木条复燃,但是空气中含有氧气,故错误。
故选BC。
18.二氧化硫和二氧化氮 天然气 NaCl 吸附 CaO
【详解】
①能引起酸雨的气体是二氧化硫和二氧化氮,二氧化硫(二氧化氮)与雨水、氧气作用生成硫酸(硝酸)。
②常见的化石燃料包括煤、石油和天然气。
③生理盐水中的溶质是氯化钠(NaCl)。
④活性炭常用作冰箱除味剂,是因为它疏松多孔,具有吸附作用。
⑤可以做干燥剂的金属氧化物是氧化钙,氧化钙能与水反应,氧化钙中钙元素化合价为+2,氧元素化合价为-2,其化学式为CaO。
19. 氢气 氢、氧元素 8 110g/100g水 105 降温结晶 BD
【详解】
①如图电解水实验,电解水生成氢气和氧气,该反应的化学方程式,根据“正氧负氢”,1处连接电源负极,产生的气体是氢气。
②该实验的主要目的是验证水由氢、氧元素组成。
③现要配制浓度为16%的食盐水50kg,需要称量氯化钠50kg×16%=8kg。
④Ⅰ.60℃时,KNO3溶解度是110g/100g水。将70g的硝酸钾加入到50g水中,最多可溶解55g硝酸钾,所得溶液的质量是55g+50g=105g。
Ⅱ.60℃时,KNO3的饱和溶液中含有少量NaCl,硝酸钾溶解度受温度影响较为显著,通过降温结晶方法获得较纯净的KNO3晶体。
Ⅲ.根据表中数据,请在坐标图中描点、绘制符合KNO3溶解度变化规律的曲线为。
Ⅳ.A、40℃时,硝酸钾溶解度大于氯化钠溶解度,根据上述分析,烧杯①中溶解的是NaCl,烧杯②中溶解的是KNO3,说法正确;
B、烧杯②中溶液可能恰好饱和,也可能是不饱和溶液,说法错误;
C、增加溶剂都有可能将烧杯①中固体全部溶解,说法正确;
D、若将烧杯①中的溶液变为不饱和溶液,若采取升温的方法,则溶液中溶质的质量分数增大,若采取增加溶剂的方法,则溶液中溶质质量分数不变或减小,说法错误;
故填:BD。
20. b 挤压软塑料瓶使液体药品与固体药品接触 0.4(实验中用足量的石灰石和稀盐酸反应,制得二氧化碳为0.2mol,设稀盐酸中参加反应的HCl的物质的量为x,则
解得x=0.4mol。 红 对照 强
【详解】
①实验室用装置A制取氧气,试管口没有棉花,是氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,反应的化学方程式。
②氧气密度比空气大,用装置C排空气法收集氧气,氧气从b进入。
③装置D是用软塑料管自制的气体发生装置,可控制反应的发生和停止,若利用该装置制取二氧化碳气体,药品加入完毕后(如图D 所示),欲产生二氧化碳接下来的操作是:挤压软塑料瓶使液体药品与固体药品接触。
④见答案。
⑤Ⅰ.二氧化碳与水反应生成碳酸,碳酸使紫色石蕊变红,图1中可观察到甲试管中的紫色液体变为红色,发生反应的化学方程式,乙试管的作用是对照
Ⅱ.由图2坐标图中的曲线可知,烧杯内溶液的pH逐渐减小,酸性逐渐变强。
21.II、I II 中无水 CuSO4粉末逐渐变蓝 黑色固体逐渐变红 检验和吸收CO与CuO反应产生的CO2 CO2+Ca(OH)2=CaCO3↓+H2O DE 或 C
【分析】
(1)硫酸铜检验水的存在,氢氧化钙溶液检验二氧化碳的存在;
(2)根据一氧化碳的性质书写反应现象;
(3)氢氧化钙溶液都是用来检验和吸收二氧化碳气体的;
(4)根据一氧化碳具有还原性和可燃性进行分析。
【详解】
(1)硫酸铜检验水的存在,氢氧化钙溶液检验二氧化碳的存在;气体通过溶液后,都会带出水蒸气,影响水蒸气的检验,故应先接Ⅱ检验有无水生成,再接Ⅰ检验是否有二氧化碳生成;证明混合气体中含有水蒸气的现象是:II 中无水 CuSO4粉末逐渐变蓝,故填:Ⅱ;Ⅰ;II 中无水 CuSO4粉末逐渐变蓝;
(2)D中一氧化碳与氧化铜在加热的条件下生成铜和二氧化碳,所以D中的现象为:黑色固体逐渐变红;故填:黑色固体逐渐变红;
(3)二氧化碳能使澄清的石灰水变浑浊,所以石灰水的作用是:检验和吸收 CO 与 CuO 反应产生的CO2,二氧化碳与石灰水反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;故填:检验和吸收 CO 与 CuO 反应产生的CO2;CO2+Ca(OH)2=CaCO3↓+H2O;
(4)去掉DE气体通入装置后,气体在F处能燃烧就说明气体中含有一氧化碳;或去掉C,通过观察D中黑色固体变红色和尾气能点燃即可证明混合气体中含有一氧化碳,故填:DE或C。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.属于物理变化的是
A.食物腐烂 B.铜丝折弯 C.火柴燃烧 D.铁器生锈
2.空气中能供给动植物呼吸的气体是( )
A.N2 B.O2 C.H2O D.CO2
3.废弃的易拉罐和塑料瓶属于
A.厨余垃圾 B.其他垃圾 C.可回收物 D.有害垃圾
4.加入足量的水搅拌能形成溶液的是( )
A.泥沙 B.植物油 C.白砂糖 D.粉笔灰
5.下列物质的主要成分属于氧化物的是( )
A. 钻石(C) B. 水晶(SiO2) C. 食盐(NaCl) D. 钟乳石(CaCO3)
6.化学用语表示错误的是( )
A.钡元素:Ba B.氦气:He2 C.2 个氯原子:2Cl D.氧化铝:Al2O3
7.氨气(NH3)燃烧反应的化学方程式为:4NH3 + 3O2 点燃 6H2O + 2 X,则X的化学式为
A.H2 B.O2 C.N2 D.NO2
8.属于同素异形体的是( )
A.二氧化碳与一氧化碳 B.水与冰 C.汞与水银 D.金刚石与石墨
9.属于分解反应的是( )
A. B.CuSO4+2NaOH=Na2SO4+Cu(OH)2
C. D.H2CO3CO2+H2O
10.二氧化氯是国际上公认的高效消毒剂,其化学式为 ClO2,其中氯元素的化合价为( )
A.+2 B.+4 C.-1 D.-2
11.物质的“性质—用途”对应关系正确的是( )
性质
用途
A
石墨软又滑
作电极
B
稀有气体通电发光
作保护气
C
CO 有还原性
冶炼金属
D
活性炭有吸附性
杀菌消毒
A.A B.B C.C D.D
12.有关分子和原子的说法正确的是( )
A.分子大,原子小 B.保持水的化学性质的微粒是水分子
C.热胀冷缩的过程分子体积变大 D.化学变化中有新的原子产生
13.甲() 和乙()是两种不同的分子,它们在一定条件下能发生化学反应,反应前后的微观变化如下图所示,下列说法正确的是( )
A.参加反应的甲、乙分子个数比为 1:1 B.该反应前后原子种类和原子个数均不变
C.生成物中一定有氧化物 D.反应生成了二种物质
14.以下说法正确的是( )
A.1mol氧气的摩尔质量为32g
B.1mol任何物质都约含有6.02×1023个分子
C.2gH2中含有1mol 氢
D.质量相等的O2和O3,它们的物质的量之比为3:2
15.比较食盐和蔗糖在水中的溶解性,必须控制的条件是( )
A.温度均相同 B.均用玻璃棒搅拌
C.均达到饱和状态 D.食盐和蔗糖颗粒大小均相同
16.工业上常用高温煅烧石灰石来制得生石灰,发生的反应为CaCO3CaO+CO2。现取一定量的石灰石样品进行煅烧(假设杂质不变),某变量 y 随时间的变化趋势如图所示。则纵坐标表示的是( )
A.生成CO2的体积 B.生成CaO的质量
C.固体中杂质的质量分数 D.固体中氧元素的质量分数
二、多选题
17.科学探究中常用到推理的方法。根据下列实验事实推出结论正确的是( )
编号
实验事实
实验结论
A
化学反应前后原子数目不变
化学反应前后分子数目也不变
B
某纯净物中含有一种元素
该物质一定是单质
C
常温下,测定某溶液的pH=3
该溶液一定呈酸性
D
某气体不能使带火星的木条复燃
该气体一定不含氧气
A.A B.B C.C D.D
三、填空题
18.日常生活,离不开化学,通过学习我们知道:
①能引起酸雨的气体是_____。
②常见的化石燃料包括煤、石油和_____。
③生理盐水中的溶质是_____。
④活性炭常用作冰箱除味剂,是因为它具有_______________作用。
⑤可以做干燥剂的金属氧化物是__________________(填化学式)。
19.水是生命的源泉,也是不可缺少的资源。
①如图电解水实验,写出该反应的化学方程式__________________,1处产生的气体是____________________。
②该实验的主要目的是验证水由______________组成。
③我区华亭大米远近闻名,选种时可用一定浓度的食盐水浸泡选种。现要配制浓度为16%的食盐水50kg,需要称量氯化钠______________________kg。
④下表是KNO3、NaCl 在不同温度下的部分溶解度数据(单位:g/100g 水),请回答问题:
温度(℃)
10
20
40
60
80
KNO3
20.9
31.6
63.9
110
169
NaCl
35.8
36
36.6
37.3
38.4
Ⅰ. 60℃时,KNO3溶解度是________________。将70g的硝酸钾加入到50g 水中,所得溶液的质量是________________g。
Ⅱ. 60℃时,KNO3的饱和溶液中含有少量NaCl,通过___________________方法获得较纯净的KNO3晶体。
Ⅲ. 根据表中数据,请在坐标图中描点、绘制符合KNO3 溶解度变化规律的曲线__________________。
Ⅳ. 40℃时,向两个分别盛有相同质量的硝酸钾和氯化钠的烧杯中,各加入100g 水,充分溶解后,恢复至40℃,其结果如图所示。下列有关说法中,错误的是____________________(填字母编号)。
A烧杯①中溶解的是NaCl,烧杯②中溶解的是KNO3
B烧杯②中溶液肯定是不饱和溶液
C使烧杯①中固体全部溶解可以增加溶剂
D若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定减小
四、综合应用题
20.利用下图所示实验装置制备常见气体,请回答有关问题:
①实验室用装置A制取氧气,写出有关反应的化学方程式____________________。
②用装置C排空气法收集氧气,氧气从_______________端(选填“a”或“b”)进入。
③装置D是用软塑料管自制的气体发生装置,可控制反应的发生和停止,若利用该装置制取二氧化碳气体,药品加入完毕后(如图D 所示),欲产生二氧化碳接下来的操作是:________________。
④实验中用足量的石灰石和稀盐酸反应,制得二氧化碳为0.2mol。试计算:稀盐酸中参加反应的HCl的物质的量为多少mol?(根据化学方程式列式计算):____________________。
⑤“数字化实验”丰富了实验研究的方法,它可将实验过程中某些因素(酸碱性、气压等)的变化以数据、图像的形式呈现出来,下面是探究二氧化碳与水的反应的两种方案。请回答:
Ⅰ. 图1中可观察到甲试管中的紫色液体变为________________色,写出发生反应的化学方程式_________________,乙试管的作用是_______________。
Ⅱ. 由图2坐标图中的曲线可知,烧杯内溶液的酸性逐渐变_____________(填“强”或“弱”)。
五、科学探究题
21.为了验证某混合气体是由水蒸气、一氧化碳、二氧化碳三种气体组成。某化学小组设计了如图1的实验方案。小组查阅资料:氢氧化钠溶液能与CO2反应,可除去CO2气体。
①验证混合气体中含有二氧化碳和水蒸气,在图1的A、B 处依次放置______________(填图2 中的编号)。证明混合气体中含有水蒸气的现象是_______________。
②装置D中的实验现象为______________。
③在图1中装置E的作用是_____________,反应的化学方程式为_____________。
④小明认为图1中,去掉部分装置,也可以达到实验目的,你认为可以去掉的装置是_____(填图1 中字母序号)。
参考答案
1.B
【解析】
物理变化和化学变化的根本区别在于是否有新物质生成,如果有新物质生成,则属于化学变化; 反之,则是物理变化。铜丝折弯,只改变形状,物质的种类没有改变,所以是物理变化;故选B
2.B
【解析】
试题分析∶空气中能供给动植物呼吸的气体是B.O2.
考点∶考查氧气的性质。
3.C
【解析】
试题分析:废弃的易拉罐,属于金属材料,塑料瓶属于塑料,都是可回收物,故选C
考点:金属材料和塑料
4.C
【详解】
A、泥沙不溶于水,与水混合形成悬浊液;
B、植物油不溶于水,与水混合形成乳浊液;
C、白砂糖易溶于水,形成均一、稳定的混合物,属于溶液;
D、粉笔灰不溶于水,与水混合形成悬浊液。
故选:C。
5.B
【详解】
A、钻石(C)是由一种元素组成的纯净物,属于单质,故A错误;
B、水晶(SiO2)是由两种元素组成的且有一种是氧元素的化合物,属于氧化物,故B正确;
C、食盐(NaCl)是由两种元素组成的化合物,但不含氧元素,不属于氧化物,故C错误;
D、钟乳石(CaCO3)是由钙、碳、氧三种元素组成的化合物,不属于氧化物,故D错误。故选B。
6.B
【详解】
A、钡元素的元素符号为Ba,故选项化学用语书写正确。
B、氦气为稀有气体,由氦原子直接构成,化学式为He,故选项化学用语书写错误。
C、由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故2Cl可表示2个氯原子,故选项化学用语书写正确。
D、氧化铝中铝元素显+3价,氧元素显-2价,其化学式为:Al2O3,故选项化学用语书写正确。
故选:B。
7.C
【解析】
试题分析:根据质量守恒定律化学反应前后原子的种类和数目不变,反应前N:4,H:12,O:6,反应后H:12,O:6,X的前面有化学计量数2,故X的化学式为N2,故选C。
考点:质量守恒定律的应用
8.D
【分析】
由同种元素组成的不同单质互为同素异形体。
【详解】
A、二氧化碳与一氧化碳都属于化合物,它们不属于同素异形体,故A不符合题意;
B、水和冰是由氢氧两种元素组成的同种物质,古B不符合题意;
C、水银是汞的俗称,它们是同一种物质,故C不符合题意;
D、金刚石是由碳元素组成的单质,石墨也是由碳元素组成的单质,所以它们互为同素异形体,故D符合题意。
故选D。
9.D
【详解】
A、,此反应是两种物质生成一种物质,属于化合反应,不符合题意;
B、CuSO4+2NaOH=Na2SO4+Cu(OH)2 ,此反应是两种化合物互相交换成分生成另外两种化合物,属于复分解反应,不符合题意;
C、,此反应是一种单质和一种化合物生成另一种单质和另一种化合物,属于置换反应,不符合题意;
D、H2CO3=CO2+H2O,是一种化合物分解生成两种化合物的反应,属于分解反应,符合题意。
故选D。
10.B
【详解】
氧显-2价,设二氧化氯中氯元素的化合价为x,根据在化合物中正负化合价代数和为零,则:x+(-2)×2=0,得x=+4。故选B。
11.C
【详解】
A、石墨具有优良的导电性,可用做电池电极,故错误;
B、稀有气体通电后能发出不同颜色的光,所以可用制霓虹灯,故错误;
C、一氧化碳具有还原性,所以可用冶炼金属,故正确;
D、活性炭具有吸附性,可以吸附色素和异味,不能杀菌消毒,故错误。
故选C。
12.B
【详解】
A、分子的质量比构成它的原子的质量大,而不同种分子和原子无法比较大小,说法错误;
B、分子是保持物质化学性质的最小粒子,所以保持水的化学性质的微粒是水分子,说法正确;
C、热胀冷缩的过程是因为微粒间间隔随温度变化而变化,说法错误;
D、在化学变化中原子的种类不变,没有新的原子产生,说法错误。
故选:B。
13.B
【详解】
A、由图可知,参加反应的甲、乙分子个数比为2:1,有一个乙分子未参与反应,不符合题意;
B、由图可知,该反应前后,原子种类和数目不变,符合题意;
C、生成物是由两种元素组成的纯净物,可能含氧元素,属于氧化物,也可能不含氧元素,不符合题意;
D、反应生成了一种物质,不符合题意。
故选B。
14.D
【详解】
A.摩尔质量是指1mol物质的质量,单位为g/mol,故摩尔质量之前不应再规定物质的量,所以应为氧气的摩尔质量为32g/mol,故选项A说法错误;
B.1mol任何物质都约含有6.02×1023个微粒,不一定是分子,也有可能是离子或原子,故选项B说法错误;
C.2gH2中含有1mol氢分子,故选项C说法错误;
D.一个氧分子的相对分子质量为32,一个臭氧分子的相对分子质量为48,故3个氧气分子和2个臭氧分子的质量相等,故它们的物质的量之比为3:2,故选项D说法正确。
故选D。
15.A
【详解】
要比较食盐和蔗糖在水中的溶解性,需要控制在相同的温度下,可以比较在相同量的水中溶解食盐和蔗糖的质量的大小,可以比较相同量的食盐和蔗糖全部溶解需要的水的质量,搅拌、饱和状态、颗粒大小不需要控制。
故选:A。
16.C
【详解】
A、开始固体中不含二氧化碳,碳酸钙高温分解生成氧化钙和CO2,CO2的体积应该是从0开始,随时间增加,到一定时间后碳酸钙反应完全,不再产生二氧化碳,体积不再变,A错误;
B、开始固体中不含氧化钙,碳酸钙高温分解生成氧化钙和CO2,CaO的质量应该是从0开始,随时间增加,到一定时间后碳酸钙反应完全,不再产生CaO,质量不再变,B错误;
C、高温煅烧碳酸钙达到分解温度才开始分解,反应开始后,碳酸钙的质量减少,生成二氧化碳,所以固体总质量减少,但杂质不变,所以固体中杂质的质量分数会增大,当碳酸钙完全分解后,质量分数不再变化,C正确;
D、碳酸钙反应生成氧化钙,CaCO3中氧元素的质量分数为:
CaO中氧元素的质量分数为:
所以固体中氧元素的质量分数先减少然后反应完全后保持不变,D错误。
故选C。
17.BC
【详解】
A、在化学反应中,反应前后原子的种类没有改变,数目没有增减,化学反应前后分子数目不一定变,故错误;
B、由同种元素组成的纯净物叫单质,故正确;
C、常温下,测定某溶液的pH=3,该溶液一定呈酸性,故正确;
D、某气体不能使带火星木条复燃,该气体中可能含有氧气,例如空气不能使带火星的木条复燃,但是空气中含有氧气,故错误。
故选BC。
18.二氧化硫和二氧化氮 天然气 NaCl 吸附 CaO
【详解】
①能引起酸雨的气体是二氧化硫和二氧化氮,二氧化硫(二氧化氮)与雨水、氧气作用生成硫酸(硝酸)。
②常见的化石燃料包括煤、石油和天然气。
③生理盐水中的溶质是氯化钠(NaCl)。
④活性炭常用作冰箱除味剂,是因为它疏松多孔,具有吸附作用。
⑤可以做干燥剂的金属氧化物是氧化钙,氧化钙能与水反应,氧化钙中钙元素化合价为+2,氧元素化合价为-2,其化学式为CaO。
19. 氢气 氢、氧元素 8 110g/100g水 105 降温结晶 BD
【详解】
①如图电解水实验,电解水生成氢气和氧气,该反应的化学方程式,根据“正氧负氢”,1处连接电源负极,产生的气体是氢气。
②该实验的主要目的是验证水由氢、氧元素组成。
③现要配制浓度为16%的食盐水50kg,需要称量氯化钠50kg×16%=8kg。
④Ⅰ.60℃时,KNO3溶解度是110g/100g水。将70g的硝酸钾加入到50g水中,最多可溶解55g硝酸钾,所得溶液的质量是55g+50g=105g。
Ⅱ.60℃时,KNO3的饱和溶液中含有少量NaCl,硝酸钾溶解度受温度影响较为显著,通过降温结晶方法获得较纯净的KNO3晶体。
Ⅲ.根据表中数据,请在坐标图中描点、绘制符合KNO3溶解度变化规律的曲线为。
Ⅳ.A、40℃时,硝酸钾溶解度大于氯化钠溶解度,根据上述分析,烧杯①中溶解的是NaCl,烧杯②中溶解的是KNO3,说法正确;
B、烧杯②中溶液可能恰好饱和,也可能是不饱和溶液,说法错误;
C、增加溶剂都有可能将烧杯①中固体全部溶解,说法正确;
D、若将烧杯①中的溶液变为不饱和溶液,若采取升温的方法,则溶液中溶质的质量分数增大,若采取增加溶剂的方法,则溶液中溶质质量分数不变或减小,说法错误;
故填:BD。
20. b 挤压软塑料瓶使液体药品与固体药品接触 0.4(实验中用足量的石灰石和稀盐酸反应,制得二氧化碳为0.2mol,设稀盐酸中参加反应的HCl的物质的量为x,则
解得x=0.4mol。 红 对照 强
【详解】
①实验室用装置A制取氧气,试管口没有棉花,是氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,反应的化学方程式。
②氧气密度比空气大,用装置C排空气法收集氧气,氧气从b进入。
③装置D是用软塑料管自制的气体发生装置,可控制反应的发生和停止,若利用该装置制取二氧化碳气体,药品加入完毕后(如图D 所示),欲产生二氧化碳接下来的操作是:挤压软塑料瓶使液体药品与固体药品接触。
④见答案。
⑤Ⅰ.二氧化碳与水反应生成碳酸,碳酸使紫色石蕊变红,图1中可观察到甲试管中的紫色液体变为红色,发生反应的化学方程式,乙试管的作用是对照
Ⅱ.由图2坐标图中的曲线可知,烧杯内溶液的pH逐渐减小,酸性逐渐变强。
21.II、I II 中无水 CuSO4粉末逐渐变蓝 黑色固体逐渐变红 检验和吸收CO与CuO反应产生的CO2 CO2+Ca(OH)2=CaCO3↓+H2O DE 或 C
【分析】
(1)硫酸铜检验水的存在,氢氧化钙溶液检验二氧化碳的存在;
(2)根据一氧化碳的性质书写反应现象;
(3)氢氧化钙溶液都是用来检验和吸收二氧化碳气体的;
(4)根据一氧化碳具有还原性和可燃性进行分析。
【详解】
(1)硫酸铜检验水的存在,氢氧化钙溶液检验二氧化碳的存在;气体通过溶液后,都会带出水蒸气,影响水蒸气的检验,故应先接Ⅱ检验有无水生成,再接Ⅰ检验是否有二氧化碳生成;证明混合气体中含有水蒸气的现象是:II 中无水 CuSO4粉末逐渐变蓝,故填:Ⅱ;Ⅰ;II 中无水 CuSO4粉末逐渐变蓝;
(2)D中一氧化碳与氧化铜在加热的条件下生成铜和二氧化碳,所以D中的现象为:黑色固体逐渐变红;故填:黑色固体逐渐变红;
(3)二氧化碳能使澄清的石灰水变浑浊,所以石灰水的作用是:检验和吸收 CO 与 CuO 反应产生的CO2,二氧化碳与石灰水反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;故填:检验和吸收 CO 与 CuO 反应产生的CO2;CO2+Ca(OH)2=CaCO3↓+H2O;
(4)去掉DE气体通入装置后,气体在F处能燃烧就说明气体中含有一氧化碳;或去掉C,通过观察D中黑色固体变红色和尾气能点燃即可证明混合气体中含有一氧化碳,故填:DE或C。
同课章节目录
