高中化学苏教版(2019)必修第二册专题6化学反应与能量变化-第三单元化学能与电能的转化基础训练 含答案
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册专题6化学反应与能量变化-第三单元化学能与电能的转化基础训练 含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 387.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-17 21:16:21 | ||
图片预览




文档简介
高中化学苏教版(2019)必修第二册专题6化学反应与能量变化-第三单元化学能与电能的转化基础训练
一、单选题
1.燃料电池是一种高效:环境友好的发电装置。下图为氢氧燃料电池示意图,下列有关说法错误的是
A.该电池工作时可将化学能转化为电能
B.电池工作时,电子从电极b移向电极a
C.负极的电极反应式为
D.电池总反应的化学方程式为
2.下面的能源中属于二次能源的是(??
)
A.电能、蒸汽
B.电能、风能
C.蒸汽、风能
D.煤、石油
3.氨硼烷()电池可在常温下工作,装置如图所示。该电池工作时的总反应为。下列说法正确的是(
)
A.正极附近溶液的pH减小
B.电池工作时,通过质子交换膜向负极移动
C.消耗氨硼烷,理论上有电子通过内电路
D.电池负极反应式为
4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,外电路的电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,d极逐渐溶解,则四种金属的活动性由强到弱的顺序为(
)
A.a>b>c>d
B.a>c>d>b
C.c>a>d>b
D.b>d>c>a
5.两种金属A与B和稀硫酸组成原电池时,A是正极。下列有关推断正确的是(?
)
A.A的金属性强于B
B.电子不断由A电极经外电路流向B电极
C.A电极上发生的电极反应是还原反应
D.A的金属活动性一定排在氢前面
6.镍-镉()可充电电池的充电总反应为
,由此可知,该电池的负极材料是(
)
A.
B.
C.
D.
7.下列有关能量的说法不正确的是( )
A.化石燃料内部贮存着大量的化学能
B.可利用清洁能源如太阳能、潮汐能、风能来发电
C.利用原电池通过氧化还原反应实现化学能向电能转化
D.化学反应都伴随着能量的变化,燃料燃烧时只是将化学能转化为热能
8.a、b在金属活动性顺序中均位于氢的前面,a还可以从b的硝酸盐溶液中置换出b。将a、b用导线相连放入溶液中,下列叙述不正确的是(
)
A.导线中有电流。电流方向由b流向a
B.a质量减小,b质量增加
C.b上有氢气产生
D.a发生氧化反应,b上发生还原反应
9.关于CH4-O2-KOH(aq)燃料电池的说法正确的是(
)
A.负极电极反应式:O2+2H2O+4e-=4OH-
B.正极电极反应式:
C.随着放电的进行,溶液的pH值保持不变
D.放电时溶液中的阴离子向负极移动
10.有一种银锌微型纽扣电池.其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,电池总反应为
Ag2O+Zn=2Ag+ZnO。下列有关叙述中不正确的是
A.Zn为负极、Ag2O为正极
B.电池工作时,正极质量逐渐减小
C.电池工作时,电子由Zn极经外电路流向Ag2O极
D.电路中每通过0.2mol电子,负极的质量理论上减少6.5g
11.A、B、C都是金属,A和C分别放入同浓度的稀硫酸中,A的反应速率比C快,A与B和硫酸铜溶液组成原电池时,A的质量增加。A、B、C三种金属的活动性顺序为(
)
A.A>B>C
B.A>C>B
C.B>A>C
D.C>A>B
12.电子表和电子计算器的电源通常用微型银-锌电池,其电极分别为
Ag2O
和Zn,
电解质为
KOH
溶液,电极总反应为:Ag2O
+
H2O
+
Zn
=
Zn(OH)2
+
2Ag。
下列叙述正确的是
A.Zn是正极
B.Ag2O
电极上发生氧化反应
C.工作时正极区溶液的pH增大
D.工作时电子由
Ag2O
极经外电路流向Zn极
13.铝-海水-空气电池在航海中得到广泛的应用,其以海水做为电解液,电池的电极反应式分别为:Al-3eˉ=Al3+,O2
+
2H2O
+
4eˉ=4OHˉ,下列说法正确的是( )
A.该电池的正极是铝,发生氧化反应
B.电池工作时,电子通过外电路从负极流向正极,再从电解质溶液流回负极。
C.该电池的正极反应物是氧气
D.该电池实现了将电能转化为化学能
14.一种新型燃料电池,一极通入空气,另一极通入丁烷(C4H10)气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池的说法正确的是:
A.在熔融电解质中,O2-移向正极
B.当负极消耗4.48L气体时,转移电子5.2mole-
C.电子的流动方向:负极经外电路流向正极,再通过内电路流回负极
D.通入丁烷的一极是负极,电极反应为:C4H10-26e-+13O2-=4CO2+5H2O
15.在下图的装置中,属于原电池且有电流产生的是( )
A.
B.
C.
D.
二、填空题
16.研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。总反应为:2Li+2H2O=2LiOH+H2↑。
(1)该电池的负极是______,负极反应式是___________。
(2)正极现象是_______________。
(3)放电时OH-向______移动(填“正极”或“负极”)。
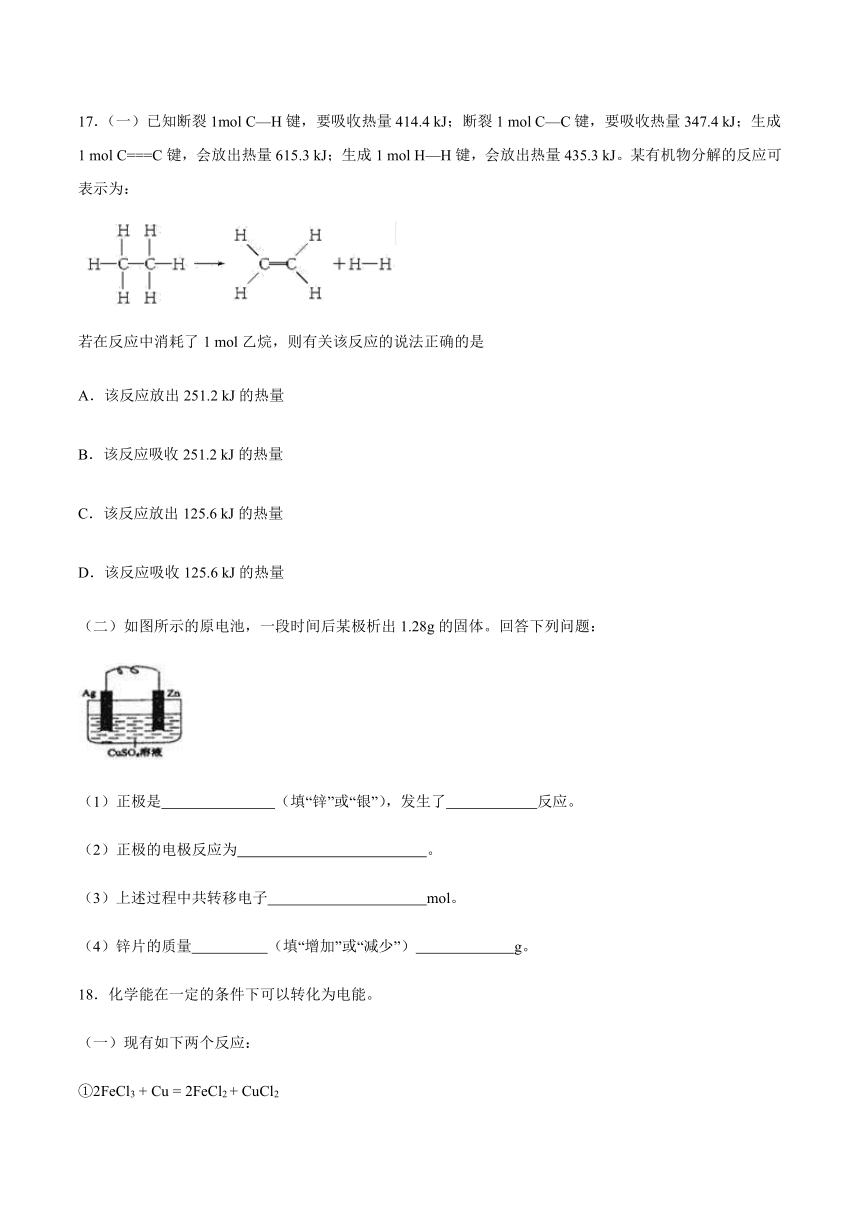
17.(一)已知断裂1mol
C—H键,要吸收热量414.4
kJ;断裂1
mol
C—C键,要吸收热量347.4
kJ;生成1
mol
C===C键,会放出热量615.3
kJ;生成1
mol
H—H键,会放出热量435.3
kJ。某有机物分解的反应可表示为:
若在反应中消耗了1
mol乙烷,则有关该反应的说法正确的是
A.该反应放出251.2
kJ的热量
B.该反应吸收251.2
kJ的热量
C.该反应放出125.6
kJ的热量
D.该反应吸收125.6
kJ的热量
(二)如图所示的原电池,一段时间后某极析出1.28g的固体。回答下列问题:
(1)正极是
(填“锌”或“银”),发生了
反应。
(2)正极的电极反应为
。
(3)上述过程中共转移电子
mol。
(4)锌片的质量
(填“增加”或“减少”)
g。
18.化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
①2FeCl3
+
Cu
=
2FeCl2
+
CuCl2
②Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是___(填反应序号),理由是___。
(二)请根据Zn
+
CuSO4
=
ZnSO4
+
Cu反应,选择适宜的材料和试剂设计一个原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。_____
(3)写出该原电池电极反应式:负极:___;正极:___。
19.“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
(1)飞船在光照区运行时,太阳能电池帆板将______能转化为______能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2,充电时,阳极的电极反应式为_______;当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性________(填“增大”、“减小”或“不变”)。
(2)紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O2Ag+Zn(OH)2,其负极的电极反应式为_________。
20.(1)家用炒菜铁锅用水清洗放置后会出现红棕色的锈斑,某同学欲对其原理及条件进行分析。该同学准备了下列实验用品:20%的NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U形管导线等;请设计一个实验方案验证铁被腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式:_____________________________,______________________________。
(2)将一铜棒和碳棒用导线连接后,插人盛有20%NaCl溶液的U形管中。
①若该装置不是原电池,请说明原因:________________________。(如果回答此题,则下面的②不用回答)。
②若该装置是原电池,请采取适当的措施(电极材料、溶液浓度均不变)来提高电池的放电效率:________________________。
三、原理综合题
21.某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:
(1)由图中所给数据进行分析,该反应的化学方程式为_________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0mol
H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s
0
50
150
250
350
n(NH3)
0
0.36
0.48
0.50
0.50
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将lmol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol
NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。
(4)CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。
电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是________(填“正极”或“负极”),c电极的电极反应式为___________。若外电路中转移2
mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为______
L。
(5)下列反应中,属于吸热反应的是
__________(填序号)
①物质燃烧
②炸药爆炸
③酸碱中和反应
④二氧化碳通过炽热的碳
⑤食物因氧化而腐败
⑥Ba(OH)2·8H2O与NH4Cl反应
⑦铁粉与稀盐酸反应
22.(1)反应
A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是______。
(2)合成氨工业中,合成塔中每产生
2mol
NH3,放出
92.2kJ
热量,已知(见图):则
1mol
N﹣H
键断裂吸收的能量约等于_______kJ。
(3)某学生为了探究锌与盐酸反应过程中的速率变化,在
100mL
稀盐酸中加入足量的锌粉,
用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min)
1
2
3
4
5
氢气体积(mL)(标况)
50
120
232
290
310
在
0~1min、1~2min、2~3min、3~4min、4~5
min
各相同的时间段里,反应速率最大的时间段是______,该段时间内用盐酸的浓度变化表示的反应速率为______。
(4)某反应中的反应物和生成物有
FeCl3、FeCl2、Cu、CuCl2。有人将上述反应设计成原电池并画图。
①该电池总反应的离子方程式为______。
②画出原电池简易装置图,并注明电极材料以及电解质溶液______。
23.NO2和N2O4之间发生反应:2NO2(g)?N2O4(g),一定温度下,体积为2L的密闭容器中,各种物质的物质的量随时间变化的关系如图所示:
请回答下列问题:
(1)曲线__________(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。在0到1min中内用X表示该反应的速率是______,该反应达最大限度时Y的转化率__________。
(2)上述反应在甲、乙两个相同容器内同时进行,测甲中v(NO2)=0.3mol/(L·min),乙中v(N2O4)=0.2mol/(L·min),则________中反应更快。
(3)NO、O2和熔融NaNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨II电极上生成氧化物Y(N2O5),则石墨I电极是_____(填“正极”或“负极”),石墨II的电极反应式为___。已知:电池中参与电极反应。
(4)研究表明,氮氧化物(NO)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如图所示:
下列关于雾霾及其形成的叙述中,正确的是____
A.雾霾的产生与燃料燃烧有关
B.整个过程涉及氧化还原反应、化合反应
C.雾霾中含有NH4NO3和(NH4)2SO4
D.NH3是形成无机颗粒物的催化剂
参考答案
1.B2.A3.D4.B5.C6.A7.D8.C9.D10.D11.C12.C13.C14.D15.D
16.锂
Li-e-=Li+
有无色气体产生
负极
17.(一)D;
(二)(1)锌
;还原;(2)Cu2++2e-=Cu;(3)0.04
;(4)减少;1.3。
18.①
反应①是氧化还原反应,有电子转移
Zn–2e-=Zn2+
Cu2++2e-=Cu
19.太阳
电
Ni(OH)2-e-+OH-=NiOOH+H2O
减小
Zn-2e-+2OH-=Zn(OH)2
20.用导线连接纯铁丝和碳棒后插人盛有20%溶液的U形管中,放置一段时间后,向插入纯铁丝的一端滴入1~2滴KSCN溶液,无明显变化,再滴入新制氯水,溶液显红色,证明负极有生成,
,=
向插入碳棒的一端滴入酚酞试液,溶液显红色,证明有生成
向插入碳棒一侧的溶液中通入氧气或空气。
21.3X(g)+Y(g)?Z(g)
946
负极
11.2
④⑥
22.D
391
2min?3min
2Fe3++Cu=2Fe2++Cu2+
23.Y
0.1mol/(L.min)
60%
乙
正极
NO2-e-+═N2O5
ABC
一、单选题
1.燃料电池是一种高效:环境友好的发电装置。下图为氢氧燃料电池示意图,下列有关说法错误的是
A.该电池工作时可将化学能转化为电能
B.电池工作时,电子从电极b移向电极a
C.负极的电极反应式为
D.电池总反应的化学方程式为
2.下面的能源中属于二次能源的是(??
)
A.电能、蒸汽
B.电能、风能
C.蒸汽、风能
D.煤、石油
3.氨硼烷()电池可在常温下工作,装置如图所示。该电池工作时的总反应为。下列说法正确的是(
)
A.正极附近溶液的pH减小
B.电池工作时,通过质子交换膜向负极移动
C.消耗氨硼烷,理论上有电子通过内电路
D.电池负极反应式为
4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,外电路的电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,d极逐渐溶解,则四种金属的活动性由强到弱的顺序为(
)
A.a>b>c>d
B.a>c>d>b
C.c>a>d>b
D.b>d>c>a
5.两种金属A与B和稀硫酸组成原电池时,A是正极。下列有关推断正确的是(?
)
A.A的金属性强于B
B.电子不断由A电极经外电路流向B电极
C.A电极上发生的电极反应是还原反应
D.A的金属活动性一定排在氢前面
6.镍-镉()可充电电池的充电总反应为
,由此可知,该电池的负极材料是(
)
A.
B.
C.
D.
7.下列有关能量的说法不正确的是( )
A.化石燃料内部贮存着大量的化学能
B.可利用清洁能源如太阳能、潮汐能、风能来发电
C.利用原电池通过氧化还原反应实现化学能向电能转化
D.化学反应都伴随着能量的变化,燃料燃烧时只是将化学能转化为热能
8.a、b在金属活动性顺序中均位于氢的前面,a还可以从b的硝酸盐溶液中置换出b。将a、b用导线相连放入溶液中,下列叙述不正确的是(
)
A.导线中有电流。电流方向由b流向a
B.a质量减小,b质量增加
C.b上有氢气产生
D.a发生氧化反应,b上发生还原反应
9.关于CH4-O2-KOH(aq)燃料电池的说法正确的是(
)
A.负极电极反应式:O2+2H2O+4e-=4OH-
B.正极电极反应式:
C.随着放电的进行,溶液的pH值保持不变
D.放电时溶液中的阴离子向负极移动
10.有一种银锌微型纽扣电池.其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,电池总反应为
Ag2O+Zn=2Ag+ZnO。下列有关叙述中不正确的是
A.Zn为负极、Ag2O为正极
B.电池工作时,正极质量逐渐减小
C.电池工作时,电子由Zn极经外电路流向Ag2O极
D.电路中每通过0.2mol电子,负极的质量理论上减少6.5g
11.A、B、C都是金属,A和C分别放入同浓度的稀硫酸中,A的反应速率比C快,A与B和硫酸铜溶液组成原电池时,A的质量增加。A、B、C三种金属的活动性顺序为(
)
A.A>B>C
B.A>C>B
C.B>A>C
D.C>A>B
12.电子表和电子计算器的电源通常用微型银-锌电池,其电极分别为
Ag2O
和Zn,
电解质为
KOH
溶液,电极总反应为:Ag2O
+
H2O
+
Zn
=
Zn(OH)2
+
2Ag。
下列叙述正确的是
A.Zn是正极
B.Ag2O
电极上发生氧化反应
C.工作时正极区溶液的pH增大
D.工作时电子由
Ag2O
极经外电路流向Zn极
13.铝-海水-空气电池在航海中得到广泛的应用,其以海水做为电解液,电池的电极反应式分别为:Al-3eˉ=Al3+,O2
+
2H2O
+
4eˉ=4OHˉ,下列说法正确的是( )
A.该电池的正极是铝,发生氧化反应
B.电池工作时,电子通过外电路从负极流向正极,再从电解质溶液流回负极。
C.该电池的正极反应物是氧气
D.该电池实现了将电能转化为化学能
14.一种新型燃料电池,一极通入空气,另一极通入丁烷(C4H10)气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池的说法正确的是:
A.在熔融电解质中,O2-移向正极
B.当负极消耗4.48L气体时,转移电子5.2mole-
C.电子的流动方向:负极经外电路流向正极,再通过内电路流回负极
D.通入丁烷的一极是负极,电极反应为:C4H10-26e-+13O2-=4CO2+5H2O
15.在下图的装置中,属于原电池且有电流产生的是( )
A.
B.
C.
D.
二、填空题
16.研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。总反应为:2Li+2H2O=2LiOH+H2↑。
(1)该电池的负极是______,负极反应式是___________。
(2)正极现象是_______________。
(3)放电时OH-向______移动(填“正极”或“负极”)。
17.(一)已知断裂1mol
C—H键,要吸收热量414.4
kJ;断裂1
mol
C—C键,要吸收热量347.4
kJ;生成1
mol
C===C键,会放出热量615.3
kJ;生成1
mol
H—H键,会放出热量435.3
kJ。某有机物分解的反应可表示为:
若在反应中消耗了1
mol乙烷,则有关该反应的说法正确的是
A.该反应放出251.2
kJ的热量
B.该反应吸收251.2
kJ的热量
C.该反应放出125.6
kJ的热量
D.该反应吸收125.6
kJ的热量
(二)如图所示的原电池,一段时间后某极析出1.28g的固体。回答下列问题:
(1)正极是
(填“锌”或“银”),发生了
反应。
(2)正极的电极反应为
。
(3)上述过程中共转移电子
mol。
(4)锌片的质量
(填“增加”或“减少”)
g。
18.化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
①2FeCl3
+
Cu
=
2FeCl2
+
CuCl2
②Na2CO3
+
2HCl
=
2NaCl
+
H2O
+
CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是___(填反应序号),理由是___。
(二)请根据Zn
+
CuSO4
=
ZnSO4
+
Cu反应,选择适宜的材料和试剂设计一个原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。_____
(3)写出该原电池电极反应式:负极:___;正极:___。
19.“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
(1)飞船在光照区运行时,太阳能电池帆板将______能转化为______能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2,充电时,阳极的电极反应式为_______;当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性________(填“增大”、“减小”或“不变”)。
(2)紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O2Ag+Zn(OH)2,其负极的电极反应式为_________。
20.(1)家用炒菜铁锅用水清洗放置后会出现红棕色的锈斑,某同学欲对其原理及条件进行分析。该同学准备了下列实验用品:20%的NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U形管导线等;请设计一个实验方案验证铁被腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式:_____________________________,______________________________。
(2)将一铜棒和碳棒用导线连接后,插人盛有20%NaCl溶液的U形管中。
①若该装置不是原电池,请说明原因:________________________。(如果回答此题,则下面的②不用回答)。
②若该装置是原电池,请采取适当的措施(电极材料、溶液浓度均不变)来提高电池的放电效率:________________________。
三、原理综合题
21.某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:
(1)由图中所给数据进行分析,该反应的化学方程式为_________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0mol
H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s
0
50
150
250
350
n(NH3)
0
0.36
0.48
0.50
0.50
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将lmol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol
NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。
(4)CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。
电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是________(填“正极”或“负极”),c电极的电极反应式为___________。若外电路中转移2
mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为______
L。
(5)下列反应中,属于吸热反应的是
__________(填序号)
①物质燃烧
②炸药爆炸
③酸碱中和反应
④二氧化碳通过炽热的碳
⑤食物因氧化而腐败
⑥Ba(OH)2·8H2O与NH4Cl反应
⑦铁粉与稀盐酸反应
22.(1)反应
A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是______。
(2)合成氨工业中,合成塔中每产生
2mol
NH3,放出
92.2kJ
热量,已知(见图):则
1mol
N﹣H
键断裂吸收的能量约等于_______kJ。
(3)某学生为了探究锌与盐酸反应过程中的速率变化,在
100mL
稀盐酸中加入足量的锌粉,
用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min)
1
2
3
4
5
氢气体积(mL)(标况)
50
120
232
290
310
在
0~1min、1~2min、2~3min、3~4min、4~5
min
各相同的时间段里,反应速率最大的时间段是______,该段时间内用盐酸的浓度变化表示的反应速率为______。
(4)某反应中的反应物和生成物有
FeCl3、FeCl2、Cu、CuCl2。有人将上述反应设计成原电池并画图。
①该电池总反应的离子方程式为______。
②画出原电池简易装置图,并注明电极材料以及电解质溶液______。
23.NO2和N2O4之间发生反应:2NO2(g)?N2O4(g),一定温度下,体积为2L的密闭容器中,各种物质的物质的量随时间变化的关系如图所示:
请回答下列问题:
(1)曲线__________(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。在0到1min中内用X表示该反应的速率是______,该反应达最大限度时Y的转化率__________。
(2)上述反应在甲、乙两个相同容器内同时进行,测甲中v(NO2)=0.3mol/(L·min),乙中v(N2O4)=0.2mol/(L·min),则________中反应更快。
(3)NO、O2和熔融NaNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨II电极上生成氧化物Y(N2O5),则石墨I电极是_____(填“正极”或“负极”),石墨II的电极反应式为___。已知:电池中参与电极反应。
(4)研究表明,氮氧化物(NO)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如图所示:
下列关于雾霾及其形成的叙述中,正确的是____
A.雾霾的产生与燃料燃烧有关
B.整个过程涉及氧化还原反应、化合反应
C.雾霾中含有NH4NO3和(NH4)2SO4
D.NH3是形成无机颗粒物的催化剂
参考答案
1.B2.A3.D4.B5.C6.A7.D8.C9.D10.D11.C12.C13.C14.D15.D
16.锂
Li-e-=Li+
有无色气体产生
负极
17.(一)D;
(二)(1)锌
;还原;(2)Cu2++2e-=Cu;(3)0.04
;(4)减少;1.3。
18.①
反应①是氧化还原反应,有电子转移
Zn–2e-=Zn2+
Cu2++2e-=Cu
19.太阳
电
Ni(OH)2-e-+OH-=NiOOH+H2O
减小
Zn-2e-+2OH-=Zn(OH)2
20.用导线连接纯铁丝和碳棒后插人盛有20%溶液的U形管中,放置一段时间后,向插入纯铁丝的一端滴入1~2滴KSCN溶液,无明显变化,再滴入新制氯水,溶液显红色,证明负极有生成,
,=
向插入碳棒的一端滴入酚酞试液,溶液显红色,证明有生成
向插入碳棒一侧的溶液中通入氧气或空气。
21.3X(g)+Y(g)?Z(g)
946
负极
11.2
④⑥
22.D
391
2min?3min
2Fe3++Cu=2Fe2++Cu2+
23.Y
0.1mol/(L.min)
60%
乙
正极
NO2-e-+═N2O5
ABC
