高中化学苏教版(2019)必修第二册专题7氨与社会可持续发展-第一单元氮的固定基础训练 含答案
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册专题7氨与社会可持续发展-第一单元氮的固定基础训练 含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 313.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-17 21:18:31 | ||
图片预览




文档简介
高中化学苏教版(2019)必修第二册专题7氨与社会可持续发展-第一单元氮的固定基础训练
一、单选题
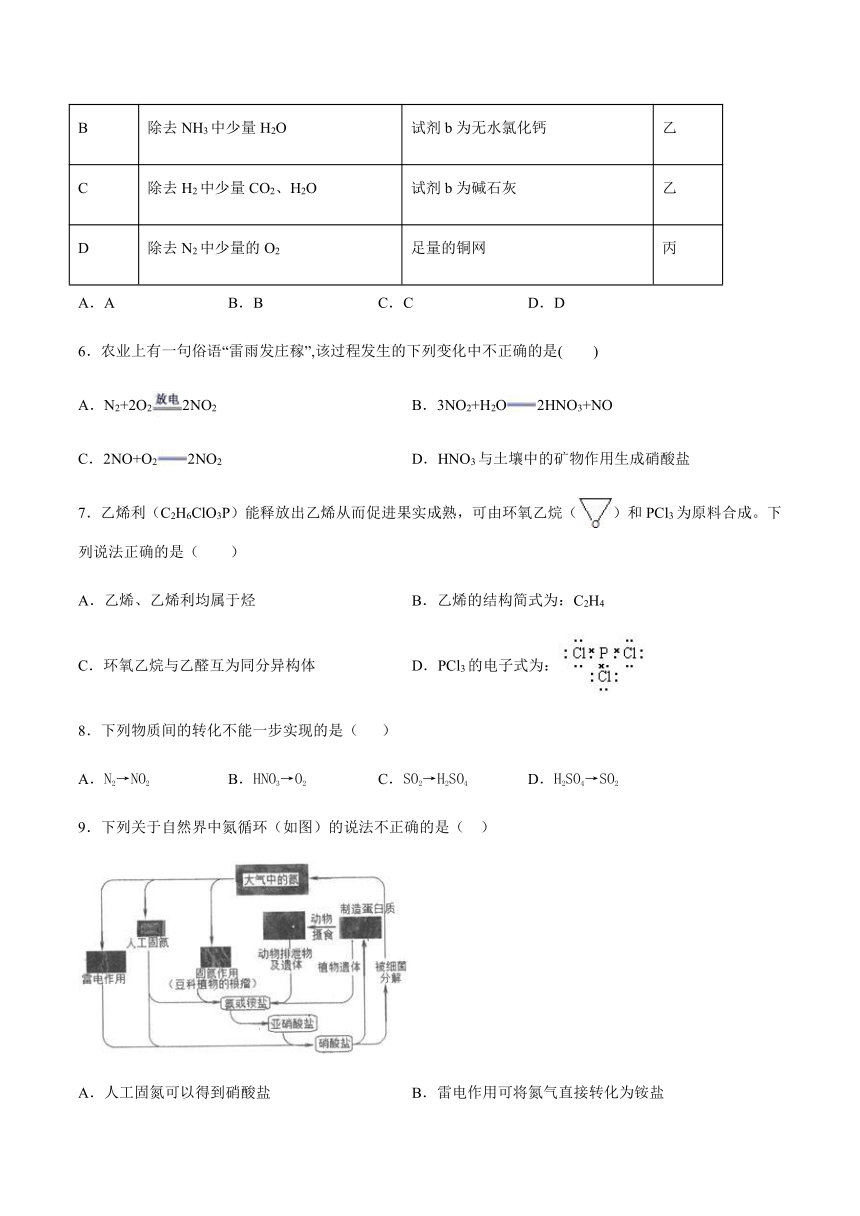
1.N2是空气的重要组成部分,因此有科学家依据蒸汽机的原理,设计制造出液氮蒸汽机,即利用液态氮的蒸发来驱动机车,从而达到环境保护的目的,其原理主要依据是(
)
A.液氮的沸点为﹣195.8℃,远低于常温
B.N2在空气中燃烧放热
C.N2的化学性质很稳定
D.N2在空气中的体积分数为78%
2.常温下能发生反应的一组气体是(
)
A.N2、O2
B.NO、O2
C.H2、O2
D.H2、CO
3.通常状况下,氮气的性质不活泼的原因是(
)
A.氮分子中有三个共价键,键能很大
B.氮元素非金属性很弱
C.氮分子中氮元素化合价为零
D.固态氮属于分子晶体
4.空气中含量较多,且性质稳定的是(
)
A.氮气
B.氧气
C.二氧化碳
D.水蒸气
5.下列实验的试剂、装置选用不合理的是
选项
实验目的
试剂
装置
A
除去Cl2中少量的HCl、H2O
试剂a为饱和氯化钠溶液
甲
B
除去NH3中少量H2O
试剂b为无水氯化钙
乙
C
除去H2中少量CO2、H2O
试剂b为碱石灰
乙
D
除去N2中少量的O2
足量的铜网
丙
A.A
B.B
C.C
D.D
6.农业上有一句俗语“雷雨发庄稼”,该过程发生的下列变化中不正确的是( )
A.N2+2O22NO2
B.3NO2+H2O2HNO3+NO
C.2NO+O22NO2
D.HNO3与土壤中的矿物作用生成硝酸盐
7.乙烯利(C2H6ClO3P)能释放出乙烯从而促进果实成熟,可由环氧乙烷()和PCl3为原料合成。下列说法正确的是(
)
A.乙烯、乙烯利均属于烃
B.乙烯的结构简式为:C2H4
C.环氧乙烷与乙醛互为同分异构体
D.PCl3的电子式为:
8.下列物质间的转化不能一步实现的是(
)
A.N2→NO2
B.HNO3→O2
C.SO2→H2SO4
D.H2SO4→SO2
9.下列关于自然界中氮循环(如图)的说法不正确的是(
)
A.人工固氮可以得到硝酸盐
B.雷电作用可将氮气直接转化为铵盐
C.细菌对氮元素的循环有重要作用
D.亚硝酸盐转化为硝酸盐的过程中,氮元素被氧化
10.工业上利用合成氨实现人工固氮。属于合成氨主要原料的是( )
A.二氧化氮
B.空气
C.碳酸钠
D.硝酸钾
11.下列物质既能用作食品防腐剂,又能用作食品干燥剂的是( )
A.烧碱
B.生石灰
C.氮气
D.铁粉
12.下列气体在通常条件下能稳定共存的是(
)
①NH3
②H2
③O2
?④HCl
⑤N2
⑥NO
⑦CO2
A.①③④
B.②④⑤
C.③⑥⑦
D.①③⑥
13.甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系。下列物质组不满足上述转化关系的是(
)
选项
甲
乙
丙
丁
A
N2
NH3
NO
NO2
B
Si
SiO2
Na2SiO3
Na2CO3
C
S
H2S
SO3
H2SO4
D
Al
Al2O3
NaAlO2
Al(OH)3
A.A
B.B
C.C
D.D
14.实验室中制取的下列气体中,可以用排空气法收集的是( )
A.N2
B.SO2
C.CO
D.NO
15.某新型合成
NH3
的原理如图所示。下列说法不正确的是
A.N2
和
O2
在高温和放电条件下都能反应
B.NH3
和
H2O
都属于电解质
C.发生反应的
n(N2)∶n(H2O)=1∶3
D.O2
分别与
N2、NH3
的反应都是氧化还原反应
二、填空题
16.用电子式表示下列化合物的形成过程:
NaF:_____
CaCl2:_____
Na2S:
_____
MgO:
_____
K2O:
_____
17.已知化合物C?为中学常见的化合物。
(1)若D是一种强酸,则C?与水反应的化学方程式为__________________________。
有人认为“浓H2SO4?可以干燥气体C”,某同学为了验证该观点是否正确,用如右上图装置进行实验。分液漏斗中应加入_______________,打开分液漏斗进行实验,过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是__________________。
(2)若D是一种常见的强碱,则C?的电子式为:_______________________。
18.在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢.当它们混合时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出过氧化氢的电子式__________.
(2)写出该反应的化学方程式:______________________________.
(3)16g液态肼与足量液态过氧化氢反应生成氮气和水蒸气时,放出的热量为__________kJ.
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是:________________________________________.
19.A、B、C、D、E、F、G的原子序数依次增大的元素,A、D元素的原子最外层电子数相同,A元素的一种原子没有中子;B的一种同位素可用于考古断代;C是地壳中含量最多的一种元素;D元素的阳离子电子层结构与氖原子相同;E的最外层电子数是电子层数的2倍;F的单质具有强氧化性.G是用途最广泛的金属元素,它的单质能被磁铁所吸引;试回答以下问题:
(1)E的原子结构示意图:____________。
(2)D单质与C单质在加热条件下反应产物的电子式
_______,该物质与A2C反应的离子方程式______。
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性.则甲、乙反应的化学方程式为____________。
(4)E的最高价氧化物对应水合物的浓溶液加入G单质,下列说法正确的是____________。
A.常温下两者不发生反应???????
B.常温下无现象
,G单质不溶解
C.受热能发生反应,开始放出氢气???????
D.受热能发生反应,开始放出是SO2
(5)用电子式写出A2C的形成过程___________________________________________________。
20.下列粒子(分子或离子)均含有18个电子:
粒子
A+
B2-
C
D
E
F
组成特点
单核离子
化合物,双核分子
单质,双核分子
化合物,三核分子
化合物,四核分子
请回答下列问题:
(1)A的元素符号是____________,B2-的结构示意图是________。
(2)C与D混合,发生反应的化学方程式为_____________________________________。
(3)E的电子式是________;F的水溶液常用于消毒剂,F的化学式是________。
三、计算题
21.下表是元素周期表的一部分,针对表中的①~⑧种元素,请按要求填写下列空白:
主族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
①
②
③
④
3
⑤
⑥
⑦
⑧
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_____;
(2)写出元素②的最简单氢化物的结构式________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序________________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式_________;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式_____________;
(6)用电子式表示⑤与⑦组成化合物的形成过程_________________________________。
四、实验题
22.实验室模拟合成氨和氨催化氧化的流程如下:
已知:实验室用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)仪器k的名称是____。
(2)从图中选择制取气体的合适装置:氮气_____、氢气_____。
(3)实验室制取氨的化学方程式是_________。
(4)如图是某学生设计收集氨的几种装置,其中可行的是______。
(5)用甲装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入甲装置的锥形瓶内,能使铂丝保持红热的原因是:_____,锥形瓶中还可观察到的现象是:___。
(6)写出甲装置中氨催化氧化的化学方程式:________。
参考答案
1.A2.B3.A4.A5.B6.A7.C8.A9.B10.B11.D12.B13.C14.B15.B
16.
17.3NO2+H2O=2HNO3+NO
浓HNO3
NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
18.
N2H4
+
2H2O2
═
N2
+
4H2O
320
生成物无污染.
19.
2Na2O2+2H2O=4Na++4OH-+O2↑
NaHCO3+NaOH=Na2CO3+H2O
BD
20.K
F2+2HCl===2HF+Cl2
H2O2
21.
r(S2-)>r(O2-)>r(Na+)>r(Al3+
)
Al2O3+2OH-=2+
H2O
NH3+HNO3=NH4NO3
22.分液漏斗
A
C
2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
d
氨气的氧化反应是放热反应
有红棕色气体生成(或有红棕色气体、白烟生成)
4NH3+5O2
4NO+6H2O
一、单选题
1.N2是空气的重要组成部分,因此有科学家依据蒸汽机的原理,设计制造出液氮蒸汽机,即利用液态氮的蒸发来驱动机车,从而达到环境保护的目的,其原理主要依据是(
)
A.液氮的沸点为﹣195.8℃,远低于常温
B.N2在空气中燃烧放热
C.N2的化学性质很稳定
D.N2在空气中的体积分数为78%
2.常温下能发生反应的一组气体是(
)
A.N2、O2
B.NO、O2
C.H2、O2
D.H2、CO
3.通常状况下,氮气的性质不活泼的原因是(
)
A.氮分子中有三个共价键,键能很大
B.氮元素非金属性很弱
C.氮分子中氮元素化合价为零
D.固态氮属于分子晶体
4.空气中含量较多,且性质稳定的是(
)
A.氮气
B.氧气
C.二氧化碳
D.水蒸气
5.下列实验的试剂、装置选用不合理的是
选项
实验目的
试剂
装置
A
除去Cl2中少量的HCl、H2O
试剂a为饱和氯化钠溶液
甲
B
除去NH3中少量H2O
试剂b为无水氯化钙
乙
C
除去H2中少量CO2、H2O
试剂b为碱石灰
乙
D
除去N2中少量的O2
足量的铜网
丙
A.A
B.B
C.C
D.D
6.农业上有一句俗语“雷雨发庄稼”,该过程发生的下列变化中不正确的是( )
A.N2+2O22NO2
B.3NO2+H2O2HNO3+NO
C.2NO+O22NO2
D.HNO3与土壤中的矿物作用生成硝酸盐
7.乙烯利(C2H6ClO3P)能释放出乙烯从而促进果实成熟,可由环氧乙烷()和PCl3为原料合成。下列说法正确的是(
)
A.乙烯、乙烯利均属于烃
B.乙烯的结构简式为:C2H4
C.环氧乙烷与乙醛互为同分异构体
D.PCl3的电子式为:
8.下列物质间的转化不能一步实现的是(
)
A.N2→NO2
B.HNO3→O2
C.SO2→H2SO4
D.H2SO4→SO2
9.下列关于自然界中氮循环(如图)的说法不正确的是(
)
A.人工固氮可以得到硝酸盐
B.雷电作用可将氮气直接转化为铵盐
C.细菌对氮元素的循环有重要作用
D.亚硝酸盐转化为硝酸盐的过程中,氮元素被氧化
10.工业上利用合成氨实现人工固氮。属于合成氨主要原料的是( )
A.二氧化氮
B.空气
C.碳酸钠
D.硝酸钾
11.下列物质既能用作食品防腐剂,又能用作食品干燥剂的是( )
A.烧碱
B.生石灰
C.氮气
D.铁粉
12.下列气体在通常条件下能稳定共存的是(
)
①NH3
②H2
③O2
?④HCl
⑤N2
⑥NO
⑦CO2
A.①③④
B.②④⑤
C.③⑥⑦
D.①③⑥
13.甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系。下列物质组不满足上述转化关系的是(
)
选项
甲
乙
丙
丁
A
N2
NH3
NO
NO2
B
Si
SiO2
Na2SiO3
Na2CO3
C
S
H2S
SO3
H2SO4
D
Al
Al2O3
NaAlO2
Al(OH)3
A.A
B.B
C.C
D.D
14.实验室中制取的下列气体中,可以用排空气法收集的是( )
A.N2
B.SO2
C.CO
D.NO
15.某新型合成
NH3
的原理如图所示。下列说法不正确的是
A.N2
和
O2
在高温和放电条件下都能反应
B.NH3
和
H2O
都属于电解质
C.发生反应的
n(N2)∶n(H2O)=1∶3
D.O2
分别与
N2、NH3
的反应都是氧化还原反应
二、填空题
16.用电子式表示下列化合物的形成过程:
NaF:_____
CaCl2:_____
Na2S:
_____
MgO:
_____
K2O:
_____
17.已知化合物C?为中学常见的化合物。
(1)若D是一种强酸,则C?与水反应的化学方程式为__________________________。
有人认为“浓H2SO4?可以干燥气体C”,某同学为了验证该观点是否正确,用如右上图装置进行实验。分液漏斗中应加入_______________,打开分液漏斗进行实验,过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是__________________。
(2)若D是一种常见的强碱,则C?的电子式为:_______________________。
18.在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢.当它们混合时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出过氧化氢的电子式__________.
(2)写出该反应的化学方程式:______________________________.
(3)16g液态肼与足量液态过氧化氢反应生成氮气和水蒸气时,放出的热量为__________kJ.
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是:________________________________________.
19.A、B、C、D、E、F、G的原子序数依次增大的元素,A、D元素的原子最外层电子数相同,A元素的一种原子没有中子;B的一种同位素可用于考古断代;C是地壳中含量最多的一种元素;D元素的阳离子电子层结构与氖原子相同;E的最外层电子数是电子层数的2倍;F的单质具有强氧化性.G是用途最广泛的金属元素,它的单质能被磁铁所吸引;试回答以下问题:
(1)E的原子结构示意图:____________。
(2)D单质与C单质在加热条件下反应产物的电子式
_______,该物质与A2C反应的离子方程式______。
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性.则甲、乙反应的化学方程式为____________。
(4)E的最高价氧化物对应水合物的浓溶液加入G单质,下列说法正确的是____________。
A.常温下两者不发生反应???????
B.常温下无现象
,G单质不溶解
C.受热能发生反应,开始放出氢气???????
D.受热能发生反应,开始放出是SO2
(5)用电子式写出A2C的形成过程___________________________________________________。
20.下列粒子(分子或离子)均含有18个电子:
粒子
A+
B2-
C
D
E
F
组成特点
单核离子
化合物,双核分子
单质,双核分子
化合物,三核分子
化合物,四核分子
请回答下列问题:
(1)A的元素符号是____________,B2-的结构示意图是________。
(2)C与D混合,发生反应的化学方程式为_____________________________________。
(3)E的电子式是________;F的水溶液常用于消毒剂,F的化学式是________。
三、计算题
21.下表是元素周期表的一部分,针对表中的①~⑧种元素,请按要求填写下列空白:
主族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
①
②
③
④
3
⑤
⑥
⑦
⑧
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_____;
(2)写出元素②的最简单氢化物的结构式________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序________________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式_________;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式_____________;
(6)用电子式表示⑤与⑦组成化合物的形成过程_________________________________。
四、实验题
22.实验室模拟合成氨和氨催化氧化的流程如下:
已知:实验室用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)仪器k的名称是____。
(2)从图中选择制取气体的合适装置:氮气_____、氢气_____。
(3)实验室制取氨的化学方程式是_________。
(4)如图是某学生设计收集氨的几种装置,其中可行的是______。
(5)用甲装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入甲装置的锥形瓶内,能使铂丝保持红热的原因是:_____,锥形瓶中还可观察到的现象是:___。
(6)写出甲装置中氨催化氧化的化学方程式:________。
参考答案
1.A2.B3.A4.A5.B6.A7.C8.A9.B10.B11.D12.B13.C14.B15.B
16.
17.3NO2+H2O=2HNO3+NO
浓HNO3
NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
18.
N2H4
+
2H2O2
═
N2
+
4H2O
320
生成物无污染.
19.
2Na2O2+2H2O=4Na++4OH-+O2↑
NaHCO3+NaOH=Na2CO3+H2O
BD
20.K
F2+2HCl===2HF+Cl2
H2O2
21.
r(S2-)>r(O2-)>r(Na+)>r(Al3+
)
Al2O3+2OH-=2+
H2O
NH3+HNO3=NH4NO3
22.分液漏斗
A
C
2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
d
氨气的氧化反应是放热反应
有红棕色气体生成(或有红棕色气体、白烟生成)
4NH3+5O2
4NO+6H2O
