高中化学苏教版(2019)必修第一册专题2研究物质的基本方法-第一单元研究物质的实验方法基础训练 含答案
文档属性
| 名称 | 高中化学苏教版(2019)必修第一册专题2研究物质的基本方法-第一单元研究物质的实验方法基础训练 含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 200.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-17 21:34:17 | ||
图片预览



文档简介
高中化学苏教版(2019)必修第一册专题2研究物质的基本方法-第一单元研究物质的实验方法基础训练
一、单选题
1.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是(
)
选项
A
B
C
D
X
FeCl2溶液
FeCl3溶液
Fe
Na2SO4溶液
Y
FeCl3
CuCl2
Al
Na2CO3
Z
Cl2
Fe
NaOH溶液
BaCl2溶液
A.A
B.B
C.C
D.D
2.下列实验操作中,符合操作规范的是(
)
A.洒出的少量酒精在桌面上燃烧起来,立即用湿抹布盖灭
B.蒸发NaCl溶液时,开始析出晶体后用玻璃棒搅拌
C.为了达到节约药品的目的,将实验后剩余的药品放回原瓶
D.配制稀硫酸时,将水沿量筒壁慢慢注入浓硫酸中,并不断搅拌
3.下列关于物质分离提纯的描述不正确的是:
A.物质分离或提纯方法的选择依据是混合物的状态和性质
B.KCl和MnO2混合物分离步骤为:溶于水、过滤、洗涤、干燥、蒸发、结晶
C.从碘水中萃取I2,可选择用苯、四氯化碳作萃取剂
D.CO2中含有少量的HCl:通过装有氢氧化钠溶液的洗气瓶
4.关于一些重要的化学概念,下列叙述错误的个数是(
)
①SO2、NO2、P2O5均为酸性氧化物
②熔融状态下,AlCl3、CH3COONa、NaOH均能导电
③氨溶于水得到的溶液氨水能导电,所以氨水是电解质
④蛋白质溶液中混有少量氯化钠杂质,可用渗析的方法提纯
⑤需要通电才可进行的有:电泳、电离、电解
A.2个
B.3个
C.4个
D.5个
5.下列粒子中,只有氧化性的是(
)
①S2-
②Fe2+
③S
④H+
⑤Na+
⑥Mg
A.①⑥
B.②③
C.④⑤
D.③④
6.下列仪器中,可直接加热的玻璃仪器是(
)
A.试管
B.坩埚
C.烧杯
D.蒸馏烧瓶
7.下列有关实验的说法正确的是(
)
A.除去氧化铁中混有的少量氧化铝,可加入过量的氢氧化钠溶液,完全反应后,过滤
B.配制的溶液可将固体放于天平左盘称其质量
C.制备胶体,通常是将固体溶于热水中
D.可用澄清石灰水和盐酸鉴别溶液和溶液
8.熔融烧碱应选用的仪器是(
)
A.生铁坩埚
B.普通玻璃坩埚
C.石英坩埚
D.陶瓷坩埚
9.称取两份铝粉,第一份加足量的NaOH溶液,第二份加足量的盐酸,若放出等量的气体,则两份铝粉的质量比为(
)
A.1:1
B.2:3
C.1:2
D.1:3
10.用一种试剂可鉴别NH4Cl,K2SO4,(NH4)2SO4,AlCl3、FeCl3五瓶溶液,该试剂是
A.Ba(OH)2
B.KSCN
C.NaOH
D.BaCl2
11.将5.4gAl投入200.0mL
2.0mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余,该溶液可能为(
)
A.HNO3溶液
B.HCl溶液
C.H2SO4溶液
D.Ba(OH)2溶液
12.下列单质中,遇到盐酸或强碱溶液都能放出氢气的是
A.Cu
B.Fe
C.Si
D.Al
13.下列除去杂质的方法正确的是(
)
A.除去CO2中混有的CO:通入O2点燃;
B.除去铜器表面的铜绿[Cu2(OH)2CO3]:用盐酸浸泡,再用清水冲洗
C.除去FeCl3溶液中的FeCl2杂质,加入足量铁粉,再过滤即可;
D.欲除去粗盐中的MgCl2、CaCl2和硫酸盐杂质,可加入的药品顺序:NaOH-Na2CO3-BaCl2-盐酸
14.下列离子的检验方法正确的是
A.某溶液有白色沉淀,说明原溶液中有Cl-
B.某溶液有白色沉淀,说明原溶液中有SO42-
C.某溶液无明显变化溶液变红色,说明原溶液中有Fe2+
D.某溶液生成无色无味气体,说明原溶液中有CO32-
15.为除去铜粉中混有的少量铝粉,下列试剂不可行的是
A.CuCl2溶液
B.稀硝酸
C.NaOH溶液
D.稀盐酸
二、填空题
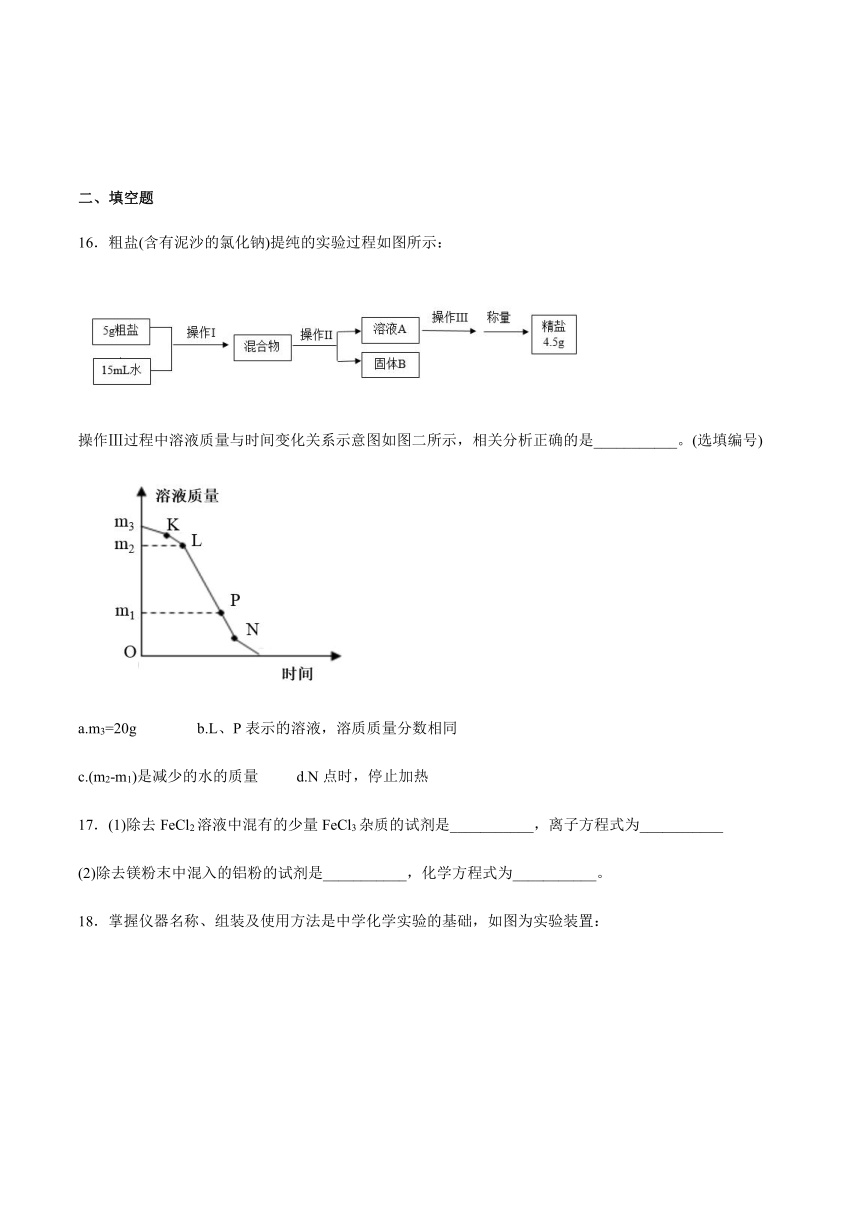
16.粗盐(含有泥沙的氯化钠)提纯的实验过程如图所示:
操作Ⅲ过程中溶液质量与时间变化关系示意图如图二所示,相关分析正确的是___________。(选填编号)
a.m3=20g
b.L、P表示的溶液,溶质质量分数相同
c.(m2-m1)是减少的水的质量
d.N点时,停止加热
17.(1)除去FeCl2溶液中混有的少量FeCl3杂质的试剂是___________,离子方程式为___________
(2)除去镁粉末中混入的铝粉的试剂是___________,化学方程式为___________。
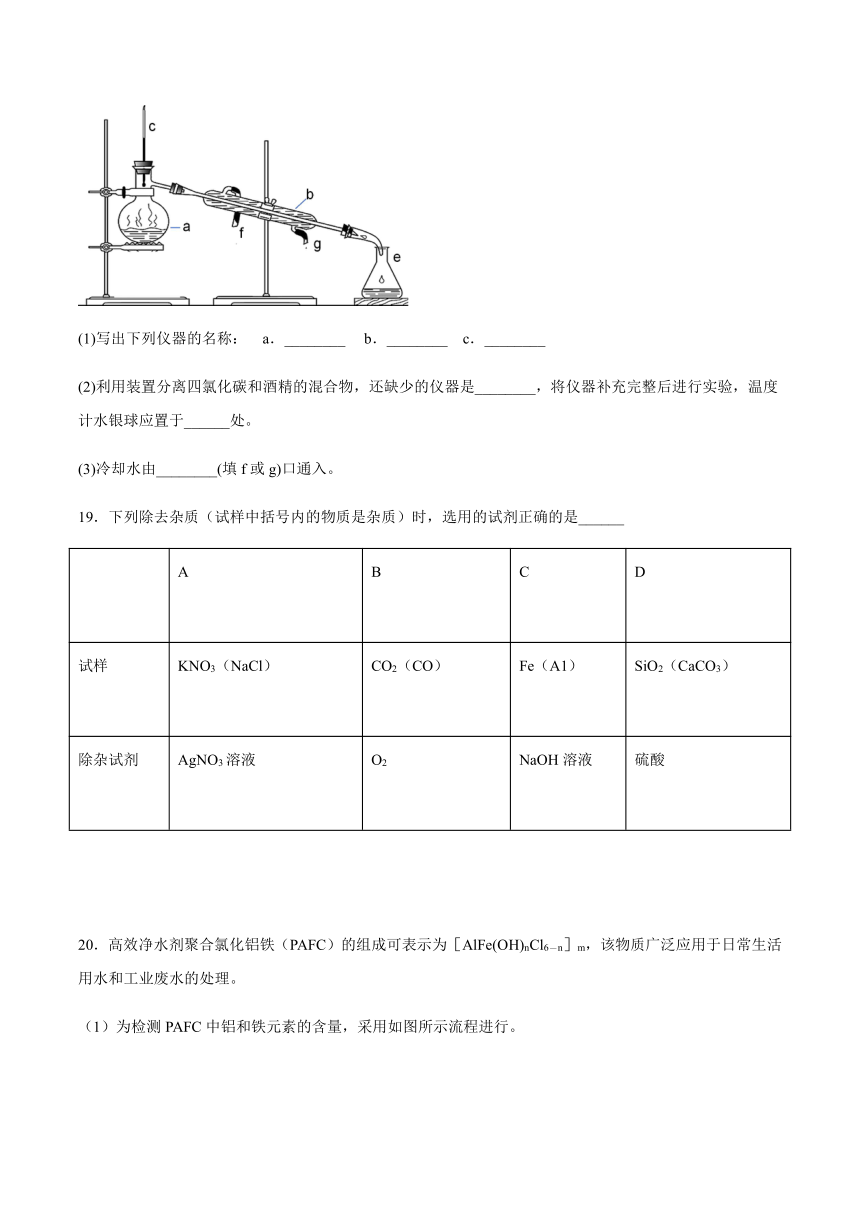
18.掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置:
(1)写出下列仪器的名称:
a.________?????b.________????c.________
(2)利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是________,将仪器补充完整后进行实验,温度计水银球应置于______处。
(3)冷却水由________(填f或g)口通入。
19.下列除去杂质(试样中括号内的物质是杂质)时,选用的试剂正确的是______
A
B
C
D
试样
KNO3(NaCl)
CO2(CO)
Fe(A1)
SiO2(CaCO3)
除杂试剂
AgNO3溶液
O2
NaOH溶液
硫酸
20.高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的处理。
(1)为检测PAFC中铝和铁元素的含量,采用如图所示流程进行。
回答下列问题:
①PAFC中铁元素的化合价为_________。
②步骤I中的试剂A是______________(从“氢氧化钠溶液”、“氨水”中选择)
步骤Ⅲ中的试剂B是_______________。
③步骤Ⅱ的操作是_________,用到的主要玻璃仪器____________________________。
(2)某工厂欲以工业废料(铁、铁和铝的氧化物)为原料制取PAFC,设计如下流程:
①在废料中加入过量稀盐酸,发生多个离子反应,请在空白处补全离子方程式:
FeO+2H+Fe2++H2O
Al2O3+6H+2Al3++3H2O
Fe2O3+6H+2Fe3++3H2O
______________。
②所得酸性溶液中,不能确定是否一定存在的阳离子是____________(填序号)。
A.Al3+B.Fe2+C.Fe3+D.H+
为证明该离子确实存在,可采用的操作(必须指明所采用的试剂及观察到的现象)是:_____________。
③往酸性溶液中加入试剂X的目的是(用离子方程式表示)_________________________。
三、工业流程题
21.从铝土矿(主要成分为Al2O3,还有少量杂质,杂质不参与反应)中提取铝的工艺流程及步骤如下:
试回答下列问题:
(1)试剂X为_______,反应Ⅰ的化学方程式为_______。
(2)操作Ⅰ、操作Ⅱ均为_______(填操作名称),在实验室进行该操作时需要的玻璃仪器有_______。
(3)反应Ⅱ的离子方程式为_______。
(4)电解熔融氧化铝制取金属铝,若有0.6
mol电子发生转移,理论上能得到金属铝的质量是_______
g。
22.某地煤矸石经预处理后含SiO2、Al2O3、Fe2O3,一种综合利用煤矸石制取绿矾(FeSO4·7H2O)的工艺流程如下图所示。
(1)过滤操作需要用到的玻璃仪器除了烧杯、玻璃棒还有_____________。
(2)写出所选试剂X、Y的化学式:X_______________,Y_____________。
(3)滤液B中含的阴离子有_____________(写离子符号)。
(4)滤渣SiO2可制取木材防火剂,该防火剂的化学式为______________。
(5)由溶液D转化为溶液E的离子方程式为:______________。
(6)根据图中数据,计算出原40g煤矸石中Fe2O3的质量分数为_____________。(假设适量均为恰好反应)
23.硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3
、FeCO3
MgO、CaO等,生产工艺流程示意如下:
(1)
将菱锌矿研磨成粉的目的是_____。
(2)
完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3+□Cl-
_____
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的ph时,理论上可选用的最大区间为______。
Mg(OH)2
Zn(OH)2
MgCO3
CaCO3
开始沉淀的pH
10.4
6.4
—
—
沉淀完全的pH
12.4
8.0
—
—
开始溶解的pH
—
10.5
—
—
Ksp
5.6×
—
6.8×
2.8×
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉
b.石灰乳
c.纯碱溶液
d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3
的质量分数不低于________。
参考答案
1.C2.A3.D4.C5.C6.A7.A8.A9.A10.A11.B12.D13.B14.C15.B
16.b
17.Fe粉
2Fe3++Fe=3Fe2+
NaOH溶液
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
18.蒸馏烧瓶
直形冷凝管
温度计
酒精灯
蒸馏烧瓶支管口
g
19.C
20.+3
NaOH溶液
CO2
过滤
烧杯、玻璃棒、漏斗
Fe+2H+=Fe2++H2↑;Fe+2Fe3+=3Fe2+
C
取溶液少量遇试管中,再滴入几滴KSCN溶液,若溶液变血红色,则存在Fe3+
2Fe2+
+Cl2=2Fe3++2Cl-
21.NaOH溶液
Al2O3+2NaOH=
2NaAlO2+
H2O
过滤
烧杯、漏斗、玻璃棒
+CO2+2H2O=Al(OH)3↓+
5.4
22.(1)漏斗;NaOH或KOH;H2SO4;
(3)AlO2-、Cl-、OH-;(4)Na2SiO3;
(5)Fe+2Fe3+=3Fe2+;(6)60%。
23.增大反应物接触面积或增大反应速率或使反应更充分
2Fe(OH)2+
1
ClO-+
1H2O
=2Fe(OH)3+
1Cl-
FeO(OH)
8.0pH10.4
bd
蒸发浓缩
冷却结晶
一、单选题
1.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是(
)
选项
A
B
C
D
X
FeCl2溶液
FeCl3溶液
Fe
Na2SO4溶液
Y
FeCl3
CuCl2
Al
Na2CO3
Z
Cl2
Fe
NaOH溶液
BaCl2溶液
A.A
B.B
C.C
D.D
2.下列实验操作中,符合操作规范的是(
)
A.洒出的少量酒精在桌面上燃烧起来,立即用湿抹布盖灭
B.蒸发NaCl溶液时,开始析出晶体后用玻璃棒搅拌
C.为了达到节约药品的目的,将实验后剩余的药品放回原瓶
D.配制稀硫酸时,将水沿量筒壁慢慢注入浓硫酸中,并不断搅拌
3.下列关于物质分离提纯的描述不正确的是:
A.物质分离或提纯方法的选择依据是混合物的状态和性质
B.KCl和MnO2混合物分离步骤为:溶于水、过滤、洗涤、干燥、蒸发、结晶
C.从碘水中萃取I2,可选择用苯、四氯化碳作萃取剂
D.CO2中含有少量的HCl:通过装有氢氧化钠溶液的洗气瓶
4.关于一些重要的化学概念,下列叙述错误的个数是(
)
①SO2、NO2、P2O5均为酸性氧化物
②熔融状态下,AlCl3、CH3COONa、NaOH均能导电
③氨溶于水得到的溶液氨水能导电,所以氨水是电解质
④蛋白质溶液中混有少量氯化钠杂质,可用渗析的方法提纯
⑤需要通电才可进行的有:电泳、电离、电解
A.2个
B.3个
C.4个
D.5个
5.下列粒子中,只有氧化性的是(
)
①S2-
②Fe2+
③S
④H+
⑤Na+
⑥Mg
A.①⑥
B.②③
C.④⑤
D.③④
6.下列仪器中,可直接加热的玻璃仪器是(
)
A.试管
B.坩埚
C.烧杯
D.蒸馏烧瓶
7.下列有关实验的说法正确的是(
)
A.除去氧化铁中混有的少量氧化铝,可加入过量的氢氧化钠溶液,完全反应后,过滤
B.配制的溶液可将固体放于天平左盘称其质量
C.制备胶体,通常是将固体溶于热水中
D.可用澄清石灰水和盐酸鉴别溶液和溶液
8.熔融烧碱应选用的仪器是(
)
A.生铁坩埚
B.普通玻璃坩埚
C.石英坩埚
D.陶瓷坩埚
9.称取两份铝粉,第一份加足量的NaOH溶液,第二份加足量的盐酸,若放出等量的气体,则两份铝粉的质量比为(
)
A.1:1
B.2:3
C.1:2
D.1:3
10.用一种试剂可鉴别NH4Cl,K2SO4,(NH4)2SO4,AlCl3、FeCl3五瓶溶液,该试剂是
A.Ba(OH)2
B.KSCN
C.NaOH
D.BaCl2
11.将5.4gAl投入200.0mL
2.0mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余,该溶液可能为(
)
A.HNO3溶液
B.HCl溶液
C.H2SO4溶液
D.Ba(OH)2溶液
12.下列单质中,遇到盐酸或强碱溶液都能放出氢气的是
A.Cu
B.Fe
C.Si
D.Al
13.下列除去杂质的方法正确的是(
)
A.除去CO2中混有的CO:通入O2点燃;
B.除去铜器表面的铜绿[Cu2(OH)2CO3]:用盐酸浸泡,再用清水冲洗
C.除去FeCl3溶液中的FeCl2杂质,加入足量铁粉,再过滤即可;
D.欲除去粗盐中的MgCl2、CaCl2和硫酸盐杂质,可加入的药品顺序:NaOH-Na2CO3-BaCl2-盐酸
14.下列离子的检验方法正确的是
A.某溶液有白色沉淀,说明原溶液中有Cl-
B.某溶液有白色沉淀,说明原溶液中有SO42-
C.某溶液无明显变化溶液变红色,说明原溶液中有Fe2+
D.某溶液生成无色无味气体,说明原溶液中有CO32-
15.为除去铜粉中混有的少量铝粉,下列试剂不可行的是
A.CuCl2溶液
B.稀硝酸
C.NaOH溶液
D.稀盐酸
二、填空题
16.粗盐(含有泥沙的氯化钠)提纯的实验过程如图所示:
操作Ⅲ过程中溶液质量与时间变化关系示意图如图二所示,相关分析正确的是___________。(选填编号)
a.m3=20g
b.L、P表示的溶液,溶质质量分数相同
c.(m2-m1)是减少的水的质量
d.N点时,停止加热
17.(1)除去FeCl2溶液中混有的少量FeCl3杂质的试剂是___________,离子方程式为___________
(2)除去镁粉末中混入的铝粉的试剂是___________,化学方程式为___________。
18.掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置:
(1)写出下列仪器的名称:
a.________?????b.________????c.________
(2)利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是________,将仪器补充完整后进行实验,温度计水银球应置于______处。
(3)冷却水由________(填f或g)口通入。
19.下列除去杂质(试样中括号内的物质是杂质)时,选用的试剂正确的是______
A
B
C
D
试样
KNO3(NaCl)
CO2(CO)
Fe(A1)
SiO2(CaCO3)
除杂试剂
AgNO3溶液
O2
NaOH溶液
硫酸
20.高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的处理。
(1)为检测PAFC中铝和铁元素的含量,采用如图所示流程进行。
回答下列问题:
①PAFC中铁元素的化合价为_________。
②步骤I中的试剂A是______________(从“氢氧化钠溶液”、“氨水”中选择)
步骤Ⅲ中的试剂B是_______________。
③步骤Ⅱ的操作是_________,用到的主要玻璃仪器____________________________。
(2)某工厂欲以工业废料(铁、铁和铝的氧化物)为原料制取PAFC,设计如下流程:
①在废料中加入过量稀盐酸,发生多个离子反应,请在空白处补全离子方程式:
FeO+2H+Fe2++H2O
Al2O3+6H+2Al3++3H2O
Fe2O3+6H+2Fe3++3H2O
______________。
②所得酸性溶液中,不能确定是否一定存在的阳离子是____________(填序号)。
A.Al3+B.Fe2+C.Fe3+D.H+
为证明该离子确实存在,可采用的操作(必须指明所采用的试剂及观察到的现象)是:_____________。
③往酸性溶液中加入试剂X的目的是(用离子方程式表示)_________________________。
三、工业流程题
21.从铝土矿(主要成分为Al2O3,还有少量杂质,杂质不参与反应)中提取铝的工艺流程及步骤如下:
试回答下列问题:
(1)试剂X为_______,反应Ⅰ的化学方程式为_______。
(2)操作Ⅰ、操作Ⅱ均为_______(填操作名称),在实验室进行该操作时需要的玻璃仪器有_______。
(3)反应Ⅱ的离子方程式为_______。
(4)电解熔融氧化铝制取金属铝,若有0.6
mol电子发生转移,理论上能得到金属铝的质量是_______
g。
22.某地煤矸石经预处理后含SiO2、Al2O3、Fe2O3,一种综合利用煤矸石制取绿矾(FeSO4·7H2O)的工艺流程如下图所示。
(1)过滤操作需要用到的玻璃仪器除了烧杯、玻璃棒还有_____________。
(2)写出所选试剂X、Y的化学式:X_______________,Y_____________。
(3)滤液B中含的阴离子有_____________(写离子符号)。
(4)滤渣SiO2可制取木材防火剂,该防火剂的化学式为______________。
(5)由溶液D转化为溶液E的离子方程式为:______________。
(6)根据图中数据,计算出原40g煤矸石中Fe2O3的质量分数为_____________。(假设适量均为恰好反应)
23.硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3
、FeCO3
MgO、CaO等,生产工艺流程示意如下:
(1)
将菱锌矿研磨成粉的目的是_____。
(2)
完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3+□Cl-
_____
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的ph时,理论上可选用的最大区间为______。
Mg(OH)2
Zn(OH)2
MgCO3
CaCO3
开始沉淀的pH
10.4
6.4
—
—
沉淀完全的pH
12.4
8.0
—
—
开始溶解的pH
—
10.5
—
—
Ksp
5.6×
—
6.8×
2.8×
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉
b.石灰乳
c.纯碱溶液
d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3
的质量分数不低于________。
参考答案
1.C2.A3.D4.C5.C6.A7.A8.A9.A10.A11.B12.D13.B14.C15.B
16.b
17.Fe粉
2Fe3++Fe=3Fe2+
NaOH溶液
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
18.蒸馏烧瓶
直形冷凝管
温度计
酒精灯
蒸馏烧瓶支管口
g
19.C
20.+3
NaOH溶液
CO2
过滤
烧杯、玻璃棒、漏斗
Fe+2H+=Fe2++H2↑;Fe+2Fe3+=3Fe2+
C
取溶液少量遇试管中,再滴入几滴KSCN溶液,若溶液变血红色,则存在Fe3+
2Fe2+
+Cl2=2Fe3++2Cl-
21.NaOH溶液
Al2O3+2NaOH=
2NaAlO2+
H2O
过滤
烧杯、漏斗、玻璃棒
+CO2+2H2O=Al(OH)3↓+
5.4
22.(1)漏斗;NaOH或KOH;H2SO4;
(3)AlO2-、Cl-、OH-;(4)Na2SiO3;
(5)Fe+2Fe3+=3Fe2+;(6)60%。
23.增大反应物接触面积或增大反应速率或使反应更充分
2Fe(OH)2+
1
ClO-+
1H2O
=2Fe(OH)3+
1Cl-
FeO(OH)
8.0pH10.4
bd
蒸发浓缩
冷却结晶
