高中化学苏教版(2019)必修第一册专题3从海水中获得的化学物质-第一单元氯气及氯的化合物基础训练 含答案
文档属性
| 名称 | 高中化学苏教版(2019)必修第一册专题3从海水中获得的化学物质-第一单元氯气及氯的化合物基础训练 含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 298.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-17 21:35:54 | ||
图片预览




文档简介
高中化学苏教版(2019)必修第一册专题3从海水中获得的化学物质-第一单元氯气及氯的化合物基础训练
一、单选题
1.反应属于氧化还原反应的是(
)
A.NaOH
+
HCl
=
NaCl+
H2O
B.3CO+
Fe2O3
=3CO2+2Fe
C.CaCO3+
2HCl=
CaCl2+
H2O+CO2↑
D.CO2+
2NaOH
=
Na2CO3+
H2O
2.我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe+CuSO4=Cu+FeSO4。有关该反应的说法正确的是(
)
A.Fe是氧化剂
B.Fe被氧化
C.CuSO4是还原剂
D.FeSO4是还原产物
3.下列关于氯气或氯元素的叙述中,正确的是(
)
A.Cl2以液态形式存在时可称作氯水或液氯
B.红热的铜丝在氯气中燃烧,生成棕黄色固体CuCl2
C.有氯气参加的化学反应必须在溶液中进行
D.氯元素有毒,应禁入口中
4.某元素在化学反应中,由化合态变为游离态,则该元素(
)
A.化合价降低为零
B.一定被还原
C.可能被氧化,也可能被还原
D.一定被氧化
5.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定NaClO与NaClO3的的物质的量之比为1:7,则Cl2与NaOH溶液反应时被氧化的氯原子与被还原的氯原子的物质的量之比为(
)
A.9:1
B.1:9
C.2:9
D.9:2
6.化合反应、分解反应、置换反应和复分解反应是四种基本化学反应类型。下列变化属于氧化还原反应,但是不属于四种基本反应类型的是
A.CO+CuOCu+CO2
B.2Al+Fe2O3Al2O3+2Fe
C.Cl2+2FeCl2=2FeCl3
D.Na2O2+2H2O=2NaOH+H2O2
7.下列物质不能通过相应的单质直接化合制取的是(
)
A.HCl
B.FeCl2
C.CuCl2
D.Na2O2
8.下列反应中,电子转移方向和数目正确的是(
)
A.
B.
C.
D.
9.漂白粉的有效成分是(
)
A.Ca(OH)2
B.CaCl2
C.CaCO3
D.Ca(ClO)2
10.通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是(
)
A.HCl
B.Cl2
C.NH3
D.NO
11.氯气能使紫色石蕊溶液
A.先变红后褪色
B.变成红色
C.先褪色后变红
D.褪色
12.下列化学反应中,水既不是氧化剂又不是还原剂的是( )
A.2Na2O2+2H2O===4NaOH+O2↑
B.2F2+2H2O===4HF+O2
C.2Na+2H2O===2NaOH+H2↑
D.NaH+H2O===NaOH+H2↑
13.ClO2是一种杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是(
)
A.KClO3在反应中失去电子
B.ClO2是氧化产物
C.1mol
KClO3参加反应有2mol电子转移
D.H2C2O4在反应中被氧化
14.实验室用Na2SO3还原MnO4-,如果还原含有2.4×10-3mol
MnO4-的溶液时,消耗30
mL0.2
mol?L-1的Na2SO3溶液,则Mn元素在还原产物中化合价为(
)
A.+1
B.+2
C.+4
D.+5
15.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用相同的是
A.2Na+2H2O=2NaOH+H2↑
B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.2F2+2H2O=4HF+O2
D.2H2O2H2↑+O2↑
二、填空题
16.Cl2是一种重要的化工原料,如图是一些含氯产品。
(1)①中钢瓶上应贴的标签为___(填字母,下同)。
A.腐蚀品
B.爆炸品
C.有毒品
D.易燃品
(2)下列有关漂白粉和84消毒液的说法正确的是___。
A.漂白粉是纯净物,84消毒液是混合物
B.84消毒液的有效成分是NaClO
制84消毒液反应方程式为___。
(3)工业上利用Cl2制取盐酸,其化学方程式为___。Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是___。
A.硝酸银溶液
B.酚酞溶液
C.碳酸钠溶液
D.紫色石蕊溶液
17.从元素化合价和物质类别两个角度学习、研究物质是一种行之有效的方法。以下是氯元素形成物质的二维图的部分信息
(1)根据图中信息,写出任意两种氯的氧化物的化学式:______、______。
(2)写出高氯酸(HClO4)与NaOH反应的化学方程式:______。
(3)HCl既具有氧化性,又具有还原性。
①请任意写出一个体现HCl氧化性的离子方程式:______。
②浓HCl可作为还原剂在加热条件下与MnO2发生反应制备Cl2,写出该反应的化学方程式:______。
(4)Cl2既具有氧化性,又具有还原性,请结合上图说明原因:______。
18.I.在2020年全国抗击新冠肺炎的战役中使用了大量的84消毒液,它是一种以次氯酸钠(NaClO)为有效成分的高效消毒剂,其水溶液具有强氧化性,可以使病毒的核酸物质被氧化从而杀灭病毒。使用时需注意:勿与洁厕灵(主要成分为浓盐酸)混用:宜储存在避光、阴凉处······
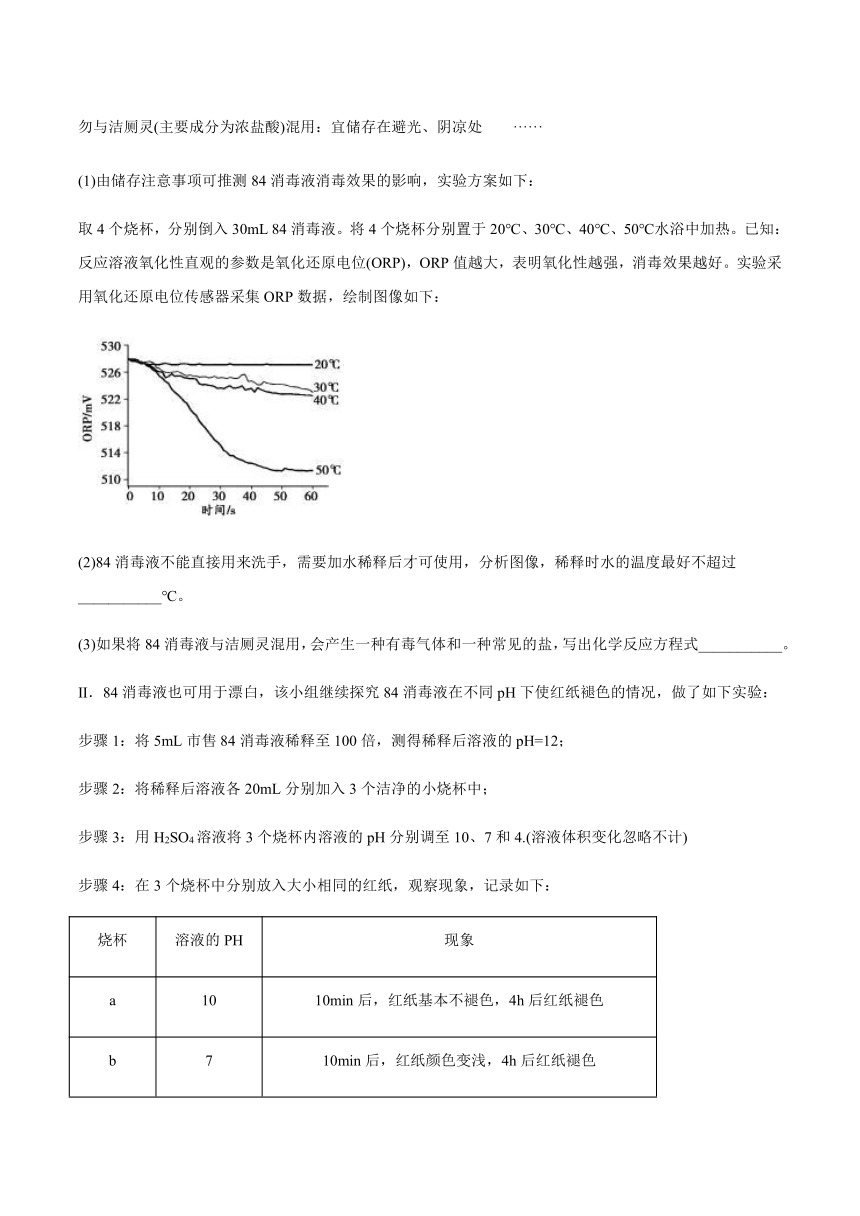
(1)由储存注意事项可推测84消毒液消毒效果的影响,实验方案如下:
取4个烧杯,分别倒入30mL
84消毒液。将4个烧杯分别置于20℃、30℃、40℃、50℃水浴中加热。已知:反应溶液氧化性直观的参数是氧化还原电位(ORP),ORP值越大,表明氧化性越强,消毒效果越好。实验采用氧化还原电位传感器采集ORP数据,绘制图像如下:
(2)84消毒液不能直接用来洗手,需要加水稀释后才可使用,分析图像,稀释时水的温度最好不超过___________℃。
(3)如果将84消毒液与洁厕灵混用,会产生一种有毒气体和一种常见的盐,写出化学反应方程式___________。
Ⅱ.84消毒液也可用于漂白,该小组继续探究84消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售84消毒液稀释至100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯
溶液的PH
现象
a
10
10min后,红纸基本不褪色,4h后红纸褪色
b
7
10min后,红纸颜色变浅,4h后红纸褪色
c
4
10min后,红纸颜色变得更浅,4h后红纸褪色
已知:溶液中Cl-、HClO和ClO-物质的量分数(a)随溶液pH变化的关系如下图所示:
(4)①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色越___________(用快或慢作答)。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是___________。
③图像表明,当调至pH=4时,84消毒液中的有效成分几乎变成HClO,由上述实验可知,其他条件相同时,氧化性HClO___________NaClO((“>”或“<”),消毒液之所以为次氯酸盐而不是次氯酸是由于次氯酸不稳定,写出HClO见光分解的化学反应方程式___________,每有10.5gHClO分解,转移电子的物质的量为___________。
19.厨房中有下列用品:①食盐②小苏打③纯碱④食醋(主要成分为醋酸)。
(1)主要成分属于酸的是___(填序号);
(2)水溶液呈碱性的是___(填序号);
(3)食盐在水中的电离方程式是___。
(4)纯碱中含有少量NaCl。检验此混合物中的Cl-、CO的实验操作步骤如下,将少量混合物加水溶解后,分别置于两支试管中。向第一支试管中加入稀盐酸,可观察到产生无色气泡,说明溶液中存在___离子,该反应的离子方程式为___。向第二支试管中先加入足量稀硝酸,再加入___溶液,可观察到白色沉淀,说明溶液中存在Cl-,该反应的离子方程式为___。
20.大气臭氧层可以保护地球生物免受紫外线的伤害,但低空臭氧的浓度过高时对人体有害。
(1)在紫外线作用下,氧气可转化臭氧:3O2=2O3
①该反应所属类型为_______(填“氧化还原”或“非氧化还原”)反应。
②若在上述反应中有60%的氧气转化为臭氧,所得混合气体的平均摩尔质量为_______。
③某区域收集到O2和O3混合气体0.96g,标准状况下体积为0.56L,其中O2与O3的体积之比为_______。
(2)实验室中常用碘量法检测臭氧,其中以淀粉为指示剂,将臭氧通入碘化钾溶液中进行反应。现需450mL0.2mol/L的KI溶液,用KI固体配制该溶液时,提供的仪器有:托盘天平、药匙、玻璃棒、烧杯、量筒、细口试剂瓶。
①还缺少的仪器有_______,所需KI固体的质量为_______。
②在配制过程中,下列操作会导致所配制溶液的浓度偏小的是_______。
A.未洗涤烧杯和玻璃棒
B.使用前,容量瓶中有少量蒸馏水
C.定容时俯视凹液面
D.定容摇匀后静置,液面低于刻度线,继续加水至刻度线
三、工业流程题
21.化工产品中,含氯物质众多,其用途广泛。回答下列问题:
(1)如图为氯及其化合物的“价一类”二维图。缺失的类别A为______、物质B为______(填化学式)。
(2)电石渣[主要成分为]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取的工艺流程如图所示:
已知易溶于水。
①工业生产电石的反应为,该反应中还原剂为______。
②流程中“制”的化学方程式为______;“转化”发生反应的离子方程式为______。
③上述流程中所用是用与浓盐酸反应制得。该反应的离子方程式是______,其中盐酸体现的性质为______性和______性。下列发生装置可用于上述方法制备的是______(填字母)。
22.氯酸钾在火柴、火药、医药、农业等领域有者广泛应用。有电解法和化学法两种制备工艺流程:
Ⅰ、电解法:
(1)饱和食盐水中往往含有Ca2+、Mg2+、SO等,“精制”时依次加入相应沉淀试剂去除。如果省略该步骤,则Mg2+会引起电解过程中的不利因素为___________(答出一条即可)。
(2)用惰性电极高电压“电解”时,总反应的离子方程式为________________。
(3)“反应”中所发生的反应类型是____________。
II、化学法
(4)“氯化”过程需要温度大于70
℃通过______________(填化学方程式)反应放热供能,可节省能源成本。“氯化”时,石灰乳于氯化塔中合成,自塔底通入氯气,这样做的目的是_____________。
(5)“除氯”步骤是去除多余的Cl2,此反应的化学反应方程式为_______。
(6)两种方法相比,__________法中的氯原子经济性更高。
23.多晶硅是广泛用于制造半导体收音机、录音机、电冰箱、彩电、录像机、电子计算机等的基础材料。以下是由石英砂制备多晶硅的简易过程。
回答下列问题:
(1)反应①中氧化剂与还原剂的物质的量之比为_______。反应②中生成SiHCl3的化学方程式为___________。分离混合物采用的方法为蒸馏,其原理是利用了物质的______不同。
(2)反应③氢化过程中所需的高纯度H2可通过电解精制的饱和食盐水制得,电解过程中同时生成一种黄绿色的气体和一种易溶、易电离的碱,电解反应的离子方程式是________。粗盐水精制过程中,为有效除去Ca2+、Mg2+、SO42-?等杂质,要按__________顺序(填标号)加入下列溶液:a.NaOH
b.Na2CO3
c.BaCl2,过滤后再向滤液中加________调节pH。
(3)反应④中H2还原SiHCl3过程中若混入O2,除可能引起爆炸外,还可能引起_____。由粗硅制备多晶硅的过程中,循环使用的物质除SiCl4、SiHCl3和Si外,还有__________(填分子式)。
参考答案
1.B2.B3.B4.C5.C6.A7.B8.D9.D10.D11.A12.A13.D14.B15.B
16.C
B
Cl2+2NaOH=NaCl+NaClO+H2O
H2+Cl22HCl
D
17.Cl2O
Cl2O3
(或ClO2、Cl2O5、Cl2O7等)
HClO4+NaOH=NaClO4+H2O
Zn+2H+=Zn2++H2↑(其它合理答案也可以)
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
Cl2中Cl元素化合价为0价,氯元素还有-1价以及+1、+3等价态,因此氯元素化合价可以升高,氯气体现还原性;氯元素化合价也可以降低,氯气体现氧化性
18.40
NaClO+2HCl=NaCl+Cl2↑+H2O
慢
b、c两烧杯中,b烧杯中溶液的pH大于c烧杯中溶液的pH,HClO的浓度较小,褪色较慢(其他合理答案也可以)
>
2HClO=2HCl+O2↑
0.4
mol
19.④
②③
NaCl=Na++Cl-
CO
CO+2H+=CO2↑+H2O
AgNO3
Ag++Cl-=AgCl↓
20.非氧化还原
40g/mol
3:2
500mL容量瓶、胶头滴管
16.6g
AD
21.酸
C
酸
还原
A
22.Mg2+会与阴极产生的OH-生成Mg(OH)2沉淀,增大电阻,增加能耗(或阻碍电解)
Cl-
+3H2OClO3-+3H2↑
复分解反应
CaO
+
H2O=Ca(OH)2
逆流时,混合、吸收、反应Cl2更加完全
Na2S+Cl2=2NaCl+S↓
电解
23.1:2
Si+3HClSiHCl3+H2
沸点
2Cl-+2H2OCl2↑+H2↑+2OH-
acb或cab或cba
盐酸
Si与O2反应导致产物不纯
HCl、H2
一、单选题
1.反应属于氧化还原反应的是(
)
A.NaOH
+
HCl
=
NaCl+
H2O
B.3CO+
Fe2O3
=3CO2+2Fe
C.CaCO3+
2HCl=
CaCl2+
H2O+CO2↑
D.CO2+
2NaOH
=
Na2CO3+
H2O
2.我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe+CuSO4=Cu+FeSO4。有关该反应的说法正确的是(
)
A.Fe是氧化剂
B.Fe被氧化
C.CuSO4是还原剂
D.FeSO4是还原产物
3.下列关于氯气或氯元素的叙述中,正确的是(
)
A.Cl2以液态形式存在时可称作氯水或液氯
B.红热的铜丝在氯气中燃烧,生成棕黄色固体CuCl2
C.有氯气参加的化学反应必须在溶液中进行
D.氯元素有毒,应禁入口中
4.某元素在化学反应中,由化合态变为游离态,则该元素(
)
A.化合价降低为零
B.一定被还原
C.可能被氧化,也可能被还原
D.一定被氧化
5.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定NaClO与NaClO3的的物质的量之比为1:7,则Cl2与NaOH溶液反应时被氧化的氯原子与被还原的氯原子的物质的量之比为(
)
A.9:1
B.1:9
C.2:9
D.9:2
6.化合反应、分解反应、置换反应和复分解反应是四种基本化学反应类型。下列变化属于氧化还原反应,但是不属于四种基本反应类型的是
A.CO+CuOCu+CO2
B.2Al+Fe2O3Al2O3+2Fe
C.Cl2+2FeCl2=2FeCl3
D.Na2O2+2H2O=2NaOH+H2O2
7.下列物质不能通过相应的单质直接化合制取的是(
)
A.HCl
B.FeCl2
C.CuCl2
D.Na2O2
8.下列反应中,电子转移方向和数目正确的是(
)
A.
B.
C.
D.
9.漂白粉的有效成分是(
)
A.Ca(OH)2
B.CaCl2
C.CaCO3
D.Ca(ClO)2
10.通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是(
)
A.HCl
B.Cl2
C.NH3
D.NO
11.氯气能使紫色石蕊溶液
A.先变红后褪色
B.变成红色
C.先褪色后变红
D.褪色
12.下列化学反应中,水既不是氧化剂又不是还原剂的是( )
A.2Na2O2+2H2O===4NaOH+O2↑
B.2F2+2H2O===4HF+O2
C.2Na+2H2O===2NaOH+H2↑
D.NaH+H2O===NaOH+H2↑
13.ClO2是一种杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是(
)
A.KClO3在反应中失去电子
B.ClO2是氧化产物
C.1mol
KClO3参加反应有2mol电子转移
D.H2C2O4在反应中被氧化
14.实验室用Na2SO3还原MnO4-,如果还原含有2.4×10-3mol
MnO4-的溶液时,消耗30
mL0.2
mol?L-1的Na2SO3溶液,则Mn元素在还原产物中化合价为(
)
A.+1
B.+2
C.+4
D.+5
15.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用相同的是
A.2Na+2H2O=2NaOH+H2↑
B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.2F2+2H2O=4HF+O2
D.2H2O2H2↑+O2↑
二、填空题
16.Cl2是一种重要的化工原料,如图是一些含氯产品。
(1)①中钢瓶上应贴的标签为___(填字母,下同)。
A.腐蚀品
B.爆炸品
C.有毒品
D.易燃品
(2)下列有关漂白粉和84消毒液的说法正确的是___。
A.漂白粉是纯净物,84消毒液是混合物
B.84消毒液的有效成分是NaClO
制84消毒液反应方程式为___。
(3)工业上利用Cl2制取盐酸,其化学方程式为___。Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是___。
A.硝酸银溶液
B.酚酞溶液
C.碳酸钠溶液
D.紫色石蕊溶液
17.从元素化合价和物质类别两个角度学习、研究物质是一种行之有效的方法。以下是氯元素形成物质的二维图的部分信息
(1)根据图中信息,写出任意两种氯的氧化物的化学式:______、______。
(2)写出高氯酸(HClO4)与NaOH反应的化学方程式:______。
(3)HCl既具有氧化性,又具有还原性。
①请任意写出一个体现HCl氧化性的离子方程式:______。
②浓HCl可作为还原剂在加热条件下与MnO2发生反应制备Cl2,写出该反应的化学方程式:______。
(4)Cl2既具有氧化性,又具有还原性,请结合上图说明原因:______。
18.I.在2020年全国抗击新冠肺炎的战役中使用了大量的84消毒液,它是一种以次氯酸钠(NaClO)为有效成分的高效消毒剂,其水溶液具有强氧化性,可以使病毒的核酸物质被氧化从而杀灭病毒。使用时需注意:勿与洁厕灵(主要成分为浓盐酸)混用:宜储存在避光、阴凉处······
(1)由储存注意事项可推测84消毒液消毒效果的影响,实验方案如下:
取4个烧杯,分别倒入30mL
84消毒液。将4个烧杯分别置于20℃、30℃、40℃、50℃水浴中加热。已知:反应溶液氧化性直观的参数是氧化还原电位(ORP),ORP值越大,表明氧化性越强,消毒效果越好。实验采用氧化还原电位传感器采集ORP数据,绘制图像如下:
(2)84消毒液不能直接用来洗手,需要加水稀释后才可使用,分析图像,稀释时水的温度最好不超过___________℃。
(3)如果将84消毒液与洁厕灵混用,会产生一种有毒气体和一种常见的盐,写出化学反应方程式___________。
Ⅱ.84消毒液也可用于漂白,该小组继续探究84消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售84消毒液稀释至100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯
溶液的PH
现象
a
10
10min后,红纸基本不褪色,4h后红纸褪色
b
7
10min后,红纸颜色变浅,4h后红纸褪色
c
4
10min后,红纸颜色变得更浅,4h后红纸褪色
已知:溶液中Cl-、HClO和ClO-物质的量分数(a)随溶液pH变化的关系如下图所示:
(4)①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色越___________(用快或慢作答)。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是___________。
③图像表明,当调至pH=4时,84消毒液中的有效成分几乎变成HClO,由上述实验可知,其他条件相同时,氧化性HClO___________NaClO((“>”或“<”),消毒液之所以为次氯酸盐而不是次氯酸是由于次氯酸不稳定,写出HClO见光分解的化学反应方程式___________,每有10.5gHClO分解,转移电子的物质的量为___________。
19.厨房中有下列用品:①食盐②小苏打③纯碱④食醋(主要成分为醋酸)。
(1)主要成分属于酸的是___(填序号);
(2)水溶液呈碱性的是___(填序号);
(3)食盐在水中的电离方程式是___。
(4)纯碱中含有少量NaCl。检验此混合物中的Cl-、CO的实验操作步骤如下,将少量混合物加水溶解后,分别置于两支试管中。向第一支试管中加入稀盐酸,可观察到产生无色气泡,说明溶液中存在___离子,该反应的离子方程式为___。向第二支试管中先加入足量稀硝酸,再加入___溶液,可观察到白色沉淀,说明溶液中存在Cl-,该反应的离子方程式为___。
20.大气臭氧层可以保护地球生物免受紫外线的伤害,但低空臭氧的浓度过高时对人体有害。
(1)在紫外线作用下,氧气可转化臭氧:3O2=2O3
①该反应所属类型为_______(填“氧化还原”或“非氧化还原”)反应。
②若在上述反应中有60%的氧气转化为臭氧,所得混合气体的平均摩尔质量为_______。
③某区域收集到O2和O3混合气体0.96g,标准状况下体积为0.56L,其中O2与O3的体积之比为_______。
(2)实验室中常用碘量法检测臭氧,其中以淀粉为指示剂,将臭氧通入碘化钾溶液中进行反应。现需450mL0.2mol/L的KI溶液,用KI固体配制该溶液时,提供的仪器有:托盘天平、药匙、玻璃棒、烧杯、量筒、细口试剂瓶。
①还缺少的仪器有_______,所需KI固体的质量为_______。
②在配制过程中,下列操作会导致所配制溶液的浓度偏小的是_______。
A.未洗涤烧杯和玻璃棒
B.使用前,容量瓶中有少量蒸馏水
C.定容时俯视凹液面
D.定容摇匀后静置,液面低于刻度线,继续加水至刻度线
三、工业流程题
21.化工产品中,含氯物质众多,其用途广泛。回答下列问题:
(1)如图为氯及其化合物的“价一类”二维图。缺失的类别A为______、物质B为______(填化学式)。
(2)电石渣[主要成分为]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取的工艺流程如图所示:
已知易溶于水。
①工业生产电石的反应为,该反应中还原剂为______。
②流程中“制”的化学方程式为______;“转化”发生反应的离子方程式为______。
③上述流程中所用是用与浓盐酸反应制得。该反应的离子方程式是______,其中盐酸体现的性质为______性和______性。下列发生装置可用于上述方法制备的是______(填字母)。
22.氯酸钾在火柴、火药、医药、农业等领域有者广泛应用。有电解法和化学法两种制备工艺流程:
Ⅰ、电解法:
(1)饱和食盐水中往往含有Ca2+、Mg2+、SO等,“精制”时依次加入相应沉淀试剂去除。如果省略该步骤,则Mg2+会引起电解过程中的不利因素为___________(答出一条即可)。
(2)用惰性电极高电压“电解”时,总反应的离子方程式为________________。
(3)“反应”中所发生的反应类型是____________。
II、化学法
(4)“氯化”过程需要温度大于70
℃通过______________(填化学方程式)反应放热供能,可节省能源成本。“氯化”时,石灰乳于氯化塔中合成,自塔底通入氯气,这样做的目的是_____________。
(5)“除氯”步骤是去除多余的Cl2,此反应的化学反应方程式为_______。
(6)两种方法相比,__________法中的氯原子经济性更高。
23.多晶硅是广泛用于制造半导体收音机、录音机、电冰箱、彩电、录像机、电子计算机等的基础材料。以下是由石英砂制备多晶硅的简易过程。
回答下列问题:
(1)反应①中氧化剂与还原剂的物质的量之比为_______。反应②中生成SiHCl3的化学方程式为___________。分离混合物采用的方法为蒸馏,其原理是利用了物质的______不同。
(2)反应③氢化过程中所需的高纯度H2可通过电解精制的饱和食盐水制得,电解过程中同时生成一种黄绿色的气体和一种易溶、易电离的碱,电解反应的离子方程式是________。粗盐水精制过程中,为有效除去Ca2+、Mg2+、SO42-?等杂质,要按__________顺序(填标号)加入下列溶液:a.NaOH
b.Na2CO3
c.BaCl2,过滤后再向滤液中加________调节pH。
(3)反应④中H2还原SiHCl3过程中若混入O2,除可能引起爆炸外,还可能引起_____。由粗硅制备多晶硅的过程中,循环使用的物质除SiCl4、SiHCl3和Si外,还有__________(填分子式)。
参考答案
1.B2.B3.B4.C5.C6.A7.B8.D9.D10.D11.A12.A13.D14.B15.B
16.C
B
Cl2+2NaOH=NaCl+NaClO+H2O
H2+Cl22HCl
D
17.Cl2O
Cl2O3
(或ClO2、Cl2O5、Cl2O7等)
HClO4+NaOH=NaClO4+H2O
Zn+2H+=Zn2++H2↑(其它合理答案也可以)
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
Cl2中Cl元素化合价为0价,氯元素还有-1价以及+1、+3等价态,因此氯元素化合价可以升高,氯气体现还原性;氯元素化合价也可以降低,氯气体现氧化性
18.40
NaClO+2HCl=NaCl+Cl2↑+H2O
慢
b、c两烧杯中,b烧杯中溶液的pH大于c烧杯中溶液的pH,HClO的浓度较小,褪色较慢(其他合理答案也可以)
>
2HClO=2HCl+O2↑
0.4
mol
19.④
②③
NaCl=Na++Cl-
CO
CO+2H+=CO2↑+H2O
AgNO3
Ag++Cl-=AgCl↓
20.非氧化还原
40g/mol
3:2
500mL容量瓶、胶头滴管
16.6g
AD
21.酸
C
酸
还原
A
22.Mg2+会与阴极产生的OH-生成Mg(OH)2沉淀,增大电阻,增加能耗(或阻碍电解)
Cl-
+3H2OClO3-+3H2↑
复分解反应
CaO
+
H2O=Ca(OH)2
逆流时,混合、吸收、反应Cl2更加完全
Na2S+Cl2=2NaCl+S↓
电解
23.1:2
Si+3HClSiHCl3+H2
沸点
2Cl-+2H2OCl2↑+H2↑+2OH-
acb或cab或cba
盐酸
Si与O2反应导致产物不纯
HCl、H2
