第二章 第1节化学反应的方向 同步训练(含答案)
文档属性
| 名称 | 第二章 第1节化学反应的方向 同步训练(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 110.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-19 10:01:16 | ||
图片预览



文档简介
2020-2021学年高二化学第一学期鲁科版(2019)选择性必修1第二章化学反应的方向、限度与速率第1节化学反应的方向同步训练
一、单选题
1.下列说法错误的是(
)
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.ΔH>0、ΔS<0的反应控制温度不能自发进行
C.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
D.NH4HCO3(g)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
2.下列叙述不正确的是(
)
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-216kJ?mol-1,则反应总能量>生成物总能量
B.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H<0
C.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,则不论在何种条件下都不可能自发
D.己知C(s)+O2(g)=CO2(g)△H1;C(s)+O2(g)=CO(g)△H2;则△H1<△H2
3.250℃和1.01×105Pa时,反应
2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ/mol,自发进行的原因是(
)
A.是吸热反应
B.是放热反应
C.是熵减少的反应
D.熵增大效应大于焓增大的效应
4.已知NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)
ΔH=+185.57
kJ·mol-1,下列说法中正确的是()
A.该反应ΔH>0且ΔS>0,因此该反应任何温度下都不能自发进行
B.一定条件下,该反应能自发进行,是因为该反应是一个熵增加的反应
C.其他条件不变,使用催化剂可以改变化学反应进行的方向
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
5.反应CH3OH(g)+NH3(g)=CH3NH2(g)+H2O(g)在高温下才能自发向右进行,则该反应的ΔH、ΔS应为( )
A.ΔH>0、ΔS<0
B.ΔH<0、ΔS>0
C.ΔH>0、ΔS>0
D.ΔH<0、ΔS<0
6.汽车尾气(含CO、NO与SO2等)是城市空气的主要污染源之一,治理的办法之一是在汽车排气管上安装催化转化器,在其作用下NO与CO反应可生成参与大气生态循环的无毒气体,其反应原理是2NO(g)+2CO(g)=N2(g)+2CO2(g)△H<0。下列说法中正确的是(
)
A.该反应是熵增大的反应
B.该反应不能自发进行,因此需要合适的催化剂
C.该反应高温下能自发进行
D.该反应低温下能自发进行
7.下列说法中,不正确的是(
)
A.乙烯聚合为聚乙烯的反应是熵减的过程,?S<0
B.金属钠和水的反应是熵增、放热、自发进行的反应
C.?H<0的反应均能够自发进行
D.氯气和消石灰的反应是熵减、自发进行的,一定是放热的反应
8.下列说法正确的是
A.在常温下,放热反应都能自发进行,吸热反应都不能自发进行
B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)
此反应的发生是熵增的过程
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
9.氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A.一定温度下,反应2H2(g)+O2(g)=2H2O(g)能自发进行,该反应的ΔH<0
B.氢氧燃料电池的负极反应为O2+2H2O+4e?=4OH?
C.常温常压下,氢氧燃料电池放电过程中消耗11.2
L
H2,转移电子的数目为1
mol
D.反应2H2(g)+O2(g)=2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和?反应中断裂旧共价键的键能之和
10.下列有关化学反应方向的说法中正确的是(
)
A.反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在一定条件下能自发进行,说明该反应的△H>0
B.反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H<0
C.反应2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)能自发进行,则该反应的△H>0
D.一定温度下,反应2NaCl(l)=2Na(l)+Cl2(g)的△H<0
11.下列有关说法错误的是(
)
A.活化能接近为0的反应速率极快
B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是△S>0
C.决定化学反应速率的主要因素是温度、浓度、压强、催化剂
D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
12.某化学反应其ΔH=122kJ·mol-1,ΔS=-431J·mol-1·K-1,则以下关于此反应的自发性描述中正确的是(
)
A.在任何温度下都能自发进行
B.仅在低温下自发进行
C.仅在高温下自发进行
D.在任何温度下都不能自发进行
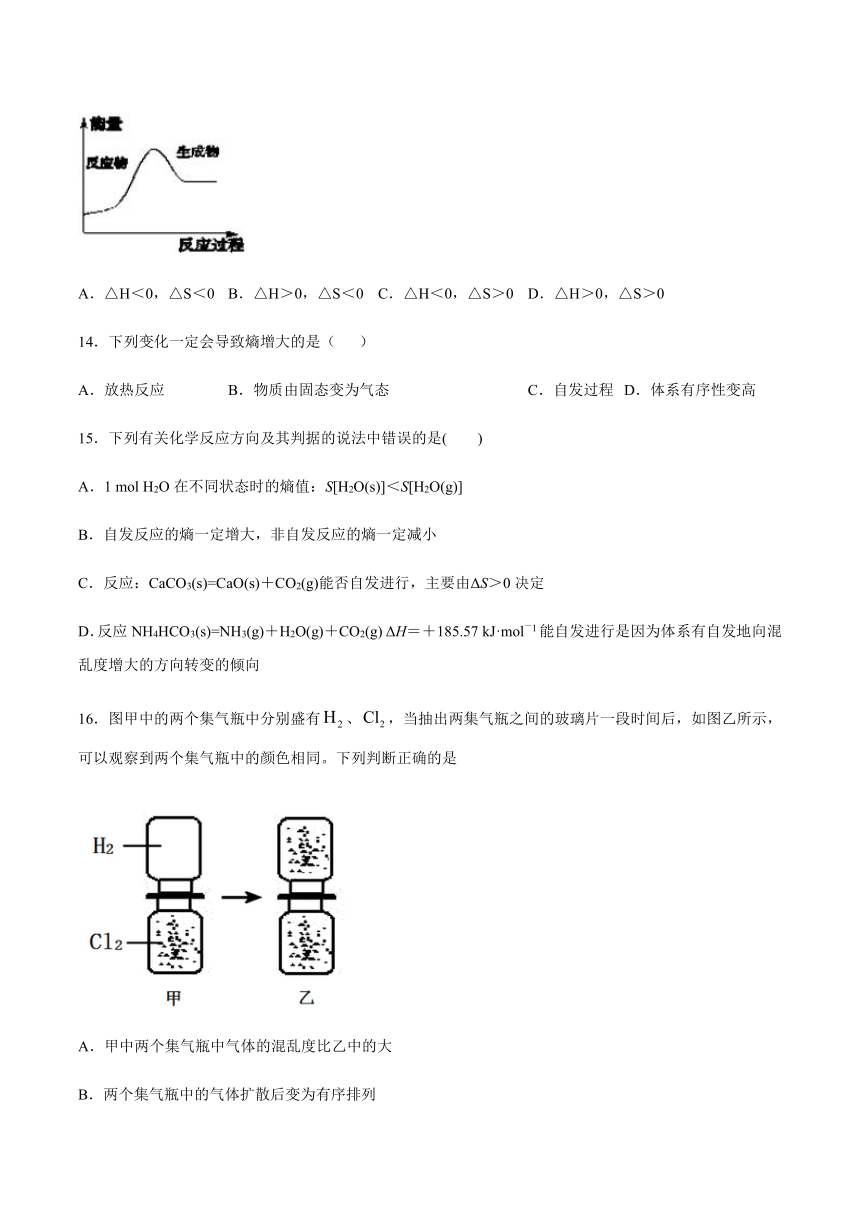
13.金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g)↑,反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )
A.△H<0,△S<0
B.△H>0,△S<0
C.△H<0,△S>0
D.△H>0,△S>0
14.下列变化一定会导致熵增大的是(
)
A.放热反应
B.物质由固态变为气态
C.自发过程
D.体系有序性变高
15.下列有关化学反应方向及其判据的说法中错误的是( )
A.1
mol
H2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)]
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.反应:CaCO3(s)=CaO(s)+CO2(g)能否自发进行,主要由ΔS>0决定
D.反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)
ΔH=+185.57
kJ·mol-1能自发进行是因为体系有自发地向混乱度增大的方向转变的倾向
16.图甲中的两个集气瓶中分别盛有、,当抽出两集气瓶之间的玻璃片一段时间后,如图乙所示,可以观察到两个集气瓶中的颜色相同。下列判断正确的是
A.甲中两个集气瓶中气体的混乱度比乙中的大
B.两个集气瓶中的气体扩散后变为有序排列
C.反应可自发进行
D.反应属于熵增反应
17.汽车尾气(含烃类CO、NO与等)是城市主要污染源之一,治理办法之一是在汽车排气管上安装催化转化器,它能使NO与CO反应生成无毒气体,其反应原理为,在298K、101kPa下,,。下列说法错误的是(
)
A.该反应中反应物的总能量高于生成物的总能量
B.该反应常温下不能自发进行,因此需要高温和催化剂条件
C.该反应常温下能自发进行,使用催化剂只能加快反应速率
D.汽车尾气中的NO、CO气体会与人体内的血红蛋白结合而使人中毒
二、填空题
18.随着人类对环境问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视,目前工业上有一种方法可用CO2来生产燃料甲醇。
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,甲醇的燃烧热为:___;
(2)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇。已知H2的燃烧热为:H=-285.8kJ/mol,又知:H2O(l)=H2O(g)
H=+44kJ/mol,写出工业上以CO2、H2合成CH3OH和气态水的热化学方程式:____;
(3)该转化的积极意义是____;
(4)有人提出,可以设计反应CO2=C+O2(△H>0、△S<0)来消除CO2对环境的影响。请你判断是否可行并说出理由:___。
19.判断下列说法的正误。
①的反应一定能自发进行
_______
②的反应一定不能自发进行
_______
③常温下,晶体与晶体的反应可自发进行
________
④常温下,反应可自发进行
_______
⑤反应的焓变是影响反应能否自发进行的一个因素
______
三、原理综合题
20.(1)已知下列热化学方程式:
a.H2(g)+O2(g)═H2O(l);△H=-285.8kJ?mol-1
b.H2(g)+O2(g)═H2O(g);△H=-241.8kJ?mol-1
c.CO(g)═C(s)+O2(g);△H=+110.5kJ?mol-1
d.C(s)+O2(g)═CO2(g);△H=-393.5kJ?mol-1
回答下列问题:
①上述反应中属于吸热反应的是________
②CO的燃烧热△H=________。表示CO燃烧热的热化学方程式为________。
③燃烧10g
H2生成液态水,放出的热量为________。
(2)可以用反应的△H和△S的正、负来判断该反应自发进行的可能性和自发进行的条件。函数△G就是一个判断的依据:△G=△H-T△S式中T为反应的温度(开尔文温度,没有负值)。
①当一个反应的△G___________0(填“>”、“<”或“=”)时,反应一定能自发进行。
②当△H<0,△S<0,温度___________(填“较高”或“较低”)时能自发反应。
参考答案
1.A2.C3.D4.B5.C6.D7.C8.B9.A10.B11.C12.B13.D14.B15.B16.C17.B
18.726.4kJ/mol
CO2(g)+3H2(g)═CH3OH(l)+H2O(l),H=-87.0kJ/mol
可降低温室效应和弥补资源短缺
不可行,该反应是一个焓增、熵减的反应,则ΔG=ΔH-TΔS>0,不能自发进行
19.错误
错误
正确
正确
正确
20.C
-283kJ?mol-1
CO(g)+
1/2
O2(g)═CO2(g)
△H=-283kJ?mol-1
1429kJ
<
较低
一、单选题
1.下列说法错误的是(
)
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.ΔH>0、ΔS<0的反应控制温度不能自发进行
C.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
D.NH4HCO3(g)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
2.下列叙述不正确的是(
)
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-216kJ?mol-1,则反应总能量>生成物总能量
B.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H<0
C.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,则不论在何种条件下都不可能自发
D.己知C(s)+O2(g)=CO2(g)△H1;C(s)+O2(g)=CO(g)△H2;则△H1<△H2
3.250℃和1.01×105Pa时,反应
2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ/mol,自发进行的原因是(
)
A.是吸热反应
B.是放热反应
C.是熵减少的反应
D.熵增大效应大于焓增大的效应
4.已知NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)
ΔH=+185.57
kJ·mol-1,下列说法中正确的是()
A.该反应ΔH>0且ΔS>0,因此该反应任何温度下都不能自发进行
B.一定条件下,该反应能自发进行,是因为该反应是一个熵增加的反应
C.其他条件不变,使用催化剂可以改变化学反应进行的方向
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
5.反应CH3OH(g)+NH3(g)=CH3NH2(g)+H2O(g)在高温下才能自发向右进行,则该反应的ΔH、ΔS应为( )
A.ΔH>0、ΔS<0
B.ΔH<0、ΔS>0
C.ΔH>0、ΔS>0
D.ΔH<0、ΔS<0
6.汽车尾气(含CO、NO与SO2等)是城市空气的主要污染源之一,治理的办法之一是在汽车排气管上安装催化转化器,在其作用下NO与CO反应可生成参与大气生态循环的无毒气体,其反应原理是2NO(g)+2CO(g)=N2(g)+2CO2(g)△H<0。下列说法中正确的是(
)
A.该反应是熵增大的反应
B.该反应不能自发进行,因此需要合适的催化剂
C.该反应高温下能自发进行
D.该反应低温下能自发进行
7.下列说法中,不正确的是(
)
A.乙烯聚合为聚乙烯的反应是熵减的过程,?S<0
B.金属钠和水的反应是熵增、放热、自发进行的反应
C.?H<0的反应均能够自发进行
D.氯气和消石灰的反应是熵减、自发进行的,一定是放热的反应
8.下列说法正确的是
A.在常温下,放热反应都能自发进行,吸热反应都不能自发进行
B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)
此反应的发生是熵增的过程
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
9.氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A.一定温度下,反应2H2(g)+O2(g)=2H2O(g)能自发进行,该反应的ΔH<0
B.氢氧燃料电池的负极反应为O2+2H2O+4e?=4OH?
C.常温常压下,氢氧燃料电池放电过程中消耗11.2
L
H2,转移电子的数目为1
mol
D.反应2H2(g)+O2(g)=2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和?反应中断裂旧共价键的键能之和
10.下列有关化学反应方向的说法中正确的是(
)
A.反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在一定条件下能自发进行,说明该反应的△H>0
B.反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H<0
C.反应2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)能自发进行,则该反应的△H>0
D.一定温度下,反应2NaCl(l)=2Na(l)+Cl2(g)的△H<0
11.下列有关说法错误的是(
)
A.活化能接近为0的反应速率极快
B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是△S>0
C.决定化学反应速率的主要因素是温度、浓度、压强、催化剂
D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
12.某化学反应其ΔH=122kJ·mol-1,ΔS=-431J·mol-1·K-1,则以下关于此反应的自发性描述中正确的是(
)
A.在任何温度下都能自发进行
B.仅在低温下自发进行
C.仅在高温下自发进行
D.在任何温度下都不能自发进行
13.金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g)↑,反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )
A.△H<0,△S<0
B.△H>0,△S<0
C.△H<0,△S>0
D.△H>0,△S>0
14.下列变化一定会导致熵增大的是(
)
A.放热反应
B.物质由固态变为气态
C.自发过程
D.体系有序性变高
15.下列有关化学反应方向及其判据的说法中错误的是( )
A.1
mol
H2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)]
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.反应:CaCO3(s)=CaO(s)+CO2(g)能否自发进行,主要由ΔS>0决定
D.反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)
ΔH=+185.57
kJ·mol-1能自发进行是因为体系有自发地向混乱度增大的方向转变的倾向
16.图甲中的两个集气瓶中分别盛有、,当抽出两集气瓶之间的玻璃片一段时间后,如图乙所示,可以观察到两个集气瓶中的颜色相同。下列判断正确的是
A.甲中两个集气瓶中气体的混乱度比乙中的大
B.两个集气瓶中的气体扩散后变为有序排列
C.反应可自发进行
D.反应属于熵增反应
17.汽车尾气(含烃类CO、NO与等)是城市主要污染源之一,治理办法之一是在汽车排气管上安装催化转化器,它能使NO与CO反应生成无毒气体,其反应原理为,在298K、101kPa下,,。下列说法错误的是(
)
A.该反应中反应物的总能量高于生成物的总能量
B.该反应常温下不能自发进行,因此需要高温和催化剂条件
C.该反应常温下能自发进行,使用催化剂只能加快反应速率
D.汽车尾气中的NO、CO气体会与人体内的血红蛋白结合而使人中毒
二、填空题
18.随着人类对环境问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视,目前工业上有一种方法可用CO2来生产燃料甲醇。
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,甲醇的燃烧热为:___;
(2)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇。已知H2的燃烧热为:H=-285.8kJ/mol,又知:H2O(l)=H2O(g)
H=+44kJ/mol,写出工业上以CO2、H2合成CH3OH和气态水的热化学方程式:____;
(3)该转化的积极意义是____;
(4)有人提出,可以设计反应CO2=C+O2(△H>0、△S<0)来消除CO2对环境的影响。请你判断是否可行并说出理由:___。
19.判断下列说法的正误。
①的反应一定能自发进行
_______
②的反应一定不能自发进行
_______
③常温下,晶体与晶体的反应可自发进行
________
④常温下,反应可自发进行
_______
⑤反应的焓变是影响反应能否自发进行的一个因素
______
三、原理综合题
20.(1)已知下列热化学方程式:
a.H2(g)+O2(g)═H2O(l);△H=-285.8kJ?mol-1
b.H2(g)+O2(g)═H2O(g);△H=-241.8kJ?mol-1
c.CO(g)═C(s)+O2(g);△H=+110.5kJ?mol-1
d.C(s)+O2(g)═CO2(g);△H=-393.5kJ?mol-1
回答下列问题:
①上述反应中属于吸热反应的是________
②CO的燃烧热△H=________。表示CO燃烧热的热化学方程式为________。
③燃烧10g
H2生成液态水,放出的热量为________。
(2)可以用反应的△H和△S的正、负来判断该反应自发进行的可能性和自发进行的条件。函数△G就是一个判断的依据:△G=△H-T△S式中T为反应的温度(开尔文温度,没有负值)。
①当一个反应的△G___________0(填“>”、“<”或“=”)时,反应一定能自发进行。
②当△H<0,△S<0,温度___________(填“较高”或“较低”)时能自发反应。
参考答案
1.A2.C3.D4.B5.C6.D7.C8.B9.A10.B11.C12.B13.D14.B15.B16.C17.B
18.726.4kJ/mol
CO2(g)+3H2(g)═CH3OH(l)+H2O(l),H=-87.0kJ/mol
可降低温室效应和弥补资源短缺
不可行,该反应是一个焓增、熵减的反应,则ΔG=ΔH-TΔS>0,不能自发进行
19.错误
错误
正确
正确
正确
20.C
-283kJ?mol-1
CO(g)+
1/2
O2(g)═CO2(g)
△H=-283kJ?mol-1
1429kJ
<
较低
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
