第五单元 化学方程式典型练习-人教版九年级上册化学(共13张PPT)
文档属性
| 名称 | 第五单元 化学方程式典型练习-人教版九年级上册化学(共13张PPT) | 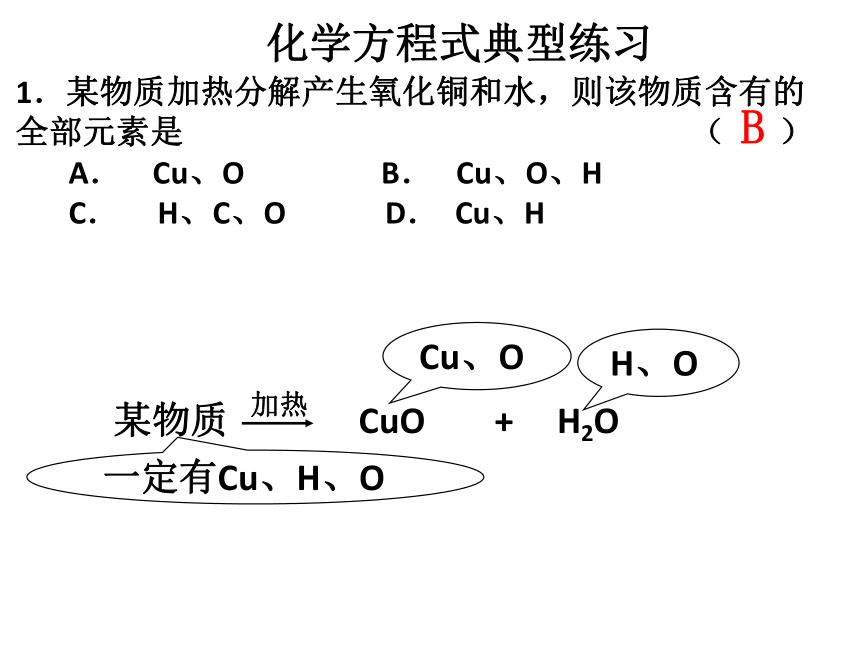 | |
| 格式 | ppt | ||
| 文件大小 | 116.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-18 21:09:49 | ||
图片预览




文档简介
化学方程式典型练习
1.某物质加热分解产生氧化铜和水,则该物质含有的全部元素是 ( )
A. Cu、O B. Cu、O、H
C. H、C、O D. Cu、H
B
某物质 CuO + H2O
加热
Cu、O
一定有Cu、H、O
H、O
2.某化合物180g在空气中完全燃烧,生成440g二氧化碳和360g水,关于该化合物组成结论正确的是 ( )
A.只含碳、氢元素
B.含有碳、氢、氧三种元素
C.一定含碳、氢元素,可能含氧元素
D.无法判断。
碳元素质量=440g×12/44=120g
氢元素质量=360g×2/18=40g
m(c)+m(H)=120g+40g=160g < 180g
B
化合物 + O2 CO2 + H2O
点燃
C、O
一定有C、H
H、O
所以有氧元素,m(O)= 180g-160g=20g
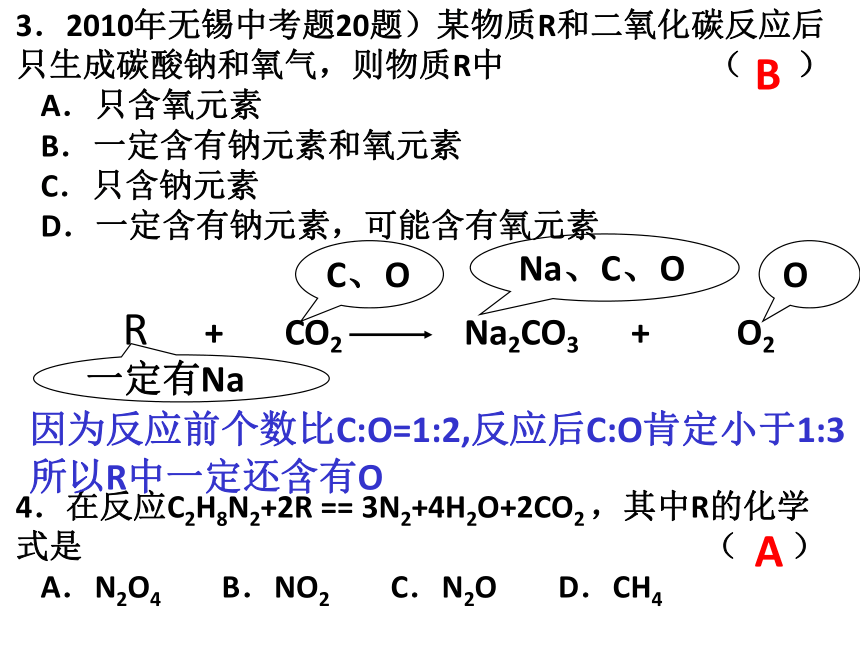
3.2010年无锡中考题20题)某物质R和二氧化碳反应后只生成碳酸钠和氧气,则物质R中 ( )
A.只含氧元素
B.一定含有钠元素和氧元素
C.只含钠元素
D.一定含有钠元素,可能含有氧元素
4.在反应C2H8N2+2R == 3N2+4H2O+2CO2 ,其中R的化学式是 ( )
A.N2O4 B.NO2 C.N2O D.CH4
B
R + CO2 Na2CO3 + O2
Na、C、O
一定有Na
O
C、O
因为反应前个数比C:O=1:2,反应后C:O肯定小于1:3
所以R中一定还含有O
A
5.在A+B==C+2D的反应中,已知29gA跟49gB恰好完全反应生成60gC,D的相对分子质量为18,则A的相对分子质量为 ( )
A.58 B.29 C.49 D.85
A
A + B ==== C + 2D
?
29g 49g 60g
+
=
+
18g
? 2x18
x
29g
=
36
18g
X=58
设A的相对分子质量为X
6.某物质在空气中充分燃烧生成二氧化碳和水,该物质中肯定含 元素;可能含 元素。
C 、 H
O
物质 + O2 CO2 + H2O
点燃
C、O
O
H、O
一定有C、H
可能有O
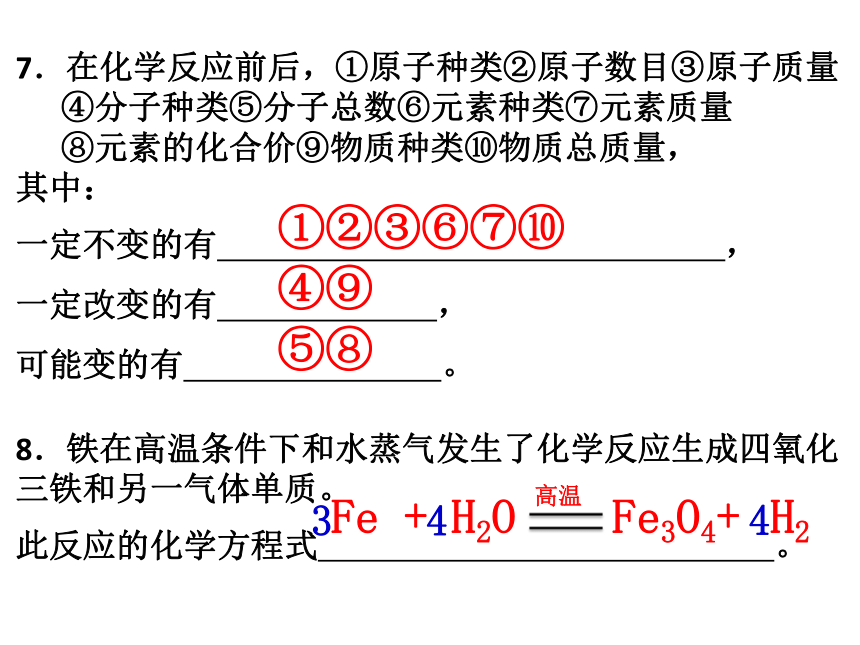
7.在化学反应前后,①原子种类②原子数目③原子质量
④分子种类⑤分子总数⑥元素种类⑦元素质量
⑧元素的化合价⑨物质种类⑩物质总质量,
其中:
一定不变的有 ,
一定改变的有 ,
可能变的有 。
8.铁在高温条件下和水蒸气发生了化学反应生成四氧化三铁和另一气体单质。
此反应的化学方程式 。
①②③⑥⑦⑩
④⑨
⑤⑧
Fe + H2O Fe3O4+
高温
3
4
4
H2
9.在密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
⑴该反应中x为 ,
⑵该反应的基本类型是 ,
⑶物质C在反应中一定是催化剂吗? 。
物质
A
B
C
D
反应前质量(g)
8
35
5
8
反应后质量(g)
2
x
5
42
变化量
-6
-28
0
+34
∵ 8+35+5+8=2+ x+5+42
∴ x = 7
∴ A + B → D
7
化合反应
不一定
10.现有氯酸钾和二氧化锰的混合物共26.5g,待反应不再有气体生成后,将试管冷却、称量,得到剩余固体16.9g。
⑴生成的氧气的质量为 g。
⑵剩余固体中含有 、 ,
质量分别是 g和 g。
149
x
=
96
0.96g
2KClO3 2KCl + 3O2↑
解:设氯化钾的质量为x
149 96
x 9.6g
26.5g - 16.9g =9.6g
9.6
KCl
MnO2
X=14.9g
14.9
16.9g - 14.9g =2g
2
11.工业上用石灰石(主要成分是CaCO3)在高温下反应,生成生石灰(CaO)和二氧化碳,现用1000g石灰石在高温下充分反应,生成448g生石灰。求这种石灰石中碳酸钙的质量分数。
100
x
=
56
448g
X=800g
CaCO3 CaO + CO2↑
高温
解:设碳酸钙的质量为x
100 56
x 448g
CaCO3 %=800g/1000g X100%=80%
答:碳酸钙的质量分数是80%
加热时间
t1
t2
t3
t4
剩余固体质量/g
2.48
2.41
2.34
2.34
12.为了测定实验室中氯酸钾样品的纯度,某学习小组取2.5g该样品与0.8g二氧化锰混合。加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体质量。重复以上操作,依次称得加热t1、t2、t3、t4时间后剩余固体的质量,记录数据如下表:
请仔细分析实验数据,回答下列问题:
(1)在 时间后,该样品中的氯酸钾已经完全反应;
(2)产生氧气的质量为 克;
(3)求该样品中氯酸钾的质量分数?
t3
0.96
2.5g + 0.8g - 2.34g = 0.96g
245
x
=
96
0.96g
X=2.45g
2KClO3 2KCl + 3O2↑
解:设氯酸钾的质量为x
245 96
x 0.96g
KClO3%=2.45g/2.5g X100%=98%
答:氯酸钾的质量分数是98%
1
2
3
4
加入盐酸质量(g)
10.0
10.0
10.0
10.0
剩余固体质量(g)
2.5
1.0
0.4
0.4
13.为测定某石灰石的纯度,取4g该石灰石(主要成分是CaCO3)样品,将40g稀盐酸(HCl)平均分成4等份,分4次加入到样品中,充分反应后测得剩余固体的质量,数据如下:(杂质不反应,不溶)
(已知:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑)
⑴ 4g石灰石样品中杂质的质量为 克,
⑵ 该石灰石样品中CaCO3的质量分数是 ,
⑶ 100g这种石灰石与足量盐酸反应,生成二氧化碳
的质量为多少克?
0.4
90%
(4g-0.4g)/4gX100%=90%
100
90g
=
44
x
X=39.6g
答:生成二氧化碳39.6g。
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
解:设二氧化碳的质量为x
100 44
100gX90% x
m/g
14.将不纯的锌粒10g(杂质不与硫酸发生反应)与足量的稀硫酸反应时,放出气体的质量(m)随时间(t)的变化曲线如图所示。(已知:Zn+H2SO4=ZnSO4+H2↑ )
(1)第 min时,锌粒与稀硫酸完全
反应,放出氢气的质量为 g。
(2)求不纯锌粒中锌的质量分数是多少?
65
x
=
2
0.2g
X=6.5g
Zn + H2SO4 = ZnSO4 + H2↑
解:设锌的质量为x
65 2
x 0.2g
Zn%=6.5g/10g X100%=65%
答:锌的质量分数是65%
3
0.2
15.请根据下图提示,自编一道有关化学方程式的计算题,并写出解答过程。
KMnO4
31.6g
O2
?
316
31.6g
=
32
x
X=3.2g
答:生成氧气3.2g。
解:设氧气的质量为x
316 32
31.6g x
2KMnO4 K2MnO4 + MnO2 + O2↑
题目:31.6g高锰酸钾完全反应能
生成多少克氧气?
1.某物质加热分解产生氧化铜和水,则该物质含有的全部元素是 ( )
A. Cu、O B. Cu、O、H
C. H、C、O D. Cu、H
B
某物质 CuO + H2O
加热
Cu、O
一定有Cu、H、O
H、O
2.某化合物180g在空气中完全燃烧,生成440g二氧化碳和360g水,关于该化合物组成结论正确的是 ( )
A.只含碳、氢元素
B.含有碳、氢、氧三种元素
C.一定含碳、氢元素,可能含氧元素
D.无法判断。
碳元素质量=440g×12/44=120g
氢元素质量=360g×2/18=40g
m(c)+m(H)=120g+40g=160g < 180g
B
化合物 + O2 CO2 + H2O
点燃
C、O
一定有C、H
H、O
所以有氧元素,m(O)= 180g-160g=20g
3.2010年无锡中考题20题)某物质R和二氧化碳反应后只生成碳酸钠和氧气,则物质R中 ( )
A.只含氧元素
B.一定含有钠元素和氧元素
C.只含钠元素
D.一定含有钠元素,可能含有氧元素
4.在反应C2H8N2+2R == 3N2+4H2O+2CO2 ,其中R的化学式是 ( )
A.N2O4 B.NO2 C.N2O D.CH4
B
R + CO2 Na2CO3 + O2
Na、C、O
一定有Na
O
C、O
因为反应前个数比C:O=1:2,反应后C:O肯定小于1:3
所以R中一定还含有O
A
5.在A+B==C+2D的反应中,已知29gA跟49gB恰好完全反应生成60gC,D的相对分子质量为18,则A的相对分子质量为 ( )
A.58 B.29 C.49 D.85
A
A + B ==== C + 2D
?
29g 49g 60g
+
=
+
18g
? 2x18
x
29g
=
36
18g
X=58
设A的相对分子质量为X
6.某物质在空气中充分燃烧生成二氧化碳和水,该物质中肯定含 元素;可能含 元素。
C 、 H
O
物质 + O2 CO2 + H2O
点燃
C、O
O
H、O
一定有C、H
可能有O
7.在化学反应前后,①原子种类②原子数目③原子质量
④分子种类⑤分子总数⑥元素种类⑦元素质量
⑧元素的化合价⑨物质种类⑩物质总质量,
其中:
一定不变的有 ,
一定改变的有 ,
可能变的有 。
8.铁在高温条件下和水蒸气发生了化学反应生成四氧化三铁和另一气体单质。
此反应的化学方程式 。
①②③⑥⑦⑩
④⑨
⑤⑧
Fe + H2O Fe3O4+
高温
3
4
4
H2
9.在密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
⑴该反应中x为 ,
⑵该反应的基本类型是 ,
⑶物质C在反应中一定是催化剂吗? 。
物质
A
B
C
D
反应前质量(g)
8
35
5
8
反应后质量(g)
2
x
5
42
变化量
-6
-28
0
+34
∵ 8+35+5+8=2+ x+5+42
∴ x = 7
∴ A + B → D
7
化合反应
不一定
10.现有氯酸钾和二氧化锰的混合物共26.5g,待反应不再有气体生成后,将试管冷却、称量,得到剩余固体16.9g。
⑴生成的氧气的质量为 g。
⑵剩余固体中含有 、 ,
质量分别是 g和 g。
149
x
=
96
0.96g
2KClO3 2KCl + 3O2↑
解:设氯化钾的质量为x
149 96
x 9.6g
26.5g - 16.9g =9.6g
9.6
KCl
MnO2
X=14.9g
14.9
16.9g - 14.9g =2g
2
11.工业上用石灰石(主要成分是CaCO3)在高温下反应,生成生石灰(CaO)和二氧化碳,现用1000g石灰石在高温下充分反应,生成448g生石灰。求这种石灰石中碳酸钙的质量分数。
100
x
=
56
448g
X=800g
CaCO3 CaO + CO2↑
高温
解:设碳酸钙的质量为x
100 56
x 448g
CaCO3 %=800g/1000g X100%=80%
答:碳酸钙的质量分数是80%
加热时间
t1
t2
t3
t4
剩余固体质量/g
2.48
2.41
2.34
2.34
12.为了测定实验室中氯酸钾样品的纯度,某学习小组取2.5g该样品与0.8g二氧化锰混合。加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体质量。重复以上操作,依次称得加热t1、t2、t3、t4时间后剩余固体的质量,记录数据如下表:
请仔细分析实验数据,回答下列问题:
(1)在 时间后,该样品中的氯酸钾已经完全反应;
(2)产生氧气的质量为 克;
(3)求该样品中氯酸钾的质量分数?
t3
0.96
2.5g + 0.8g - 2.34g = 0.96g
245
x
=
96
0.96g
X=2.45g
2KClO3 2KCl + 3O2↑
解:设氯酸钾的质量为x
245 96
x 0.96g
KClO3%=2.45g/2.5g X100%=98%
答:氯酸钾的质量分数是98%
1
2
3
4
加入盐酸质量(g)
10.0
10.0
10.0
10.0
剩余固体质量(g)
2.5
1.0
0.4
0.4
13.为测定某石灰石的纯度,取4g该石灰石(主要成分是CaCO3)样品,将40g稀盐酸(HCl)平均分成4等份,分4次加入到样品中,充分反应后测得剩余固体的质量,数据如下:(杂质不反应,不溶)
(已知:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑)
⑴ 4g石灰石样品中杂质的质量为 克,
⑵ 该石灰石样品中CaCO3的质量分数是 ,
⑶ 100g这种石灰石与足量盐酸反应,生成二氧化碳
的质量为多少克?
0.4
90%
(4g-0.4g)/4gX100%=90%
100
90g
=
44
x
X=39.6g
答:生成二氧化碳39.6g。
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
解:设二氧化碳的质量为x
100 44
100gX90% x
m/g
14.将不纯的锌粒10g(杂质不与硫酸发生反应)与足量的稀硫酸反应时,放出气体的质量(m)随时间(t)的变化曲线如图所示。(已知:Zn+H2SO4=ZnSO4+H2↑ )
(1)第 min时,锌粒与稀硫酸完全
反应,放出氢气的质量为 g。
(2)求不纯锌粒中锌的质量分数是多少?
65
x
=
2
0.2g
X=6.5g
Zn + H2SO4 = ZnSO4 + H2↑
解:设锌的质量为x
65 2
x 0.2g
Zn%=6.5g/10g X100%=65%
答:锌的质量分数是65%
3
0.2
15.请根据下图提示,自编一道有关化学方程式的计算题,并写出解答过程。
KMnO4
31.6g
O2
?
316
31.6g
=
32
x
X=3.2g
答:生成氧气3.2g。
解:设氧气的质量为x
316 32
31.6g x
2KMnO4 K2MnO4 + MnO2 + O2↑
题目:31.6g高锰酸钾完全反应能
生成多少克氧气?
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
