2020-2021学年高二化学山东省临沂市费县二中高二化学人教版(2019)必修一第四章原电池与电解池(含解析)
文档属性
| 名称 | 2020-2021学年高二化学山东省临沂市费县二中高二化学人教版(2019)必修一第四章原电池与电解池(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 661.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-19 00:00:00 | ||
图片预览

文档简介
费县二中高二化学期末专题训练测评
(二)---原电池与电解池
一、单选题
1.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为,在此电池放电时,正极上发生反应的物质是(
)
A.
Ag
B.
C.
D.Zn
2.下列关于各装置图的叙述不正确的是(
)
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是溶液
B.图②装置盐桥中的移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
3.下列关于金属腐蚀的说法正确的是(
)
A.金属在潮湿空气中腐蚀的实质是:
B.金属的化学腐蚀的实质是,该过程有电流产生
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐蚀
4.a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。a、b相连时,电流由a经导线流向b;c、d相连时,电子由d到c;a、c相连时,a极上产生大量气泡;b、d相连时,移向d极。则四种金属的活动性由强到弱的顺序为(
)
A.a>b>c
>d
B.
a>c>d>b
C.c>a>b>d
D.b>d>c>a
5.某燃料电池可实现NO和CO的无害转化,其结构如图所示。下列说法正确的是(
)
A.石墨Ⅰ电极上发生氧化反应
B.电池工作时向石墨Ⅱ电极处移动
C.石墨Ⅱ电极上的反应式为
D.电路中每通过6mol电子,生成1mol
6.浓差电池是电化学电池的一种。一般所说的原电池在电池工作时都有某种化学变化发生,因而被称为化学电池;浓差电池虽然也经历了氧化还原过程,但电池的总反应中并没有反映出这种变化,它是通过一种物质从高浓度状态向低浓度状态的转移而获得电动势。如图是利用硫酸铜溶液构成的浓差电池的示意图,下列说法错误的是(
)
A.电池需采用阳离子交换膜
B.左室发生反应:
C.左室流出的硫酸铜溶液物质的量浓度低于2mol/L
D.工作一段时间后右室电极质量减轻
7.高铁酸钠()是一种新型绿色水处理剂。工业上可用电解浓NaOH溶液制备,其工作原理如图所示,两端隔室中离子不能进入中间隔室。下列说法错误的是(
)
A.阳极反应为
B.甲溶液可循环利用
C.离子交换膜a是阴离子交换膜
D.当电路中通过2
mol电子的电量时,会有1
mol生成
8.如图所示,甲池的总反应式为,下列说法正确是(
)
A.甲池是将电能转化为化学能的装置,乙、丙池是将化学能转化电能的装置
B.甲池通入的电极的电极反应式为
C.反应一段时间后,向乙池中加入一定量固体能使溶液恢复到原浓度
D.甲池中消耗280mL(标准状况下),丙池中理论上最多产生1.45g固体
9.用滴有酚酞和氯化钠溶液的湿润滤纸分别做甲、乙两个实验,下列判断不正确的是(
)
A.b极附近有气泡冒出
B.d极附近出现红色
C.a、c极上都发生氧化反应
D.甲中的铁比乙中的铁更易被腐蚀
10.工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是(
)
已知:①在弱酸性溶液中发生水解;②氧化性:(高浓度)>>(低浓度)。
A.碳棒上发生的电极反应:
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的电解过程中需要控制废水的pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解总反应的方程式发生改变
11.工业废气经资源化利用后可回收能量并得到单质硫。反应原理为。燃料电池的工作原理如图所示。
下列有关说法不正确的是(
)
A.电极a为电池的负极
B.电极b上的电极反应式为
C.若电路中通过2
mol电子,则电池内部释放632
kJ热能
D.若有17
g参与反应,则会有1
mol经质子膜进入正极区
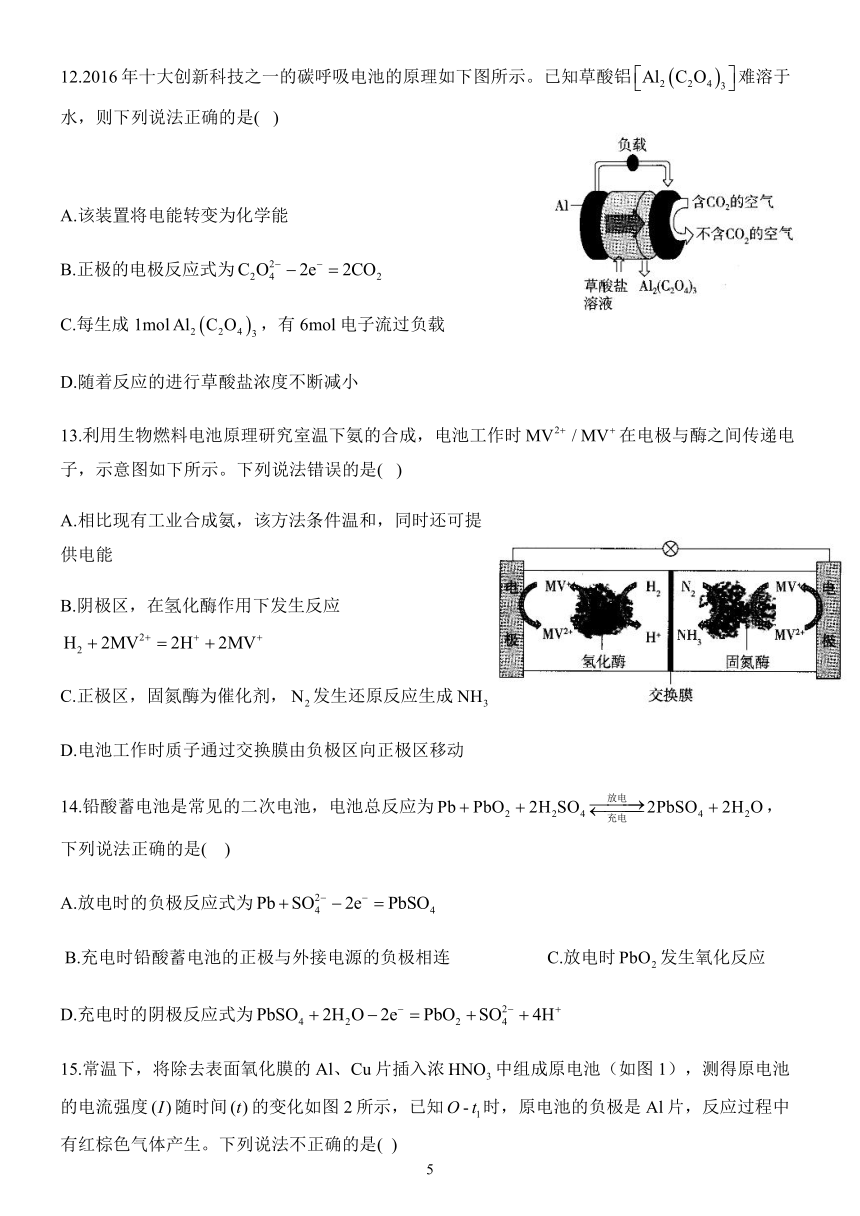
12.2016年十大创新科技之一的碳呼吸电池的原理如下图所示。已知草酸铝难溶于水,则下列说法正确的是(
)
A.该装置将电能转变为化学能
B.正极的电极反应式为
C.每生成1mol,有6mol电子流过负载
D.随着反应的进行草酸盐浓度不断减小
13.利用生物燃料电池原理研究室温下氨的合成,电池工作时在电极与酶之间传递电子,示意图如下所示。下列说法错误的是(
)
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应
C.正极区,固氮酶为催化剂,发生还原反应生成
D.电池工作时质子通过交换膜由负极区向正极区移动
14.铅酸蓄电池是常见的二次电池,电池总反应为,下列说法正确的是(
)
A.放电时的负极反应式为
B.充电时铅酸蓄电池的正极与外接电源的负极相连
C.放电时发生氧化反应
D.充电时的阴极反应式为
15.常温下,将除去表面氧化膜的Al、Cu片插入浓中组成原电池(如图1),测得原电池的电流强度随时间的变化如图2所示,已知时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是(
)
A.
时,正极的电极反应式为
B.
时,溶液中的向Cu电极移动
C.时,负极的电极反应式为
D.时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
二、填空题
16.某研究性学习小组根据反应设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为,溶液的体积均为200mL,盐桥中装有饱和溶液。
回答下列问题:
(1)此原电池的正极是石墨
(填“a”或“b"”),发生
反应。
(2)电池工作时,盐桥中的移向
(填“甲”或“乙”)烧杯。
(3)写出两烧杯中的电极反应式:
甲
,
乙
。
(4)若不考虑溶液的体积变化,浓度变为,则反应中转移的电子
mol。
17.下图是一个用铂丝作电极电解稀溶液的装置,电解液中加有中性红色指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸性—红色,碱性—黄色)
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是_________(填编号)。
①A极附近溶液由红变黄
②B极附近溶液由红变黄
③A极附近溶液不变色
④B极附近溶液不变色
(2)写出A极发生的电极反应式:__________________。
(3)写出B极发生的电极反应式:__________________。
(4)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是__________________。
18.如图所示装置中,甲、乙、丙三个烧杯分别盛放100g
5%
NaOH溶液、足量溶液和100g
10%
溶液,电极均为石墨电极。
(1)接通电源,一段时间后,测得丙中溶液的质量分数为10.47%,乙中c电极质量增加。则
①电源的N端为
极;
②电极b上发生的电极反应为
;
③电极b上生成的气体在标准状况下的体积为
L;
④电解前后丙中溶液的pH
(填“增大”“减小”或“不变”)。
(2)乙装置中如果电解过程中铜全部析出,此时电解能否继续进行
(填“能”或“不能”),原因是
。
三、实验题
19.如图所示,
X是一种生活中常见的金属元素,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间(实验中所有溶液均足量)。
(1)甲池是_____________(填“原电池”或“电解池”,下同)装置;乙池是______________装置。
(2)D极为___________(填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是_____________(填“a”或“b”);
C极上的电极反应为_____________。
(4)F极上的电极反应为___________________。
(5)当电路中通过0.02
mol电子时,B电极上沉积0.64
g金属X,则X为____________(填元素符号),甲池中发生反应的化学方程式为_______________。
20.在如图所示的装置中,试管A、B中的电极为多孔的惰性电极;C、
D为两个铂夹,夹在被溶液浸湿的滤纸条上,滤纸条的中部滴有一滴液滴;电源有a、b两极。若在A、B中充满0.01
mol/L的KOH溶液后倒立于装有同浓度的KOH溶液的水槽中,断开,闭合、,通直流电,实验现象如图所示:
回答下列问题:
(1)断开,闭合、,通直流电,试管B中产生的气体为___________(填化学式)。
(2)在溶液浸湿的滤纸条中部的液滴处现象为_______________。
(3)断开,闭合、,通直流电较长一段时间后,
KOH溶液的浓度______________(填“变大”“变小”或“不变”)。
(4)电解一段时间后,A、B中均有气体包围电极。此时切断、,闭合,检流计有指数,此时该装置A试管中电极上发生的反应为______________。
参考答案
1.答案:C
解析:放电时,正极上发生还原反应,发生反应的物质是。
2.答案:B
解析:根据装置图中电流方向可知,a极为阳极、b极为阴极,铁上镀铜时,Cu为阳极、Fe为阴极,电解质溶液可以是溶液,A正确;双液铜锌原电池中,Zn为负极、Cu为正极,原电池工作时,阳离子移向正极、阴离子移向负极,即盐桥中的移向左烧杯,B错误;图③装置是外加电流法防腐,其中钢闸门接外加电源的负极、作阴极,发生还原反应,C正确;图④中两装置均为原电池,左侧装置中Al为负极,电极反应为,右侧装置中Zn为负极,电极反应为,装置中通过导线的电子数相同时,消耗负极材料的关系为,消耗负极材料的物质的量不同,D正确。
3.答案:D
解析:金属在潮湿的空气中发生吸氧腐蚀,正极上氧气得电子发生还原反应,所以没有氢气生成,A错误;金属的化学腐蚀实质是,是金属直接和氧化剂反应的过程,该过程中没有电流产生,
B错误;金属的化学腐蚀在酸性和碱性条件下均有可能进行,C错误;在潮湿的中性环境中,负极上金属失电子被腐蚀,正极上氧气得电子,即金属的电化学腐蚀主要是吸氧腐蚀,D正确。
4.答案:D
解析:
a、b相连时,电流由a经导线流向b,则a为正极,b的金属活动性强于a;c、d相连时,电子由d到c,所以c上得电子发生还原反应,故d的金属活动性强于c;a、c相连时,a极上产生大量气泡,a上得电子发生还原反应,所以c上失电子发生氧化反应,故c的金属活劲性强于a;b、d相连时,移向d极,所以d是正极,b是负极,b的金属活动性强于d,所以a、b、c、d四种金属的活动性由强到弱的顺序为b>d>c>a。
5.答案:C
解析:石墨Ⅰ电极上NO发生反应生成,氮元素化合价降低,属于还原反应,A错误;电池工作时向正极移动,即向石墨Ⅰ电极处移动,B错误;石墨Ⅱ为负极,发生还原反应,反应式为,C正确;氮元素化合价由+2价降低为0价,每生成1mol得到4mol电子,则电路中每通过6mol电子,生成1.5mol,D错误。
6.答案:A
解析:左室得电子生成Cu,硫酸根离子浓度相对较大,右室Cu电极失去电子生成,浓度相对较大,所以硫酸根离子通过离子交换膜由左室移向右室,即离子交换膜为阴离子交换膜,A错误;该浓差电池中,左室溶液浓度高,发生反应,因而左室为正极区,右室为负极区,B正确;左室溶液中得电子生成Cu,所以左室流岀的硫酸铜溶液物质的量浓度低于2mol/L,C正确;该浓差电池中,右室为负极区,电极反应式为,所以原电池工作一段时间后右室电极质量减轻,D正确。
7.答案:C
解析:A项,阳极发生氧化反应,电极反应为,正确;B项,阴极发生还原反应,水电离出的氢离子放电生成氢气,甲溶液为浓的氢氧化钠溶液,可循环利用,正确;C项,电解池中阳离子向阴极移动,通过离子交换膜a的是,故离子交换膜a为阳离子交换膜,错误;D项,阴极发生还原反应,电极反应为,当电路中通过2
mol电子的电量时,会有1
mol
生成,正确。
8.答案:D
解析:
A项,甲池是燃料电池,属于原电池,是将化学能转化为电能的装置,乙、丙池属于电解池,是将电能转化为化学能的装置,错误。B项,甲池是燃料电池,通入的电极是电池的负极,发生氧化反应,因电解质是氢氧化钾,所以该电极反应不会生成氢离子,错误。C项,乙中电解足量硫酸铜溶液时,阳极生成氧气,阴极析出金属铜,所以要让电解质溶液在电解后恢复到原浓度,应加入氧化铜,错误。D项,甲池中正极发生的电极反应为,消耗280mL(标准状况下)即0.0125
mol,转移电子的物质的量为0.05mol;丙池中阴极上得电子生成氢气,产生的与结合生成沉淀,则丙池中生成固体的质量为58g/mol×0.025mol=1.45g,正确。
9.答案:A
解析:题图甲构成原电池,题图乙为电解池,b极是正极,电极反应为,所以无气泡冒出,A错误;题图乙中d极上电极反应为,d极附近溶液呈碱性,酚酞遇碱变红,B正确;是原电池的负极,发生氧化反应,c是电解池的阳极,发生氧化反应,所以a、c极上都发生氧化反应,C正确;甲中的铁
是原电池的负极被腐蚀,而乙中的铁是电解池的阴极被保护,所以甲中的铁比乙中的铁更易被腐蚀,D正确。
10.答案:B
解析:由题图知,碳棒与电源正极相连是电解池的阳极,电极反应为,A正确;镀镍铁棒与电源负极相连是电解池的阴极,电极反应为,电解过程中为平衡A、C中的电荷,A中的和C中的分别通过阳离子膜和阴离子膜移向B中,则B中NaCl溶液的物质的量浓度不断增大,B错误;因在弱酸性溶液中易发生水解,氧化性:(高浓度)>>(低浓度),为了提高Ni的产率,电解过程中需要控制废水的pH,C正确;若将题图中阳离子交换膜去掉,由于先放电,则移向阳极放电:,电解总反应的方程式会发生改变,D正确。
11.答案:C
解析:由,得出负极失电子发生氧化反应,则电极a为电池的负极,A正确;正极得电子发生还原反应,所以电极b上发生的电极反应为,B正确;电路中每通过2
mol电子,则消耗0.5
mol氧气,但该装置将化学能转化为电能,所以电池内部几乎不放出热量,C错误;每17
g
即0.5
mol参与反应,则消耗0.25
mol氧气,根据可知,有1
mol经质子膜进入正极区,D正确。
12.答案:C
解析:该装置属于原电池,将化学能转变为电能,A错误;原电池正极上发生得电子的还原反应,正极的电极反应式为,B错误;每生成1mol,负极就有2mol铝失电子,共失去6mol电子,所以有6mol电子流过负载,C正确;该原电池的总反应为,生成的草酸铝难溶于水,所以随着反应的进行草酸盐浓度保持不变,D错误。
13.答案:B
解析:A项,现有工业合成氨的反应条件是高温、高压、催化剂,则题述方法合成氨条件更为温和,同时可将化学能转化为电能,正确;B项,阴(正)极区,在固氮酶催化作用下发生反应,错误;C项,由B项分析可知正极区被还原为,正确;D项,原电池工作时,质子()通过交换膜由负极区向正极区移动,正确。
14.答案:A
解析:放电时Pb在负极失电子,电极反应式为,
A正确;充电时铅酸蓄电池的正极要恢复原状,则应该作电解池的阳极,与电源极相连,B错误;放电时得电子,发生还原反应,生成
C错误;充电时的阴极反应式为,D错误。
15.答案:A
解析:正极得电子发生还原反应,电极反应式为,A项错误;在时,铝作负极,溶液中的向Cu电极移动,B项正确;由题图可知,时刻电流方向发生改变,说明电池的负极发生变化,所以时,负极的电极反应式为,C项正确;时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应,D项正确。
16.答案:(1)a;还原
(2)乙
(3);
(4)0.5
解析:(1)根据题目提供的总反应方程式可知,
作氧化剂,发生还原反应,故石墨a是正极。
(2)电池工作时,向负极移动,即向乙烧杯移动。
(3)甲烧杯中的电极反应式为;乙烧杯中的电极反应式。
(4)溶液中的浓度由变为,由于溶液的体积未变,则反应过程中生成的的物质的量为,故转移的电子为0.1
mol×5=0.5
mol。
17.答案:(1)①④
(2)、
(3)
(4)溶液呈红色,白色沉淀溶解(或大部分溶解)
解析:电解溶液,阴极(A极)上水电离出的放电生成,同时增大,生成,溶液变为黄色;阳极(B极)上水电离出的放电生成,同时增大,生成,溶液仍保持红色;将电解液倒入烧杯内,则与混合,导致沉淀溶解,且溶液恢复红色。
18.答案:(1)①正
②
③2.8
④不变
(2)能;溶液变为,可继续电解溶液,相当于电解水
解析:
(1)①接通电源一段时间后,乙中c电极质量增加,说明c电极表面析出Cu,则该电极为阴极,从而推知M端为电源的负极,N端为电源的正极。②电极b为阳极,用惰性电极电解NaOH溶液,阳极上放电生成,电极反应为。③用惰性电极电解溶液相当于电解水,设电解过程中消耗水的质量为,据电解前后溶质的质量不变可得,解得,则电解过程中消耗水的物质的量为,转移电子的物质的量为0.5mol,故电极b上生成的在标准状况下的体积为。④丙中用情性电极电解溶液相当于电解水,电解过程中增大,但溶液的pH不变。
(2)当电解过程中铜全部析出时,溶液变为溶液,继续电解则为电解溶液,相当于电解水。
19.答案:(1)电解池;原电池
(2)阴极
(3)a;
(4)
(5)Cu;
解析:(1)E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应,则E是金属铝,所以F是金属镁,乙是原电池,甲是电解池。
(2)铝电极是负极,镁电极是正极,所以D是阴极,C是阳极,B是阴极,A是阳极。
(3)C是阳极,电极反应为,产生的能将氧化为,遇到淀粉变蓝色。
(4)F是正极,溶液呈碱性,所以电极反应为。
(5)当电路中通过0.02
mol电子时,B电极上沉积0.64
g金属X。根据的化学式可知X的化合价为+2价,则转移0.02
mo1电子时生成0.01
mol
X,所以,X为Cu。甲池为电解池,A、B为石墨电极,所以电解溶液的化学方程式为。
20.答案:(1)
(2)紫色向D极方向移动
(3)变大
(4)
解析:断开,闭合、,通直流电,A、B,C、D处是电解原理的应用,依据A、B中气体体积变化分析,电解的是水,A端产生的是氧气,为电解池的阳极,B端产生的是氢气,为电解池的阴极,则a为电源的负极,b为电源正极。
(1)断开,闭合、,通直流电,试管B中产生的气体为氢气。
(2)浸有硫酸钠溶液的滤纸和电极C、D与电源构成了电解池,因为a是负极,b是正极,所以C是阴极,D是阳极,电解质溶液中的钾离子向阴极移动,高锰酸根离子向阳极移动,则紫色向D极方向移动;电解质溶液中氢离子和氢氧根离子放电,所以在两极上都产生气体。
(3)电解KOH溶液时,实际上是电解水,KOH不参加反应,所以KOH的物质的量不变,水的量减少,导致KOH溶液的浓度增大。
(4)A、B中均有气体包围电极,此时切断、,闭合,检流计有指数,说明构成原电池,有氢气的电极是负极,有氧气的电极是正极,正极上氧气得电子和水反应生成氢氧根离子。
(
1
)
(二)---原电池与电解池
一、单选题
1.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为,在此电池放电时,正极上发生反应的物质是(
)
A.
Ag
B.
C.
D.Zn
2.下列关于各装置图的叙述不正确的是(
)
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是溶液
B.图②装置盐桥中的移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
3.下列关于金属腐蚀的说法正确的是(
)
A.金属在潮湿空气中腐蚀的实质是:
B.金属的化学腐蚀的实质是,该过程有电流产生
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐蚀
4.a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。a、b相连时,电流由a经导线流向b;c、d相连时,电子由d到c;a、c相连时,a极上产生大量气泡;b、d相连时,移向d极。则四种金属的活动性由强到弱的顺序为(
)
A.a>b>c
>d
B.
a>c>d>b
C.c>a>b>d
D.b>d>c>a
5.某燃料电池可实现NO和CO的无害转化,其结构如图所示。下列说法正确的是(
)
A.石墨Ⅰ电极上发生氧化反应
B.电池工作时向石墨Ⅱ电极处移动
C.石墨Ⅱ电极上的反应式为
D.电路中每通过6mol电子,生成1mol
6.浓差电池是电化学电池的一种。一般所说的原电池在电池工作时都有某种化学变化发生,因而被称为化学电池;浓差电池虽然也经历了氧化还原过程,但电池的总反应中并没有反映出这种变化,它是通过一种物质从高浓度状态向低浓度状态的转移而获得电动势。如图是利用硫酸铜溶液构成的浓差电池的示意图,下列说法错误的是(
)
A.电池需采用阳离子交换膜
B.左室发生反应:
C.左室流出的硫酸铜溶液物质的量浓度低于2mol/L
D.工作一段时间后右室电极质量减轻
7.高铁酸钠()是一种新型绿色水处理剂。工业上可用电解浓NaOH溶液制备,其工作原理如图所示,两端隔室中离子不能进入中间隔室。下列说法错误的是(
)
A.阳极反应为
B.甲溶液可循环利用
C.离子交换膜a是阴离子交换膜
D.当电路中通过2
mol电子的电量时,会有1
mol生成
8.如图所示,甲池的总反应式为,下列说法正确是(
)
A.甲池是将电能转化为化学能的装置,乙、丙池是将化学能转化电能的装置
B.甲池通入的电极的电极反应式为
C.反应一段时间后,向乙池中加入一定量固体能使溶液恢复到原浓度
D.甲池中消耗280mL(标准状况下),丙池中理论上最多产生1.45g固体
9.用滴有酚酞和氯化钠溶液的湿润滤纸分别做甲、乙两个实验,下列判断不正确的是(
)
A.b极附近有气泡冒出
B.d极附近出现红色
C.a、c极上都发生氧化反应
D.甲中的铁比乙中的铁更易被腐蚀
10.工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是(
)
已知:①在弱酸性溶液中发生水解;②氧化性:(高浓度)>>(低浓度)。
A.碳棒上发生的电极反应:
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的电解过程中需要控制废水的pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解总反应的方程式发生改变
11.工业废气经资源化利用后可回收能量并得到单质硫。反应原理为。燃料电池的工作原理如图所示。
下列有关说法不正确的是(
)
A.电极a为电池的负极
B.电极b上的电极反应式为
C.若电路中通过2
mol电子,则电池内部释放632
kJ热能
D.若有17
g参与反应,则会有1
mol经质子膜进入正极区
12.2016年十大创新科技之一的碳呼吸电池的原理如下图所示。已知草酸铝难溶于水,则下列说法正确的是(
)
A.该装置将电能转变为化学能
B.正极的电极反应式为
C.每生成1mol,有6mol电子流过负载
D.随着反应的进行草酸盐浓度不断减小
13.利用生物燃料电池原理研究室温下氨的合成,电池工作时在电极与酶之间传递电子,示意图如下所示。下列说法错误的是(
)
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应
C.正极区,固氮酶为催化剂,发生还原反应生成
D.电池工作时质子通过交换膜由负极区向正极区移动
14.铅酸蓄电池是常见的二次电池,电池总反应为,下列说法正确的是(
)
A.放电时的负极反应式为
B.充电时铅酸蓄电池的正极与外接电源的负极相连
C.放电时发生氧化反应
D.充电时的阴极反应式为
15.常温下,将除去表面氧化膜的Al、Cu片插入浓中组成原电池(如图1),测得原电池的电流强度随时间的变化如图2所示,已知时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是(
)
A.
时,正极的电极反应式为
B.
时,溶液中的向Cu电极移动
C.时,负极的电极反应式为
D.时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
二、填空题
16.某研究性学习小组根据反应设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为,溶液的体积均为200mL,盐桥中装有饱和溶液。
回答下列问题:
(1)此原电池的正极是石墨
(填“a”或“b"”),发生
反应。
(2)电池工作时,盐桥中的移向
(填“甲”或“乙”)烧杯。
(3)写出两烧杯中的电极反应式:
甲
,
乙
。
(4)若不考虑溶液的体积变化,浓度变为,则反应中转移的电子
mol。
17.下图是一个用铂丝作电极电解稀溶液的装置,电解液中加有中性红色指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸性—红色,碱性—黄色)
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是_________(填编号)。
①A极附近溶液由红变黄
②B极附近溶液由红变黄
③A极附近溶液不变色
④B极附近溶液不变色
(2)写出A极发生的电极反应式:__________________。
(3)写出B极发生的电极反应式:__________________。
(4)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是__________________。
18.如图所示装置中,甲、乙、丙三个烧杯分别盛放100g
5%
NaOH溶液、足量溶液和100g
10%
溶液,电极均为石墨电极。
(1)接通电源,一段时间后,测得丙中溶液的质量分数为10.47%,乙中c电极质量增加。则
①电源的N端为
极;
②电极b上发生的电极反应为
;
③电极b上生成的气体在标准状况下的体积为
L;
④电解前后丙中溶液的pH
(填“增大”“减小”或“不变”)。
(2)乙装置中如果电解过程中铜全部析出,此时电解能否继续进行
(填“能”或“不能”),原因是
。
三、实验题
19.如图所示,
X是一种生活中常见的金属元素,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间(实验中所有溶液均足量)。
(1)甲池是_____________(填“原电池”或“电解池”,下同)装置;乙池是______________装置。
(2)D极为___________(填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是_____________(填“a”或“b”);
C极上的电极反应为_____________。
(4)F极上的电极反应为___________________。
(5)当电路中通过0.02
mol电子时,B电极上沉积0.64
g金属X,则X为____________(填元素符号),甲池中发生反应的化学方程式为_______________。
20.在如图所示的装置中,试管A、B中的电极为多孔的惰性电极;C、
D为两个铂夹,夹在被溶液浸湿的滤纸条上,滤纸条的中部滴有一滴液滴;电源有a、b两极。若在A、B中充满0.01
mol/L的KOH溶液后倒立于装有同浓度的KOH溶液的水槽中,断开,闭合、,通直流电,实验现象如图所示:
回答下列问题:
(1)断开,闭合、,通直流电,试管B中产生的气体为___________(填化学式)。
(2)在溶液浸湿的滤纸条中部的液滴处现象为_______________。
(3)断开,闭合、,通直流电较长一段时间后,
KOH溶液的浓度______________(填“变大”“变小”或“不变”)。
(4)电解一段时间后,A、B中均有气体包围电极。此时切断、,闭合,检流计有指数,此时该装置A试管中电极上发生的反应为______________。
参考答案
1.答案:C
解析:放电时,正极上发生还原反应,发生反应的物质是。
2.答案:B
解析:根据装置图中电流方向可知,a极为阳极、b极为阴极,铁上镀铜时,Cu为阳极、Fe为阴极,电解质溶液可以是溶液,A正确;双液铜锌原电池中,Zn为负极、Cu为正极,原电池工作时,阳离子移向正极、阴离子移向负极,即盐桥中的移向左烧杯,B错误;图③装置是外加电流法防腐,其中钢闸门接外加电源的负极、作阴极,发生还原反应,C正确;图④中两装置均为原电池,左侧装置中Al为负极,电极反应为,右侧装置中Zn为负极,电极反应为,装置中通过导线的电子数相同时,消耗负极材料的关系为,消耗负极材料的物质的量不同,D正确。
3.答案:D
解析:金属在潮湿的空气中发生吸氧腐蚀,正极上氧气得电子发生还原反应,所以没有氢气生成,A错误;金属的化学腐蚀实质是,是金属直接和氧化剂反应的过程,该过程中没有电流产生,
B错误;金属的化学腐蚀在酸性和碱性条件下均有可能进行,C错误;在潮湿的中性环境中,负极上金属失电子被腐蚀,正极上氧气得电子,即金属的电化学腐蚀主要是吸氧腐蚀,D正确。
4.答案:D
解析:
a、b相连时,电流由a经导线流向b,则a为正极,b的金属活动性强于a;c、d相连时,电子由d到c,所以c上得电子发生还原反应,故d的金属活动性强于c;a、c相连时,a极上产生大量气泡,a上得电子发生还原反应,所以c上失电子发生氧化反应,故c的金属活劲性强于a;b、d相连时,移向d极,所以d是正极,b是负极,b的金属活动性强于d,所以a、b、c、d四种金属的活动性由强到弱的顺序为b>d>c>a。
5.答案:C
解析:石墨Ⅰ电极上NO发生反应生成,氮元素化合价降低,属于还原反应,A错误;电池工作时向正极移动,即向石墨Ⅰ电极处移动,B错误;石墨Ⅱ为负极,发生还原反应,反应式为,C正确;氮元素化合价由+2价降低为0价,每生成1mol得到4mol电子,则电路中每通过6mol电子,生成1.5mol,D错误。
6.答案:A
解析:左室得电子生成Cu,硫酸根离子浓度相对较大,右室Cu电极失去电子生成,浓度相对较大,所以硫酸根离子通过离子交换膜由左室移向右室,即离子交换膜为阴离子交换膜,A错误;该浓差电池中,左室溶液浓度高,发生反应,因而左室为正极区,右室为负极区,B正确;左室溶液中得电子生成Cu,所以左室流岀的硫酸铜溶液物质的量浓度低于2mol/L,C正确;该浓差电池中,右室为负极区,电极反应式为,所以原电池工作一段时间后右室电极质量减轻,D正确。
7.答案:C
解析:A项,阳极发生氧化反应,电极反应为,正确;B项,阴极发生还原反应,水电离出的氢离子放电生成氢气,甲溶液为浓的氢氧化钠溶液,可循环利用,正确;C项,电解池中阳离子向阴极移动,通过离子交换膜a的是,故离子交换膜a为阳离子交换膜,错误;D项,阴极发生还原反应,电极反应为,当电路中通过2
mol电子的电量时,会有1
mol
生成,正确。
8.答案:D
解析:
A项,甲池是燃料电池,属于原电池,是将化学能转化为电能的装置,乙、丙池属于电解池,是将电能转化为化学能的装置,错误。B项,甲池是燃料电池,通入的电极是电池的负极,发生氧化反应,因电解质是氢氧化钾,所以该电极反应不会生成氢离子,错误。C项,乙中电解足量硫酸铜溶液时,阳极生成氧气,阴极析出金属铜,所以要让电解质溶液在电解后恢复到原浓度,应加入氧化铜,错误。D项,甲池中正极发生的电极反应为,消耗280mL(标准状况下)即0.0125
mol,转移电子的物质的量为0.05mol;丙池中阴极上得电子生成氢气,产生的与结合生成沉淀,则丙池中生成固体的质量为58g/mol×0.025mol=1.45g,正确。
9.答案:A
解析:题图甲构成原电池,题图乙为电解池,b极是正极,电极反应为,所以无气泡冒出,A错误;题图乙中d极上电极反应为,d极附近溶液呈碱性,酚酞遇碱变红,B正确;是原电池的负极,发生氧化反应,c是电解池的阳极,发生氧化反应,所以a、c极上都发生氧化反应,C正确;甲中的铁
是原电池的负极被腐蚀,而乙中的铁是电解池的阴极被保护,所以甲中的铁比乙中的铁更易被腐蚀,D正确。
10.答案:B
解析:由题图知,碳棒与电源正极相连是电解池的阳极,电极反应为,A正确;镀镍铁棒与电源负极相连是电解池的阴极,电极反应为,电解过程中为平衡A、C中的电荷,A中的和C中的分别通过阳离子膜和阴离子膜移向B中,则B中NaCl溶液的物质的量浓度不断增大,B错误;因在弱酸性溶液中易发生水解,氧化性:(高浓度)>>(低浓度),为了提高Ni的产率,电解过程中需要控制废水的pH,C正确;若将题图中阳离子交换膜去掉,由于先放电,则移向阳极放电:,电解总反应的方程式会发生改变,D正确。
11.答案:C
解析:由,得出负极失电子发生氧化反应,则电极a为电池的负极,A正确;正极得电子发生还原反应,所以电极b上发生的电极反应为,B正确;电路中每通过2
mol电子,则消耗0.5
mol氧气,但该装置将化学能转化为电能,所以电池内部几乎不放出热量,C错误;每17
g
即0.5
mol参与反应,则消耗0.25
mol氧气,根据可知,有1
mol经质子膜进入正极区,D正确。
12.答案:C
解析:该装置属于原电池,将化学能转变为电能,A错误;原电池正极上发生得电子的还原反应,正极的电极反应式为,B错误;每生成1mol,负极就有2mol铝失电子,共失去6mol电子,所以有6mol电子流过负载,C正确;该原电池的总反应为,生成的草酸铝难溶于水,所以随着反应的进行草酸盐浓度保持不变,D错误。
13.答案:B
解析:A项,现有工业合成氨的反应条件是高温、高压、催化剂,则题述方法合成氨条件更为温和,同时可将化学能转化为电能,正确;B项,阴(正)极区,在固氮酶催化作用下发生反应,错误;C项,由B项分析可知正极区被还原为,正确;D项,原电池工作时,质子()通过交换膜由负极区向正极区移动,正确。
14.答案:A
解析:放电时Pb在负极失电子,电极反应式为,
A正确;充电时铅酸蓄电池的正极要恢复原状,则应该作电解池的阳极,与电源极相连,B错误;放电时得电子,发生还原反应,生成
C错误;充电时的阴极反应式为,D错误。
15.答案:A
解析:正极得电子发生还原反应,电极反应式为,A项错误;在时,铝作负极,溶液中的向Cu电极移动,B项正确;由题图可知,时刻电流方向发生改变,说明电池的负极发生变化,所以时,负极的电极反应式为,C项正确;时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应,D项正确。
16.答案:(1)a;还原
(2)乙
(3);
(4)0.5
解析:(1)根据题目提供的总反应方程式可知,
作氧化剂,发生还原反应,故石墨a是正极。
(2)电池工作时,向负极移动,即向乙烧杯移动。
(3)甲烧杯中的电极反应式为;乙烧杯中的电极反应式。
(4)溶液中的浓度由变为,由于溶液的体积未变,则反应过程中生成的的物质的量为,故转移的电子为0.1
mol×5=0.5
mol。
17.答案:(1)①④
(2)、
(3)
(4)溶液呈红色,白色沉淀溶解(或大部分溶解)
解析:电解溶液,阴极(A极)上水电离出的放电生成,同时增大,生成,溶液变为黄色;阳极(B极)上水电离出的放电生成,同时增大,生成,溶液仍保持红色;将电解液倒入烧杯内,则与混合,导致沉淀溶解,且溶液恢复红色。
18.答案:(1)①正
②
③2.8
④不变
(2)能;溶液变为,可继续电解溶液,相当于电解水
解析:
(1)①接通电源一段时间后,乙中c电极质量增加,说明c电极表面析出Cu,则该电极为阴极,从而推知M端为电源的负极,N端为电源的正极。②电极b为阳极,用惰性电极电解NaOH溶液,阳极上放电生成,电极反应为。③用惰性电极电解溶液相当于电解水,设电解过程中消耗水的质量为,据电解前后溶质的质量不变可得,解得,则电解过程中消耗水的物质的量为,转移电子的物质的量为0.5mol,故电极b上生成的在标准状况下的体积为。④丙中用情性电极电解溶液相当于电解水,电解过程中增大,但溶液的pH不变。
(2)当电解过程中铜全部析出时,溶液变为溶液,继续电解则为电解溶液,相当于电解水。
19.答案:(1)电解池;原电池
(2)阴极
(3)a;
(4)
(5)Cu;
解析:(1)E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应,则E是金属铝,所以F是金属镁,乙是原电池,甲是电解池。
(2)铝电极是负极,镁电极是正极,所以D是阴极,C是阳极,B是阴极,A是阳极。
(3)C是阳极,电极反应为,产生的能将氧化为,遇到淀粉变蓝色。
(4)F是正极,溶液呈碱性,所以电极反应为。
(5)当电路中通过0.02
mol电子时,B电极上沉积0.64
g金属X。根据的化学式可知X的化合价为+2价,则转移0.02
mo1电子时生成0.01
mol
X,所以,X为Cu。甲池为电解池,A、B为石墨电极,所以电解溶液的化学方程式为。
20.答案:(1)
(2)紫色向D极方向移动
(3)变大
(4)
解析:断开,闭合、,通直流电,A、B,C、D处是电解原理的应用,依据A、B中气体体积变化分析,电解的是水,A端产生的是氧气,为电解池的阳极,B端产生的是氢气,为电解池的阴极,则a为电源的负极,b为电源正极。
(1)断开,闭合、,通直流电,试管B中产生的气体为氢气。
(2)浸有硫酸钠溶液的滤纸和电极C、D与电源构成了电解池,因为a是负极,b是正极,所以C是阴极,D是阳极,电解质溶液中的钾离子向阴极移动,高锰酸根离子向阳极移动,则紫色向D极方向移动;电解质溶液中氢离子和氢氧根离子放电,所以在两极上都产生气体。
(3)电解KOH溶液时,实际上是电解水,KOH不参加反应,所以KOH的物质的量不变,水的量减少,导致KOH溶液的浓度增大。
(4)A、B中均有气体包围电极,此时切断、,闭合,检流计有指数,说明构成原电池,有氢气的电极是负极,有氧气的电极是正极,正极上氧气得电子和水反应生成氢氧根离子。
(
1
)
