2020—2021学年高中化学鲁科版有机化学基础第三章《有机合成及其应用 合成高分子化合物》单元测试卷 含解析
文档属性
| 名称 | 2020—2021学年高中化学鲁科版有机化学基础第三章《有机合成及其应用 合成高分子化合物》单元测试卷 含解析 |

|
|
| 格式 | docx | ||
| 文件大小 | 326.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-19 17:45:16 | ||
图片预览




文档简介
第三章《有机合成及其应用
合成高分子化合物》单元测试卷
一、单选题(共15小题)
1.实下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是( )
①②③④⑤CH3CH2OH
⑥C6H12O6⑦CH3COOH
⑧硬脂酸甘油酯
⑨蛋白质
⑩聚乙烯
A.
能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B.
投入钠能产生H2的是⑤⑦⑧⑨
C.
属于高分子材料的是⑧⑨⑩
D.
含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
2.化学与工农业生产和人类生活密切相关,下列说法中不正确的是( )
A.
硫酸铝钾[KAl(SO4)2]可用作净水剂
B.
海轮外壳上镶入锌块,可减缓船体的腐蚀
C.
聚氯乙烯塑料袋可用于包装食品
D.
减少化石燃料使用,有利于降低空气中pM2.5(直径2.5μm以下细颗粒物)的含量
3.能在有机物分子中引入羟基的反应类型有:①酯化
②取代
③消去
④加成⑤水解
⑥氧化,其中正确的组合是( )
A.
①②③⑥
B.
④⑤
C.
②④⑤⑥
D.
②④⑥
4.化学已渗透到人类生活的各个方面,下列说法不正确的是( )
A.
国家有关部门提出超市、商场等场所限制使用塑料制品可以减少“白色污染”
B.
可以用Si3N4、Al2O3制作高温结构陶瓷制品
C.
在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
D.
禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染
5.某软质隐形眼镜材料为如图所示的聚合物,下列有关说法错误的是( )
A.
生成该聚合物的反应属于加聚反应
B.
该聚合物的单体是丙酸乙酯
C.
该聚合物分子中存在大量的﹣OH,所以具有较好的亲水性
D.
该聚合物的结构筒式为:
6.化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
A.
绿色荧光蛋白质(GFP)是高分子化合物,不可降解,其水溶液有丁达尔效应
B.
五彩缤纷的北京奥运会焰火利用了“焰色反应”原理
C.
三聚氰胺分子结构如图所示,分子式是C3H6N6
D.
氮化硅、光导纤维、氧化铝陶瓷等属于新型无机非金属材料
7.下列物质中不属于新型有机高分子材料的是( )
A.
高分子分离膜
B.
液晶高分子材料
C.
生物高分子材料
D.
有机玻璃
8.由CH2=CH2→CH3CH2Cl→CH3CH2OH→CH3CHO→CH3COOH的转化过程中,经过的反应为( )
A.
加成→消去→氧化→取代
B.
消去→取代→氧化→加成
C.
加成→取代→消去→氧化
D.
加成→取代→氧化→氧化
9.国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成聚全氟乙丙烯,下列说法错误的是( )
A.
ETFE分子中可能存在“﹣CH2﹣CH2﹣CF2﹣CF2﹣”的连接方式
B.
聚全氟乙丙烯分子的结构简式可能为
C.
四氟乙烯分子中含有极性键和非极性键,六氟丙烯中所有原子不可能共平面
D.
合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应
10.下列说法中不正确的是( )
A.
高吸水性树脂属于功能高分子材料
B.
SiC,Al2O3的熔点很高,可用作高温结构陶瓷
C.
光导纤维、合成纤维和人造纤维都是有机高分子化合物
D.
合金拓展了金属材料的使用范围,合金中也可能含有非金属元素
11.如图表示取1mol乙烯雌酚进行的4个实验,下列对实验数据的预测正确的是( )
A.
①中生成7
mol
H2O
B.
②中生成2
mol
CO2
C.
③最多消耗3
mol
Br2
D.
④中最多消耗7
mol
H2
12.下列描述正确的是( )
A.
我国首创用CO2合成可降塑料聚二氧化碳,使用该塑料可减少白色污染
B.
超临界流体是介于气态和液态之间的一种状态,故超临界流体CO2是合成的新物质
C.
澳大利亚开发出被称为第五形态的固体碳——“纳米泡沫”,其形似海绵,密度极小并有磁性.可以预见,这种新材料的化学性质与金钢石完全不同
D.
雷达微波过滤器里使用的铁氧磁性体,如钇铁石榴石Y3Fe5O12(Y:ⅢB族、+3价),其组成可表示为Y3O5?Fe3O4?Fe2O3
13.加热聚丙烯费塑料可以得到碳、氢气、甲烷、乙烯、苯和甲苯,用图所示装置探究废旧塑料的再利用,下列叙述不正确的是( )
A.
装置乙的试管中可收集到芳香烃
B.
装置丙中的试剂可吸收烯烃以制取卤代烃
C.
最后收集的气体可做燃料
D.
聚丙烯的链节是﹣CH2﹣CH2﹣CH2﹣
14.乙酸甲酯(CH3COOCH3)核磁共振氢谱的峰数为( )
A.
1
B.
2
C.
3
D.
4
15.叶蝉散(isoprocard)对水稻叶蝉和飞虱具有较强的触杀作用,防效迅速,但残效不长.工业上用邻异丙基苯酚合成叶蝉散的过程如下:
下列有关说法正确的是( )
A.
叶蝉散的分子式是C11H16NO2
B.
邻异丙基苯酚发生了取代反应
C.
叶蝉散在强酸、强碱性环境中能稳定存在
D.
可用FeCl3检验叶蝉散中是否含邻异丙基苯酚
二、实验题(共3小题)
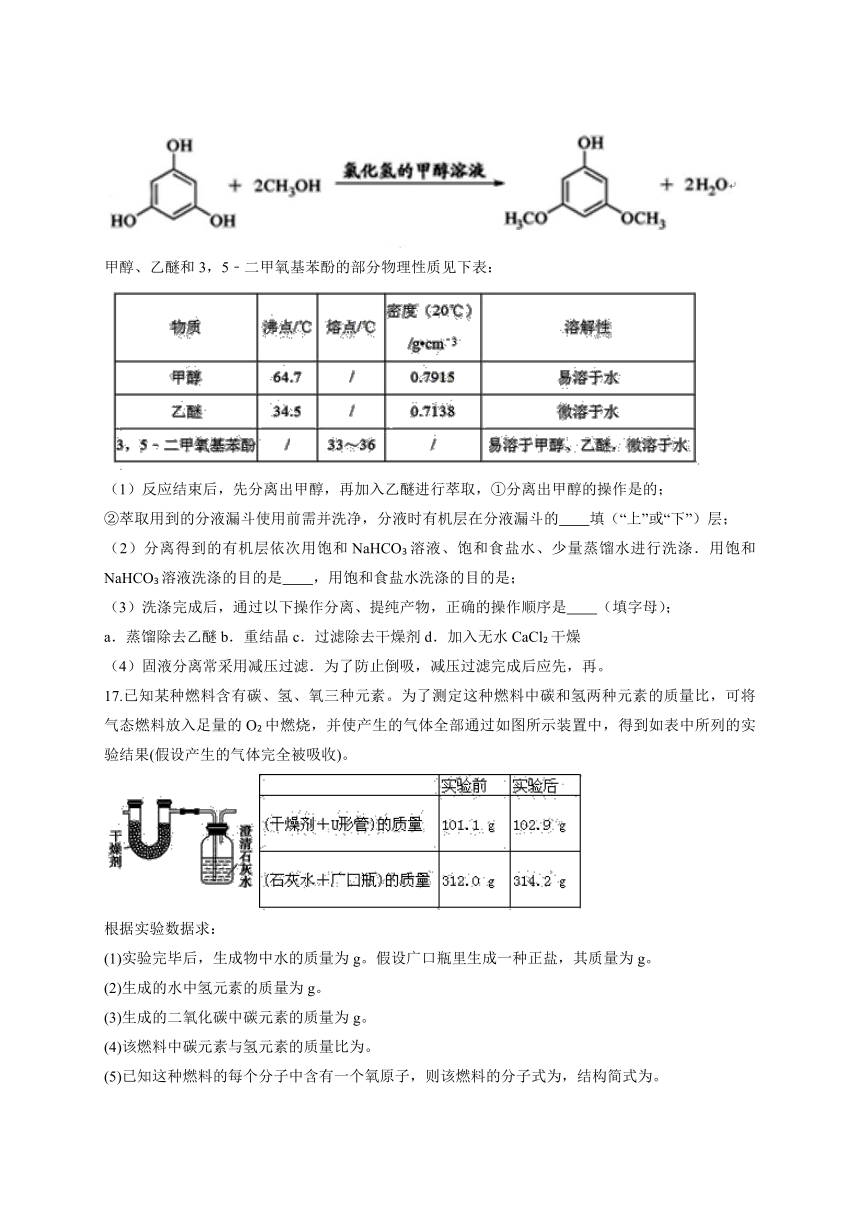
16.3,5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:
甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的;
②萃取用到的分液漏斗使用前需并洗净,分液时有机层在分液漏斗的 填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是 ,用饱和食盐水洗涤的目的是;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是 (填字母);
a.蒸馏除去乙醚
b.重结晶
c.过滤除去干燥剂
d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先,再。
17.已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
根据实验数据求:
(1)实验完毕后,生成物中水的质量为g。假设广口瓶里生成一种正盐,其质量为g。
(2)生成的水中氢元素的质量为g。
(3)生成的二氧化碳中碳元素的质量为g。
(4)该燃料中碳元素与氢元素的质量比为。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为,结构简式为。
18.金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_________变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_________(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:
请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_________;
②实验室常采用_________操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_________;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止_________(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_________污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用________ 方法区分尼龙和蚕丝。
三、填空题(共3小题)
19.现有2.3g某有机物A完全燃烧后,生成0.1molCO2和2.7gH2O,测得该化合物的蒸汽与空气的相对密度是1.586,(已知空气的相对密度为29);
(1)求该有机物的分子式;
(2)若该有机物是合成酯的一种原料,试写出它的结构式。
20.核磁共振氢谱是研究有机物结构的有力手段之一.例如乙醛的结构简式为CH3-CHO,在核磁共振氢谱中有两个峰,其峰面积之比为3:1。
(1)结构式为的有机物,在核磁共振氢谱上吸收峰的面积之比为
________________;
(2)某含氧有机物,其质谱图中最大质荷比为46.0,碳的质量分数为52.2%,氢的质量分数为13.0%,核磁共振氢谱中只有一个吸收峰,则该有机物的相对分子质量为
_________________,其结构简式是
_________________。
21.玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂有苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中_________加入甲醛,且反应釜应装有_________装置;
(2)玻璃纤维由玻璃拉丝得到.普通玻璃是由石英砂、_________和石灰石(或长石)高温熔融而成,主要反应的化学方程式为_________;
(3)玻璃钢中玻璃纤维的作用是_________;玻璃钢具有_________等优异性能(写出亮点即可);
(4)下列处理废旧热固性酚醛塑料的做法合理的是_________;
a.深埋
b.粉碎后用作树脂填料
c.用作燃料
d.用有机溶剂将其溶解,回收树脂
答案解析
1.【答案】D
【解析】A.①苯和⑩聚乙烯中不含碳碳双键或者三键,不能与溴发生加成反应,故A错误;B.⑧硬脂酸甘油酯官能团为酯基不能与钠反应,故B错误;
C.⑧硬脂酸甘油酯不是高分子化合物,不属于高分子材料,故C错误;
D.苯是一种有毒的液体,分子式为C6H6,含碳量高,点燃时有浓烟,故D正确。
2.【答案】C
【解析】A.硫酸铝钾可水解生成具有吸附性的氢氧化铝胶体,可用于净水,故A正确;
B.锌比铁活泼,海轮外壳上镶入锌块,为牺牲阳极的阴极保护法,可减缓船体的腐蚀,故B正确;
C.聚氯乙烯塑料中的增塑剂有毒,不能用于包装食品,故C错误;
D.减少化石燃料使用,可减少颗粒物的排放,故D正确。
3.【答案】C
【解析】①酯化反应是消除羟基,不会引入羟基,故不选;
②取代反应可以引入羟基,例如卤代烃的水解反应、酯的水解反应,故选;
③消去反应是消除羟基,不会引入羟基,故不选;
④加成反应可以引入羟基,例如乙烯水化制乙醇,故选;
⑤水解反应可引入羟基,如酯的水解反应生成醇,故选;
⑥氧化反应可可引入羟基,如醛的氧化生成羧酸,故选,故选C。
4.【答案】C
【解析】A.限制塑料制品的使用可以节约能源,减少白色污染,故A正确;
B.因氮化硅陶瓷、三氧化二铝陶瓷为常见的新型陶瓷材料,故B正确;
C.因铁铜相比,铁更活泼,由原电池原理可知铁更易发生氧化发应而损耗,则利用牺牲阳极的阴极保护法来保护闸门,故C错误;
D.因铅能使人体中毒,则禁止使用四乙基铅作汽油防爆剂来减少铅污染,故D正确。
5.【答案】B
6.【答案】A
【解析】A,胶体具有丁达尔效应,绿色荧光蛋白质(GFP)其水溶液属于胶体,但蛋白质能够通过水解反应而降解,故A错误;
B,不同元素的焰色反应其颜色不同,焰火五颜六色的颜色,利用了“焰色反应”原理,故B正确;
C,根据三聚氰胺分子的结构简式可得化学式为C3H6N6,故C正确;
D,氮化硅、光导纤维、氧化铝陶瓷的成分是无机化合物,则等属于新型无机非金属材料,故D正确。
7.【答案】D
【解析】高分子分离膜、液晶高分子材料、生物高分子材料属于新型有机高分子材料,有机玻璃属于传统有机高分子材料,故选D。
8.【答案】D
【解析】由CH2=CH2→CH3CH2Cl→CH3CH2OH→CH3CHO→CH3COOH合成流程可知,先发生烯烃的加成、再发生卤代烃水解(也属于取代反应),然后连续氧化生成乙酸,
即合成中涉及的反应为加成→取代→氧化→氧化,故选D。
9.【答案】B
【解析】A.CF2=CF2、CH2=CH2的链节分别为:﹣CF2﹣CF2﹣、﹣CH2﹣CH2﹣,故A正确;
B.B项结构简式中,﹣CF3﹣中碳原子超过4个价键,其链节为﹣CF2﹣CF2﹣CF(CF3)﹣或﹣CF2﹣CF2﹣CF(CF3)﹣CF2﹣,故B错误;
C.CF2=CF2中C﹣F键为极性共价键,C=C键为非极性共价键,六氟丙烯中有一个﹣CF3,﹣CF3具有甲烷的结构特点,因此所有原子不可能处于同一平面上,故C正确;
D.CF3CF=CF2与CF2=CF2加聚反应生成聚全氟乙丙烯,故D正确。
10.【答案】C
【解析】A.高吸水性树脂属于功能高分子材料,故A正确;
B.SiC,Al2O3的熔点很高,可做高温陶瓷,故B正确;
C.人造纤维、合成纤维都是有机高分子化合物,光导纤维的成分是二氧化硅,不是有机高分子化合物,故C错误;
D.合金是由两种或两种以上的金属与金属(或非金属)经一定方法所合成的具有金属特性的物质,合金材料中一定有金属,也可能含有非金属元素,故D正确。
11.【答案】D
【解析】A.1mol己烯雌酚中含22molH,由H原子守恒可知,①中生成11mol
H2O,故A错误;
B.酚﹣OH与碳酸氢钠溶液不反应,则②中无CO2生成,故B错误;
C.酚﹣OH的邻、对位均可与溴发生取代反应,则③中最多消耗4mol
Br2,故C错误;
D.苯环与C=C双键都能与氢气发生加成反应,1mol己烯雌酚与氢气发生加成反应,最多消耗7mol氢气,故D正确。
12.【答案】A
【解析】A.聚二氧化碳可降解,所以使用过程中不会产生白色污染可减少白色污染,故A正确;
B.超临界二氧化碳与CO2,二者结构不变,只是分子间距发生变化,属于同一物质,只是物理性质与二氧化碳气体有所不同,不是合成的新物质,故B错误;
C.纳米泡沫碳与金刚石都是碳元素的不同单质,是同素异形体,化学性质相似,故C错误;
D.因Y是ⅢB族稀土元素,则Y元素的化合价为+3价,根据化合物中元素正负化合价的代数和为0,设铁元素的化合价为x,则(+3)×3+5x+(﹣2)×12=0,解得x=+3,即铁元素的化合价也为+3价,故D错误。
13.【答案】D
14.【答案】B
【解析】乙酸甲酯(CH3COOCH3)中有2种氢原子,核磁共振氢谱中有2种峰,故选B。
15.【答案】D
【解析】A.由结构简式可知,1个分子中含有15个H原子,则叶蝉散的分子式是C11H15NO2,故A错误;
B.由合成反应可知,﹣OH上O﹣H碱断裂,与﹣CONCH3中C=N键发生加成反应,故B错误;
C.分子中含有﹣OCONH﹣结构,能水解,则叶蝉散在强酸、强碱性环境中不能稳定存在,故C错误;
D.邻异丙基苯酚遇氯化铁溶液显紫色,而叶蝉散不能,现象不同,则可用FeCl3检验叶蝉散中是否含邻异丙基苯酚,故D正确。
16.【答案】(1)①蒸馏②检漏 上
(2)除去HCl
除去少量NaHCO3且减少产物损失
(3)dcab
(4)拆去连接抽气泵和吸滤瓶的橡皮管
关闭抽气泵
【解析】(1)①根据图表知,甲醇和乙醚的能互溶,但沸点不同,所以可以采用蒸馏的方法分离出甲醇;
②分液漏斗在使用前要进行检漏,当分液漏斗不漏时才能使用,根据密度知,有机层的密度小于水,在上方;
(2)因为混合物中含有氯化氢,氯化氢能和碳酸氢钠反应,所以为除去氯化氢用饱和NaHCO3溶液洗涤,碳酸氢钠易溶于水,为除去剩余的碳酸氢钠用饱和食盐水洗涤且不减少产物的损失;
(3)洗涤完成后,为除去水分,用无水氯化钙干燥,然后过滤除去干燥剂,再根据沸点不同利用蒸馏的方法除去乙醚,最后再利用重结晶的方法制得较纯产物,所以其排列顺序为:dcab;
(4)为了防止倒吸,减压过滤完成后要先拆去连接抽气泵和吸滤瓶的橡皮管再关闭抽气泵。
17.【答案】(1)1.8 5 (2)0.2 (3)0.6 (4)3∶1
(5)CH4O CH3OH
【解析】由题意知,燃料燃烧生成的H2O和CO2分别被干燥剂和澄清石灰水吸收,二者的增重量即为燃烧时产生的H2O和CO2的质量。
(1)m(H2O)=102.9
g-101.1
g=1.8
g,m(CO2)=314.2
g-312.0
g=2.2
g。反应生成的正盐CaCO3质量为m(CaCO3)=×100=5
g。
(2)m(H)=×2=0.2
g
(3)m(C)=×12=0.6
g
(4)m(C)∶m(H)=0.6
g∶0.2
g=3∶1
(5)燃料中n(C)∶n(H)=∶=1∶4
所以燃料的分子式为CH4O,结构简式为CH3OH。
18.【答案】(1)化学;锌块(2)①复分解反应
②过滤
③高温灼烧会使碳酸钙分解,所得的碳酸钙含有杂质氧化钙而不纯
④CaO+H2O═Ca(OH)2
(3)白色污染;灼烧
【解析】(1)根据反应过程:贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,有新物质生成所以是化学变化,根据金属活动顺序表,比金属铁活泼的金属是锌;
(2)①硝酸钙与碳酸铵在溶液中反应生成硝酸铵和碳酸钙沉淀,化合物之间交换成分,属于复分解反应;
②固体和液体的分离采用过滤的方法;
③高温灼烧条件下碳酸钙会分解生成氧化钙和二氧化碳气体,所得的碳酸钙含有杂质氧化钙而不纯;
④氧化钙和水反应会生成氢氧化钙,所以在高纯氧化钙生产过程中一定要保持“干燥”;
(3)可降解塑料不会导致白色污染,蚕丝主要成分是蛋白质燃烧会有焦羽毛味,人造丝因含有硫元素往往会燃烧后有刺鼻气味,且冒黑烟,生活中可采用灼烧的方法区分尼龙和蚕丝。
19.【答案】分子式为C2H6O,结构简式为CH3CH2OH
【解析】(1)n(CO2)=0.1mol,则2.3g有机物中:n(C)=n(CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,n(H2O)==0.15mol,则2.3g有机物中:n(H)=2n(H2O)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,因(1.2g+0.3g)<2.3g,所以有机物中还应还用O元素,且m(O)=2.3g-1.2g-0.3g=0.8g,n(O)==0.05mol,则有机物中:n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,所以该有机物的最简式为C2H6O,测得该化合物的蒸汽与空气的相对密度是1.586,则M=29×1.586=46,而C2H6O的相对分子质量为46,所以,该有机物的分子式为C2H6O;
(2)若该有机物是合成酯的一种原料,则该有机物为乙醇,结构简式为:CH3CH2OH。
20.【答案】(1)1:1:1:1:1(2)46
CH3-O-CH3
【解析】(1)是对称结构,有5种氢原子,都是1个氢原子,吸收峰的面积之比为1:1:1:1:1,故答案为:1:1:1:1:1;
(2)最大质荷比为46.0,测该有机物的相对分子质量为46;碳原子数:=2;氢原子数:=6,核磁共振氢谱中只有一个吸收峰说明只有一个氢原子,结构简式是CH3-O-CH3。
21.【答案】(1)间歇性、散热
(2)纯碱;Na2CO3+SiO2Na2SiO3+CO2↑、CaCO3+SiO2CaSiO3+CO2↑
(3)增强体
强度高、质量轻(或耐腐蚀、抗冲击、绝缘性能好等)
(4)bc
合成高分子化合物》单元测试卷
一、单选题(共15小题)
1.实下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是( )
①②③④⑤CH3CH2OH
⑥C6H12O6⑦CH3COOH
⑧硬脂酸甘油酯
⑨蛋白质
⑩聚乙烯
A.
能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B.
投入钠能产生H2的是⑤⑦⑧⑨
C.
属于高分子材料的是⑧⑨⑩
D.
含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
2.化学与工农业生产和人类生活密切相关,下列说法中不正确的是( )
A.
硫酸铝钾[KAl(SO4)2]可用作净水剂
B.
海轮外壳上镶入锌块,可减缓船体的腐蚀
C.
聚氯乙烯塑料袋可用于包装食品
D.
减少化石燃料使用,有利于降低空气中pM2.5(直径2.5μm以下细颗粒物)的含量
3.能在有机物分子中引入羟基的反应类型有:①酯化
②取代
③消去
④加成⑤水解
⑥氧化,其中正确的组合是( )
A.
①②③⑥
B.
④⑤
C.
②④⑤⑥
D.
②④⑥
4.化学已渗透到人类生活的各个方面,下列说法不正确的是( )
A.
国家有关部门提出超市、商场等场所限制使用塑料制品可以减少“白色污染”
B.
可以用Si3N4、Al2O3制作高温结构陶瓷制品
C.
在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
D.
禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染
5.某软质隐形眼镜材料为如图所示的聚合物,下列有关说法错误的是( )
A.
生成该聚合物的反应属于加聚反应
B.
该聚合物的单体是丙酸乙酯
C.
该聚合物分子中存在大量的﹣OH,所以具有较好的亲水性
D.
该聚合物的结构筒式为:
6.化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
A.
绿色荧光蛋白质(GFP)是高分子化合物,不可降解,其水溶液有丁达尔效应
B.
五彩缤纷的北京奥运会焰火利用了“焰色反应”原理
C.
三聚氰胺分子结构如图所示,分子式是C3H6N6
D.
氮化硅、光导纤维、氧化铝陶瓷等属于新型无机非金属材料
7.下列物质中不属于新型有机高分子材料的是( )
A.
高分子分离膜
B.
液晶高分子材料
C.
生物高分子材料
D.
有机玻璃
8.由CH2=CH2→CH3CH2Cl→CH3CH2OH→CH3CHO→CH3COOH的转化过程中,经过的反应为( )
A.
加成→消去→氧化→取代
B.
消去→取代→氧化→加成
C.
加成→取代→消去→氧化
D.
加成→取代→氧化→氧化
9.国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成聚全氟乙丙烯,下列说法错误的是( )
A.
ETFE分子中可能存在“﹣CH2﹣CH2﹣CF2﹣CF2﹣”的连接方式
B.
聚全氟乙丙烯分子的结构简式可能为
C.
四氟乙烯分子中含有极性键和非极性键,六氟丙烯中所有原子不可能共平面
D.
合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应
10.下列说法中不正确的是( )
A.
高吸水性树脂属于功能高分子材料
B.
SiC,Al2O3的熔点很高,可用作高温结构陶瓷
C.
光导纤维、合成纤维和人造纤维都是有机高分子化合物
D.
合金拓展了金属材料的使用范围,合金中也可能含有非金属元素
11.如图表示取1mol乙烯雌酚进行的4个实验,下列对实验数据的预测正确的是( )
A.
①中生成7
mol
H2O
B.
②中生成2
mol
CO2
C.
③最多消耗3
mol
Br2
D.
④中最多消耗7
mol
H2
12.下列描述正确的是( )
A.
我国首创用CO2合成可降塑料聚二氧化碳,使用该塑料可减少白色污染
B.
超临界流体是介于气态和液态之间的一种状态,故超临界流体CO2是合成的新物质
C.
澳大利亚开发出被称为第五形态的固体碳——“纳米泡沫”,其形似海绵,密度极小并有磁性.可以预见,这种新材料的化学性质与金钢石完全不同
D.
雷达微波过滤器里使用的铁氧磁性体,如钇铁石榴石Y3Fe5O12(Y:ⅢB族、+3价),其组成可表示为Y3O5?Fe3O4?Fe2O3
13.加热聚丙烯费塑料可以得到碳、氢气、甲烷、乙烯、苯和甲苯,用图所示装置探究废旧塑料的再利用,下列叙述不正确的是( )
A.
装置乙的试管中可收集到芳香烃
B.
装置丙中的试剂可吸收烯烃以制取卤代烃
C.
最后收集的气体可做燃料
D.
聚丙烯的链节是﹣CH2﹣CH2﹣CH2﹣
14.乙酸甲酯(CH3COOCH3)核磁共振氢谱的峰数为( )
A.
1
B.
2
C.
3
D.
4
15.叶蝉散(isoprocard)对水稻叶蝉和飞虱具有较强的触杀作用,防效迅速,但残效不长.工业上用邻异丙基苯酚合成叶蝉散的过程如下:
下列有关说法正确的是( )
A.
叶蝉散的分子式是C11H16NO2
B.
邻异丙基苯酚发生了取代反应
C.
叶蝉散在强酸、强碱性环境中能稳定存在
D.
可用FeCl3检验叶蝉散中是否含邻异丙基苯酚
二、实验题(共3小题)
16.3,5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:
甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的;
②萃取用到的分液漏斗使用前需并洗净,分液时有机层在分液漏斗的 填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是 ,用饱和食盐水洗涤的目的是;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是 (填字母);
a.蒸馏除去乙醚
b.重结晶
c.过滤除去干燥剂
d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先,再。
17.已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
根据实验数据求:
(1)实验完毕后,生成物中水的质量为g。假设广口瓶里生成一种正盐,其质量为g。
(2)生成的水中氢元素的质量为g。
(3)生成的二氧化碳中碳元素的质量为g。
(4)该燃料中碳元素与氢元素的质量比为。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为,结构简式为。
18.金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_________变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_________(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:
请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_________;
②实验室常采用_________操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_________;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止_________(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_________污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用________ 方法区分尼龙和蚕丝。
三、填空题(共3小题)
19.现有2.3g某有机物A完全燃烧后,生成0.1molCO2和2.7gH2O,测得该化合物的蒸汽与空气的相对密度是1.586,(已知空气的相对密度为29);
(1)求该有机物的分子式;
(2)若该有机物是合成酯的一种原料,试写出它的结构式。
20.核磁共振氢谱是研究有机物结构的有力手段之一.例如乙醛的结构简式为CH3-CHO,在核磁共振氢谱中有两个峰,其峰面积之比为3:1。
(1)结构式为的有机物,在核磁共振氢谱上吸收峰的面积之比为
________________;
(2)某含氧有机物,其质谱图中最大质荷比为46.0,碳的质量分数为52.2%,氢的质量分数为13.0%,核磁共振氢谱中只有一个吸收峰,则该有机物的相对分子质量为
_________________,其结构简式是
_________________。
21.玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂有苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中_________加入甲醛,且反应釜应装有_________装置;
(2)玻璃纤维由玻璃拉丝得到.普通玻璃是由石英砂、_________和石灰石(或长石)高温熔融而成,主要反应的化学方程式为_________;
(3)玻璃钢中玻璃纤维的作用是_________;玻璃钢具有_________等优异性能(写出亮点即可);
(4)下列处理废旧热固性酚醛塑料的做法合理的是_________;
a.深埋
b.粉碎后用作树脂填料
c.用作燃料
d.用有机溶剂将其溶解,回收树脂
答案解析
1.【答案】D
【解析】A.①苯和⑩聚乙烯中不含碳碳双键或者三键,不能与溴发生加成反应,故A错误;B.⑧硬脂酸甘油酯官能团为酯基不能与钠反应,故B错误;
C.⑧硬脂酸甘油酯不是高分子化合物,不属于高分子材料,故C错误;
D.苯是一种有毒的液体,分子式为C6H6,含碳量高,点燃时有浓烟,故D正确。
2.【答案】C
【解析】A.硫酸铝钾可水解生成具有吸附性的氢氧化铝胶体,可用于净水,故A正确;
B.锌比铁活泼,海轮外壳上镶入锌块,为牺牲阳极的阴极保护法,可减缓船体的腐蚀,故B正确;
C.聚氯乙烯塑料中的增塑剂有毒,不能用于包装食品,故C错误;
D.减少化石燃料使用,可减少颗粒物的排放,故D正确。
3.【答案】C
【解析】①酯化反应是消除羟基,不会引入羟基,故不选;
②取代反应可以引入羟基,例如卤代烃的水解反应、酯的水解反应,故选;
③消去反应是消除羟基,不会引入羟基,故不选;
④加成反应可以引入羟基,例如乙烯水化制乙醇,故选;
⑤水解反应可引入羟基,如酯的水解反应生成醇,故选;
⑥氧化反应可可引入羟基,如醛的氧化生成羧酸,故选,故选C。
4.【答案】C
【解析】A.限制塑料制品的使用可以节约能源,减少白色污染,故A正确;
B.因氮化硅陶瓷、三氧化二铝陶瓷为常见的新型陶瓷材料,故B正确;
C.因铁铜相比,铁更活泼,由原电池原理可知铁更易发生氧化发应而损耗,则利用牺牲阳极的阴极保护法来保护闸门,故C错误;
D.因铅能使人体中毒,则禁止使用四乙基铅作汽油防爆剂来减少铅污染,故D正确。
5.【答案】B
6.【答案】A
【解析】A,胶体具有丁达尔效应,绿色荧光蛋白质(GFP)其水溶液属于胶体,但蛋白质能够通过水解反应而降解,故A错误;
B,不同元素的焰色反应其颜色不同,焰火五颜六色的颜色,利用了“焰色反应”原理,故B正确;
C,根据三聚氰胺分子的结构简式可得化学式为C3H6N6,故C正确;
D,氮化硅、光导纤维、氧化铝陶瓷的成分是无机化合物,则等属于新型无机非金属材料,故D正确。
7.【答案】D
【解析】高分子分离膜、液晶高分子材料、生物高分子材料属于新型有机高分子材料,有机玻璃属于传统有机高分子材料,故选D。
8.【答案】D
【解析】由CH2=CH2→CH3CH2Cl→CH3CH2OH→CH3CHO→CH3COOH合成流程可知,先发生烯烃的加成、再发生卤代烃水解(也属于取代反应),然后连续氧化生成乙酸,
即合成中涉及的反应为加成→取代→氧化→氧化,故选D。
9.【答案】B
【解析】A.CF2=CF2、CH2=CH2的链节分别为:﹣CF2﹣CF2﹣、﹣CH2﹣CH2﹣,故A正确;
B.B项结构简式中,﹣CF3﹣中碳原子超过4个价键,其链节为﹣CF2﹣CF2﹣CF(CF3)﹣或﹣CF2﹣CF2﹣CF(CF3)﹣CF2﹣,故B错误;
C.CF2=CF2中C﹣F键为极性共价键,C=C键为非极性共价键,六氟丙烯中有一个﹣CF3,﹣CF3具有甲烷的结构特点,因此所有原子不可能处于同一平面上,故C正确;
D.CF3CF=CF2与CF2=CF2加聚反应生成聚全氟乙丙烯,故D正确。
10.【答案】C
【解析】A.高吸水性树脂属于功能高分子材料,故A正确;
B.SiC,Al2O3的熔点很高,可做高温陶瓷,故B正确;
C.人造纤维、合成纤维都是有机高分子化合物,光导纤维的成分是二氧化硅,不是有机高分子化合物,故C错误;
D.合金是由两种或两种以上的金属与金属(或非金属)经一定方法所合成的具有金属特性的物质,合金材料中一定有金属,也可能含有非金属元素,故D正确。
11.【答案】D
【解析】A.1mol己烯雌酚中含22molH,由H原子守恒可知,①中生成11mol
H2O,故A错误;
B.酚﹣OH与碳酸氢钠溶液不反应,则②中无CO2生成,故B错误;
C.酚﹣OH的邻、对位均可与溴发生取代反应,则③中最多消耗4mol
Br2,故C错误;
D.苯环与C=C双键都能与氢气发生加成反应,1mol己烯雌酚与氢气发生加成反应,最多消耗7mol氢气,故D正确。
12.【答案】A
【解析】A.聚二氧化碳可降解,所以使用过程中不会产生白色污染可减少白色污染,故A正确;
B.超临界二氧化碳与CO2,二者结构不变,只是分子间距发生变化,属于同一物质,只是物理性质与二氧化碳气体有所不同,不是合成的新物质,故B错误;
C.纳米泡沫碳与金刚石都是碳元素的不同单质,是同素异形体,化学性质相似,故C错误;
D.因Y是ⅢB族稀土元素,则Y元素的化合价为+3价,根据化合物中元素正负化合价的代数和为0,设铁元素的化合价为x,则(+3)×3+5x+(﹣2)×12=0,解得x=+3,即铁元素的化合价也为+3价,故D错误。
13.【答案】D
14.【答案】B
【解析】乙酸甲酯(CH3COOCH3)中有2种氢原子,核磁共振氢谱中有2种峰,故选B。
15.【答案】D
【解析】A.由结构简式可知,1个分子中含有15个H原子,则叶蝉散的分子式是C11H15NO2,故A错误;
B.由合成反应可知,﹣OH上O﹣H碱断裂,与﹣CONCH3中C=N键发生加成反应,故B错误;
C.分子中含有﹣OCONH﹣结构,能水解,则叶蝉散在强酸、强碱性环境中不能稳定存在,故C错误;
D.邻异丙基苯酚遇氯化铁溶液显紫色,而叶蝉散不能,现象不同,则可用FeCl3检验叶蝉散中是否含邻异丙基苯酚,故D正确。
16.【答案】(1)①蒸馏②检漏 上
(2)除去HCl
除去少量NaHCO3且减少产物损失
(3)dcab
(4)拆去连接抽气泵和吸滤瓶的橡皮管
关闭抽气泵
【解析】(1)①根据图表知,甲醇和乙醚的能互溶,但沸点不同,所以可以采用蒸馏的方法分离出甲醇;
②分液漏斗在使用前要进行检漏,当分液漏斗不漏时才能使用,根据密度知,有机层的密度小于水,在上方;
(2)因为混合物中含有氯化氢,氯化氢能和碳酸氢钠反应,所以为除去氯化氢用饱和NaHCO3溶液洗涤,碳酸氢钠易溶于水,为除去剩余的碳酸氢钠用饱和食盐水洗涤且不减少产物的损失;
(3)洗涤完成后,为除去水分,用无水氯化钙干燥,然后过滤除去干燥剂,再根据沸点不同利用蒸馏的方法除去乙醚,最后再利用重结晶的方法制得较纯产物,所以其排列顺序为:dcab;
(4)为了防止倒吸,减压过滤完成后要先拆去连接抽气泵和吸滤瓶的橡皮管再关闭抽气泵。
17.【答案】(1)1.8 5 (2)0.2 (3)0.6 (4)3∶1
(5)CH4O CH3OH
【解析】由题意知,燃料燃烧生成的H2O和CO2分别被干燥剂和澄清石灰水吸收,二者的增重量即为燃烧时产生的H2O和CO2的质量。
(1)m(H2O)=102.9
g-101.1
g=1.8
g,m(CO2)=314.2
g-312.0
g=2.2
g。反应生成的正盐CaCO3质量为m(CaCO3)=×100=5
g。
(2)m(H)=×2=0.2
g
(3)m(C)=×12=0.6
g
(4)m(C)∶m(H)=0.6
g∶0.2
g=3∶1
(5)燃料中n(C)∶n(H)=∶=1∶4
所以燃料的分子式为CH4O,结构简式为CH3OH。
18.【答案】(1)化学;锌块(2)①复分解反应
②过滤
③高温灼烧会使碳酸钙分解,所得的碳酸钙含有杂质氧化钙而不纯
④CaO+H2O═Ca(OH)2
(3)白色污染;灼烧
【解析】(1)根据反应过程:贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,有新物质生成所以是化学变化,根据金属活动顺序表,比金属铁活泼的金属是锌;
(2)①硝酸钙与碳酸铵在溶液中反应生成硝酸铵和碳酸钙沉淀,化合物之间交换成分,属于复分解反应;
②固体和液体的分离采用过滤的方法;
③高温灼烧条件下碳酸钙会分解生成氧化钙和二氧化碳气体,所得的碳酸钙含有杂质氧化钙而不纯;
④氧化钙和水反应会生成氢氧化钙,所以在高纯氧化钙生产过程中一定要保持“干燥”;
(3)可降解塑料不会导致白色污染,蚕丝主要成分是蛋白质燃烧会有焦羽毛味,人造丝因含有硫元素往往会燃烧后有刺鼻气味,且冒黑烟,生活中可采用灼烧的方法区分尼龙和蚕丝。
19.【答案】分子式为C2H6O,结构简式为CH3CH2OH
【解析】(1)n(CO2)=0.1mol,则2.3g有机物中:n(C)=n(CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,n(H2O)==0.15mol,则2.3g有机物中:n(H)=2n(H2O)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,因(1.2g+0.3g)<2.3g,所以有机物中还应还用O元素,且m(O)=2.3g-1.2g-0.3g=0.8g,n(O)==0.05mol,则有机物中:n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,所以该有机物的最简式为C2H6O,测得该化合物的蒸汽与空气的相对密度是1.586,则M=29×1.586=46,而C2H6O的相对分子质量为46,所以,该有机物的分子式为C2H6O;
(2)若该有机物是合成酯的一种原料,则该有机物为乙醇,结构简式为:CH3CH2OH。
20.【答案】(1)1:1:1:1:1(2)46
CH3-O-CH3
【解析】(1)是对称结构,有5种氢原子,都是1个氢原子,吸收峰的面积之比为1:1:1:1:1,故答案为:1:1:1:1:1;
(2)最大质荷比为46.0,测该有机物的相对分子质量为46;碳原子数:=2;氢原子数:=6,核磁共振氢谱中只有一个吸收峰说明只有一个氢原子,结构简式是CH3-O-CH3。
21.【答案】(1)间歇性、散热
(2)纯碱;Na2CO3+SiO2Na2SiO3+CO2↑、CaCO3+SiO2CaSiO3+CO2↑
(3)增强体
强度高、质量轻(或耐腐蚀、抗冲击、绝缘性能好等)
(4)bc
