第4节几种重要的盐(第2课时)
图片预览







文档简介
(共26张PPT)
一、盐的制取
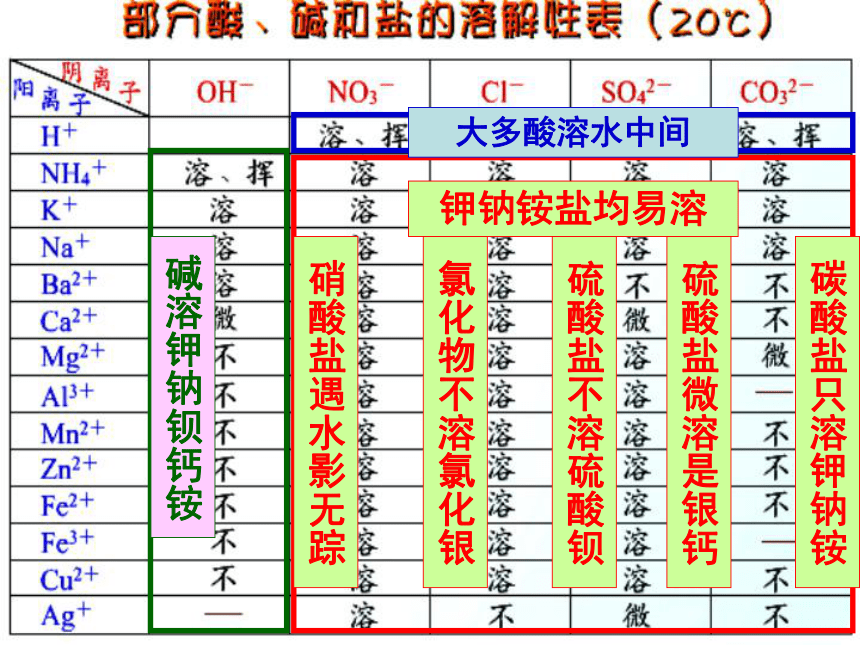
1.盐的溶解性
(1).根据盐的溶解性的不同可将盐分为
_________盐和_______盐。
(2).常见盐的溶解性表:
可溶性
不溶性
碱溶钾钠钡钙铵
大多酸溶水中间
钾钠铵盐均易溶
硝酸盐遇水影无踪
氯化物不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾钠铵
硫酸盐微溶是银钙
记忆规律:
可溶性盐:钾盐(含K+)、钠盐(含Na+)
大部分碳酸盐如CaCO3、BaCO3、MgCO3等
铵盐(含NH4+)、硝酸盐(含NO3-)
硫酸钡BaSO4、 氯化银AgCI
不可溶性盐:
不溶性碱:
如Fe(OH)3、Cu(OH)2、Mg(OH)2等
可溶性碱:
KOH 、NaOH 、Ba(OH)2
Ca(OH)2 、NH3.H2O
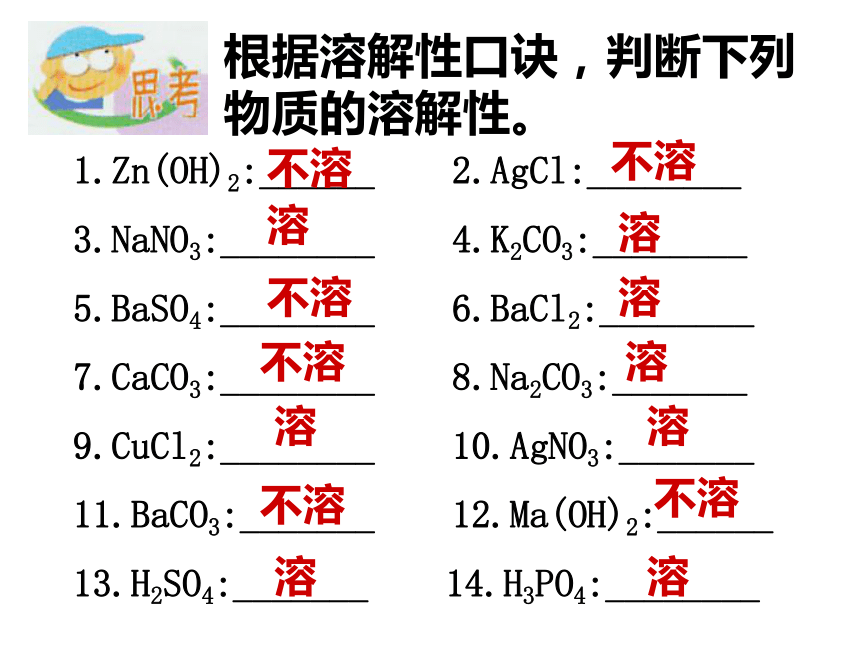
根据溶解性口诀,判断下列物质的溶解性。
1.Zn(OH)2:______ 2.AgCl:________
3.NaNO3:________ 4.K2CO3:________
5.BaSO4:________ 6.BaCl2:________
7.CaCO3:________ 8.Na2CO3:_______
9.CuCl2:________ 10.AgNO3:_______
11.BaCO3:_______ 12.Ma(OH)2:______
13.H2SO4:_______ 14.H3PO4:________
不溶
不溶
不溶
不溶
不溶
不溶
溶
溶
溶
溶
溶
溶
溶
溶
根据酸的共性和碱的共性,以及盐的有关性质,你知道可以用哪些方法制取盐?
2.盐的制取
(1)有些盐是天然存在的。如:食盐、纯碱等,但有些是用化学方法制取。
侯氏联合制碱法
向浓氨水中通入足量的二氧化碳生成碳铵,再加入食盐粉未充分搅拌,由于碳酸氢钠在该状态下的溶解度较其他物质要少得多,便呈晶体析出;最后将析出的碳酸氢钠加热便制得了纯碱;请写出该过程的化学方程式并注明反应类型;指出该过程中反应的起始原料和最终产物.
侯德榜
1、酸+金属=盐+氢气
(2)制取盐的化学途经:
7、盐+盐=新盐+新盐
8、金属+盐=新金属+新盐(下节学习)
6、碱+非金属氧化物=盐+水
5、碱+盐=新碱+新盐
4、酸+盐=新酸+新盐
3、酸+碱=盐+水
2、酸+金属氧化物=盐+水
制硝酸钡:
1、酸+碱
2、酸+盐
4、盐+盐
3、碱+盐
HNO3 +Ba(OH)2
HNO3 +Ba CO3
Ba(OH)2 + Cu(NO3 )2
Ba Cl 2 + Ag NO3
碳酸钠与氯化钙反应原理分析:
Na2CO3溶液中含有离子
2Na+
CO32-
CaCl2溶液中含有离子
Ca2+
2Cl—
Na2CO3+CaCl2 = CaCO3↓+ 2NaCl
2Na++CO32-+Ca2++2Cl-==CaCO3↓+2Na++2Cl-
KNO3溶液中含有离子
K+
NO3-
NaCl溶液中含有离子
Na+
Cl-
K+ + NO3- + Na+ + Cl- = Na++ NO3- + K+ + Cl-
KNO3
NaCl
=
+
KCl
NaNO3
+
反应 反应物条件 生成物条件
酸+金氧→盐+水
酸+碱→盐+水
酸+盐→酸+盐
碱+盐→碱+盐
盐+盐→盐+盐
复分解反应及发生条件 AB + CD = AD + CB
(1)发生范围:酸.碱.盐.金属氧化物四大类物质之间
(2)反应进行的环境:大多数在水溶液中进行
生成沉
淀或气
体或水
盐可以不溶
酸应是强酸
碱可以不溶
金氧可以不溶
两者均可溶
两者均可溶
思考1:农作物正常生长发育和开花结果需要哪些外界条件?
充足的光照.水分.空气.适宜的温度.无机盐等(营养元素)做养料.
思考2:主要是需要哪几种营养元素作养料
N、P、K
N.P.K养料的来源:
1.有些来自于自然界的一些物质:土壤中的矿物质.动物的粪便.草木灰等.
2.有些来自于人工合成:如化学肥料(化肥).
化肥:用矿物.空气.水等做原料,经过化学加工精制而成,能为农作物的生长提供养料的一些盐,称为化学肥料,简称为“化肥”.
“庄稼一枝花,全靠肥当家”
2.化肥的类型:
氮肥 含有氮元素的化肥
磷肥 含有磷元素的化肥
钾肥 含有钾元素的化肥
复合肥 含有两种或两种以上
主要营养元素的化肥
写一写:写出只含有N或P或K元素的盐;
写出既含有N元素又含有K元素的盐;
写出既含有P元素又含有K元素的盐;
写出既含有N元素又含有P元素的盐。
氮肥
磷肥
钾肥
复合肥料
(NH4)2SO4
NH4HCO3
NaNO3
NH4Cl
Ca(H2PO4)2
k3PO4
K2SO4
KCl
K2CO3
kNO3
(NH4)3PO4
NH4NO3
请把对应的化肥类型的线条连起来:
正常
缺氮
正常
缺磷
正常
缺钾
正常
缺肥
植株矮小,叶色发黄
植株暗绿带红,只开花不结果
茎秆软弱,容易倒伏,叶边缘尖端呈褐色,逐渐焦枯
类型 常见
种类 作用 缺乏症
氮肥
磷肥
钾肥
NH4+.NO3-
尿素CO(NH2)2
过磷酸钙[CaSO4和Ca(H2PO4)2混合物]
含K+的盐如:草木灰K2CO3
能促使农作物的茎叶生长茂盛,含有组成叶绿素的重要元素
植株矮小,叶色发黄
能促使农作物根系发达,增强吸收养分和抗寒抗旱能力,促进作物穗数增多.籽粒饱满
植株暗绿带红,只开花不结果
能促使农作物生长旺盛,茎秆粗壮,增强抗病虫害能力,促进糖和淀粉生成
茎秆软弱,容易倒伏,叶边缘尖端呈褐色,逐渐焦枯
尿素:是一种含氮有机物,人的尿液中就含有,它在微生物的作用下会转变为铵盐或氨气.
施肥原则:
以农家肥为主,化肥为辅.
使用化肥注意:长期使用会造成土壤板结,破坏土壤结构,所以需要施一些农家肥料(有机肥),有利于该良土壤结构,提高土壤肥力。
思考:经常使用化肥有哪些利弊
(1)向硫酸铵浓溶液中滴加氢氧化钠溶液,观察到什么现象
(2)把湿润的红色石蕊试纸放在试管口,试纸颜色是否发生变化 ,变化的原因是什么
产生大量的气泡,产生的气体具有刺激性气味的气体
变蓝
NH3溶于水后形成的氨水溶液呈碱性
(NH4)2SO4+2NaOH==Na2SO4+2H2O+2NH3↑
5.铵盐的性质:
(3)铵盐的性质:铵盐能与碱反应,生成氨气
如:NH4Cl + KOH==
KCl + H2O + NH3↑
NH4HCO3+Ca(OH)2=CaCO3↓+2H2O+NH3↑
思考: 在农村,人们常取少量白色粉末状的化肥和消石灰一起放在手掌心搓,通过闻气味来检验是否是氮肥,这是根据什么原理
注意:使用铵盐作肥料时,不能跟熟石灰等碱混合施用,因为反应放出氨气而失效.
铵盐与氢氧化钙混合加热后,有氨气放出
(4)检验NH4+的方法:
加NaOH等碱溶液,如果产生使湿润的红色石蕊试纸变蓝的刺激性气味气体,则含有NH4+.
(5)工业制法:酸与氨气反应制得
2NH3+H2SO4=(NH4)2SO4(硫铵)
NH3+H2O+CO2=NH4HCO3(碳铵)
盐的组成中:
阳离子不一定
是金属阳离子
(可能NH4+)
课堂练习
1.下列属于复合肥的是( )
A.KH2PO4 B.K2CO3 C.NH4NO3 D.KNO3
2.草木灰是农家肥料,其主要成分是碳酸钾,它属于( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥
3.尿素CO(NH2)2是一种高效化肥,它属于( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
AD
C
A
4.PH>7的土壤中能否施加NH4HCO3 为什么
1.从理论上判断复分解反应能否发生,一般不考虑的因素是( )
A.反应物的溶解性
B.生成物中有无气体.沉淀和水
C.反应物中有无酸碱盐
D.金属活动性强弱
2.思考:硝酸钾.硝酸钠为何一般不参加复分解反应?
3.下列各组在溶液中能大量共存的是( )
A.KOH CuSO4 NaCl B.NaCl Na2CO3 Ba(OH)2
C.Ca(0H)2 KCl H2SO4 D.Na2CO3 KOH NaCl
D
难以形成沉淀.气体或水
D
4.已知某无色溶液中含有硫酸,则该溶液中还可能含有的物质是( )
A.硫酸铜 B.氧化钙 C.硫酸锌 D.氢氧化钠
5.下列各组物质的溶液,不能发生复分解反应是( )
A.HCl和Ca(OH)2 B.Na2CO3和H2SO4 C.AgNO3和BaCl2 D.KCl和CuSO4
6.白色粉末,可能含MgCl2.CuSO4.AgCl.BaSO4.K2CO3中的一种或几种,将粉末溶于水为无色溶液,当加入BaCl2溶液后有白色沉淀产生,再加入过量盐酸,白色沉淀溶解,有气泡放出。
原混合物中一定含有______,一定不含有_______。
C
D
K2CO3
MgCl2.CuSO4.
AgCl.BaSO4
一、盐的制取
1.盐的溶解性
(1).根据盐的溶解性的不同可将盐分为
_________盐和_______盐。
(2).常见盐的溶解性表:
可溶性
不溶性
碱溶钾钠钡钙铵
大多酸溶水中间
钾钠铵盐均易溶
硝酸盐遇水影无踪
氯化物不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾钠铵
硫酸盐微溶是银钙
记忆规律:
可溶性盐:钾盐(含K+)、钠盐(含Na+)
大部分碳酸盐如CaCO3、BaCO3、MgCO3等
铵盐(含NH4+)、硝酸盐(含NO3-)
硫酸钡BaSO4、 氯化银AgCI
不可溶性盐:
不溶性碱:
如Fe(OH)3、Cu(OH)2、Mg(OH)2等
可溶性碱:
KOH 、NaOH 、Ba(OH)2
Ca(OH)2 、NH3.H2O
根据溶解性口诀,判断下列物质的溶解性。
1.Zn(OH)2:______ 2.AgCl:________
3.NaNO3:________ 4.K2CO3:________
5.BaSO4:________ 6.BaCl2:________
7.CaCO3:________ 8.Na2CO3:_______
9.CuCl2:________ 10.AgNO3:_______
11.BaCO3:_______ 12.Ma(OH)2:______
13.H2SO4:_______ 14.H3PO4:________
不溶
不溶
不溶
不溶
不溶
不溶
溶
溶
溶
溶
溶
溶
溶
溶
根据酸的共性和碱的共性,以及盐的有关性质,你知道可以用哪些方法制取盐?
2.盐的制取
(1)有些盐是天然存在的。如:食盐、纯碱等,但有些是用化学方法制取。
侯氏联合制碱法
向浓氨水中通入足量的二氧化碳生成碳铵,再加入食盐粉未充分搅拌,由于碳酸氢钠在该状态下的溶解度较其他物质要少得多,便呈晶体析出;最后将析出的碳酸氢钠加热便制得了纯碱;请写出该过程的化学方程式并注明反应类型;指出该过程中反应的起始原料和最终产物.
侯德榜
1、酸+金属=盐+氢气
(2)制取盐的化学途经:
7、盐+盐=新盐+新盐
8、金属+盐=新金属+新盐(下节学习)
6、碱+非金属氧化物=盐+水
5、碱+盐=新碱+新盐
4、酸+盐=新酸+新盐
3、酸+碱=盐+水
2、酸+金属氧化物=盐+水
制硝酸钡:
1、酸+碱
2、酸+盐
4、盐+盐
3、碱+盐
HNO3 +Ba(OH)2
HNO3 +Ba CO3
Ba(OH)2 + Cu(NO3 )2
Ba Cl 2 + Ag NO3
碳酸钠与氯化钙反应原理分析:
Na2CO3溶液中含有离子
2Na+
CO32-
CaCl2溶液中含有离子
Ca2+
2Cl—
Na2CO3+CaCl2 = CaCO3↓+ 2NaCl
2Na++CO32-+Ca2++2Cl-==CaCO3↓+2Na++2Cl-
KNO3溶液中含有离子
K+
NO3-
NaCl溶液中含有离子
Na+
Cl-
K+ + NO3- + Na+ + Cl- = Na++ NO3- + K+ + Cl-
KNO3
NaCl
=
+
KCl
NaNO3
+
反应 反应物条件 生成物条件
酸+金氧→盐+水
酸+碱→盐+水
酸+盐→酸+盐
碱+盐→碱+盐
盐+盐→盐+盐
复分解反应及发生条件 AB + CD = AD + CB
(1)发生范围:酸.碱.盐.金属氧化物四大类物质之间
(2)反应进行的环境:大多数在水溶液中进行
生成沉
淀或气
体或水
盐可以不溶
酸应是强酸
碱可以不溶
金氧可以不溶
两者均可溶
两者均可溶
思考1:农作物正常生长发育和开花结果需要哪些外界条件?
充足的光照.水分.空气.适宜的温度.无机盐等(营养元素)做养料.
思考2:主要是需要哪几种营养元素作养料
N、P、K
N.P.K养料的来源:
1.有些来自于自然界的一些物质:土壤中的矿物质.动物的粪便.草木灰等.
2.有些来自于人工合成:如化学肥料(化肥).
化肥:用矿物.空气.水等做原料,经过化学加工精制而成,能为农作物的生长提供养料的一些盐,称为化学肥料,简称为“化肥”.
“庄稼一枝花,全靠肥当家”
2.化肥的类型:
氮肥 含有氮元素的化肥
磷肥 含有磷元素的化肥
钾肥 含有钾元素的化肥
复合肥 含有两种或两种以上
主要营养元素的化肥
写一写:写出只含有N或P或K元素的盐;
写出既含有N元素又含有K元素的盐;
写出既含有P元素又含有K元素的盐;
写出既含有N元素又含有P元素的盐。
氮肥
磷肥
钾肥
复合肥料
(NH4)2SO4
NH4HCO3
NaNO3
NH4Cl
Ca(H2PO4)2
k3PO4
K2SO4
KCl
K2CO3
kNO3
(NH4)3PO4
NH4NO3
请把对应的化肥类型的线条连起来:
正常
缺氮
正常
缺磷
正常
缺钾
正常
缺肥
植株矮小,叶色发黄
植株暗绿带红,只开花不结果
茎秆软弱,容易倒伏,叶边缘尖端呈褐色,逐渐焦枯
类型 常见
种类 作用 缺乏症
氮肥
磷肥
钾肥
NH4+.NO3-
尿素CO(NH2)2
过磷酸钙[CaSO4和Ca(H2PO4)2混合物]
含K+的盐如:草木灰K2CO3
能促使农作物的茎叶生长茂盛,含有组成叶绿素的重要元素
植株矮小,叶色发黄
能促使农作物根系发达,增强吸收养分和抗寒抗旱能力,促进作物穗数增多.籽粒饱满
植株暗绿带红,只开花不结果
能促使农作物生长旺盛,茎秆粗壮,增强抗病虫害能力,促进糖和淀粉生成
茎秆软弱,容易倒伏,叶边缘尖端呈褐色,逐渐焦枯
尿素:是一种含氮有机物,人的尿液中就含有,它在微生物的作用下会转变为铵盐或氨气.
施肥原则:
以农家肥为主,化肥为辅.
使用化肥注意:长期使用会造成土壤板结,破坏土壤结构,所以需要施一些农家肥料(有机肥),有利于该良土壤结构,提高土壤肥力。
思考:经常使用化肥有哪些利弊
(1)向硫酸铵浓溶液中滴加氢氧化钠溶液,观察到什么现象
(2)把湿润的红色石蕊试纸放在试管口,试纸颜色是否发生变化 ,变化的原因是什么
产生大量的气泡,产生的气体具有刺激性气味的气体
变蓝
NH3溶于水后形成的氨水溶液呈碱性
(NH4)2SO4+2NaOH==Na2SO4+2H2O+2NH3↑
5.铵盐的性质:
(3)铵盐的性质:铵盐能与碱反应,生成氨气
如:NH4Cl + KOH==
KCl + H2O + NH3↑
NH4HCO3+Ca(OH)2=CaCO3↓+2H2O+NH3↑
思考: 在农村,人们常取少量白色粉末状的化肥和消石灰一起放在手掌心搓,通过闻气味来检验是否是氮肥,这是根据什么原理
注意:使用铵盐作肥料时,不能跟熟石灰等碱混合施用,因为反应放出氨气而失效.
铵盐与氢氧化钙混合加热后,有氨气放出
(4)检验NH4+的方法:
加NaOH等碱溶液,如果产生使湿润的红色石蕊试纸变蓝的刺激性气味气体,则含有NH4+.
(5)工业制法:酸与氨气反应制得
2NH3+H2SO4=(NH4)2SO4(硫铵)
NH3+H2O+CO2=NH4HCO3(碳铵)
盐的组成中:
阳离子不一定
是金属阳离子
(可能NH4+)
课堂练习
1.下列属于复合肥的是( )
A.KH2PO4 B.K2CO3 C.NH4NO3 D.KNO3
2.草木灰是农家肥料,其主要成分是碳酸钾,它属于( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥
3.尿素CO(NH2)2是一种高效化肥,它属于( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
AD
C
A
4.PH>7的土壤中能否施加NH4HCO3 为什么
1.从理论上判断复分解反应能否发生,一般不考虑的因素是( )
A.反应物的溶解性
B.生成物中有无气体.沉淀和水
C.反应物中有无酸碱盐
D.金属活动性强弱
2.思考:硝酸钾.硝酸钠为何一般不参加复分解反应?
3.下列各组在溶液中能大量共存的是( )
A.KOH CuSO4 NaCl B.NaCl Na2CO3 Ba(OH)2
C.Ca(0H)2 KCl H2SO4 D.Na2CO3 KOH NaCl
D
难以形成沉淀.气体或水
D
4.已知某无色溶液中含有硫酸,则该溶液中还可能含有的物质是( )
A.硫酸铜 B.氧化钙 C.硫酸锌 D.氢氧化钠
5.下列各组物质的溶液,不能发生复分解反应是( )
A.HCl和Ca(OH)2 B.Na2CO3和H2SO4 C.AgNO3和BaCl2 D.KCl和CuSO4
6.白色粉末,可能含MgCl2.CuSO4.AgCl.BaSO4.K2CO3中的一种或几种,将粉末溶于水为无色溶液,当加入BaCl2溶液后有白色沉淀产生,再加入过量盐酸,白色沉淀溶解,有气泡放出。
原混合物中一定含有______,一定不含有_______。
C
D
K2CO3
MgCl2.CuSO4.
AgCl.BaSO4
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
