沪科版高一化学下册-7.3.2 盐类水解 教案
文档属性
| 名称 | 沪科版高一化学下册-7.3.2 盐类水解 教案 |

|
|
| 格式 | doc | ||
| 文件大小 | 138.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-22 20:01:10 | ||
图片预览


文档简介
盐类水解(共一课时)
设计思想
1、教材分析
(1)、课标要求
三级主题
学习内容
学
说
明
活动建议
Ⅰ
Ⅱ
Ⅲ
盐类水解
1.概念
2.水解规律
3.水解的方程式
B
B
B
1.学会判别盐溶液的酸碱性。
2.掌握一些常见离子的水解:
NH4+、Al3+、Fe3+、Ac-、CO32-、HCO3-
、S2-。
3.多元弱酸根离子的水解为分步水解(只要掌握CO32-)
4.弱酸弱碱盐,水解规律不作要求。
5.只要求会正确判别水解的方程式。
1.通过实验探究,使学生充分感知不同盐溶液的酸碱性存在差异,进而让学生分析、比较、归纳出盐溶液酸碱性的规律,掌握盐类水解的实质。
2.通过举一些生活中的例子,让学生了解盐类水解在生活中有广泛的应用。
盐类水解
的影响因素
1.影响因素
2.盐类水解的应用
B
B
A
1.运用勒夏特列原理判断水解平衡的移动。
2.能运用盐类水解的原理解释日常生活中的某些现象。
3.理解泡沫灭火器的反应原理。
(2)、教材内容
本节包括三个部分:建立盐类水解的概念;探讨盐类水解的本质和规律;运用盐类水解的知识。其中,盐类水解的概念是基础,旨在揭示盐类水解的实质,并为研究盐类水解规律提供依据。盐类水解的规律是核心,它是盐类水解原理的具体化,并使盐类水解一般概念得以直接应用。盐类水解的利用,则是通过具体的情境及实例,促进对盐类水解及其规律的理解、巩固和深化。本节是前面所学的电解质的电离、水的电离平衡和水的离子积,以及平衡移动原理等知识的综合应用。在进入本节内容的学习前,学生已经掌握了强弱电解质的概念以及水的电离等知识,且具备一定的逻辑推理能力和抽象思维能力。本节课教学设计从实验测定盐溶液pH出发,与已有知识形成认知矛盾,进而深入探究。因此教学流程的安排分三大块:实验探究——理论分析——应用提升,突出学生主体性地位,着重强化对理论分析的严谨推进,让学生以主动的姿态进行科学论证,同时初步掌握对科学理论的基本学习方法。
2、学情分析
在学习了弱电解质的电离以及移动的理论后,学生们在理论上已经能够明白为什么不同盐类的水溶液会呈现不同的酸碱性。本节的教学需要引导学生根据弱电解质的电离来认识盐类水解的实质;从水解后溶液中的C(H+)和C(OH-)的相对大小来判断溶液的酸碱性。
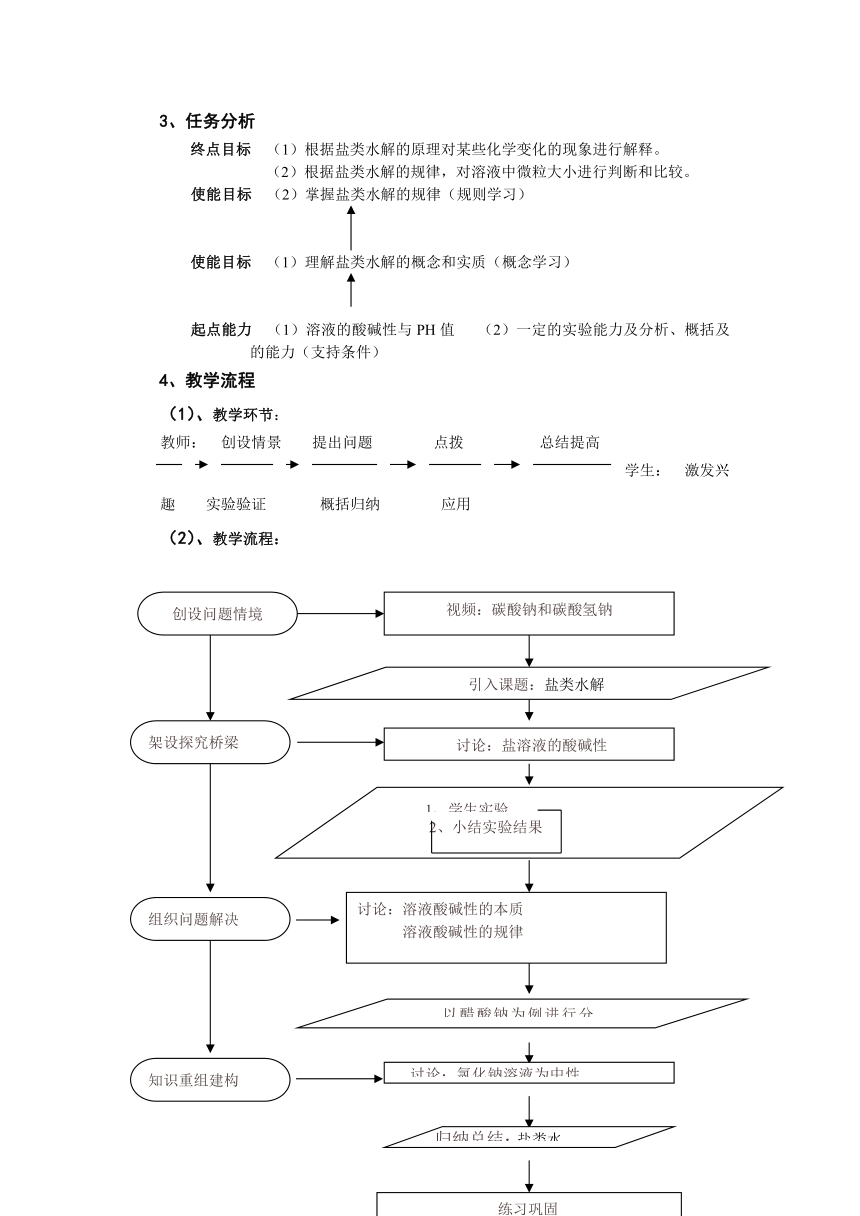
3、任务分析
终点目标
(1)根据盐类水解的原理对某些化学变化的现象进行解释。
(2)根据盐类水解的规律,对溶液中微粒大小进行判断和比较。
使能目标
(2)掌握盐类水解的规律(规则学习)
使能目标
(1)理解盐类水解的概念和实质(概念学习)
起点能力
(1)溶液的酸碱性与PH值
(2)一定的实验能力及分析、概括及的能力(支持条件)
4、教学流程
(1)、教学环节:
教师:
创设情景
提出问题
点拨
总结提高
学生:
激发兴趣
实验验证
概括归纳
应用
(2)、教学流程:
4、教学模式
问题---探究---解决模式
5、教学媒体
实验、多媒体
二、教学目标
1、知识与技能目标
(1)、理解盐类水解的概念和实质,了解盐类水解的特点,掌握盐类水解的规律。
(2)、加强实验探究技能,提高学生的观察能力和动手能力
2、过程与方法目标
通过实验,培养学生的质疑精神,掌握分析盐类水解造成溶液酸碱性的方法,体验盐类水解规律的产生过程。
3、思想与情感目标
(1)、培养学生参与合作精神,学会透过现象看事物的本质。
(2)、养成通过实验进行实证的科学行为方式。
三、教学重点和难点
1、重点
盐类水解概念及规律;体验理论和实验相结合的研究方法。
2、教学难点
水解实质的理解及规律的应用;感悟由个别到一般,由实验到理论再到实验的研究方法
四、教学用品
浓度均为0.1mol/L的CH3COONa、NH4Cl、NaCl、Na2SO4、Na2CO3
、Al2(SO4)3
、KNO3、FeCl3、Na2S、Cu(NO3)2溶液,pH试纸,试管、胶头滴管、表面皿、玻璃棒。
五、教学过程
教学内容
教师活动
学生活动
说明
问题引入
酸溶液中H+浓度大于OH-浓度显酸性;碱溶液中OH-浓度大于H+浓度显碱性。盐溶液呈什么性?
倾听,思考,猜想。
探究实验I
[组织学生进行实验]
[板书]
7.3盐溶液的酸碱性
一、盐溶液的酸碱性
[引导学生得出结论]
实验:用pH试纸测CH3COONa
、NH4Cl
、NaCl三种盐溶液的pH。
盐溶液不一定显中性。
训练学生的化学实验基本操作
探究实验II
盐溶液呈现什么性是否存在规律呢?
思考、猜想
实验:用pH试纸测Na2SO4、Na2CO3
、Al2(SO4)3
、KNO3、FeCl3、Na2S、Cu(NO3)七种盐溶液的pH。并将实验结果填入教材P89“探究与实践”栏目。
总结盐溶液的酸碱性与盐的类型的关系
能否根据实验结果,对表中所列出的九种盐进行分类,从而找出盐溶液酸碱性与盐的类型之间的关系?
[引导学生小结]]
[板书]
强酸强碱盐
溶液pH=7
强酸弱碱盐
溶液pH<7
强碱弱酸盐
溶液pH>7
猜想、讨论、交流
得出结论:
可以将盐分成三种类型:强酸强碱盐、强酸弱碱盐、强碱弱酸盐。
盐的类型与盐溶液酸碱性的关系:
强碱弱酸盐的水溶液显碱性,强酸弱碱盐的水溶液显酸性,强酸强碱盐的水溶液显中性。
分析盐类水解的实质
盐的组成中既不含H+,也不含OH—,水本身是中性的,为什么加进不同的盐之后就会显酸性、碱性或中性呢?
请以氯化铵为例进行分析。
列出浓度为0.1mol/L的氯化铵溶液中离子浓度大小的顺序。
思考
讨论、交流
NH4Cl
+
H2O
NH3·H2O
+
HCl
NH4+
+
H2ONH3·H2O
+
H+
思考,回答
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
[板书]二、盐类的水解
1、盐类水解的本质:在溶液中盐电离出的某种离子与水电离出的H+或OH—结合生成弱电解质的反应。
请分析醋酸钠、氯化钠溶液分别呈碱性和中性的原因
列出浓度为0.1mol/L的醋酸钠、氯化钠溶液中离子浓度大小的顺序。
讨论、分析
CH3COONa
+H2O
CH3COOH
+
NaOH
CH3COO-
+
H2O
CH3COOH
+
OH-
氯化钠是强酸、强碱生成的盐,所以其电离产生的离子不能与水电离出来的H+或OH—结合生成弱电解质,因此不水解。
醋酸钠
c(Na+)>c(Ac-)>c(OH-)>c(H+)
氯化钠
c(Cl-)=c(Na+)>c(H+)=c(OH-)
总结盐类水解的规律
[板书]
弱酸根离子
+
H2O
弱酸
+
OH-
弱碱阳离子
+
H2O
弱碱
+
H+
归纳出水解的规律:
[板书]
2、盐类水解的规律:
有弱才水解,无弱不水解。
谁弱谁水解,谁强显谁性。
思考、讨论、理解。
讨论、分析、倾听、整理、记录。
盐类水解的应用
[课堂练习]
1.判断下列盐的溶液的酸碱性。
(1)CH3COOK
(2)NH4NO3
2.在配制FeCl3溶液时,直接将FeCl3溶解于蒸馏水中,常见溶液略混浊,请分析原因。如何才能配制出澄清的FeCl3溶液?
3.明矾[KAl(SO4)2·12H2O]可以净水是因为明矾在水中生成Al(OH)3,试分析生成Al(OH)3的原因。将明矾溶液与碳酸钠溶液混合在一起,产生大量CO2,可用于灭火。试分析其中的化学原理。
练习,实验验证。
讨论、分析。
[作业]:1、看课本。2、本节书后练习。
2.主要板书
7.3盐溶液的酸碱性
一、盐溶液的酸碱性
强酸强碱盐
溶液pH=7
强酸弱碱盐
溶液pH<7
强碱弱酸盐
溶液pH>7
二、盐类的水解
1、盐类水解的本质:在溶液中盐电离出的某种离子与水电离出的H+或OH—结合生成弱电解质的反应。
中和
酸
+
碱
盐
+
水
水解
弱酸根离子
+
H2O
弱酸
+
OH-
弱碱阳离子
+
H2O
弱碱
+
H+
2、盐类水解的规律:
有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。
3、作业:练习册7.3
七、教学反思
本节课的教学设计针对的是一般中学学生的学情。设计的假设依据是:学生已经比较好地掌握了强、弱电解质、水的电离、弱电解质的电离平衡等知识。由此假设出发,认为学生已经掌握了探究的必要知识储备,因此教学设计中安排了比较多的学生活动:学生实验、学生讨论等等。如果在教学过程中发现学生的知识储备不够,教师应及时给与提示,变学生活动为师生活动,加强教师的指导作用,同时,也通过在学习盐类的水解过程中运用过去学过的知识而强化对这些知识的掌握。
4
设计思想
1、教材分析
(1)、课标要求
三级主题
学习内容
学
说
明
活动建议
Ⅰ
Ⅱ
Ⅲ
盐类水解
1.概念
2.水解规律
3.水解的方程式
B
B
B
1.学会判别盐溶液的酸碱性。
2.掌握一些常见离子的水解:
NH4+、Al3+、Fe3+、Ac-、CO32-、HCO3-
、S2-。
3.多元弱酸根离子的水解为分步水解(只要掌握CO32-)
4.弱酸弱碱盐,水解规律不作要求。
5.只要求会正确判别水解的方程式。
1.通过实验探究,使学生充分感知不同盐溶液的酸碱性存在差异,进而让学生分析、比较、归纳出盐溶液酸碱性的规律,掌握盐类水解的实质。
2.通过举一些生活中的例子,让学生了解盐类水解在生活中有广泛的应用。
盐类水解
的影响因素
1.影响因素
2.盐类水解的应用
B
B
A
1.运用勒夏特列原理判断水解平衡的移动。
2.能运用盐类水解的原理解释日常生活中的某些现象。
3.理解泡沫灭火器的反应原理。
(2)、教材内容
本节包括三个部分:建立盐类水解的概念;探讨盐类水解的本质和规律;运用盐类水解的知识。其中,盐类水解的概念是基础,旨在揭示盐类水解的实质,并为研究盐类水解规律提供依据。盐类水解的规律是核心,它是盐类水解原理的具体化,并使盐类水解一般概念得以直接应用。盐类水解的利用,则是通过具体的情境及实例,促进对盐类水解及其规律的理解、巩固和深化。本节是前面所学的电解质的电离、水的电离平衡和水的离子积,以及平衡移动原理等知识的综合应用。在进入本节内容的学习前,学生已经掌握了强弱电解质的概念以及水的电离等知识,且具备一定的逻辑推理能力和抽象思维能力。本节课教学设计从实验测定盐溶液pH出发,与已有知识形成认知矛盾,进而深入探究。因此教学流程的安排分三大块:实验探究——理论分析——应用提升,突出学生主体性地位,着重强化对理论分析的严谨推进,让学生以主动的姿态进行科学论证,同时初步掌握对科学理论的基本学习方法。
2、学情分析
在学习了弱电解质的电离以及移动的理论后,学生们在理论上已经能够明白为什么不同盐类的水溶液会呈现不同的酸碱性。本节的教学需要引导学生根据弱电解质的电离来认识盐类水解的实质;从水解后溶液中的C(H+)和C(OH-)的相对大小来判断溶液的酸碱性。
3、任务分析
终点目标
(1)根据盐类水解的原理对某些化学变化的现象进行解释。
(2)根据盐类水解的规律,对溶液中微粒大小进行判断和比较。
使能目标
(2)掌握盐类水解的规律(规则学习)
使能目标
(1)理解盐类水解的概念和实质(概念学习)
起点能力
(1)溶液的酸碱性与PH值
(2)一定的实验能力及分析、概括及的能力(支持条件)
4、教学流程
(1)、教学环节:
教师:
创设情景
提出问题
点拨
总结提高
学生:
激发兴趣
实验验证
概括归纳
应用
(2)、教学流程:
4、教学模式
问题---探究---解决模式
5、教学媒体
实验、多媒体
二、教学目标
1、知识与技能目标
(1)、理解盐类水解的概念和实质,了解盐类水解的特点,掌握盐类水解的规律。
(2)、加强实验探究技能,提高学生的观察能力和动手能力
2、过程与方法目标
通过实验,培养学生的质疑精神,掌握分析盐类水解造成溶液酸碱性的方法,体验盐类水解规律的产生过程。
3、思想与情感目标
(1)、培养学生参与合作精神,学会透过现象看事物的本质。
(2)、养成通过实验进行实证的科学行为方式。
三、教学重点和难点
1、重点
盐类水解概念及规律;体验理论和实验相结合的研究方法。
2、教学难点
水解实质的理解及规律的应用;感悟由个别到一般,由实验到理论再到实验的研究方法
四、教学用品
浓度均为0.1mol/L的CH3COONa、NH4Cl、NaCl、Na2SO4、Na2CO3
、Al2(SO4)3
、KNO3、FeCl3、Na2S、Cu(NO3)2溶液,pH试纸,试管、胶头滴管、表面皿、玻璃棒。
五、教学过程
教学内容
教师活动
学生活动
说明
问题引入
酸溶液中H+浓度大于OH-浓度显酸性;碱溶液中OH-浓度大于H+浓度显碱性。盐溶液呈什么性?
倾听,思考,猜想。
探究实验I
[组织学生进行实验]
[板书]
7.3盐溶液的酸碱性
一、盐溶液的酸碱性
[引导学生得出结论]
实验:用pH试纸测CH3COONa
、NH4Cl
、NaCl三种盐溶液的pH。
盐溶液不一定显中性。
训练学生的化学实验基本操作
探究实验II
盐溶液呈现什么性是否存在规律呢?
思考、猜想
实验:用pH试纸测Na2SO4、Na2CO3
、Al2(SO4)3
、KNO3、FeCl3、Na2S、Cu(NO3)七种盐溶液的pH。并将实验结果填入教材P89“探究与实践”栏目。
总结盐溶液的酸碱性与盐的类型的关系
能否根据实验结果,对表中所列出的九种盐进行分类,从而找出盐溶液酸碱性与盐的类型之间的关系?
[引导学生小结]]
[板书]
强酸强碱盐
溶液pH=7
强酸弱碱盐
溶液pH<7
强碱弱酸盐
溶液pH>7
猜想、讨论、交流
得出结论:
可以将盐分成三种类型:强酸强碱盐、强酸弱碱盐、强碱弱酸盐。
盐的类型与盐溶液酸碱性的关系:
强碱弱酸盐的水溶液显碱性,强酸弱碱盐的水溶液显酸性,强酸强碱盐的水溶液显中性。
分析盐类水解的实质
盐的组成中既不含H+,也不含OH—,水本身是中性的,为什么加进不同的盐之后就会显酸性、碱性或中性呢?
请以氯化铵为例进行分析。
列出浓度为0.1mol/L的氯化铵溶液中离子浓度大小的顺序。
思考
讨论、交流
NH4Cl
+
H2O
NH3·H2O
+
HCl
NH4+
+
H2ONH3·H2O
+
H+
思考,回答
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
[板书]二、盐类的水解
1、盐类水解的本质:在溶液中盐电离出的某种离子与水电离出的H+或OH—结合生成弱电解质的反应。
请分析醋酸钠、氯化钠溶液分别呈碱性和中性的原因
列出浓度为0.1mol/L的醋酸钠、氯化钠溶液中离子浓度大小的顺序。
讨论、分析
CH3COONa
+H2O
CH3COOH
+
NaOH
CH3COO-
+
H2O
CH3COOH
+
OH-
氯化钠是强酸、强碱生成的盐,所以其电离产生的离子不能与水电离出来的H+或OH—结合生成弱电解质,因此不水解。
醋酸钠
c(Na+)>c(Ac-)>c(OH-)>c(H+)
氯化钠
c(Cl-)=c(Na+)>c(H+)=c(OH-)
总结盐类水解的规律
[板书]
弱酸根离子
+
H2O
弱酸
+
OH-
弱碱阳离子
+
H2O
弱碱
+
H+
归纳出水解的规律:
[板书]
2、盐类水解的规律:
有弱才水解,无弱不水解。
谁弱谁水解,谁强显谁性。
思考、讨论、理解。
讨论、分析、倾听、整理、记录。
盐类水解的应用
[课堂练习]
1.判断下列盐的溶液的酸碱性。
(1)CH3COOK
(2)NH4NO3
2.在配制FeCl3溶液时,直接将FeCl3溶解于蒸馏水中,常见溶液略混浊,请分析原因。如何才能配制出澄清的FeCl3溶液?
3.明矾[KAl(SO4)2·12H2O]可以净水是因为明矾在水中生成Al(OH)3,试分析生成Al(OH)3的原因。将明矾溶液与碳酸钠溶液混合在一起,产生大量CO2,可用于灭火。试分析其中的化学原理。
练习,实验验证。
讨论、分析。
[作业]:1、看课本。2、本节书后练习。
2.主要板书
7.3盐溶液的酸碱性
一、盐溶液的酸碱性
强酸强碱盐
溶液pH=7
强酸弱碱盐
溶液pH<7
强碱弱酸盐
溶液pH>7
二、盐类的水解
1、盐类水解的本质:在溶液中盐电离出的某种离子与水电离出的H+或OH—结合生成弱电解质的反应。
中和
酸
+
碱
盐
+
水
水解
弱酸根离子
+
H2O
弱酸
+
OH-
弱碱阳离子
+
H2O
弱碱
+
H+
2、盐类水解的规律:
有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。
3、作业:练习册7.3
七、教学反思
本节课的教学设计针对的是一般中学学生的学情。设计的假设依据是:学生已经比较好地掌握了强、弱电解质、水的电离、弱电解质的电离平衡等知识。由此假设出发,认为学生已经掌握了探究的必要知识储备,因此教学设计中安排了比较多的学生活动:学生实验、学生讨论等等。如果在教学过程中发现学生的知识储备不够,教师应及时给与提示,变学生活动为师生活动,加强教师的指导作用,同时,也通过在学习盐类的水解过程中运用过去学过的知识而强化对这些知识的掌握。
4
