7.1 第一课时 常见的酸 讲义 鲁教版九年级下册化学
文档属性
| 名称 | 7.1 第一课时 常见的酸 讲义 鲁教版九年级下册化学 |
|
|
| 格式 | docx | ||
| 文件大小 | 473.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-23 21:59:16 | ||
图片预览





文档简介
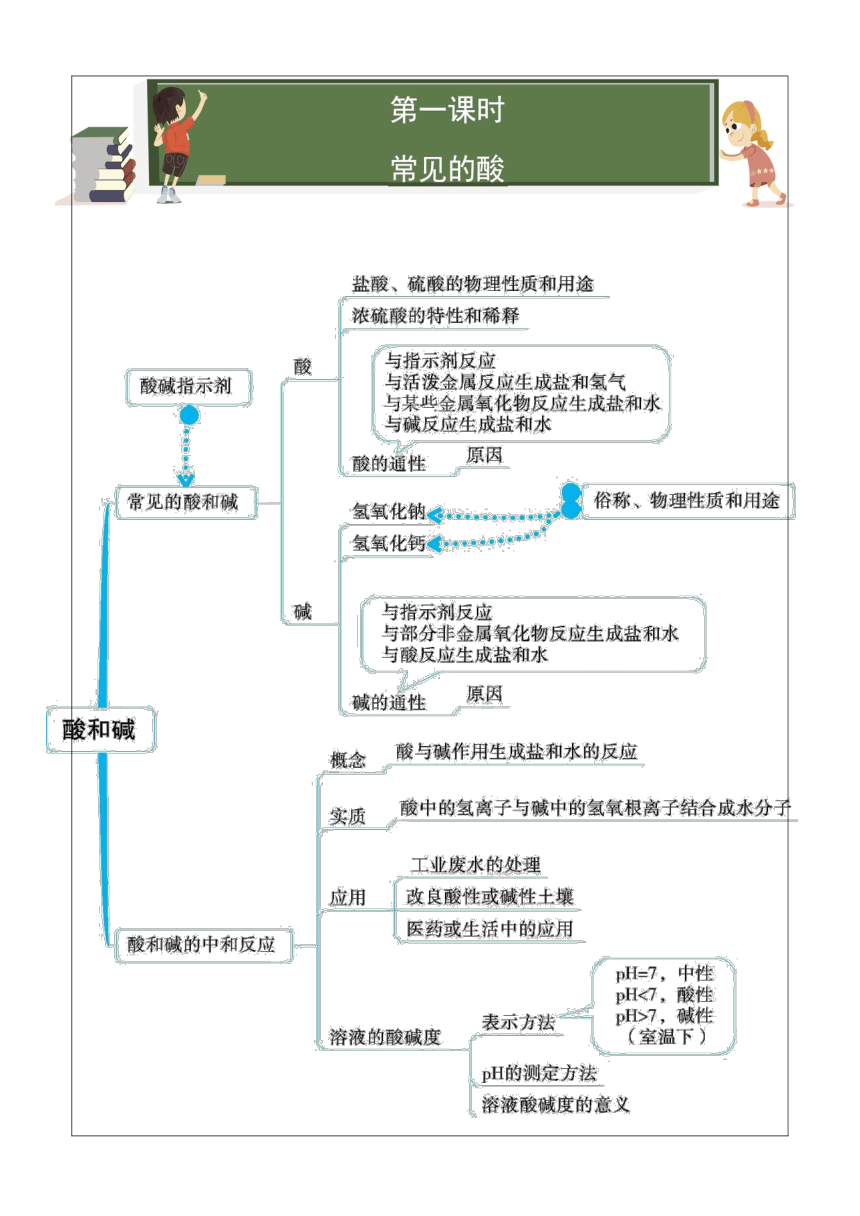
-311785-51435113411037465第一课时
常见的酸
第一课时
常见的酸
-276860334645
-4508575565知识点一 常见的酸
知识点一 常见的酸
2628900396240一、酸的定义:电离时生成的阳离子全部是氢离子(H+)的化合物叫酸。
2152650635例:盐酸(强酸) HCl = H+ + Cl- 盐酸根离子
263842518415硫酸(强酸) H2SO4 = 2H+ + SO42- 硫酸根离子
264795026670 硝酸(强酸) HNO3 = H+ + NO3- 硝酸根离子
265747582550碳酸(弱酸) H2CO3= 2H+ + CO32- 碳酸根离子
263842529845 醋酸(弱酸)CH3COOH = H+ + CH3COO- 醋酸根离子
二、盐酸和硫酸的物理性质和主要用途
盐酸(HCl)
硫酸(H2SO4)
颜色、状态
无色、透明液体
无色、黏稠、油状液体
打开瓶盖
现象
瓶口有白雾出现
无明显现象
原因
具有挥发性(溶质减少)
——
气味
有刺激性气味
无味
用途
金属除锈、制造药物、胃液中的盐酸可帮助消化等
金属除锈、冶炼金属、作干燥剂等
4000522860练习
练习
小强发现使用了一段时间的文具盒出现了铁锈痕迹,他从家中选择了一种最合适的物质对铁锈进行处理,这种物质是( C )
A.酒精 B.食盐水 C.白醋 D.蔗糖溶液
三、浓硫酸的特性
(1)吸水性(物理性质):浓硫酸具有吸水性,在实验室常用作某些气体的干燥剂。
(2)脱水性(化学性质):它能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等元素的化合物组成)里的水分(严格地说,浓硫酸能将这些物质中的氢、氧元 素按水的组成比脱去),生成黑色的炭。
(3)浓硫酸还具有强烈的腐蚀性,如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
476250212090四、浓硫酸的稀释
注意:稀释浓硫酸时切不可将水注入浓硫酸。(口诀:酸入水,沿器壁,慢慢倒,不断搅)
4953053340练习
练习
硫酸是工农业生产中使用非常广泛的一种试剂,实验室用质量分数为98%的浓硫酸(密度为1.84 g/cm3)配制49 g质量分数为20%的硫酸。
(1)经计算,所需水的质量为 g,所需98%的浓硫酸的体积为 mL。?
(2)量取上述体积的浓硫酸所选用的仪器为 。(填选项)?
A.10 mL量筒 B.100 mL烧杯 C.100 mL量筒 D.胶头滴管
(3)稀释浓硫酸时,将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,并 。?
(4)如果不慎将浓硫酸沾到皮肤上,应立即 ,然后涂上3%的小苏打溶液。?
答案 (1)39 5.4 (2)AD (3)用玻璃棒不断搅拌 (4)用大量水冲洗
解析 (1)设取用浓硫酸的质量为x,根据“稀释前后溶质质量不变”可得,98%×x=49 g×20%,解得x=10 g,则所需水的质量为49 g-10 g=39 g;所需浓硫酸的体积V(浓硫酸)=10 g÷1.84 g/cm3≈5.43 mL,量筒的精确度只有0.1 mL,因此浓硫酸体积应取5.4 mL。(2)浓硫酸的体积为5.4 mL,应用10 mL 量筒和胶头滴管。(3)稀释浓硫酸时,应将浓硫酸沿着烧杯壁缓慢注入盛有水的烧杯里,并用玻璃棒不断搅拌。(4)如果不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%的碳酸氢钠溶液。
五、浓硫酸和浓盐酸在空气中敞口放置一段时间后都会变稀(溶质质量分数减小),但原因不同: 浓硫酸:吸水性,吸收水分,溶剂增加;
浓盐酸:挥发性,氯化氢(HCl)跑了,溶质减少。
400056350练习
练习
1.下列物质长期放置在空气中,溶液质量和溶质质量都会减小的是( )
A.浓硫酸 B.浓盐酸 C.食盐溶液 D.蔗糖溶液
答案 B 浓盐酸具有挥发性,长期放置在空气中,溶质的质量减小,溶液的质量也会减小。
18637253016252.如图所示已平衡的天平两端放着两个分别盛有浓盐酸和浓硫酸的敞口烧杯,过一段时间后,天平会( )
A.左端下沉 B.右端下沉 C.仍平衡 D.无法判断
答案 B 浓盐酸有挥发性,一段时间后质量减小,浓硫酸有吸水性,一段时间后质量增加,所以过一段时间后,天平会右端下沉。
2159049530知识点二 酸的化学性质
知识点二 酸的化学性质
补充知识——盐的定义:
像NaCl、FeCl3、KNO3、Na2CO3、CaCO3、Na2SO4等由金属阳离子和酸根阴离子组成的化合物称为盐。
像NH4Cl﹑ (NH4)2SO4等由铵根离子(NH4+)和酸根离子组成的化合物 ,也是盐。
二、酸的化学性质
因为所有酸的溶液里都有相同的阳离子——H+,所以酸具有一些相似的化学性质,叫酸的通性。
1.酸与指示剂的作用
酸能使紫色的石蕊变成红色,使无色酚酞不变色(酸使石蕊变红,使酚酞不变色)。
2.酸+活泼金属——盐+氢气
A、化学方程式
Mg+2HCl=MgCl2+H2↑
Fe+2HCl=FeCl2+H2↑现象:铁的表面有气泡产生,溶液由无色变成浅绿色
Zn+2HCl= ZnCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
Mg+H2SO4=MgSO4+ H2↑
Fe+H2SO4=FeSO4+H2↑现象:铁的表面有气泡产生,溶液由无色变成浅绿色
Zn+H2SO4= ZnSO4+H2↑
2Al+3H2SO4=Al2(SO4)3+3H2↑
B、金属活动性顺序表的应用
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
①只有排在氢前面的金属才能与酸发生反应
②酸能常为稀盐酸、稀硫酸,浓酸不行(浓酸具有强氧化性)
③K、 Ca、 Na除外(过于活泼)
用途:验室制氢气
4000510795练习
练习
白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁酸腐蚀的是? ( )
A.镀锌水管 B.铜制塑像 C.大理石栏杆 D.铝合金门窗
答案 B 金属活动性顺序中,铜排在氢的后面,不能与酸发生反应,不易被蚁酸腐蚀。
3.酸+金属氧化物——盐+水
①化学方程式
Fe2O3+6HCl=2FeCl3+3H2O 现象:铁锈消失,溶液由无色变为黄色
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O现象:铁锈消失,溶液由无色变为黄色
②用途:金属除锈
补充说明:(1)金属氧化物一般为碱性,如Fe2O3,CuO等,可以和酸反应
(2)单质的铁与稀酸反应生成二价的亚铁离子(Fe2+)
氧化铁与酸反应生成三价的铁离子(Fe3+)
4.酸+碱——盐+水
①Al(OH)2+3HCl =AlCl3+3H2O 治疗胃酸过多
②Mg(OH)2+H2SO4=MgSO4+2H2O
③Ca(OH)2+2HCl=CaCl2+2H2O
④Ca(OH)2+ H2SO4=CaSO4+2H2O
⑤NaOH+ HCl=NaCl+ H2O
5.酸+盐——新酸+新盐
①化学方程式
2HCl+Na2CO3=2NaCl+H2O+CO2↑用于检验碳酸根离子
HCl+AgNO3=AgCl↓+HNO3用于检验氯离子
H2SO4+BaCl2=BaSO4↓+2HCl用于检验硫酸根离子
②实例:检验一瓶无色溶液中含有碳酸根离子
取无色溶液少许注入试管,向试管中加入稀盐酸,将产生的气体通入澄清石灰水,如果石灰水变浑浊,证明产生二氧化碳,因此证明原溶液中含有碳酸根。
400053810例1
例1
下列关于酸的说法错误的是? ( C )
A.浓硫酸具有吸水性,浓盐酸具有挥发性
B.稀盐酸和稀硫酸都可用于金属除锈
C.稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色
D.稀硫酸能够与活泼金属反应制取氢气
解析 浓硫酸具有吸水性,浓盐酸具有挥发性,故A说法正确;稀盐酸和稀硫酸都可与金属氧化物反应,都可用于金属除锈,故B说法正确;无色酚酞溶液遇酸不变色,故C说法错误;稀硫酸能够与活泼金属反应制取氢气,故D说法正确。 答 案 C
114309525例2
例2
将稀盐酸分别滴入盛有不同物质的试管中。如下图所示:
18097537465
(1)不能发生反应的是 (填序号,下同)。 ?
(2)有气泡产生的是 。?
(3)溶液能变成浅绿色的是 。?
(4)生成蓝色溶液的是 。?
(5)溶液变成红色的是 。?
答案 (1)A (2)B、C (3)B (4)D (5)E
1143017145例3
例3
用稀盐酸除去铁锈主要成分的原理是( )
32766022860
答案 D 铁锈的主要成分是三氧化二铁,三氧化二铁与盐酸反应生成氯化铁和水,故选D。
2095520955例4
例4
4679951591945?
?
酸是一类重要的化合物,它能与许多物质发生化学反应,请将你所学过的有关酸的性质与用途归纳整理,并完成下面的填空。
102679562230
不反应的是(填序号,下同) ;反应一开始就冒气泡的是 ;有浅绿色溶液出现的是 ;有黄色溶液出现的是 ;有蓝色溶液出现的是 。
(2)根据实验及现象,分析、比较和归纳而得出的结论有(至少答3条):
① ;
② ;
③ 。
(3)指出上述实验中有关物质及反应在实验室、生产和生活等方面的实际应用(答2条):
① ;
② 。
解析 铜的化学性质不活泼,不能与稀硫酸发生反应,而能反应放出氢气的是铁片、镁条、锌粒;铁片与酸反应产生亚铁离子,所以溶液显浅绿色; 铁锈与酸反应产生铁离子,故溶液呈现黄色;氧化铜可与酸反应产生铜离子,故溶液呈现蓝色。由以上实验不难得出酸的通性,即①酸能跟某些金属氧化物反应,②酸能跟多种活泼金属反应,③酸并不能跟所有的金属反应等。物质的性质决定物质的用途,所以酸可以用于除去铁锈,与活泼金
属反应可以制得氢气等。 答案 (1)D CEF C A B
(2)①酸能跟某些金属氧化物反应 ②酸能跟多种活泼金属反应 ③酸并不能跟所有的金属反应(合理答案均可)
(3)①盐酸可用于除铁锈 ②锌粒和稀盐酸或稀硫酸反应常用于实验室制取H2(合理答案均可)
4000547625练习
练习
1.盐酸、稀硫酸都属于酸,故有许多共同的性质,下列有关叙述正确的是( B )
A.打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾
B.稀盐酸和稀硫酸都可用于除铁锈
387985036830C.浓盐酸、浓硫酸都可用来干燥氧气
D.稀盐酸、稀硫酸都可用于实验室制取二氧化碳气体
2.如图所示实验,一段时间后,不能观察到的现象是( D )
A.甲图中,浸入浓硫酸的火柴梗变黑
B.乙图中,浸入硫酸铜溶液部分的铁丝表面出现红色物质
C.丙图中,铁钉水面处部分生锈
D.丁图中,试纸变蓝色
3.向一定质量的稀盐酸中,加入足量的表面已经生锈的铁片,产生氢气的质量m和时间t的关系图像正确的是( )
73152038100
答案 B 向一定质量的稀盐酸中,加入足量的表面已经生锈的铁片,盐酸先与铁锈反应,不会产生氢气,反应一段时间后,里面的铁与盐酸反应生成氢气,当盐酸完全反应后,生成氢气的质量不再变化。
4.把一枚生锈的铁钉放入过量的稀盐酸中,首先可观察到的现象是 ,反应的化学方程式为 ;过一段时间后,又观察到铁钉表面有 产生,产生该现象的化学方程式为 。
23177515240
5.如图所示化学反应的溶液颜色变化体现了“魔法世界,魅力化学”。请回答:
(1)溶液X是 (选填“酸”或“碱”),试剂A的名称是 。?
(2)若X是稀硫酸,B是氧化物,则B的化学式为 。?
(3)若X是稀盐酸,C是单质,则C的名称是 。?
(4)若X是稀硫酸,D是氧化物,则X与D反应的化学方程式为 。?
答案 (1)酸 石蕊溶液 (2)Fe2O3 (3)铁 (4)CuO+H2SO4 CuSO4+H2O
常见的酸
第一课时
常见的酸
-276860334645
-4508575565知识点一 常见的酸
知识点一 常见的酸
2628900396240一、酸的定义:电离时生成的阳离子全部是氢离子(H+)的化合物叫酸。
2152650635例:盐酸(强酸) HCl = H+ + Cl- 盐酸根离子
263842518415硫酸(强酸) H2SO4 = 2H+ + SO42- 硫酸根离子
264795026670 硝酸(强酸) HNO3 = H+ + NO3- 硝酸根离子
265747582550碳酸(弱酸) H2CO3= 2H+ + CO32- 碳酸根离子
263842529845 醋酸(弱酸)CH3COOH = H+ + CH3COO- 醋酸根离子
二、盐酸和硫酸的物理性质和主要用途
盐酸(HCl)
硫酸(H2SO4)
颜色、状态
无色、透明液体
无色、黏稠、油状液体
打开瓶盖
现象
瓶口有白雾出现
无明显现象
原因
具有挥发性(溶质减少)
——
气味
有刺激性气味
无味
用途
金属除锈、制造药物、胃液中的盐酸可帮助消化等
金属除锈、冶炼金属、作干燥剂等
4000522860练习
练习
小强发现使用了一段时间的文具盒出现了铁锈痕迹,他从家中选择了一种最合适的物质对铁锈进行处理,这种物质是( C )
A.酒精 B.食盐水 C.白醋 D.蔗糖溶液
三、浓硫酸的特性
(1)吸水性(物理性质):浓硫酸具有吸水性,在实验室常用作某些气体的干燥剂。
(2)脱水性(化学性质):它能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等元素的化合物组成)里的水分(严格地说,浓硫酸能将这些物质中的氢、氧元 素按水的组成比脱去),生成黑色的炭。
(3)浓硫酸还具有强烈的腐蚀性,如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
476250212090四、浓硫酸的稀释
注意:稀释浓硫酸时切不可将水注入浓硫酸。(口诀:酸入水,沿器壁,慢慢倒,不断搅)
4953053340练习
练习
硫酸是工农业生产中使用非常广泛的一种试剂,实验室用质量分数为98%的浓硫酸(密度为1.84 g/cm3)配制49 g质量分数为20%的硫酸。
(1)经计算,所需水的质量为 g,所需98%的浓硫酸的体积为 mL。?
(2)量取上述体积的浓硫酸所选用的仪器为 。(填选项)?
A.10 mL量筒 B.100 mL烧杯 C.100 mL量筒 D.胶头滴管
(3)稀释浓硫酸时,将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,并 。?
(4)如果不慎将浓硫酸沾到皮肤上,应立即 ,然后涂上3%的小苏打溶液。?
答案 (1)39 5.4 (2)AD (3)用玻璃棒不断搅拌 (4)用大量水冲洗
解析 (1)设取用浓硫酸的质量为x,根据“稀释前后溶质质量不变”可得,98%×x=49 g×20%,解得x=10 g,则所需水的质量为49 g-10 g=39 g;所需浓硫酸的体积V(浓硫酸)=10 g÷1.84 g/cm3≈5.43 mL,量筒的精确度只有0.1 mL,因此浓硫酸体积应取5.4 mL。(2)浓硫酸的体积为5.4 mL,应用10 mL 量筒和胶头滴管。(3)稀释浓硫酸时,应将浓硫酸沿着烧杯壁缓慢注入盛有水的烧杯里,并用玻璃棒不断搅拌。(4)如果不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%的碳酸氢钠溶液。
五、浓硫酸和浓盐酸在空气中敞口放置一段时间后都会变稀(溶质质量分数减小),但原因不同: 浓硫酸:吸水性,吸收水分,溶剂增加;
浓盐酸:挥发性,氯化氢(HCl)跑了,溶质减少。
400056350练习
练习
1.下列物质长期放置在空气中,溶液质量和溶质质量都会减小的是( )
A.浓硫酸 B.浓盐酸 C.食盐溶液 D.蔗糖溶液
答案 B 浓盐酸具有挥发性,长期放置在空气中,溶质的质量减小,溶液的质量也会减小。
18637253016252.如图所示已平衡的天平两端放着两个分别盛有浓盐酸和浓硫酸的敞口烧杯,过一段时间后,天平会( )
A.左端下沉 B.右端下沉 C.仍平衡 D.无法判断
答案 B 浓盐酸有挥发性,一段时间后质量减小,浓硫酸有吸水性,一段时间后质量增加,所以过一段时间后,天平会右端下沉。
2159049530知识点二 酸的化学性质
知识点二 酸的化学性质
补充知识——盐的定义:
像NaCl、FeCl3、KNO3、Na2CO3、CaCO3、Na2SO4等由金属阳离子和酸根阴离子组成的化合物称为盐。
像NH4Cl﹑ (NH4)2SO4等由铵根离子(NH4+)和酸根离子组成的化合物 ,也是盐。
二、酸的化学性质
因为所有酸的溶液里都有相同的阳离子——H+,所以酸具有一些相似的化学性质,叫酸的通性。
1.酸与指示剂的作用
酸能使紫色的石蕊变成红色,使无色酚酞不变色(酸使石蕊变红,使酚酞不变色)。
2.酸+活泼金属——盐+氢气
A、化学方程式
Mg+2HCl=MgCl2+H2↑
Fe+2HCl=FeCl2+H2↑现象:铁的表面有气泡产生,溶液由无色变成浅绿色
Zn+2HCl= ZnCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
Mg+H2SO4=MgSO4+ H2↑
Fe+H2SO4=FeSO4+H2↑现象:铁的表面有气泡产生,溶液由无色变成浅绿色
Zn+H2SO4= ZnSO4+H2↑
2Al+3H2SO4=Al2(SO4)3+3H2↑
B、金属活动性顺序表的应用
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
①只有排在氢前面的金属才能与酸发生反应
②酸能常为稀盐酸、稀硫酸,浓酸不行(浓酸具有强氧化性)
③K、 Ca、 Na除外(过于活泼)
用途:验室制氢气
4000510795练习
练习
白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁酸腐蚀的是? ( )
A.镀锌水管 B.铜制塑像 C.大理石栏杆 D.铝合金门窗
答案 B 金属活动性顺序中,铜排在氢的后面,不能与酸发生反应,不易被蚁酸腐蚀。
3.酸+金属氧化物——盐+水
①化学方程式
Fe2O3+6HCl=2FeCl3+3H2O 现象:铁锈消失,溶液由无色变为黄色
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O现象:铁锈消失,溶液由无色变为黄色
②用途:金属除锈
补充说明:(1)金属氧化物一般为碱性,如Fe2O3,CuO等,可以和酸反应
(2)单质的铁与稀酸反应生成二价的亚铁离子(Fe2+)
氧化铁与酸反应生成三价的铁离子(Fe3+)
4.酸+碱——盐+水
①Al(OH)2+3HCl =AlCl3+3H2O 治疗胃酸过多
②Mg(OH)2+H2SO4=MgSO4+2H2O
③Ca(OH)2+2HCl=CaCl2+2H2O
④Ca(OH)2+ H2SO4=CaSO4+2H2O
⑤NaOH+ HCl=NaCl+ H2O
5.酸+盐——新酸+新盐
①化学方程式
2HCl+Na2CO3=2NaCl+H2O+CO2↑用于检验碳酸根离子
HCl+AgNO3=AgCl↓+HNO3用于检验氯离子
H2SO4+BaCl2=BaSO4↓+2HCl用于检验硫酸根离子
②实例:检验一瓶无色溶液中含有碳酸根离子
取无色溶液少许注入试管,向试管中加入稀盐酸,将产生的气体通入澄清石灰水,如果石灰水变浑浊,证明产生二氧化碳,因此证明原溶液中含有碳酸根。
400053810例1
例1
下列关于酸的说法错误的是? ( C )
A.浓硫酸具有吸水性,浓盐酸具有挥发性
B.稀盐酸和稀硫酸都可用于金属除锈
C.稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色
D.稀硫酸能够与活泼金属反应制取氢气
解析 浓硫酸具有吸水性,浓盐酸具有挥发性,故A说法正确;稀盐酸和稀硫酸都可与金属氧化物反应,都可用于金属除锈,故B说法正确;无色酚酞溶液遇酸不变色,故C说法错误;稀硫酸能够与活泼金属反应制取氢气,故D说法正确。 答 案 C
114309525例2
例2
将稀盐酸分别滴入盛有不同物质的试管中。如下图所示:
18097537465
(1)不能发生反应的是 (填序号,下同)。 ?
(2)有气泡产生的是 。?
(3)溶液能变成浅绿色的是 。?
(4)生成蓝色溶液的是 。?
(5)溶液变成红色的是 。?
答案 (1)A (2)B、C (3)B (4)D (5)E
1143017145例3
例3
用稀盐酸除去铁锈主要成分的原理是( )
32766022860
答案 D 铁锈的主要成分是三氧化二铁,三氧化二铁与盐酸反应生成氯化铁和水,故选D。
2095520955例4
例4
4679951591945?
?
酸是一类重要的化合物,它能与许多物质发生化学反应,请将你所学过的有关酸的性质与用途归纳整理,并完成下面的填空。
102679562230
不反应的是(填序号,下同) ;反应一开始就冒气泡的是 ;有浅绿色溶液出现的是 ;有黄色溶液出现的是 ;有蓝色溶液出现的是 。
(2)根据实验及现象,分析、比较和归纳而得出的结论有(至少答3条):
① ;
② ;
③ 。
(3)指出上述实验中有关物质及反应在实验室、生产和生活等方面的实际应用(答2条):
① ;
② 。
解析 铜的化学性质不活泼,不能与稀硫酸发生反应,而能反应放出氢气的是铁片、镁条、锌粒;铁片与酸反应产生亚铁离子,所以溶液显浅绿色; 铁锈与酸反应产生铁离子,故溶液呈现黄色;氧化铜可与酸反应产生铜离子,故溶液呈现蓝色。由以上实验不难得出酸的通性,即①酸能跟某些金属氧化物反应,②酸能跟多种活泼金属反应,③酸并不能跟所有的金属反应等。物质的性质决定物质的用途,所以酸可以用于除去铁锈,与活泼金
属反应可以制得氢气等。 答案 (1)D CEF C A B
(2)①酸能跟某些金属氧化物反应 ②酸能跟多种活泼金属反应 ③酸并不能跟所有的金属反应(合理答案均可)
(3)①盐酸可用于除铁锈 ②锌粒和稀盐酸或稀硫酸反应常用于实验室制取H2(合理答案均可)
4000547625练习
练习
1.盐酸、稀硫酸都属于酸,故有许多共同的性质,下列有关叙述正确的是( B )
A.打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾
B.稀盐酸和稀硫酸都可用于除铁锈
387985036830C.浓盐酸、浓硫酸都可用来干燥氧气
D.稀盐酸、稀硫酸都可用于实验室制取二氧化碳气体
2.如图所示实验,一段时间后,不能观察到的现象是( D )
A.甲图中,浸入浓硫酸的火柴梗变黑
B.乙图中,浸入硫酸铜溶液部分的铁丝表面出现红色物质
C.丙图中,铁钉水面处部分生锈
D.丁图中,试纸变蓝色
3.向一定质量的稀盐酸中,加入足量的表面已经生锈的铁片,产生氢气的质量m和时间t的关系图像正确的是( )
73152038100
答案 B 向一定质量的稀盐酸中,加入足量的表面已经生锈的铁片,盐酸先与铁锈反应,不会产生氢气,反应一段时间后,里面的铁与盐酸反应生成氢气,当盐酸完全反应后,生成氢气的质量不再变化。
4.把一枚生锈的铁钉放入过量的稀盐酸中,首先可观察到的现象是 ,反应的化学方程式为 ;过一段时间后,又观察到铁钉表面有 产生,产生该现象的化学方程式为 。
23177515240
5.如图所示化学反应的溶液颜色变化体现了“魔法世界,魅力化学”。请回答:
(1)溶液X是 (选填“酸”或“碱”),试剂A的名称是 。?
(2)若X是稀硫酸,B是氧化物,则B的化学式为 。?
(3)若X是稀盐酸,C是单质,则C的名称是 。?
(4)若X是稀硫酸,D是氧化物,则X与D反应的化学方程式为 。?
答案 (1)酸 石蕊溶液 (2)Fe2O3 (3)铁 (4)CuO+H2SO4 CuSO4+H2O
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
